需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对衣原体视网膜的光行为观察
* 这些作者具有相同的贡献
摘要
大多数游泳的光自养生物表现出光诱导的行为改变(光行为)。本方案在模式生物 衣原体中观察到所述光行为。
摘要
对于运动光养微生物的生存,在适当的光照条件下至关重要。因此,它们显示出光诱导的行为(或光行为),并改变它们的运动方向以响应光。典型的光行为包括光震(或光恐惧症)响应和光出租车。光晕是对光强度突然变化(例如,闪光照明)的反应,其中生物体短暂地停止移动或向后移动。在光氧化期间,生物体向光源或相反方向移动(分别称为正光共济或负光氧化)。单细胞绿藻 衣原体是 研究光行为的极好生物体,因为它通过在光感受后调节纤毛(又名鞭毛)的跳动来迅速改变其游泳模式。在这里,展示了各种简单的方法来观察 莱因哈迪猪笼草中的光行为。对 C. reinhardtii的光行为的研究导致了真核纤毛和通道视紫红质之间的共同调节机制的发现,这可能有助于更好地了解纤毛病和开发新的光遗传学方法。
引言
光是光合生物不可缺少的能量来源,但过多的光可能会造成光氧化损伤。因此,光养生物需要在中等强度的光下生存,在那里它们可以光合作用而不会遭受光氧化损伤1。在陆地植物中,叶绿体不能从叶子中移出并在细胞中显示照片运动;叶绿体在高光下移动到细胞的外围,在低光下移动到细胞表面2,而许多运动藻类显示出光行为,使它们能够找到合适的光合作用光条件,从而促进它们的生存3。
衣原体是 一种单细胞绿藻,在纤毛(又名鞭毛)、光合作用和光行为等研究领域被视为模型生物。 莱因哈蒂猪笼草 每个细胞有一个眼斑和两个纤毛,分别用于光感受和游泳。眼斑有两个组成部分:通道视紫红质(ChRs),质膜中的光门控离子通道以及位于ChR后面的富含类胡萝卜素的颗粒层。眼斑充当定向光受体,因为富含类胡萝卜素的颗粒层起到光反射器的作用4,5。
ChRs最初被确定为在莱恩哈迪衣原体6,7,8,9中引起光行为的光感受器。虽然在眼斑中发现了两种亚型ChR1和ChR2,但敲低实验表明,ChR1是光行为10的主要光感受器。尽管如此,ChR2受到了更多的关注,并在光遗传学的发展中发挥了核心作用,光遗传学是一种通过光11控制细胞激发的技术。因此,研究控制雷恩哈迪光行为的调控机制将进一步了解ChR功能并改善光遗传学。
在光接收后, 莱恩哈蒂猪笼草 细胞显示出两种类型的光行为:光出租车和光锤反应12。光出租车是细胞在光源方向或相反方向上游动的行为,分别称为正光出租车或负光出租车。光晕反应是细胞在感知到光强度的突然变化后表现出的一种行为,例如在闪光灯照射时。细胞停止游泳或向后游(即,随着细胞体向前游动)一小段时间,通常为<1 s。
莱因哈迪猪笼草的纤毛运动参与了其摄影行为。两个纤毛通常像人类的蛙泳一样跳动,这是针对光行为调制的。对于光出租车,由两个纤毛产生的力通过调节跳频和每个纤毛13的波形幅度而不平衡。最靠近眼斑的纤毛称为顺式纤毛,另一种称为反式纤毛。这两个纤毛在各个方面都有不同之处。例如,反式纤毛在体外的睫状跳动频率高出30%-40%14。此外,它们的Ca2 +灵敏度是不同的。去膜细胞模型15的再激活表明,对于Ca2+ <1 x 10−8 M,顺式纤毛的跳动比反式纤毛更强,而对于Ca2+ >1 x 10−7 M则相反。这种Ca2+灵敏度的不对称性对于光定向转弯可能很重要,因为缺乏这种不对称性的突变体不会表现出正常的光出租车16,17。相反,波形转换对于光震是必要的。睫状波形从前向游泳中的非对称波形转换为向后游泳中的对称波形。该波形转换也由Ca2+调节,阈值为1 x 10−4 M18,19。由于调节睫状体运动的缺陷导致人类原发性睫状体运动障碍,因此研究莱因哈迪猪笼草的光行为可能有助于更好地了解这些疾病和治疗发展20.
本文演示了四种观察 雷恩哈蒂猪笼 草中光行为的简单方法。首先,显示了使用培养皿的光出租车测定,其次,显示了针对细胞悬浮液滴的光出租车测定。在这两种情况下观察到的现象都不是严格的光出租车,而是光积累,其中细胞倾向于在光源侧或另一侧附近积聚。在 C. reinhardtii 中,光累积主要由光出租车引起,其方式可用作光出租车的近似值。第三,显示了在显微镜下对光氧化的更严格的测定,最后是在显微镜下进行光锤测定。
Access restricted. Please log in or start a trial to view this content.
研究方案
在本研究中,使用了杂交CC-124 x CC-125与agg1 + mt-的杂交的生殖细胞 衣原体的野生型菌株21。从衣原体资源中心获得CC-124和CC-125(见 材料表),并在20-25°C下维持在三醋酸磷酸酯(TAP)22,1.5%琼脂糖培养基上。 任何运动菌株都可用于该方案。
1. 细胞培养
- 在TAP液体培养基中培养感兴趣的 衣原体 菌株,并在20-25°C下在12 h /12 h的光暗期(光照期,~50μmol光子·m−2·s−1 白光)中通过冒泡无菌空气曝气2天。
注意:需要使用中期对数生长阶段的细胞。长时间培养(>3天,在后期对数生长阶段)使细胞对光刺激不那么敏感,并增加培养物中死细胞的数量,阻碍结果的读出。

图1:培养2天后的液体培养。 从TAP-1.5%琼脂平板中,将填充铂环的一大块野生型细胞接种到烧瓶中的〜150 mL TAP液体培养基中。培养2天后的细胞密度为〜5.0×106 个细胞/ mL。 请点击此处查看此图的大图。
2. 细胞的预处理
- 将约10μL培养物与等体积的抽解溶液混合,以阻止细胞游动并使用细胞计数器或血细胞计数器测量细胞密度。
注意:培养2天后,大约有1-5 x 106 个细胞/ mL(图1)。所述脱锂溶液的组成如下:40 mM乙酸钾、1 mM氯化钙2、pH 4.5用HCl调节。 - 在室温下以1000× g 离心所需量的液体培养物3分钟。
注意:一个实验需要3 mL的2 x 107 个细胞/ mL,用于培养皿中光氧化测定的标准条件。如果要用1 x 106 个细胞/ mL培养物进行两个实验,则需要离心120 mL培养物。 - 用所需量的光行为实验溶液将细胞沉淀悬浮至〜2×107 个细胞/ mL(用于培养皿光氧化测定)或1×106 个细胞/ mL(用于细胞水平光氧化测定或光锤反应测定),并将细胞悬浮液置于锥形管中。
注意:细胞密度不需要非常严格地控制以粗略估计光行为,或者可以根据测定的目的而变化。光行为实验溶液14:5 mM HEPES (pH 7.4),0.2 mM EGTA,1 mM氯化钾,0.3 mM钙Cl2。可以省略该缓冲液交换步骤,以简单地测定表现出光行为的能力,并且可以使用培养基进行实验。然而,由于溶液的离子组成影响光定向标志24,并且培养后培养基的离子组成可能不是恒定的,因此建议使用该溶液进行更严格的测定。可以用新鲜的TAP培养基代替。 - 将试管置于暗淡的红光(10-30μmol光子·m−2·s−1)下约1小时(图2)。
注意:此步骤会增加细胞对光刺激的敏感性。

图2:红灯下的电池悬液。 一种普通的荧光白光,上面覆盖着一片红色玻璃纸。将含有细胞悬浮液的管置于~10μmol光子·m−2·s−1 红光下。 请点击此处查看此图的大图。
3. 使用培养皿进行光氧化测定(所谓的"培养皿测定")
- 将2-3mL细胞悬浮液放入培养皿(3.5厘米)中,将其放在灯箱(或者,白纸或白色塑料板)上,轻轻摇动以均匀分布细胞,并在照明前获得图像。
注意:盘子的大小可以根据目的而变化。根据菌株和培养状态,细胞可能会粘附在培养皿的底部。在这种情况下,在测定之前需要通过移液去除卡住的细胞。 - 在桌面暗室中用绿色发光二极管(LED,参见 材料表)从一侧照亮培养皿(图3)。
注意:典型的光照条件为λ = 525 nm和50-100 μmol光子·m−2·s−1。请参阅讨论部分中有关选择光源波长的讨论。使用小型 LED 时,用盒子或黑布盖住盘子和 LED。 - 将它们放置≥5分钟,然后获取图像。
注:光照时间可以根据培养皿的大小或用途进行更改(图4)。 - 将图片文件导入斐济(参见 材料表)进行量化。
注意:斐济是ImageJ2的发行版,捆绑了许多插件。 - 通过 "图像>类型"将 彩色图片更改为灰度>8位(图5)。
- 通过 "编辑>反转"反转黑白。
- 将整个培养皿包围为感兴趣区域(ROI),并通过 分析>测量来测量密度。
注意:总碟子的密度可以计算为(面积)x(平均值)。 - 将最靠近光源的盘子的一半包围起来作为ROI并测量密度。
- 将光定向指数计算为每(总细胞的密度)的(光定向细胞的密度)。

图3:用于光氧化皿测定的侧面照明 (A)将含有细胞悬浮液的培养皿放置在桌面暗室的灯箱上。绿光(525 nm LED板,~100 μmol光子·m−2·s−1)从侧面照射。(B)替代照明方法。5 毫米炮弹型发光二极管。(C)为了阻挡来自外部的光线,可以使用内部带有黑布的盒子代替桌面暗室。 请点击此处查看此图的大图。

图4:侧面照明5分钟后负光电效应的示例(A)在培养皿中照射5分钟的Wild型细胞悬浮液。大多数细胞积聚在光源的另一侧。这些数据可以解释为负光电效应。(B)从顶部开始的菜肴图像。请点击此处查看此图的大图。
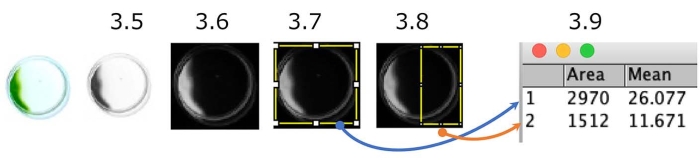
图5:培养皿光氧化测定的定量。 显示负光电出租车的细胞示例(光源位于右侧)。彩色图片将转换为灰度(步骤 3.5),然后反转(步骤 3.6)。对感兴趣的区域(ROI),整个盘子(步骤3.7)和盘子的光源侧的一半(步骤3.8)进行分隔。测量每个ROI的密度(步骤3.9)。在这种情况下,光定向指数(PI)约为0.18([1,512 x 11.671]/[2,970 x 26.077])。当所有细胞分别显示阳性或阴性光出租车时,PI为1或0。 请点击此处查看此图的大图。
4. 使用细胞培养液滴进行光出租车测定
- 使用微量移液管将25μL细胞悬浮液滴(步骤2.4)直接置于白色塑料板上。
- 在桌面暗室中用绿色LED从一侧照亮液滴(图6)。
注意:典型的光条件是λ = 525 nm和50-100μmol光子m−2 s−1。使用小型 LED 时,用盒子或黑布覆盖板和 LED。 - 将它们放置3分钟,然后获取图像。
注意:该测定适用于一次快速检查许多样品的光氧化,例如在突变体筛选或四元分析中。在96孔板中生长的对数中期阶段的细胞培养物可以直接照明,以便于性能。在这两种情况下,都可以省略步骤2(细胞预处理)。

图6:液滴光出租车测定 (A)将25μL细胞悬浮液的9个液滴放置在白色塑料片上,并由绿色LED从侧面照射。(B) 照明3分钟后。在每个液滴中,细胞要么积聚在光源侧(正光出租车),要么积聚在另一侧(负光出租车),要么扩散到液滴中(无光出租车)。比例尺 = 1 cm .请点击此处查看此图的放大图。
5. 显微镜下的光氧化测定
- 将〜30μL细胞悬浮液(1 x 106 个细胞/ mL在光行为实验溶液中)带到载玻片上,并放置盖玻片(18 mm x 18 mm),顶部有垫片(图7)。
注意:垫片可以用白色石油或双面胶带在盖玻片的两个相对面上制成。光需要来自没有垫片的方向。 - 在没有带有绿色LED的垫片的情况下从盖玻片的一侧照射样品,并在暗淡的红光下用10倍物镜在暗场显微镜下观察细胞(λ>630nm,〜5μmol光子·m−2·s−1, 图8)。
注:避免将舞台上的细胞暴露在LED或观察灯以外的光线下,例如房间照明或来自PC显示器的光线。物镜的适当放大倍率取决于相机的视角。选择一个放大倍率允许细胞在不离开视野的情况下游动约2秒的镜头。为了跟踪细胞,需要高对比度的图像;因此,建议使用暗场聚光镜进行显微镜观察。然而,其他聚光镜,如明场,可以用来观察光出租车。确保 LED 发出的光照射在电池上。 - 使用配备相机的显微镜记录光照后约20秒的细胞运动。
注:绿色LED照明开始后几秒钟,可能会发生光震响应,和/或光定向(或符号)不稳定;因此,建议进行20秒的录音以稳定响应(电影1)。

图 7:在盖玻片边缘上制作垫片 (A) 在手掌上涂上一层薄薄的凡士林。少量的白色石油被盖玻片的边缘刮掉。(B) 盖玻片边缘的垫片。(C) 另一个垫片位于另一侧边缘。 请点击此处查看此图的大图。

图 8:显微镜下的侧面照明( A) 绿色 LED 的设置。炮弹型绿色LED固定在消音器上,并固定在显微镜旁边的支架上。在具有尖锐切割滤光片(λ> 630nm)的暗场显微镜下观察细胞。(B) 由绿色指示灯照亮的侧面。 请点击此处查看此图的大图。
电影1:显微镜下的光出租车测定。 绿灯从右侧约 0 秒处亮起。在这一点上,细胞倾向于向随机方向游动。在时间计数器中0秒后,细胞向右或向左游动,显示正或负光偏移。当细胞再次开始向随机方向游动时,灯在大约15秒时关闭。比例尺 = 100 μm .请点击这里下载这部电影。
6. 光定向细胞的跟踪和极性直方图绘制
- 从录制的视频中提取1.5秒,照明后15秒开始。
注意:轨迹持续时间可能会根据细胞的游泳速度而变化。1.5 秒的视频包含 46 帧,录制速度为 30 fps。 - 通过文件>导入图像序列,将文件作为标记 图像文件格式图像序列导入斐济>。
- 使用插件运行插件"手动跟踪"以进行细胞跟踪 >跟踪>手动跟踪。
- 单击 "添加轨道",将出现第一个帧。
- 单击 感兴趣的单元格,将出现第二个框架。
- 将滑块移动到最后一帧,然后单击步骤 6.5 中的同一单元格。
注意:不必跟踪每帧中的单元格。只有光轴与起点和终点形成的线段之间的角度才是必不可少的。 - 重复步骤 6.4.-6.6。用于约30个细胞。
注意:选择在整个 1.5 秒内保持在视角内的单元格。如果细胞密度足够低,并且没有细胞游泳轨迹相交1.5秒,则可以执行自动跟踪。在这种情况下,选择插件" MTrack2"(典型设置:最小对象大小= 1;最大对象大小 = 10,000;最大速度 = 100;最小粘性长度 [框架] = 46)。建议通过选中 "显示文本?">"叠加点/线"来获取数据,从而验证视频上单元格与跟踪结果之间的对应关系。 - 将结果复制并粘贴到电子表格软件(例如 Excel)中。
注意:这里显示了如何使用Excel绘制极坐标直方图。 - 通过"=度(atan2(x2-x1),-(y2-y1))"测量光轴与单元格游泳方向之间的角度,其中单元格的起始位置(切片#1)是(x1,y1),最后一个位置(切片#46)是(x2,y1)。
注意:在斐济图像中,左上角是原点 (0, 0)。 - 重复步骤 6.9。对于所有测量的细胞(通常约30个细胞)。
- 使用−180°至+180°的箱子获得的所有数据准备频率分布表,使用"FREQUENCY"功能在两端分为15°,其余部分分为30°。
注意:选择立即进入 bin 列的列后,在顶部列 = FREQUENCY(data_array,bins_array) 中输入以下内容,然后按 shift + ctrl + Enter 键(补充图 1)。 - 使用步骤 6.8 中计算的值重新创建频率分布表。旋转−90°以将右侧设置为0°(即,将范围从−15°到15°,到−105°到−75°范围内的数字转换),因为使用上述方法,向上游动的细胞被认为与光的角度为0°(即,显示正光出租车),尽管光来自右侧(补充图2)。
- 在30°箱的范围中间输入角度值(例如,30°表示15°-45°),跳过一列,并在其右侧输入相应的样品计数(补充图3)。
- 将每个样本计数值转换为百分比,并在与箱之间的空白列对应的列中输入 0。
- 使用角度值作为水平轴标签,使用百分比 (%) 值作为图例绘制雷达图(补充图 4)。
- 通过平均cosθ(θ = 光轴与游泳方向之间的角度)来计算光定向指数(PI)以进行进一步量化16。
注意:当细胞沿随机方向游动时,PI分别为0,当100%的细胞显示阳性或阴性光出租车时,PI分别为1或−1。
7. 显微镜下的光锤反应测定
- 将〜30μL细胞悬浮液(1 x 106 个细胞/ mL在光行为实验溶液中)放在载玻片上,并将盖玻片(18 mm x 18 mm)与垫片放在顶部,如步骤4.1所示。
- 在具有暗红光(λ>630 nm,~5 μmol光子·m−2·s−1)的显微镜下观察细胞。
- 使用相机闪光灯应用闪光灯照明(动画2,3)。
注意:诱导光震响应的另一种方法是用手从观察光路中快速移除红色滤光片。但是,由于过滤器的去除速度因人而异,因此此方法的可变性更大(电影4,5)。 - 使用配备相机的显微镜记录细胞运动。
- 对于定量,执行以下一项或两项:(1)计算显示每总细胞16的光震响应的细胞比率;(2)对于细胞表现出光激反应,测量从光激刺激到恢复向前游泳的时间25.
短片 2:相机闪光灯照亮照片。 相机闪光灯被举到显微镜载物台上并打开。 请按此下载此影片。
电影3:显微镜下闪光灯引起的光晕反应。 在昏暗的红光下观察细胞。在~0秒时发出闪光。几乎所有的细胞都停止了向前游动,向后游了一小段时间,并恢复了向前游动。比例尺 = 100 μm .请点击这里下载这部电影。
电影4:在显微镜下移除红色滤光片引起的照片冲击反应。 在昏暗的红光下观察细胞。红色滤光片在~5秒时被移除。几乎所有的细胞都停止了向前游动,向后游了一小段时间,并恢复了向前游动。比例尺 = 100 μm .请点击这里下载这部电影。
电影 5:删除红色滤镜。 快速移除光路中设置的红色滤光片,以提供光晕。 请按此下载此影片。
Access restricted. Please log in or start a trial to view this content.
结果
这里显示了典型的 莱因哈迪 猪笼草光出租车和光冲击反应测定。细胞密度估计后,用光行为实验溶液洗涤野生型细胞培养物(交叉CC-124×CC-125的后代,agg1 + mt -)23 用于光出租车培养皿测定。将细胞悬浮液置于昏暗的红光下约1小时。将2mL细胞悬浮液置于3.5cm培养皿中。培养皿被轻轻摇晃,放在灯箱上,并用固定在支架上的相机拍照。在这种情况下,细胞显示出明显的负光?...
Access restricted. Please log in or start a trial to view this content.
讨论
目前的协议简单且不耗时。如果怀疑 莱纳迪 猪笼草突变体存在光感受或睫状体运动缺陷,则该方法可用作主要表型分析。
但是,存在一些关键步骤。一种是在对数生长阶段的早期到中期在实验中使用细胞。长时间培养后,细胞变得不那么活跃,对光敏感,甚至形成棕榈类化合物(细胞团块)27。另一个重要步骤是在实验前将细胞暴露在红光下(步骤2...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
这项研究得到了日本科学促进会KAKENHI(https://www.jsps.go.jp/english/index.html)到NU(19K23758,21K06295),TH(16H06556)和KW(19H03242,20K21420,21H00420),大隅前沿科学财团(https://www.ofsf.or.jp/en/)到KW的资助,以及从人类,环境和材料桥接人类,环境和材料动态联盟(http://alliance.tagen.tohoku.ac.jp/english/)到NU,TH和KW的资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
参考文献
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。