このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
クラミドモナス・ラインハルティイにおける光挙動の観察
* これらの著者は同等に貢献しました
要約
ほとんどの遊泳光独立栄養生物は、光誘発性行動変化(光行動)を示す。本プロトコールは、モデル生物 クラミドモナス・ラインハルティイにおける前記光挙動を観察する。
要約
運動性光栄養微生物の生存のためには、適切な光条件下での生存が極めて重要である。その結果、それらは光誘発行動(または光行動)を示し、光に応答して移動方向を変える。典型的な光行動には、光ショック(または光恐怖症)反応および光タクシーが含まれる。光ショックは、光強度の突然の変化(例えば、フラッシュ照明)に対する応答であり、ここで、生物は一過性に動きを止めるか、または後退する。フォトタクシーの間、生物は光源に向かって、または反対の方向に移動します(それぞれ、正または負のフォトタクシーと呼ばれます)。単細胞緑藻 クラミドモナス・ラインハルティイ は、光受容後の繊毛(別名鞭毛)の鼓動を調節することによって水泳パターンを急速に変化させるため、光行動を研究する優れた生物である。ここでは、 C. reinhardtiiにおける光挙動を観察するための様々な簡単な方法が示されている。 C. reinhardtiiの光行動に関する研究は、真核生物繊毛とチャネルロドプシンの間に共通の調節機構の発見につながり、繊毛症の理解を深め、新しい光遺伝学的方法の開発に貢献する可能性がある。
概要
光は光合成生物にとって不可欠なエネルギー源ですが、光が多すぎると光酸化的な損傷を引き起こす可能性があります。したがって、光栄養生物は、光合成はできるが光酸化的損傷を受けない適度な強度の光の下で生存する必要がある1。陸上植物では、葉緑体は葉から出て細胞内の写真の動きを示すことはできません。葉緑体は、高光下では細胞の周囲に移動し、低光下では細胞表面2に移動するが、多くの運動性藻類は、光合成のための適切な光条件を見つけることを可能にする光挙動を示し、したがって、それらの生存を促進する3。
クラミドモナス・ラインハルティイは、繊毛(別名、鞭毛)、光合成、光行動などの研究分野でモデル生物と見なされている単細胞緑藻です。C. reinhardtiiは、細胞ごとに1つのアイスポットと2つの繊毛を提示し、それぞれ受光と水泳に使用されます。アイスポットには、チャネルロドプシン(ChR)、原形質膜内の光依存性イオンチャネル、およびChRのすぐ後ろに位置するカロテノイドに富む顆粒層の2つの成分があります。アイスポットは、カロテノイドに富む顆粒層が光反射体として機能するので、指向性光受容体として作用する4,5。
ChRsは当初、C. reinhardtii6,7,8,9において光挙動を引き起こす光受容体として同定された。2つのアイソフォーム、ChR1およびChR2がアイスポットに見出されるが、ノックダウン実験は、ChR1が光挙動10の主要な光受容体であることを示した。それにもかかわらず、ChR2はより注目を集め、光11による細胞励起を制御する技術である光遺伝学の開発において中心的な役割を果たしてきた。したがって、C. reinhardtiiにおける光挙動を支配する調節機構を研究することは、ChR機能の理解を深め、光遺伝学を改善するであろう。
光受容後、 C. reinhardtii 細胞は、フォトタクシーとフォトショック応答の2種類の光挙動を示す12。フォトタクシーは、光源の方向または反対方向に泳ぐ細胞の挙動であり、それぞれ正または負のフォトタクシーと呼ばれます。光ショック応答は、フラッシュによって照らされたときなど、光強度の急激な変化を感知した後に細胞が示す行動である。細胞は、泳ぐのをやめるか、または逆向きに泳ぐ(すなわち、細胞体を前方に泳ぐ)短期間、典型的には<1秒である。
C. reinhardtiiの毛様体の動きは、その写真行動に関与しています。2つの繊毛は通常、人間の平泳ぎのように泳ぐように鼓動し、これは光行動のために変調されます。光タクシーの場合、2つの繊毛によって生成される力は、各繊毛13の拍動周波数および波形振幅の変調によって不均衡になる。アイスポットに最も近い繊毛はシス繊毛と呼ばれ、もう一方はトランス繊毛と呼ばれます。これら2つの繊毛は様々な点で異なります。例えば、インビトロでのトランスシリウムの毛様体拍動頻度は30%〜40%高い14。また、それらのCa2+感度は異なる。デメンブラン化細胞モデル15の再活性化は、シス繊毛がCa2+ <1 x 10−8 Mではトランス繊毛よりも強く鼓動することを示したが、Ca2+ >1 x 10−7 Mではその逆が当てはまる。Ca2+感度におけるこの非対称性は、この非対称性を欠く変異体が正常なフォトタキシスを示さないため、フォトタクティクスターンにとっておそらく重要である16,17。逆に、光衝撃には波形変換が必要です。毛様体波形は、前方スイミングにおける非対称波形から、後方スイミングにおける対称波形に変換される。この波形変換は、Ca2+によっても1 x 10−4 M18,19の閾値で安定化されます。毛様体運動の調節における欠陥はヒトに原発性毛様体ジスキネジアを引き起こすので、C. reinhardtiiにおける光行動を研究することは、これらの疾患および治療開発のよりよい理解に役立つかもしれない20。
本明細書では、 C. reinhardtii における光挙動を観察するための4つの簡単な方法が実証される。第1に、シャーレを用いたフォトタクシーアッセイが示され、第2に、細胞懸濁液液滴に対するフォトタクシーアッセイが示されている。どちらの場合も観察される現象は、厳密にはフォトタクシーではなく、細胞が光源側または反対側の近くに蓄積する傾向がある光蓄積である。 C. reinhardtiiでは、写真の蓄積は主にフォトタクシーによって引き起こされ、フォトタクシーの近似として使用できます。第三に、顕微鏡下でのフォトタクシーのより厳密なアッセイが示され、最後に顕微鏡下でのフォトショックアッセイである。
Access restricted. Please log in or start a trial to view this content.
プロトコル
本研究では、agg1+mt-との交叉CC-124 x CC-125の子孫である クラミドモナス・ラインハルティイの野生型株21を用いた。CC-124およびCC-125は、クラミドモナス資源センター( 材料表参照)から入手し、20-25°Cでトリス-酢酸-リン酸(TAP)22、1.5%アガロース培地上に維持した。 任意の運動性株をこのプロトコルに使用することができる。
1. 細胞培養
- クラミドモナス・ラインハルティイの目的株をTAP液体培地中で、滅菌空気を12時間/12時間の明暗期(明期、~50μmol光子・m−2・s−1白色光)で20~25°Cで2日間培養する。
注:中間対数増殖期の細胞を使用する必要があります。長時間培養(>3日間、後期対数増殖期)は、細胞を光刺激に対する感受性を低下させ、培養中の死細胞の数を増加させ、結果の読み出しを妨げる。

図1:2日間培養後の液体培養。 TAP-1.5%寒天プレートから、白金耳を充填した野生型細胞の塊を、フラスコ内の〜150mLのTAP液体培地に接種した。2日間培養後の細胞密度は〜5.0 x106 細胞/ mLであった。 この図の拡大版を表示するには、ここをクリックしてください。
2. 細胞の前処理
- 約10μLの培養物を等量の脱落溶液と混合して細胞の遊泳を止め、セルカウンターまたは血球計数器を使用して細胞密度を測定する。
注: 2 日間の培養後には約 1 ~ 5 x106 個の細胞/mL があります(図 1)。脱リチウム溶液の組成は以下の通りである:40 mM酢酸カリウム、1 mM CaCl2、HClでpH4.5調整した。 - 必要量の液体培養物を1000 x g で室温で3分間遠心分離する。
注:1回の実験では、ペトリ皿でのフォトタクシーアッセイの標準条件に3 mLの2 x107 細胞/ mLが必要です。1 x106 cells/mL の培養で 2 つの実験を行う場合は、120 mL の培養物を遠心分離する必要があります。 - 必要量の光挙動実験溶液で細胞ペレットを約2 x107 細胞/mL(ディッシュフォトタクシーアッセイ用)または1 x106 細胞/ mL(細胞レベルの光タクシーアッセイまたは光ショック応答アッセイ用)に懸濁し、細胞懸濁液を円錐形チューブに入れます。
注:細胞密度は、光挙動の大まかな推定のために厳密に制御する必要はなく、アッセイの目的に応じて変化する可能性があります。光挙動実験液14:5 mM HEPES(pH 7.4)、0.2 mM EGTA、1 mM KCl、0.3 mMCaCl2。このバッファー交換工程は、光挙動を示す能力に関する簡単なアッセイのために省略することができ、実験は培養培地を用いて行うことができる。しかしながら、溶液のイオン組成はフォトタクチック徴候24に影響し、培養後の培地のイオン組成は一定ではない可能性があるため、より厳密なアッセイのためにこの溶液を使用することが推奨される。新鮮なTAP培地への置換もオプションとなり得る。 - チューブを薄暗い赤色光(10~30μmolの光子・m−2・s−1)の下に約1時間置きます(図2)。
注:このステップは、光刺激に対する細胞の感度を高めます。

図2:赤色光下での細胞懸濁液。 赤いセロハンのシートで覆われた規則的な蛍光白色光。細胞懸濁液を含むチューブを、〜10μmol光子・m−2・s−1 赤色光の下に置く。 この図の拡大版を表示するには、ここをクリックしてください。
シャーレを用いたフォトタクシーアッセイ(いわゆる「ディッシュアッセイ」)
- 2〜3mLの細胞懸濁液をシャーレ(3.5cm)に入れ、ライトボックス(または白い紙または白いプラスチックプレート)の上に置き、細胞を均一に分配するために静かに振って、照明前に画像を取得する。
注:皿のサイズは目的に応じて変更することができます。菌株や培養の状態によっては、細胞がシャーレの底にくっつくことがあります。このような場合、接着した細胞は、アッセイ前にピペッティングによって除去される必要がある。 - デスクトップ暗室で緑色の発光ダイオード(LED、 材料表を参照)で皿を片側から照らします(図3)。
注:典型的な光条件は、λ = 525nmおよび50〜100μmol光子・m−2・s−1である。光源波長の選択については、ディスカッションセクションを参照してください。小さなLEDを使用する場合は、皿とLEDの両方を箱または黒い布で覆います。 - それらを≥5分間放置してから画像を取得します。
メモ:光照明の時間は、シャーレのサイズや目的に応じて変更できます(図4)。 - 定量化のために画像ファイルをフィジーにインポートします( 材料表を参照)。
注:フィジーはImageJ2のディストリビューションで、多くのプラグインをバンドルしています。 - [画像>タイプ]でカラー画像をグレースケールに変更>8ビットにします(図5)。
- 編集と反転で白黒 を反転>ます。
- 皿全体を関心領域 (ROI) として囲み、[分析と測定] で密度 >測定します。
注:料理全体の密度は、(面積)x(平均)として計算できます。 - 光源に最も近い皿の半分をROIとして囲み、密度を測定します。
- (全細胞の密度)あたり(光戦術細胞の密度)としてフォトタクティクス指数を計算します。

図3:フォトタクシーディッシュアッセイのためのサイド照明(A)デスクトップ暗室のライトボックスに置かれた細胞懸濁液を含むペトリ皿。緑色光(525nmのLEDプレート、約100μmolの光子・m−2・s−1)が側面から照らされた。(b)代替照明方法。5mm砲弾型LED。(C)外部からの光を遮るために、デスクトップ暗室の代わりに、内側に黒い布が付いた箱を使用することができます。この図の拡大版を表示するには、ここをクリックしてください。

図4:5分間側方照射後のネガティブフォトタクシーの例(A)シャーレ中の野生型細胞懸濁液を5分間照明した。ほとんどの細胞は光源の反対側に蓄積した。これらのデータは、ネガティブフォトタクシーとして解釈することができます。(B)上から見た料理のイメージ。この図の拡大版を表示するには、ここをクリックしてください。
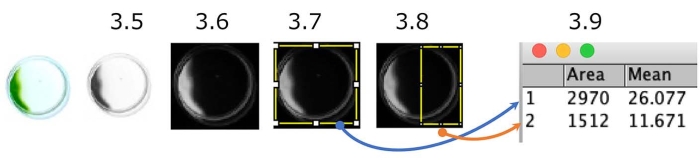
図5:ディッシュフォトタクシーアッセイの定量化。 陰性フォトタクシーを示す細胞の例(光源は右側にあります)。カラー画像がグレースケールに変換され(ステップ 3.5)、反転されます (ステップ 3.6)。関心領域(ROI)、ディッシュ全体(ステップ3.7)、およびディッシュの光源側半分(ステップ3.8)を区切った。各ROIの密度を測定した(ステップ3.この場合、フォトタクティクス指数(PI)は約0.18([1,512 x 11.671] / [2,970 x 26.077])です。PIは、すべての細胞がそれぞれ正または陰性の光タクシーを示す場合、1または0である。 この図の拡大版を表示するには、ここをクリックしてください。
4. 細胞培養液滴を用いた光タクシーアッセイ
- 25 μL の細胞懸濁液液滴 (Step 2.4.) を、マイクロピペットを使用して白いプラスチックプレートに直接置きます。
- デスクトップの暗室で緑色のLEDで片側から液滴を照らします(図6)。
注:典型的な光条件は、λ = 525nmおよび50〜100μmol光子m−2s−1である。小さなLEDを使用する場合は、プレートとLEDの両方を箱または黒い布で覆います。 - それらを3分間放置してから画像を取得します。
注:このアッセイは、変異スクリーニングやテトラッド分析など、一度に多くのサンプルの光タクシーの迅速なチェックに適しています。96ウェルプレートで増殖させた中間対数期の細胞培養物を、より容易な性能のために直接照明することができる。いずれの場合も、ステップ2(細胞前処理)は省略することができる。

(A)25 μLの細胞懸濁液の9つの液滴を白いプラスチックシートの上に置き、緑色のLEDで側面から照らした。(B)3分後照明。各液滴において、細胞は光源側に蓄積し(正のフォトタクシー)、反対側に蓄積するか(ネガティブなフォトタクシー)、または液滴に拡散する(フォトタクシーなし)。スケール バー = 1 cm。この図の拡大版を表示するには、ここをクリックしてください。
顕微鏡下での光タクシーアッセイ
- 約30 μLの細胞懸濁液(光挙動実験溶液では1 x106 cells/mL)をスライドガラスの上に置き、スペーサー付きのカバースリップ(18 mm x 18 mm)を置きます(図7)。
メモ:スペーサーは、カバースリップの反対側の2つの側面に白い石油または両面粘着テープで作ることができます。光はスペーサーのない方向から来る必要があります。 - スペーサーなしでカバースリップの片側から緑色LEDでサンプルを照らし、薄暗い赤色光(λ > 630 nm、約5 μmolの光子・m−2・s−1、図8)の下で10倍対物レンズを備えた暗視野顕微鏡下で細胞を観察します。
メモ: ステージ上のセルを、部屋の照明や PC モニターの光など、LED や観察光以外の光にさらさないでください。対物レンズの適切な倍率は、カメラの画角によって異なります。セルが視野を離れることなく〜2秒間泳ぐことができる倍率のレンズを選択します。細胞を追跡するには、高コントラスト画像が望ましい。したがって、顕微鏡観察には暗視野コンデンサーの使用が推奨されます。しかし、明視野などの他のコンデンサーは、フォトタクシーを観察するために使用することができます。LED からのライトがセルに照らされていることを確認します。 - カメラ付き顕微鏡を使用して、光照射後〜20秒間の細胞の動きを記録します。
注:緑色のLED照明の開始から数秒後に、光衝撃応答が発生したり、光戦術の向き(またはサイン)が安定しないことがあります。したがって、応答安定化のために20秒の記録が推奨されます(動画1)。

図7:カバースリップの端にスペーサーを作る (A)ワセリンの薄い層を手のひらに塗布した。少量の白い石油がカバースリップの端でこすり落とされました。(B) カバースリップの端にあるスペーサー。(C)反対側の端に別のスペーサー。 この図の拡大版を表示するには、ここをクリックしてください。

図8:顕微鏡下での側面照明 (A)緑色LEDのセットアップキャノンボール型の緑色LEDをマフに固定し、顕微鏡の横のスタンドに固定します。細胞をシャープカットフィルター(λ>630nm)を備えた暗視野顕微鏡下で観察した。(B)緑色LEDによる側面照明。 この図の拡大版を表示するには、ここをクリックしてください。
動画1:顕微鏡下でのフォトタクシーアッセイ。 緑色のライトは、右から約0秒で点灯しました。その時点で、細胞はランダムな方向に泳ぐ傾向がありました。タイムカウンターで0秒後、細胞は右または左に泳ぎ、正または陰性のフォトタクシーを示した。光は、細胞が再びランダムな方向に泳ぎ始めたとき、〜15秒で消灯した。スケール バー = 100 μm。 このムービーをダウンロードするには、ここをクリックしてください。
6. フォトタクティクス細胞の追跡と極ヒストグラム描画
- 録画したビデオから1.5秒を抽出し、照明の15秒後に開始します。
メモ: 軌道の持続時間は、セルの遊泳速度に応じて変わることがあります。1.5 秒のビデオには、30 fps 録画で 46 フレームが含まれています。 - ファイルをタグ画像ファイル形式の画像シーケンスとしてフィジーに インポートするには、ファイル>>画像シーケンスをインポートします。
- プラグイン「手動追跡」を実行して、 プラグインと手動追跡を使用してセル追跡>>します。
- [トラックの追加]をクリックすると、最初のフレームが表示されます。
- 目的のセルをクリックすると、2番目のフレームが表示されます。
- スライダを最後のフレームに移動し、手順 6.5 と同じセルをクリックします。
メモ: フレームごとにセルを追跡する必要はありません。光軸と始点と終点によって形成される線分の間の角度のみが重要です。 - 手順 6.4.-6.6 を繰り返します。〜30セル用。
メモ: 1.5 秒全体にわたって画角内に残るセルを選択します。セル密度が十分に低く、セルの遊泳軌道が1.5秒間交差しない場合、自動トラッキングを実行できます。その場合は、プラグイン「MTrack2」を選択してください(典型的な設定:最小オブジェクトサイズ= 1;最大オブジェクトサイズ = 10,000;最大速度 = 100;最小タック長 [フレーム] = 46)。ビデオ上のセルと追跡結果との対応関係を確認するには、[ テキストを表示?] > [オーバーレイの点と線] をオンにしてデータを取得することをお勧めします。 - 結果をコピーして表計算ソフト(Excelなど)に貼り付けます。
注: ここでは、Excel で極座標ヒストグラムを描画する方法を示します。 - セルの開始位置(スライス#1)が(x1,y1)で、最後の位置(スライス#46)が(x2,y1)である「=度(atan2(x2-x1),-(y2-y1))」で、光軸とセルの泳ぐ方向との間の角度を測定します。
注: フィジーの画像では、左上隅が原点(0, 0)です。 - 手順 6.9 を繰り返します。測定されたすべての細胞(典型的には〜30細胞)について。
- 「FREQUENCY」関数を使用して、-180°から+180°までのビンで得られたすべてのデータの度数分布表を、両端で15°、残りの範囲で30°に分割します。
メモ: 列をすぐにビン列まで選択したら、一番上の列 =FREQUENCY (data_array、bins_array) に次のように入力し、 shift + Ctrl + Enter キーを押します (補足図 1)。 - ステップ6.8で計算した値で度数分布表を再作成します。上記の方法では、光は右から来ているにもかかわらず、上向きに泳ぐ細胞は光に対して0°の角度で泳いでいる(すなわち、正の光タクシーを示す)と考えられるので、右側を0°に設定するために−90°回転した(すなわち、−15°から15°の範囲の数値を−105°から−75°の範囲に変換する(すなわち、肯定的な光タクシーを示す)。
- 30°ビンの範囲の中央に角度値を入力し(たとえば、15°-45°の場合は30°)、1つの列をスキップして、対応するサンプル数を右側に入力します(補足図3)。
- 各サンプルカウント値をパーセンテージに変換し、ビン間の空白列に対応する列に0を入力します。
- 角度値を横軸ラベルとして、パーセント値 (%) を凡例として使用してレーダー チャートを描画します (補足図 4)。
- cosθ(θ=光軸と遊泳方向とのなす角)を平均化して、さらに定量化するためにフォトタクティクスインデックス(PI)を計算します16。
注:PIは、細胞がランダムな方向に泳いでいるときは0で、細胞の100%が正または負の光タクシーを示している場合は1または-1です。
7. 顕微鏡下での光ショック応答アッセイ
- ステップ4.1のように、約30 μLの細胞懸濁液(光挙動実験溶液では1 x106 cells/mL)をスライドガラスの上に置き、上部にスペーサー付きのカバースリップ(18 mm x 18 mm)を置きます。
- 薄暗い赤色光(λ > 630 nm、~5 μmol光子・m−2・s−1)で顕微鏡下で細胞を観察します。
- カメラのフラッシュを使用してフラッシュ照明を適用します(ムービー2、3)。
注:フォトショック応答を誘発するもう1つの方法は、観察光路から赤色フィルターを手で素早く取り外すことです。ただし、この方法は、フィルターの取り外し速度が人によって異なるため、より可変です(ムービー4,5)。 - カメラ付き顕微鏡を使用して細胞の動きを記録します。
- 定量化のために、以下のいずれかまたは両方を行う:(1)全細胞16当たりの光ショック応答を示す細胞の比率を計算する;(2)光ショック応答を示す細胞について、光ショック刺激から順泳25の回復までの時間を測定する。
動画2:カメラのフラッシュによるフォトショック照明。 カメラのフラッシュを顕微鏡ステージにかざし、電源を入れた。 この映画をダウンロードするにはここをクリックしてください。
動画3:顕微鏡下でのフラッシュによる光衝撃反応。 細胞は薄暗い赤色光下で観察した。閃光が約0秒で放出された。ほとんどすべての細胞が前方泳ぎをやめ、短期間後方に泳ぎ、前方泳ぎを回復した。スケール バー = 100 μm。 このムービーをダウンロードするには、ここをクリックしてください。
動画4:顕微鏡下で赤いフィルターを外すことによる光衝撃反応。 細胞は薄暗い赤色光下で観察した。赤色フィルターを〜5秒で除去した。ほとんどすべての細胞が前方泳ぎをやめ、短期間後方に泳ぎ、前方泳ぎを回復した。スケール バー = 100 μm。 このムービーをダウンロードするには、ここをクリックしてください。
動画5:赤いフィルターの取り外し 光路にセットされた赤色フィルターを素早く取り外して、フォトショックを与えます。 この映画をダウンロードするにはここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
典型的な C. reinhardtii フォトタクシーおよびフォトショック応答アッセイがここに示されている。細胞密度推定後、野生型細胞培養物(agg1+mt-を有するCC-124×CC-125の交配の子孫)23 を、光タクシーディッシュアッセイ用の光挙動実験溶液で洗浄した。細胞懸濁液を薄暗い赤色光の下に〜1時間置いた。2 mLの細胞懸濁液を3.5 cmシャーレに入れた。ペトリ皿を軽く振ってライト?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
現在のプロトコルは簡単で、時間がかかりません。 C. reinhardtii 変異体が光受容または毛様体運動に欠陥を呈している疑いがある場合、この方法は一次表現型解析として役立つ可能性がある。
ただし、いくつかの重要な手順が存在します。1つは、初期から中期に細胞を実験に使用することです。長期間培養すると、細胞は運動性が低下し、光感受性が低下し、パル...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らには開示するものは何もありません。
謝辞
本研究は、科学研究費助成事業(基盤研究(https://www.jsps.go.jp/english/index.html)からNU(19K23758、21K06295)、TH(16H06556)、KW(19H03242、20K21420、21H00420)、大隅フロンティアサイエンス財団(https://www.ofsf.or.jp/en/)からKW、および人間・環境・材料をつなぐオープンイノベーションダイナミックアライアンス(http://alliance.tagen.tohoku.ac.jp/english/)からNU、TH、KWへの助成を受けて実施されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
参考文献
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved