Method Article
رصد استجابات الإشارات على الهدف في يرقات الزرد - يكشف Z-REX عن آليات دقيقة للأدوية والمستقلبات المحبة للكهرباء
In This Article
Summary
الزرد الذي يستهدف الإلكتروفيل والمؤكسدات التفاعلية (Z-REX) هو طريقة قائمة على البيولوجيا الكيميائية للتحقيق في إشارات الجزيئات الصغيرة التفاعلية. يمكن تطبيق هذه التقنية على الأسماك الحية في مراحل النمو المختلفة. هنا ، نقوم بإقران المقايسات القياسية في الزرد مع Z-REX لتحليل مسار الإشارة.
Abstract
تعد المستقلبات التفاعلية والأدوية المحبة للكهرباء ذات الصلة من بين الجزيئات الصغيرة الأكثر تحديا للدراسة. النهج التقليدية لتفكيك طريقة العمل (MOA) لهذه الجزيئات تستفيد من المعالجة السائبة للعينات التجريبية مع وجود فائض من الأنواع التفاعلية المحددة. في هذا النهج ، فإن التفاعل العالي للإلكتروفيل يجعل وضع العلامات غير التمييزية للبروتين بطريقة تعتمد على الوقت والسياق. يمكن أيضا أن تتأثر البروتينات والعمليات الحساسة للأكسدة والاختزال بشكل غير مباشر وغالبا ما لا رجعة فيه. في ظل هذه الخلفية من الأهداف المحتملة التي لا حصر لها والآثار الثانوية غير المباشرة ، يظل ربط النمط الظاهري بإشراك هدف محدد مهمة معقدة. تم تصميم Zebrafish الذي يستهدف المحبة الكهربائية التفاعلية والمؤكسدات (Z-REX) - وهي منصة توصيل تفاعلية للكهرباء عند الطلب تم تكييفها للاستخدام في يرقات الزرد - لتوصيل الإلكتروفيل إلى بروتين معين مهم (POI) في أجنة الأسماك الحية غير المضطربة. تشمل الميزات الرئيسية لهذه التقنية مستوى منخفضا من الغزو ، إلى جانب توصيل دقيق للجرعة والنمط الكيميائي والزمان المكاني الذي يتم التحكم فيه بالكهرباء. وبالتالي ، بالاقتران مع مجموعة فريدة من الضوابط ، تتجنب هذه التقنية التأثيرات غير المستهدفة والسمية الجهازية ، والتي لوحظت بخلاف ذلك بعد التعرض الجماعي غير المنضبط للحيوانات لمحبة كهربائية تفاعلية وعقاقير محبة للكهرباء متعددة الخواص. بالاستفادة من Z-REX ، يمكن للباحثين إنشاء موطئ قدم في فهم كيفية تغيير استجابات الإجهاد الفردية ومخرجات الإشارات نتيجة لمشاركة الرباط التفاعلية المحددة مع POI محدد ، في ظل ظروف شبه فسيولوجية في الحيوانات الحية السليمة.
Introduction
يتضمن عدد لا يحصى من أحداث الإشارات الخلوية تفاعلات بين جزيئات تفاعلية صغيرة (يتم إنتاجها داخليا في الخلية أو xenobiotics / xenometabolites ، مثل الأدوية) وهدفها البروتيني. في كثير من الحالات ، يمكن أن يؤدي المستوى المتكافئ لأحداث الارتباط التساهمي هذه إلى استجابات خلوية ، مما يؤدي إلى تغييرات ، على سبيل المثال ، في النمو ، والتمثيل الغذائي ، وموت الخلايا المبرمج ، و / أو الاستجابة المناعية1. ومع ذلك ، فقد ثبت أن تفكيك طريقة العمل (MOA) من خلال ربط أحداث ملزمة محددة بعواقبها المظهرية يمثل تحديا. غالبا ما تؤدي طرق جرعات البلعة التقليدية التي تنطوي على إدخال تركيزات عالية من الأنواع التفاعلية إلى تعديل العديد من البروتينات ، فضلا عن السمية المفرطة للكائن النموذجي2. مثل هذه الظروف بعيدة عن المثالية. تم تطوير طريقة لحل هذه المشكلات في زراعة الخلايا باستخدام توصيل إلكتروفيل موضعي دقيق في سياق خلوي أصلي ، يسمى T-REX (المحبة والمؤكسدات التفاعلية القابلة للاستهداف) 3. في السنوات الفاصلة ، تحول التركيز إلى التجارب في الكائنات الحية بأكملها ، والتي تتيح الفرصة لدراسة البروتينات في سياقات خلوية محددة في الخلايا غير المتحولة. وبالتالي ، قمنا بتوسيع التقنية لتكون متوافقة مع العديد من النماذج ، بما في ذلك نماذج جنين Danio rerio . هنا ، نقدم Z-REX (الزرد الذي يستهدف الإلكتروفيل التفاعلي والمواد المؤكسدة) (الشكل 1).
لفهم Z-REX ، تقدم هذه المقالة أولا تقنيات REX ومفاهيمها الأساسية. في جوهرها ، تقوم هذه التقنيات بنمذجة إشارات الأنواع الكهربية التفاعلية الفسيولوجية الداخلية (RES) من خلال محاكاة كيفية إنتاج الإلكتروفيل الطبيعي محليا في الجسم الحي بدقة مكانية زمانية. يتم التعبير عن البروتين محل الاهتمام (POI) كبناء اندماج لهالة. هذا الأخير يثبت المسبار المنفذ للأنسجة والخامل الذي يحمل RES في قفص ضوئي في قياس متكافئ 1: 1. أحد هذه RES الذاتية هو 4-هيدروكسي نونينال (HNE فيما بعد) ، والذي يتم وضعه في قفص ضوئي في المسبار Ht-PreHNE. في كثير من الحالات ، نستخدم نسخة وظيفية من الألكاين من HNE [أي HNE (alkyne)] ، والتي لها خصائص بيولوجية متطابقة بشكل أساسي مع HNE ، ولكن يمكن تسميتها بكيمياء النقر. يشار إلى المسبار ، الذي يعمل أيضا مع كلورو ألكان للتفاعل مع Halo ، باسم Ht-PreHNE (ألكين). يسمح مجمع اندماج Halo-POI والمسبار المتشكل على هذا النحو بالتوصيل القريب ل RES إلى POI المنصهر عند التشعيع بضوء الأشعة فوق البنفسجية. إذا كان POI يتفاعل بسرعة مع الدقة المحررة ، فإن وضع العلامات التساهمية الناتجة ل POI مع RES يسمح لنا بتحديد cysteines ذات الامتيازات الحركية.
يأخذ Z-REX المزايا المذكورة أعلاه لتقنيات REX ويطبقها على نطاق واسع لدراسة مسارات إشارات محددة في الأسماك الحية. تم تحسين هذا البروتوكول لأسماك الزرد (D. rerio) ، لأنها كائنات فقارية قابلة للتتبع وراثيا وشفافة أثناء التطور ، وبالتالي فهي مثالية للتقنيات الكيميائية البصرية / الوراثية مثل تقنيات REX. ومع ذلك ، من المرجح أيضا أن تعمل استراتيجية مماثلة بشكل جيد على أنواع الأسماك الأخرى القابلة للسحب وراثيا ، نظرا لأن التطبيق الواسع للطريقة يرجع إلى الآلية الزائفة داخل الجزيئات لتوصيل الإلكتروفيل المشتق من الدهون (LDE). في الواقع ، الإجراء متوافق حيويا للغاية ، حيث يمكن معالجة الأسماك باستخدام Z-REX photocaged-electrophile [على سبيل المثال ، Ht-PreHNE (alkyne)] لمدة 48 ساعة على الأقل دون أي تأثيرات ملحوظة على النمو. يعمل بروتوكول مماثل في C. elegans 4,5.
يصف البروتوكول أولا استخدام حقن mRNA لإنتاج تعبير عابر عن بنية اندماج Halo-POI غير الأصلية في نماذج الزرد الجنينية ، بعد 1-1.5 يوم من الإخصاب (dpf). ينتج عن هذا التعبير عن البروتين خارج الرحم في غالبية الخلايا داخل الأسماك (يشار إليها فيما يلي باسم "في كل مكان") ، وليس في أنسجة أو أماكن محددة. ومع ذلك ، تظهر البيانات أنه يمكن ملاحظة التأثيرات الخاصة بالخلية في حالات معينة. بعد الحقن ، يتم تحضين الأجنة بتركيز منخفض [0.3-5 ميكرومتر Ht-PreHNE (ألكاين)] من المسبار لمدة تصل إلى 30.5 ساعة بعد الإخصاب (hpf). بعد ذلك ، في الوقت الذي يحدده المستخدم ، يتم تسليم RES إلى POI داخل الأسماك عن طريق الفك الضوئي لمدة 2-5 دقائق. بعد الفك الضوئي ل RES ، يمكن إجراء مجموعة متنوعة من فحوصات النمط الظاهري النهائية خلال 2-10 ساعات القادمة: 1) التصوير الحي لخطوط المراسل (الشكل 2 أ) ؛ 2) تقييم وضع العلامات المستهدفة من خلال تحليل اللطخة الغربية (الشكل 3) ؛ 3) التحليل النسخي (الشكل 4) ؛ أو 4) التألق المناعي الكامل (الشكل 5).
كمثال على التصوير الحي لخطوط المراسل ، يتم عرض Z-REX جنبا إلى جنب مع التصوير الحي لخطوط الأسماك ، Tg (lyz: TagRFP) و Tg (mpeg1: eGFP) ، لقياس كيفية تعديل RES لنقطة اهتمام محددة لمستشعر كهربائي (أي Keap1) يقلل من مستويات العدلات والبلاعم ، على التوالي ، مع عدم وجود تأثيرات ملحوظة على الخلايا الأخرى في الأسماك. ومع ذلك ، فقد أظهرنا سابقا أنه يمكن إعادة إنتاج علامات POI وإشارات المسار اللاحقة من دراسات T-REX باستخدام Z-REX للعديد من البروتينات: Akt3 6 و Keap17 و Ube2v26. بشكل عام ، مع Z-REX ، يمكن للعلماء دراسة نتيجة (نتائج) التعديل التساهمي لنقاط الاهتمام بواسطة RES في سياق العديد من مسارات الأكسدة والاختزال المعقدة. تم إعداد هذه التقنية لتحديد الأهداف ومخلفاتها الوظيفية لتصميم الأدوية التساهمية وآليات الأدوية الجديدة في نموذج حيواني كامل أكثر صلة بالسياق.
Protocol
تم تنفيذ إجراءات تربية الزرد ومناولته في جامعة كورنيل (الولايات المتحدة) وفقا لإرشادات المعاهد الوطنية للصحة (NIH) ووافقت عليها اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC). تم تنفيذ إجراءات تربية الزرد ومناولته في وحدة الزرد التابعة للمعهد الفيدرالي السويسري للتكنولوجيا في لوزان (EPFL ، سويسرا) وفقا لقانون رعاية الحيوان SR 455 وقانون رعاية الحيوان SR 455.1 ، مع ترخيص بيطري من الكانتون VD-H23.
ملاحظة: في هذا البروتوكول ، يتم استخدام خطوط أسماك Tg ( lyz: TagRFP ) و Tg (mpeg1: EGFP) التي تعبر عن Halo-TeV-Keap1 لإظهار Z-REX. يمكن توسيع هذه الطريقة لتشمل البروتينات الأخرى ذات الأهمية ، وخطوط الأسماك المراسل المعدلة وراثيا ، والمقايسات البيولوجية في اتجاه مجرى النهر. راجع الجدول التكميلي 1 للاطلاع على المخازن المؤقتة المستخدمة في هذه الدراسة. يتم سرد جميع الكواشف والأدوات والمعدات والأجسام المضادة والبلازميدات وسلالات الزرد والمعدات في جدول المواد.
1. إعداد الحمض النووي الريبي المرسال
- قم بإعداد Halo-TeV-Keap1-2xHA و Halo-2xHA-P2A-Keap1-2xHA mRNA باستخدام mMessage mMachine SP6 في مجموعة النسخ المختبري .
ملاحظة: اتبع تعليمات الشركة المصنعة وقم بإجراء تفاعلات مقياس 40 ميكرولتر لكل mRNA. أعد إذابة حبيبات mRNA في 10 ميكرولتر من الماء الخالي من النيوكلياز. - تقييم جودة mRNA وقياس التركيز بواسطة مقياس الطيف الضوئي microvolume وهلام الأغاروز الكهربائي. يجب أن يكون ل mRNA ذو النوعية الجيدة نسبة A260 / A280 حوالي أو أعلى من 2.0.
- قم بتخفيف mRNA إلى 1-1.5 مجم / مل بالماء الخالي من النيوكلياز.
- قسمة محلول mRNA (1-2 ميكرولتر لكل أنبوب) ، وتخزين القسامات عند -80 درجة مئوية.
2. إنتاج أجنة الأسماك
- الخيار 1: إنتاج أجنة الأسماك من النوع البري (WT).
- قم بإعداد 10 أزواج متقاطعة للأسماك في 10 أحواض منفصلة ، حيث يحتوي كل حوض على فاصل بين الأسماك الأم من الذكور والإناث.
ملاحظة: ما مجموعه 10 أزواج متقاطعة توفر عادة عددا كافيا من الأجنة للمقايسات. يمكن تعديل عدد أزواج التهجين وفقا لتصميم / حاجة التجربة وخصوبة الأسماك الأم. - في صباح اليوم التالي ، بعد إعداد الحاقن ، قم بإزالة الفواصل في خمسة من الخزانات. انتظر لمدة 30 دقيقة حتى تتزاوج الأسماك.
- انقل السمكة الأم إلى حوض آخر ، واجمع الأجنة عن طريق تمرير ماء الخزان عبر مصفاة ، ثم اشطف الأجنة من المصفاة إلى طبق بتري 10 سم. سيتم استخدام هذه الأجنة في الجولة الأولى من الحقن.
ملاحظة: إذا كانت جودة البويضات من دفعة معينة رديئة (على سبيل المثال ، البيض معتم بسبب تراكم البروتينات) ، فلا تجمعها مع الأجنة الأخرى. - (اختياري) نفذ إجراءات مماثلة كما هو موضح في الخطوات 2.1.2-2.1.3 على الخزانات الخمسة الأخرى للجولة التالية من الحقن.
ملاحظة: من الأفضل إجراء جولة واحدة فقط من الحقن ، لتقليل فارق السن بين الأجنة. ومع ذلك ، إذا كانت هناك حاجة إلى أجنة أكثر مما يمكن حقنه في دفعة واحدة ، يوصى بإجراء جولتين من الحقن لضمان بقاء الأجنة في مرحلة 1-4 خلايا أثناء حقن mRNA. يمكن تعديل عدد جولات الحقن وفقا لمهارة الحقن لدى المشغل وتصميم التجربة. ومع ذلك ، يقترح تنفيذ الإجراء بأكمله (من إزالة المقسم الأول إلى حقن الجنين الأخير) في غضون 2 ساعة. قد يؤدي الاختلاف الكبير في العمر عبر الأجنة إلى إضعاف موثوقية نتائج التجربة وإمكانية استنساخها.
- قم بإعداد 10 أزواج متقاطعة للأسماك في 10 أحواض منفصلة ، حيث يحتوي كل حوض على فاصل بين الأسماك الأم من الذكور والإناث.
- الخيار 2: إنتاج أجنة أسماك العدلات المعدلة وراثيا / البلاعم غير المتجانسة الزيجوت.
- قم بإعداد 10 أزواج متقاطعة للأسماك في 10 أحواض منفصلة ، مع إدخال كل حوض مع فاصل بين الأسماك الأم من الذكور والإناث: أسماك WT مقابل Tg (lyz: TagRFP) ، أو أسماك WT مقابل Tg (mpeg1: eGFP).
ملاحظة: تجنب التهجين بين الأسماك المعدلة وراثيا غير المتجانسة ، والتي قد تؤثر على قراءات الفلورسنت في اتجاه مجرى النهر حيث تظهر أسماك المراسل متماثلة الزيجوت إشارة فلورية أعلى مقارنة بالأسماك غير المتجانسة الزيجوت. يمكن تمييز خطوط المراسل المعدلة وراثيا وأجنة WT بسهولة عند التصوير. وجود مزيج من WT والأجنة غير المتجانسة في نفس المجموعة ليس مشكلة. lyz:TagRFP يبلغ عن العدلات، و mpeg:eGFP يبلغ عن البلاعم. يمكن تطبيق هذا البروتوكول على خطوط الأسماك الأخرى للمراسلين أيضا. - اتبع الخطوات 2.1.2-2.1.4.
- قم بإعداد 10 أزواج متقاطعة للأسماك في 10 أحواض منفصلة ، مع إدخال كل حوض مع فاصل بين الأسماك الأم من الذكور والإناث: أسماك WT مقابل Tg (lyz: TagRFP) ، أو أسماك WT مقابل Tg (mpeg1: eGFP).
3. إعداد حاقن دقيق
- قم بتشغيل مصدر الهواء ، واضبط الضغط الخلفي على 0.2-0.5 رطل / بوصة مربعة ، واضبط ضغط الحقن على 25-30 رطل / بوصة مربعة. يوصى عادة بالنطاق المحدد للضغط الموضح.
ملاحظة: من الضروري أن يكون لديك ضغط خلفي ثابت لمنع ارتجاع وسائط الأسماك في الإبرة. عند معايرة حجم الحقن في الخطوة 3.8 ، يجب تغيير وقت الحقن فقط. لا تغير ضغط الحقن في الخطوات التالية ؛ يمكن أن يؤدي ضغط الحقن المنخفض إلى فشل الحقن بسبب التوتر السطحي والسطحي ، في حين أن ضغط الحقن المرتفع يمكن أن يتلف الأجنة. - قم بتنظيف المعدات ومنصة الحقن باستخدام محلول إزالة التلوث RNase.
ملاحظة: يمكن أن يأتي RNase ، الذي يحلل mRNA ، من المشغل أو الجهاز. من الضروري إجراء التنظيف قبل التجربة وارتداء القفازات. - (اختياري) في حالة الحقن المشترك ل mRNA و morpholino ، قم بخلط الاثنين مسبقا في أنبوب 0.2 مل.
ملاحظة: يعمل Z-REX بشكل جيد باستخدام محلول Halo-TeV-Keap1-2xHA mRNA بتركيز 250-1500 نانوغرام / ميكرولتر. كما تم استخدام العديد من المورفولينات في الزرد ، وتم الإبلاغ عن التركيزات المثلى7. في حالة استخدام مورفولينو بتسلسل غير منشور ، يجب على المشغل أولا تقييم السمية وكفاءة ضربة قاضية للجينات للمورفولينو قبل استخدامه في Z-REX. - نقل 1-2 ميكرولتر من mRNA (و / أو المورفولينو عند الاقتضاء7) إلى إبرة حقن بطرف ماصة محمل صغير.
ملاحظة: في حالة تحضير الإبر باستخدام مجتذب ماصة دقيقة مشتعلة / بنية ، يكون الإعداد كما يلي. الحرارة: 520 وحدة. قوة السحب: 60 وحدة ؛ السرعة: 70 وحدة ؛ التأخير: 155 وحدة ؛ الضغط: 550 وحدة ؛ منحدر: 530 وحدة. - تثبيت الإبرة على مناور الحقن المجهري.
ملاحظة: يجب أن يدفع الضغط الخلفي من مصدر الهواء محلول mRNA (/ morpholino) إلى طرف الإبرة. - استخدم ملقط حاد أو شفرة حلاقة لكسر طرف الإبرة ، مما يخلق فتحة مناسبة للحقن.
- اغمر طرف الإبرة في الزيت المعدني على ميكرومتر المرحلة.
- ضع نبضتين أو ثلاث نبضات حقن لإزالة فقاعات الهواء في الحافة.
- قم بمعايرة حجم السقوط إلى 2 نانولتر عن طريق تغيير وقت الحقن.
ملاحظة: من الأفضل القيام بذلك عن طريق الحقن في الزيت المعدني (الذي يحاكي لزوجة كيس الصفار) الموضوعة على مقياس الدم. باستخدام المجهر ، استخدم خطوط الشبكة الخاصة بمقياس الدم لتقدير حجم القطرة المتكونة أثناء الحقن ، وضبط وقت الحقن وفقا لذلك. على الرغم من استخدام صبغة الفينول الحمراء في بعض الأحيان ، إلا أن الحاجة إليها في إجراء حقن mRNA الموصوف هنا لم يتم ملاحظتها.
4. الحقن المجهري
- املأ صفيحة الحقن بمحلول ملح هانك المتوازن (HBSS) الطازج بنسبة 10٪ ، وقم بمحاذاة الأجنة في أخاديد اللوحة بملقط حاد.
ملاحظة: يتم تحضير لوحة الحقن بنسبة 2٪ أغاروز في وسط HBSS 10٪ ؛ يتم تشكيل الأخاديد باستخدام قالب بلاستيكي. - اغمر طرف الإبرة في وسط HBSS بنسبة 10٪ في لوحة الحقن.
- ضع نبضتين أو ثلاث نبضات حقن لإزالة فقاعات الهواء في الحافة.
- لكل حقنة ، اخترق كيس المشيم والصفار في خطوة واحدة وقم بتطبيق نبض الحقن. يمكن رؤية هذا السائل المحقون مباشرة بعد الحقن ككروي صغير داخل كيس الصفار. هذا كروي صغير يتبدد بسرعة نسبيا. كرر هذه الخطوة للأجنة الأخرى ، حتى يتم الحصول على عدد كاف من الأجنة المحقونة.
ملاحظة: يتراوح معدل بقاء الأجنة (سواء المحقونة أو غير المحقونة) عادة من 50٪ إلى 90٪. تهدف إلى حقن ضعف عدد الأجنة اللازمة لكل مجموعة مراقبة / تجريبية. في مقايسة البيوتين المنسدلة ، يلزم وجود 100-140 جنينا قابلا للحياة لكل حالة. في مقايسة qRT-PCR ، يوصى بخمسة أجنة قابلة للحياة لكل حالة. يتم تحديد حجم العينة لتصوير الأسماك الحية ومقايسة تلطيخ التألق المناعي الكامل من قبل المستخدم. يوصى بوجود ما لا يقل عن 20 جنينا قابلا للحياة لكل حالة لتحقيق قوة إحصائية جيدة في التحليل. - اشطف الأجنة المحقونة بطبق بتري جديد 10 سم يحتوي على وسائط HBSS طازجة بنسبة 10٪.
ملاحظة: يمكن شطف الأجنة بسهولة من الأخاديد باستخدام زجاجة بخ. - تجمع الأجنة غير المحقونة في طبق آخر.
ملاحظة: يمكن أن تكون الأجنة غير المحقونة بمثابة ضوابط جودة لصحة الأسماك ، وتعبير البروتين الأساسي ، ومستويات مضان الخلفية ، وما إلى ذلك ، حسب الحاجة. إذا كان إجراء الحقن يعمل بشكل جيد ، ولم يكن حقن mRNA / morpholino قاتلا للأجنة ، فيجب أن يكون للأجنة المحقونة وغير المحقونة صلاحية مماثلة.
5. زد ريكس
- توزيع الأجنة المحقونة في أطباق 10 سم ، وفقا لإعداد التجربة (أي عدد مجموعات التحكم / التجربة).
- في غرفة مظلمة مع إضاءة الضوء الأحمر ، استبدل الوسائط ب 30 مل من 10٪ HBSS مع أو بدون 1 ميكرومتر Ht-PreHNE (ألكين).
ملاحظة: Ht-PreHNE (ألكين) هو مركب خفيف. يجب أن تبقى الأجنة في الظلام في الخطوات التالية. - احتضان الأجنة عند 28.5 درجة مئوية في الظلام.
- عند 30.5 حصان ، في غرفة مظلمة ، استبدل الوسائط ب 30 مل جديدة من 10٪ HBSS.
ملاحظة: عند استبدال الوسيط، قم بإزالة أكبر قدر ممكن من الوسط القديم. هذا أمر بالغ الأهمية لإزالة الكمية غير المنضمة / الزائدة من Ht-PreHNE (الألكين) من الأجنة. - احتضان الأجنة على حرارة 28.5 درجة مئوية في الظلام لمدة 30 دقيقة.
- كرر الخطوات من 5.4 إلى 5.5 مرتين أخريين.
- قم بتشغيل مصباح الأشعة فوق البنفسجية (365 نانومتر ، 3 ميجاوات / سم2) لمدة 5 دقائق لتسخين المصباح مسبقا.
ملاحظة: يجب تنفيذ خطوة التسخين المسبق للمصباح قبل الخطوة 5.8. طاقة المصباح أقل / غير مستقرة في الدقائق القليلة الأولى بعد تشغيلها. يجب قياس قوة المصباح بواسطة مقياس الأشعة فوق البنفسجية بانتظام. - عند 32 حصان ، قم بتعريض الأجنة للأشعة فوق البنفسجية.
- الخيار 1: بالنسبة للقراءات النهائية ، مثل تصوير الأسماك الحية ، أو تلطيخ التألق المناعي الكامل ، أو تحليل التألق داخل الهلام (انقر فوق اقتران مع Cy5 azide) ، أو RNA-seq ، أو qRT-PCR ، قم بتعريض الأجنة لضوء الأشعة فوق البنفسجية لمدة 3 دقائق ، مع تحريك الألواح كل 30 ثانية.
- الخيار 2: بالنسبة للقراءات النهائية ، مثل مقايسة سحب البيوتين ، قم بتعريض الأجنة لضوء الأشعة فوق البنفسجية لمدة أقصاها 5 دقائق (و 3 دقائق كحد أدنى) ، وقم بتدوير الألواح كل 30 ثانية ، وقم بتبريد الألواح على الجليد لمدة 1 دقيقة.
ملاحظة: في حالة استخدام مجسات مختلفة ، يجب تحسين وقت التعرض للضوء ، اعتمادا على t1/2 من القفص الضوئي لمسبار كهربائي محبوس ضوئي معين ومصدر ضوء تم نشره. يمكن تحديد التنقيب الضوئي T 1/2 باستخدام الإجراءات المعروفة8. بالنسبة إلى Ht-PreHNE (ألكين) ، فإن t 1/2 < 1 دقيقة3 ؛ وبالتالي ، فإن الوقت المشار إليه أعلاه كاف.
6. مقايسات المصب
- الخيار 1: مقايسة النمط الظاهري. التصوير المباشر لمراسل العدلات / البلاعم المعدلة وراثيا
خطوط الأسماك ، Tg (lyz: TagRFP) و Tg (mpeg1: eGFP) (الشكل 2)- تخدير الأجنة عن طريق الحضانة عند 4 درجات مئوية لمدة 10 دقائق.
ملاحظة: يوصى بوجود 20 جنينا قابلا للحياة على الأقل لكل حالة. - قم بإزالة الأجنة غير المخصبة / الميتة من اللوحة.
ملاحظة: الأجنة غير المخصبة / الميتة غائمة / غير شفافة ، ويمكن التعرف عليها بصريا. إذا لوحظ ارتفاع معدل الوفيات ، تحقق مرة أخرى من إجراء الحقن أو حاول تقليل تركيز mRNA أو المورفولينو. - إزالة الأجنة بالملقط الحاد. امسك المشيم بزوج واحد من الملقط ، دون لمس أسماك اليرقات ، واستخدم الزوج الآخر من الملقط لتمزيق المشيم. الجنين هش. المس المشيم فقط عند إجراء dehorionation.
ملاحظة: من الشائع ، خاصة عند المبتدئين ، إتلاف بعض الأجنة أثناء عملية نزع الأجرة. لذلك ، لديك دائما أجنة أكثر من الحد الأدنى المطلوب. - قم بتركيب الأجنة على صفيحة أغاروز 2٪ (محضرة بوسط HBSS بنسبة 10٪) وصور الأجنة باستخدام مجهر مجسم (مجال ساطع وقنوات الفلورسنت المعنية) (الشكل 2A ، C ، G).
ملاحظة: بعد Z-REX [مزيج من حقن Halo-TeV-Keap1-2xHA mRNA ومعالجة Ht-PreHNE (alkyne)] ، وجد أن استنفاد العدلات (lyz: TagRFP) يكون أكثر أهمية عند 36 hpf (4 ساعات بعد Z-REX) ، في حين أن تقليل البلاعم (mpeg1: eGFP) كان أكثر أهمية عند 34 hpf (2 ساعة بعد Z-REX) (الشكل 2E ، F). يمكن استخدام نقاط زمنية أخرى في حالة استخدام خطوط مراسل مختلفة أو mRNA / morpholino أو مجسات. يجب تحسين وقت التعرض و / أو الكسب لتصور الخلايا المفردة أو الهياكل المحددة (الفائقة) المطلوبة. - احسب عدد العدلات / البلاعم لكل سمكة بواسطة ImageJ (NIH) (الشكل 2B ، D-F ، H). استخدم أداة التحديد اليدوي في ImageJ لوضع دائرة حول السمكة بأكملها، واستخدم خيار Find Maxima لحساب الخلايا الفلورية.
- تخدير الأجنة عن طريق الحضانة عند 4 درجات مئوية لمدة 10 دقائق.
- الخيار 2: تقييم وضع العلامات المستهدفة. اقتران نقرة أزيد البيوتين ومقايسة البيوتين المنسدلة (الشكل 3)
- تخدير الأجنة عن طريق الحضانة عند 4 درجات مئوية. يستغرق هذا عادة 10 دقائق.
ملاحظة: للحصول على ما يكفي من محللات الأسماك ، يلزم 100-140 جنينا قابلا للحياة لكل حالة. - قم بإزالة الأجنة غير المخصبة / الميتة من اللوحة.
- أداء dechorionation و deyolking. قم بإجراء التلاعبين عن طريق إمساك المشيم بزوج من الملقط الحاد ، باستخدام الزوج الآخر من الملقط لاختراق كيس الصفار ، ثم فصل كيس الصفار أثناء إزالة المشيمة للسماح لبروتينات الصفار بالخروج.
ملاحظة: من الأهمية بمكان إزالة بروتينات صفار البيض في هذه الخطوة. تتداخل بروتينات صفار البيض الوفيرة في العينة مع التحليل اللاحق. - نقل الأجنة منزوعة الصفار إلى أنبوب سعة 1.5 مل.
ملاحظة: قم بتدوير اللوحة لتوسيط الأجنة منزوعة الأصداء ، مما يسهل جمعها. يتلاشى حطام المشيم الأخف وزنا خلال هذه العملية. - بعد أن تستقر الأجنة في قاع الأنبوب ، قم بإزالة المادة الطافية وإضافة 1 مل من محلول ملحي مبرد مخزن HEPES (درجة الحموضة 7.6).
- كرر الخطوة 6.2.5 مرتين أخريين.
- (اختياري) إذا لم تكن تنوي متابعة الخطوة التالية على الفور ، فقم بإزالة المخزن المؤقت ، وقم بتجميد العينات في النيتروجين السائل ، وقم بتخزينها في -80 درجة مئوية.
ملاحظة: يمكن تجميد كريات الأسماك منزوعة الصفار في النيتروجين السائل وتخزينها عند -80 درجة مئوية. يمكن تخزين العينات المجمدة في -80 درجة مئوية لمدة تصل إلى 2 أسابيع. - أعد تعليق كريات السمك في محلول التحلل.
ملاحظة: يتكون المخزن المؤقت للتحلل (درجة الحموضة 7.6) من 50 مللي مول HEPES ، 100 mM NaCl ، 1٪ Triton X-100 ، 0.3 mM TCEP ، 2x Roche cOmplete Mini مثبطات الأنزيم البروتيني الخالية من EDTA ، ومثبطات التربسين 0.1 مجم / مل من فول الصويا. يعطي جنين واحد حوالي 2 ميكروغرام من المحللة. استخدم 100 ميكرولتر من محلول التحلل لكل 120 جنينا. يجب إضافة اثنين من مثبطات الأنزيم البروتيني الخالية من Roche cOmplete Mini EDTA ومثبطات التربسين من فول الصويا إلى مخزن التحلل قبل الاستخدام مباشرة. - أضف 20٪ من حبات الزركونيا v / v إلى الأنبوب.
- دوامة لمدة 20 ثانية ، تجميد فلاش في النيتروجين السائل ، وذوبان الجليد في حمام مائي 37 درجة مئوية.
- كرر الخطوة 6.2.10 مرتين أخريين.
- جهاز طرد مركزي الحل عند 21000 × جم عند 4 درجات مئوية لمدة 10 دقائق.
- انقل المادة الطافية إلى أنبوب جديد مبرد مسبقا سعة 1.5 مل.
- قياس تركيز البروتين عن طريق فحص برادفورد.
- خفف المحللة إلى 1 ملغ/مل.
- لكل حالة ، انقل 170 ميكروغرام من المحللة إلى أنبوب 2 مل.
- امزج المحللة من الخطوة 6.2.16 مع 0.2 مجم / مل من بروتياز TeV (S219V) ، واحتضن المحلول عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: بالنسبة للمجموعات المعالجة بالبروتياز غير TeV ، ما عليك سوى خلط المحللة مع حجم متساو من محلول التحلل إلى محلول البروتياز TeV المستخدم في مجموعات أخرى. - قم بإعداد مزيج رئيسي 10x لتفاعل نقر البيوتين أزيد: 10٪ وزن / فولت SDS ، 10 مللي متر CuSO4 ، 1 مللي متر CuSO (TBTA) ، 1 مللي متر بيوتين أزيد ، و 20 مللي متر TCEP.
ملاحظة: أضف TCEP إلى المزيج قبل الخطوة 6.2.19 مباشرة. - أضف 8.5 ميكرولتر من t-BuOH و 17 ميكرولتر من مزيج التفاعل الرئيسي 10x إلى محلول (هضم البروتياز TeV) من الخطوة 6.2.17. دوامة ، أجهزة الطرد المركزي ، واحتضان الحل في 37 درجة مئوية لمدة 15 دقيقة.
- أضف 1 mM TCEP أخرى إلى المحلول ، ثم الدوامة ، وأجهزة الطرد المركزي ، واحتضان المحلول عند 37 درجة مئوية لمدة 15 دقيقة أخرى. وقت الحضانة للخطوات 6.2.19-6.2.20 هو 30 دقيقة في المجموع.
ملاحظة: هذا الملحق من TCEP ، كاشف اختزال لتوليد النحاس (I) ، يحسن كفاءة تفاعل النقر. - أضف 600 ميكرولتر من الإيثانول -20 درجة مئوية إلى كل أنبوب ، ودوامة المحلول ، واحتضانه عند -80 درجة مئوية طوال الليل.
ملاحظة: يمكن تخزين العينات في -80 °C لمدة 1 أسبوع. إذا لم يكن كذلك ، فتابع الخطوة التالية على الفور. - جهاز طرد مركزي الحل عند 21000 × جم عند 4 درجات مئوية لمدة 1 ساعة.
ملاحظة: يجب أن تتشكل الحبيبات في قاع الأنبوب بعد الطرد المركزي ، وهو الجزء المطلوب. - قم بإزالة المادة الطافية ، أضف 1 مل من -20 درجة مئوية من الإيثانول والدوامة وأجهزة الطرد المركزي المحلول عند 21000 × جم عند 4 درجات مئوية لمدة 10 دقائق.
- كرر الخطوة 6.2.23.
- قم بإزالة المادة الطافية ، أضف 1 مل من -20 درجة مئوية من الأسيتون والدوامة وأجهزة الطرد المركزي المحلول عند 21000 × جم عند 4 درجات مئوية لمدة 10 دقائق.
- إزالة الطاف. اسمح للأسيتون المتبقي الزائد بالتبخر ، ولكن ليس تماما للجفاف.
- أعد تعليق الحبيبات في 100 ميكرولتر من محلول إعادة التعليق (8٪ وزن / فولت كبريتات دوديسيل الليثيوم [LDS] ، 1 مللي متر EDTA في محلول ملحي HEPES 50 مللي متر ، درجة الحموضة 7.6) ، دوامة لمدة 15 ثانية ، وصوتنة حتى تذوب الحبيبات.
- جهاز طرد مركزي المحلول عند 21000 × جم في درجة حرارة الغرفة (RT) لمدة 5 دقائق.
- انقل المادة الطافية إلى أنبوب جديد سعة 2 مل ، وأضف 1.5 مل من محلول ملحي HEPES 50 مللي متر ، درجة الحموضة 7.6.
ملاحظة: التركيز النهائي ل LDS في هذه الخطوة هو 0.5٪. قد تؤدي تركيزات LDS الأعلى إلى تقويض كفاءة السحب لأسفل. وبالتالي ، على الرغم من أن زيادة تركيز LDS يمكن أن يساعد في تقليل الارتباط غير المحدد ، إلا أنه قد يقلل أيضا من كفاءة السحب. وفقا لذلك ، يوصى بعدم تغيير تركيز LDS في هذه الخطوة. - اجمع عينة "المدخلات" (الشكل 3): انقل 30 ميكرولتر من 1 مجم / مل محللة إلى أنبوب جديد سعة 1.5 مل ، وأضف 10 ميكرولتر من محلول عينة 4x Laemmli يحتوي على 6٪ β-Mercaptoethanol (BME). قم بتجميد المحلول بسرعة ، وقم بتخزينه في -80 درجة مئوية.
- انقل 100 ميكرولتر من راتنج الستربتافيدين عالي السعة بحجم السرير إلى أنبوب جديد سعة 2 مل. أضف 1 مل من 0.5٪ LDS في محلول ملحي HEPES 50 mM (درجة الحموضة 7.6) ، وأجهزة الطرد المركزي عند 1500 × g في RT لمدة 2 دقيقة ، وإزالة المادة الطافية. كرر الغسيل مع 1 مل أخرى من 0.5٪ LDS في محلول ملحي HEPES 50 mM (درجة الحموضة 7.6).
- انقل المحلول من الخطوة 6.2.29 إلى الأنبوب الذي يحتوي على راتنج عالي السعة من الستربتافيدين المغسول مسبقا من الخطوة 6.2.31 ، واحتضان المحلول على خلاط طرف إلى طرف في RT لمدة 4-6 ساعات.
- قم بطرد الخليط عند 1500 × جم في RT لمدة 2 دقيقة ، وخذ 30 ميكرولتر من المادة الطافية ، واخلطها مع 10 ميكرولتر من 4x Laemmli عينة عازلة تحتوي على 6٪ BME لعينة "التدفق". ثم قم بإزالة المادة الطافية المتبقية.
ملاحظة: يمكن تحليل عينات "التدفق" عن طريق النشاف الغربي للتحقق من كفاءة القائمة المنسدلة للستربتافيدين. من الضروري إزالة أكبر قدر ممكن من المادة الطافية لغسل البروتينات غير المنضمة. أولا ، قم بإزالة معظم المادة الطافية باستخدام ماصة P-1000 ، ثم قم بإزالة المادة الطافية المتبقية باستخدام ماصة P-20 مع طرف تحميل هلام. - أضف 1 مل من 0.5٪ LDS في محلول ملحي HEPES 50 mM (درجة الحموضة 7.6) إلى الراتنج ، واحتضن الخليط لمدة 30 دقيقة في RT مع الدوران من طرف إلى طرف.
- أجهزة الطرد المركزي الخليط في 1500 × غرام في RT لمدة 2 دقيقة ، وإزالة طاف .
ملاحظة: عادة ، 0.5٪ LDS كافية لإزالة معظم بروتينات الربط غير المحددة. إذا استمرت إشارات الربط غير المحددة في التحليل اللاحق ، فيمكن زيادة تركيز LDS في المخزن المؤقت للغسيل. - كرر الخطوة 6.2.34-6.2.35 مرتين أخريين.
- أضف 40 ميكرولتر من 2x Laemmli عينة عازلة تحتوي على 6٪ BME إلى الراتنج.
- تخلص من البروتينات المرتبطة عن طريق احتضان الخليط على حرارة 98 درجة مئوية لمدة 5 دقائق.
- قم بطرد الخليط عند 21000 × جم في RT لمدة 5 دقائق ، وانقل المادة الطافية إلى أنبوب جديد سعة 1.5 مل. هذه هي عينة "elute".
ملاحظة: قد يؤثر التحميل المباشر للمحلول الذي يحتوي على الراتنج من الخطوة 6.2.38 في الجل على تحليل SDS-PAGE. - قم بتحميل 20 ميكرولتر في كل بئر من جل بولي أكريلاميد 10٪ من 10 حارات ، وقم بتشغيل الرحلان الكهربائي للهلام.
ملاحظة: قم بتشغيل الجل بجهد منخفض (120 فولت) حتى تصل مقدمة الصبغة إلى هلام الحل ، وقم بتغيير الجهد إلى 170 فولت. أوقف البرنامج بعد خروج واجهة الصبغة. - قم بإجراء النشاف الغربي باستخدام الأجسام المضادة ل HA أو Anti-Halo أو غيرها من الأجسام المضادة التي تكتشف بروتينات التدبير المنزلي (الشكل 3).
- تخدير الأجنة عن طريق الحضانة عند 4 درجات مئوية. يستغرق هذا عادة 10 دقائق.
- الخيار 3: تحليل النسخ. RNA-seq و qRT-PCR (الشكل 4)
ملاحظة: يوصى بشدة باستخدام الأجنة الموضوعة في غضون 15 دقيقة من بعضها البعض لهذا الفحص. يؤثر فارق سن الأجنة بشكل كبير على نتائج الفحص.- تخدير الأجنة عن طريق احتضانها عند 4 درجات مئوية لمدة 10 دقائق ، 2 ساعة بعد Z-REX.
- أداء dechorionation مع ملقط حاد (الخطوة 6.1.3).
- (اختياري) قم بإجراء التجزئة باستخدام الملقط (على سبيل المثال ، افصل الرأس عن الذيل) إذا كان سيتم تحليل الأجزاء المختلفة بشكل منفصل.
- في حالة استخراج الحمض النووي الريبي من جنين كامل ، انقل ثلاثة إلى خمسة أجنة إلى أنبوب سعة 1.5 مل. في حالة استخراج الحمض النووي الريبي من الرأس أو الذيل ، انقل 10-12 قطعة تشريح إلى أنبوب سعة 1.5 مل.
ملاحظة: يوصى بإجراء التجربة باستخدام ثلاث إلى خمس نسخ بيولوجية. - أضف 1 مل من كاشف TRIzol والخرز الزجاجي إلى الأنبوب.
ملاحظة: وجد أن الخرز الزجاجي يعمل بشكل أفضل من حبات الزركونيا لاستخراج الحمض النووي الريبي. - دوامة الخليط لمدة 30 ثانية.
ملاحظة: إذا لم تتم متابعة الخطوة التالية على الفور ، فيمكن تخزين المحلول عند -80 درجة مئوية لمدة 1-3 أسابيع. - استخراج الحمض النووي الريبي وفقا لتعليمات الشركة الصانعة.
- تقييم جودة الحمض النووي الريبي وتركيزه بواسطة مقياس الطيف الضوئي المجهري والرحلان الكهربائي لهلام الأغاروز.
ملاحظة: يجب أن يكون للحمض النووي الريبي ذو النوعية الجيدة نسبةA 260 / A280 حوالي أو أعلى من 2.0. - إما أن ترسل الحمض النووي الريبي للتسلسل ، أو تعالج 1 ميكروغرام من الحمض النووي الريبي باستخدام DNase I بدرجة التضخيم ، والنسخ العكسي باستخدام النسخ العكسي المرتفع III و oligo- (dT) 20. نفذ هذه الخطوة وفقا لتعليمات الشركة المصنعة.
- قم بإجراء qRT-PCR وتحليل البيانات بطريقة ΔΔCT9 (الشكل 4B-D).
- الخيار 4: تعبير نقاط الاهتمام وتحليل التوطين المشترك. مقايسة تلطيخ التألق المناعي الكامل (الشكل 5)
ملاحظة: الأجنة الثابتة بالفورمالديهايد هشة. تجنب الاهتزاز القوي ، وتعامل معه بحذر.- نزع الأجنة باتباع الخطوات 6.1.1-6.1.3.
- نقل الأجنة إلى أنبوب سعة 1.5 مل.
ملاحظة: يجب أن يحتوي كل أنبوب على عدد متساو من الأجنة ، ولا يزيد عن 40 جنينا. - بعد أن تستقر الأجنة في قاع الأنبوب ، قم بإزالة المادة الطافية ، وأضف 1 مل من محلول ملحي مخزن بالفوسفات (PBS) (درجة الحموضة 7.6).
- كرر الخطوة 6.4.3 مرة أخرى.
- قم بإزالة المادة الطافية ، وأضف 1 مل من 4٪ فورمالديهايد في PBS (درجة الحموضة 7.6) ، واحتضان الأنبوب عند 4 درجات مئوية طوال الليل مع هزاز لطيف.
ملاحظة: يمكن تخزين العينات في محلول الفورمالديهايد في 4 °C لمدة 1 أسبوع. - قم بإزالة المادة الطافية ، وأضف 1 مل من الميثانول -20 درجة مئوية ، واحتضن الأنبوب على جانبه عند -20 درجة مئوية لمدة 18 ساعة على الأقل.
ملاحظة: يمكن تخزين العينات في -20 °C لمدة 1 شهر أو أكثر. - قم بإزالة المادة الطافية ، وأضف 1 مل من المخزن المؤقت PDT (0.3٪ v / v Triton X-100 ، 0.1٪ v / v Tween-20 ، و 1٪ v / v ثنائي ميثيل سلفوكسيد [DMSO] في المخزن المؤقت PBS).
- كرر الخطوة 6.4.7 ، واحتضن الأنبوب في RT لمدة 30 دقيقة مع هزاز لطيف.
- قم بإزالة المادة الطافية ، وأضف 1 مل من المخزن المؤقت المانع (10٪ v / v مصل بقري جنيني معطل بالحرارة [FBS] ، 2٪ وزن / في مصل الألبومين البقري [BSA] ، و 0.1٪ v / v Tween-20 في المخزن المؤقت PBS) ، واحتضان الأنبوب في RT لمدة 1 ساعة مع هزاز لطيف.
- قم بإزالة المادة الطافية ، وأضف 200 ميكرولتر من محلول الأجسام المضادة الأولية (المخفف في المخزن المؤقت للحظر).
- قم بإزالة المادة الطافية ، وأضف 500 ميكرولتر من محلول الأجسام المضادة الأولية (المخفف في المخزن المؤقت للحظر) ، واحتضان الأنبوب عند 4 درجات مئوية طوال الليل مع هزاز لطيف.
ملاحظة: في حالة استخدام جسم مضاد أولي جديد ، يجدر تضمين بعض العينات دون تلطيخ الأجسام المضادة الأولية لتكون بمثابة عناصر تحكم سلبية. ومع ذلك ، من الناحية المثالية ، فإن أجنة الضربة القاضية للمورفولينو أو الأجنة المهندسة بالضربة القاضية للجينات ، أو الأجنة التي تم فيها تحفيز التعبير عن البروتين المستهدف ، هي وسائل أكثر موثوقية للتحقق من صحة الجسم المضاد. - قم بإزالة المادة الطافية ، وأضف 1 مل من المخزن المؤقت PDT ، واحتضن الأنبوب في RT لمدة 30 دقيقة مع هزاز لطيف.
- كرر الخطوة 6.4.12.
- قم بإزالة المادة الطافية ، وأضف 1 مل من المخزن المؤقت المانع ، واحتضان الأنبوب في RT لمدة 1 ساعة مع هزاز لطيف.
ملاحظة: يجب حماية العينات من الضوء بعد هذه الخطوة ، لمنع التبييض الضوئي للفلوروفور المترافق على الجسم المضاد الثانوي. - قم بإزالة المادة الطافية ، وأضف 200 ميكرولتر من محلول الأجسام المضادة الثانوي (المخفف في المخزن المؤقت للحظر).
- قم بإزالة المادة الطافية ، وأضف 500 ميكرولتر من محلول الأجسام المضادة الثانوي (المخفف في المخزن المؤقت للحظر) ، واحتضان الأنبوب في RT لمدة 1.5 ساعة مع هزاز لطيف.
- قم بإزالة المادة الطافية ، وأضف 1 مل من المخزن المؤقت PDT ، واحتضن الأنبوب في RT لمدة 30 دقيقة مع هزاز لطيف.
- كرر الخطوة 6.4.17.
- قم بتركيب الأجنة على صفيحة أغاروز 2٪ (مصنوعة من PBS ، درجة الحموضة 7.6) وصور الأجنة باستخدام مجهر مجسم (مجال ساطع وقنوات الفلورسنت المعنية) (الشكل 5A ، B ، D ، F).
ملاحظة: في حالة استخدام المجهر المجسم الفلوري Leica M165 FC ، استخدم تكبيرا قدره 25x للحصول على صور بدقة جيدة. - تحديد / تحليل شدة إشارة الفلورسنت بواسطة ImageJ (NIH). استخدم أداة التحديد اليدوي في ImageJ لتحديد الإشارة في منطقة الاهتمام.
النتائج
التصوير الحي لأسماك مراسل العدلات / البلاعم المعدلة وراثيا المعالجة ب Z-REX ، Tg (lyz: TagRFP) و Tg (mpeg1: EGFP). تحريض موت الخلايا المبرمج للعدلات / البلاعم من خلال Keap1 HNEylation. (انظر أيضا الشكل 2). تم تقييم تأثير وضع العلامات الكهربائية ل Keap1 على مستويات العدلات والبلاعم عن طريق حقن أجنة معدلة وراثيا غير متجانسة الزيجوت مشتقة من Tg (lyz: TagRFP) أو Tg (mpeg1: EGFP) مع ترميز mRNA Halo-Keap1 ، ثم معالجتها باستخدام Ht-PreHNE (ألكاين). باتباع الإجراءات الخاصة بالخطوة 6.1 - تم تحرير خيار الفحص النهائي 1-HNE (alkyne) وتم تسمية Keap1. تم تقييم مستويات العدلات والبلاعم عن طريق التصوير الحي لخطوط المراسل ، Tg (lyz: TagRFP) و Tg (mpeg1: eGFP) ، على التوالي. انخفض مستوى كلا النوعين من الخلايا بنسبة 30٪ -40٪ بعد علاج Z-REX ، حيث تم تسليم HNE إلى Keap1. على العكس من ذلك ، لم يلاحظ أي فقدان للعدلات أو الضامة في مجموعات التحكم الفنية Z-REX [بدون ضوء و Ht-PreHNE (ألكين) ، الضوء وحده ، أو Ht-PreHNE (ألكين) وحده] (الشكل 1D والشكل 2A-D).
أشار تحريض موت الخلايا المبرمج للعدلات / البلاعم إلى نجاح توصيل HNE إلى Keap1 من خلال Z-REX. تم نشر تفاصيل تحليل المسار وآلية موت الخلايا المبرمج5. لحساب التأثيرات غير المستهدفة ل HNE (الألكاين) ، تم استخدام العديد من الضوابط. (1) في ظل نفس الظروف التجريبية ، بدلا من Halo-TeV-Keap1 mRNA ، تم حقن الأجنة ب Halo-P2A-Keap1 mRNA. سمح رابط P2A بالتعبير عن بروتينات Halo و Keap1 بشكل مستقل. في هذا السيناريو ، لم يتمكن HNE (alkyne) المنطلق من Halo من تسمية Keap1 ، لأنه لم يعد قريبا من Halo (الشكل 1D) ؛ وبالتالي ، لم يتم تشغيل مسار إشارات موت الخلايا المبرمج. لم تلاحظ أي تغييرات في مستويات البلاعم أو العدلات في هذه المجموعة (الشكل 2 أ ، ب). (2) تم إجراء نفس الظروف التجريبية باستخدام ترميز mRNA Halo-TeV-Keap1 (C151S ، C273W ، C288E) ، وهو طافر من Keap1 لا يستجيب ل HNE (ألكين) (الشكل 1D). لم تلاحظ أي تغييرات في مستويات البلاعم أو العدلات (الشكل 2G ، H).
اقتران البيوتين أزيد انقر ومقايسة القائمة المنسدلة البيوتين. تقييم تسمية الهدف. (انظر أيضا الشكل 3). تم إجراء تقييم وضع العلامات المستهدفة باستخدام أجنة WT ، تم حقنها بتشفير mRNA إما Halo-TeV-Keap1-2xHA (بناء اندماج Halo-POI) أو Halo-2xHA-P2A-Keap1-2xHA (بناء تقسيم P2A ، حيث لا يتم دمج Halo و Keap1 ؛ الشكل 1 د). تم سحب بروتين Keap1 المسمى لأسفل فقط في المجموعة التي تعبر عن بروتين الاندماج وعولج باستخدام Z-REX (الممر الثاني في أعلى لطخة مضادة لحمض الهيالورونيك) ، ولكن ليس في مجموعات التحكم الأخرى (لا يوجد حقن mRNA ، أو بناء الاندماج بدون Z-REX ، أو بناء انقسام P2A). تشير النتائج إلى أن HNE (الألكاين) تم تسليمه بنجاح إلى Keap1 ، وتم لاحقا اقتران Keap1 المعدل مع البيوتين من خلال تفاعل النقر ، وتم سحب Keap1 المسمى بالبيوتين بواسطة راتنج الستربتافيدين.
تحليل النسخ. RNA-seq و qRT-PCR. (انظر أيضا الشكل 4). تم تقييم التغيير النسخي بعد علاج Z-REX بواسطة RNA-seq و qRT-PCR. في RNA-seq ، تم تخفيض تنظيم العديد من الجينات المرتبطة بالمناعة بعد Z-REX. في المقابل ، تم تنظيم العديد من الجينات المرتبطة بالاستجابة المضادة للأكسدة (AR) بعد Z-REX ، والتي نتجت عن تحريض مسار Keap1-Nrf2-AR عند HNEylation على Keap110 (الشكل 4A). في تحليل qRT-PCR ، تم العثور على نتائج مماثلة عند تحليل ثلاثة جينات مرتبطة بالمناعة (lyz و mpeg1.1 و coro1a) (الشكل 4B). أظهر التنظيم العلوي والسفلي للجينات المعنية الحث الناجح للمسارات بوساطة Keap1 HNEylation.
مقايسة تلطيخ التألق المناعي الكامل (المشترك) وتحليل التمركز. (انظر أيضا الشكل 5). تم تقييم تعبير Halo-TeV-Keap1-2xHA الخارجي و Halo-2xHA-P2A-Keap1-2xHA عن طريق تلطيخ المناعة الكامل (IF) (الشكل 5A ، B). كان لدى P2A-split-construct ضعف عدد علامات HA من TeV-fusion-construct ، والذي يتوافق مع إشارة مضادة ل HA أعلى بضعفين في مجموعة حقن P2A - split - build - mRNA من الأخرى ، مما يشير إلى أن مستوى التعبير للبنيتين كانا متشابهين (الشكل 5C). تم العثور أيضا على مستويات التعبير ل Halo-TeV-Keap1 (wt) و Halo-TeV-Keap1 (C151S ، C273W ، C288E) متشابهة عند التحقيق باستخدام مضاد Halo (الشكل 5D ، E). لوحظ التموضع المشترك للعدلات والكاسباز النشط 3 في Tg (lyz: TagRFP) المعالج ب Z-REX عن طريق التلوين المناعي المشترك مع مضاد RFP ومضاد Caspase النشط 3 (الشكل 5F). نشط Caspase 3 هو مؤشر على أحداث موت الخلايا المبرمج.
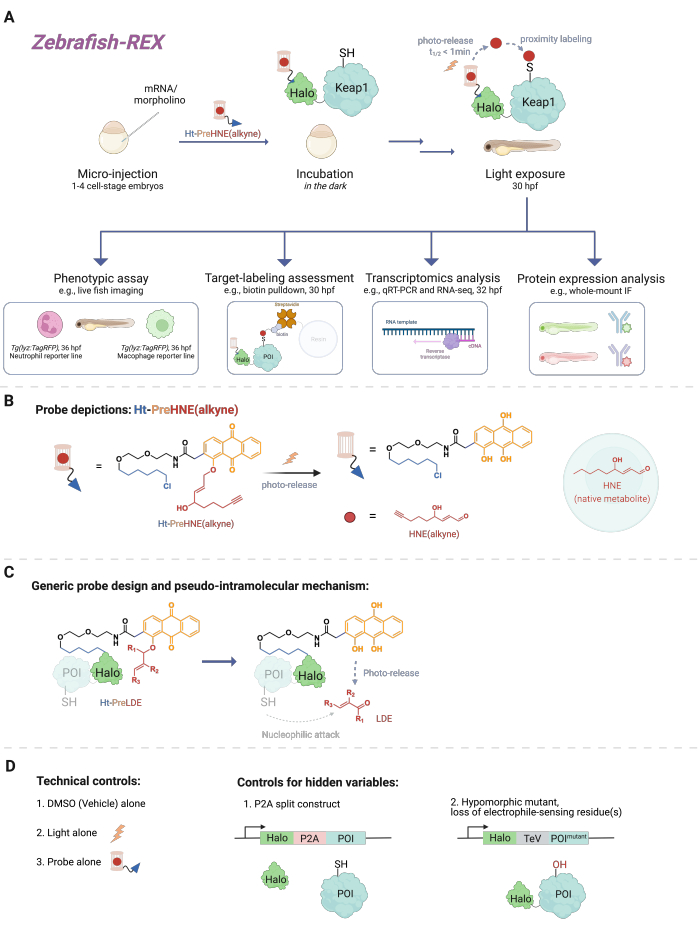
الشكل 1: سير عمل Z-REX. (أ ، ب) يتم حقن جنين الزرد في المرحلة الخلوية 1-4 بترميز (مورفولينو و) mRNA Halo-POI (على سبيل المثال ، Halo-Keap1). ثم يتم التعامل مع الأجنة المحقونة بمسبار يتكون من ليجند HaloTag ومحبب كهربائي محبوس ضوئي ملحق بمجموعة وظيفية من الألكاين ، مثل Ht-PreHNE (alkyne) في B. بعد إزالة الكمية الزائدة من المسبار ، يتعرض الجنين للضوء لإطلاق الإلكتروفيل محل الاهتمام [على سبيل المثال ، HNE أو نظيره ، HNE (alkyne)]. يتم إجراء تحليل المصب في نقطة زمنية معينة / يحددها المستخدم. (ج) تصميم وآلية مسبار Ht-PreLDE ، والذي ينطبق على مختلف الإلكتروفيل المشتق من الدهون (LDE). (د) مجموعات التحكم السلبية / التقنية ل Z-REX. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
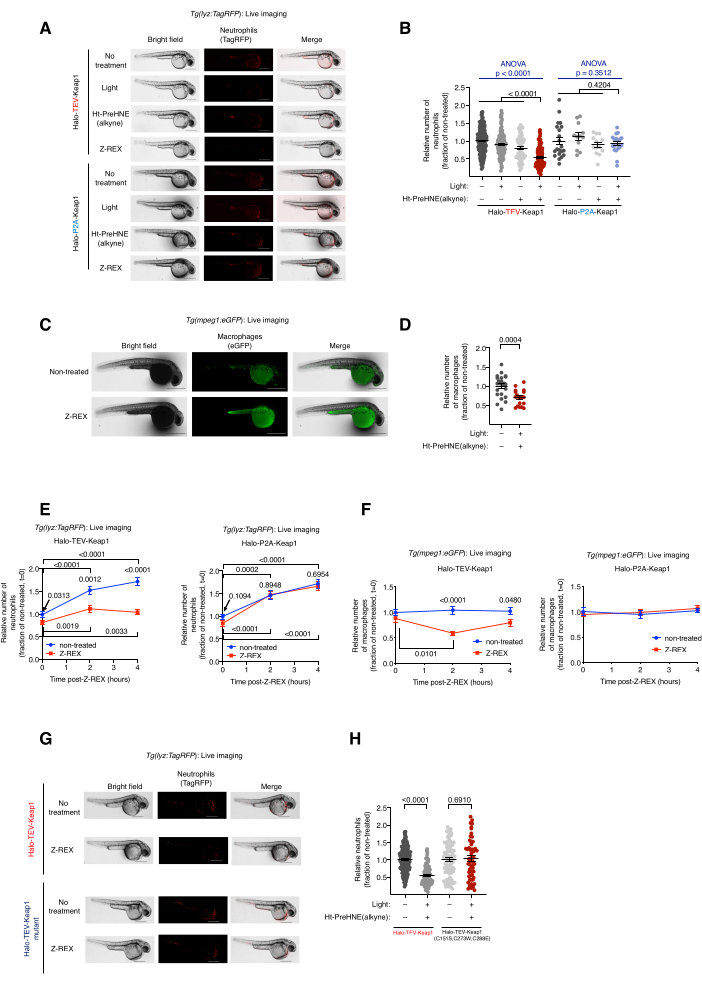
الشكل 2: التصوير الحي للأسماك المراسل للعدلات المعدلة وراثيا / البلاعم المعرضة ل Z-REX. يؤدي Keap1 HNEylation بوساطة Z-REX إلى موت الخلايا المبرمج للعدلات / البلاعم. (A) صور تمثيلية لأسماك Tg (lyz: TagRFP ) تعبر إما عن Halo-TeV-Keap1 (بناء الانصهار) أو Halo-P2A-Keap1 (بنية مقسمة) ، وتخضع لظروف تحكم سلبية [بدون معالجة ، الضوء وحده ، أو Ht-PreHNE (الألكين) وحده أو Z-REX]. عمر الجنين: 36 hpf. (ب) القياس الكمي لمستويات العدلات في (أ). (C) صور تمثيلية لأسماك Tg (mpeg1: eGFP) التي تعبر عن Halo-TeV-Keap1 مع أو بدون معالجة Z-REX. عمر الجنين: 34 hpf. (د) القياس الكمي لمستويات البلاعم في C. (ه، و) قياس الدورة الزمنية لمستويات العدلات (E) والبلاعم (F) بعد معالجة Z-REX. (ز) تجربة مماثلة كما في A في الأسماك التي تعبر إما عن Halo-TeV-Keap1 (WT) أو Halo-TeV-Keap1 (C151S ، C273W ، C288E) ، وهي متحولة ليس لديها قدرة على استشعار HNE. (ح) القياس الكمي لمستويات العدلات في G. قضبان المقياس: 500 ميكرومتر. يتم تقديم جميع الرسوم البيانية بمتوسط ± SEM. تم حساب قيم p باستخدام اختبار ANOVA أحادي الاتجاه (أزرق) واختبار t للطالب ثنائي الطرف (أسود). تم تعديل هذا الرقم من Poganik et al.7. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مقايسة البيوتين المنسدلة. تم علاج أجنة WT التي تعبر عن Halo-TeV-Keap1-2XHA أو Halo-2XHA-P2A-Keap1-2XHA باستخدام Z-REX أو ظروف التحكم السلبية ذات الصلة (لا يوجد علاج مسبار في هذه الحالة). بعد الحصاد ، تم تحليل الأجنة ومعالجتها ببروتياز TeV قبل فحص سحب البيوتين. تم تحليل النتائج عن طريق النشاف الغربي. تم تعديل هذا الرقم من Huang et al. Z-REX: رعاية الإلكتروفيل التفاعلي لبروتينات معينة يتم التعبير عنها إما على وجه التحديد أو في كل مكان ، وتسجيل استجابات الأكسدة والاختزال الوظيفية الناتجة عن الإلكتروفيل في أسماك اليرقات. تم تعديل هذا الرقم من Huang et al.11. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
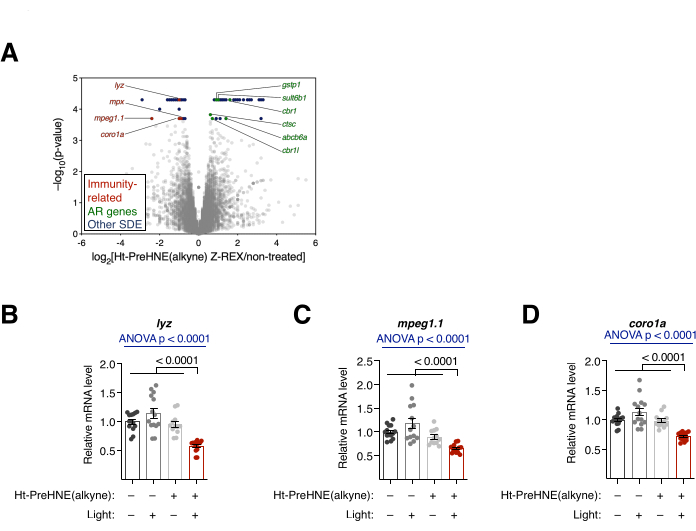
الشكل 4: التحليل النسخي. (أ) نتائج تسلسل الحمض النووي الريبوزي (RNA) للأجنة المعالجة ب Z-REX مقابل الأجنة غير المعالجة. يتم تسليط الضوء على الجينات ذات الدلالة التفاضلية ذات الدلالة الإحصائية (SDE). جينات SDE المرتبطة بالمناعة ملونة باللون الأحمر. الجينات المرتبطة بالاستجابة المضادة للأكسدة (AR) ملونة باللون الأخضر. جينات SDE الأخرى ملونة باللون الأزرق. تم حساب جميع قيم p باستخدام CuffDiff. (ب-د) تم تحليل ثلاثة جينات SDE مرتبطة بالمناعة من A: (B) lyz و (C) mpeg1.1 و (D) coro1a باستخدام qRT-PCR ، وأظهرت الأجنة المعالجة ب Z-REX فقط قمع هذه النصوص. يتم تقديم جميع الرسوم البيانية بمتوسط ± SEM. تم حساب قيم p باستخدام اختبار ANOVA أحادي الاتجاه (أزرق) واختبار t للطالب ثنائي الطرف (أسود). تم تعديل هذا الرقم من Poganik et al.7. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
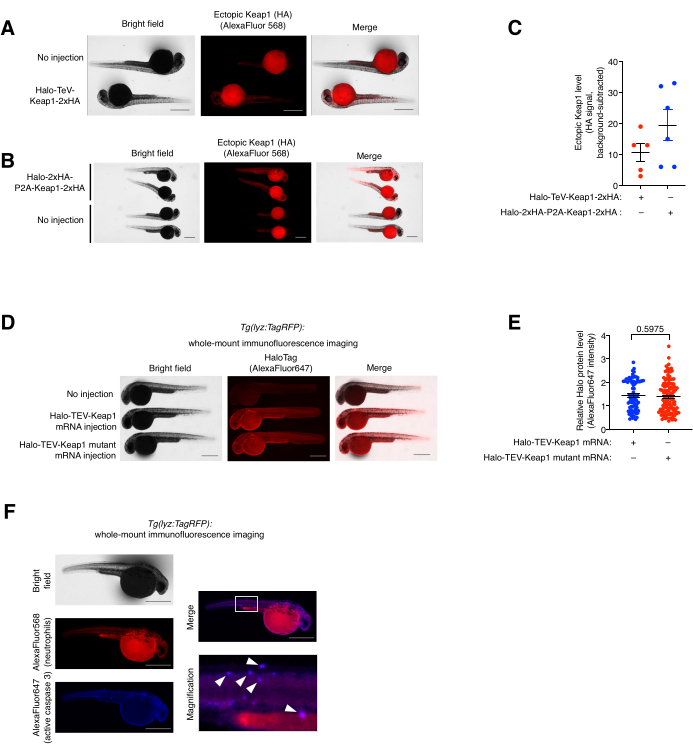
الشكل 5: مقايسة تلطيخ التألق المناعي الكامل . (أ ، ب) صور تمثيلية للأجنة تعبر إما عن (أ) Halo-TeV-Keap1-2xHA أو (ب) Halo-2xHA-P2A-Keap1-2xHA مناعيا مع الأجسام المضادة ل HA والجسم المضاد الثانوي المترافق مع AlexaFluor568. تمت مقارنة الأسماك المحقونة بالرنا المرسال بالأسماك غير المحقونة المتطابقة مع العمر. (ج) القياس الكمي للإشارة المضادة ل HA في (A ، B). (د) صور تمثيلية للأجنة التي تعبر عن Halo-TeV-Keap1 (WT) أو Halo-TeV-Keap1 (C151S، C273W، C288E) الملطخة بالمناعة مع الأجسام المضادة المضادة للهالة والثانوية المترافقة مع AlexaFluor647. تمت مقارنة الأسماك المحقونة بالرنا المرسال بالأسماك غير المحقونة المتطابقة مع العمر. (ه) التحديد الكمي للإشارة المضادة للهالة في D. تم حساب قيم p باستخدام اختبار t للطالب ثنائي الذيل. (و) Tg (lyz: TagRFP) الأجنة التي تعرضت ل Z-REX كانت مناعية مشتركة مع مضادات RFP ومضادات Caspase 3 النشطة ، والأجسام المضادة الثانوية المترافقة بالفلوروفور ذات الصلة. يشير المربع الأبيض إلى المنطقة المكبرة. تشير الأسهم البيضاء إلى تمركز العدلات و Caspase 3 النشط. قضبان المقياس: 500 ميكرومتر. يتم عرض جميع الرسوم البيانية بمتوسط ± SEM. تم تعديل هذا الرقم من Poganik et al.7. وهوانغ وآخرون.11. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: قائمة المخازن المؤقتة المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يوضح Z-REX الموصوف في هذا البروتوكول استراتيجية قوية لفحص الزوج المستهدف بالكهرباء وإلغاء التفاف مسار الإشارات في الأسماك الحية. يتيح التسليم الموجه عن قرب الجرعة والتحكم المكاني في المعالجة المركبة المحبة للكهرباء. على عكس طرق جرعات البلعة التقليدية ، حيث غالبا ما تؤدي التركيزات فوق الفسيولوجية للإلكتروفيل المنتشرة إلى مشكلات خارج الهدف ، فإن الكمية الصغيرة نسبيا من الإلكتروفيل التي يتم إطلاقها في النظام تجعل Z-REX غير جراحي إلى حد كبير. لقد استخدمنا 0.1-6 ميكرومتر Ht-PreHNE (ألكين) في أجنة الزرد ، وأظهرت النتائج أن العلاج لا يضر بتطور الجنين11.
عادة ما يكون إجراء Z-REX أطول من T-REX ، وهي تقنية لفحص / دراسة البروتينات المستشعرة للكهرباء في الخلايا المزروعة. لنفترض أن الغرض من التجربة هو فحص التفاعلات بين الإلكتروفيل والهدف. نقترح أولا إجراء فحص مكثف بواسطة T-REX في الخلايا المستزرعة واستخدام Z-REX للتحقق من الصحة في الجسم الحي وتحليل الظاهراتية / المسار. بالمقارنة مع زراعة الخلايا ، فإن متطلبات أداء Z-REX هي تقنيات تربية الأسماك الأساسية بالإضافة إلى المهارات التجريبية البيوكيميائية التي تتطلبها T-REX. الإطار الزمني النموذجي ل Z-REX (من عبور الأسماك إلى توصيل الإلكتروفيل القابل للضوء) هو 2-3 أيام ، وهو ما لا يزيد عن يوم واحد أطول من الوقت المعتاد لتجربة T-REX على الخلايا الحية المنقولة. يمكن إجراء التصوير الحي لتحليل النمط الظاهري بعد 2-10 ساعات من إضاءة الضوء ؛ انقر فوق اقتران مع البيوتين أزيد للفحص المنسدل يستغرق 3 أيام ؛ qRT-PCR لفحص استجابة النسخ يستغرق 3 أيام ؛ إذا تلطيخ يستغرق 5 أيام. تشبه هذه الخطوات تقريبا مكافئاتها في زراعة الخلايا ، على الرغم من أن تفسير البيانات يتطلب فهما لفسيولوجيا الأسماك وسلالات المراسل.
كإجراء متعدد المتغيرات12 ، تعد عدة مجموعات تحكم ضرورية ل Z-REX لاستبعاد أوجه عدم اليقين في النتائج (الشكل 1D). مجموعات التحكم الشائعة هي: (1) DMSO / علاج السيارة فقط ؛ (2) معالجة المسبار ، ولكن بدون إضاءة ضوئية ؛ (3) إضاءة الضوء ، ولكن بدون معالجة مسبار ؛ (4) بناء تقسيم P2A ، حيث يتم التعبير عن Halo و POI بشكل منفصل ، لذلك يتم إلغاء تسليم القرب ؛ و (5) طفرات ناقصة الشكل ، والتي يتم تحور بقاياها (بقايا) استشعار الكهرباء ، مثل Akt3 (C119S) 6 و Keap1 (C151S ، C273W ، C288E) 5 ، والتي استخدمناها في الدراسات السابقة.
إذا كانت المقايسات النهائية تتضمن تحليل اللطخة الغربية ، فيجب إجراء deyolking قبل الحصاد. تقلل بروتينات صفار البيض من دقة تقييمات تركيز المحللة وقد ترتبط بشكل غير محدد بالأجسام المضادة. عند إجراء تصوير الأسماك الحية أو تلطيخ IF الكامل ، لاحظنا أيضا إشارات فلورية غير محددة في كيس الصفار ، من المحتمل أن تكون ناتجة عن بروتينات الفلورسنت الذاتي في كيس الصفار ، أو الارتباط غير المحدد للأجسام المضادة نفسها. إذا كانت إشارة التألق الذاتي تتداخل مع الإشارة ، فإننا نقترح استبعاد كيس الصفار من القياس الكمي ، أو تحديد مناطق مختلفة بشكل منفصل. يعد إزالة البقع ضروريا لتصوير الأسماك الحية ومقايسة تلطيخ IF كاملة التركيب. يمكن أن تتداخل المشيمية مع التصوير ، وبعد ذلك مع القياس الكمي / عد الخلايا. ومع ذلك ، فإن dechorination ينطبق فقط على الأجنة التي يزيد عمرها عن 1 dpf. الأجنة الأصغر سنا في مراحل الانفجار / المعدة / التجزئة هشة للغاية بحيث لا يمكن تفكيكها.
يعتمد بروتوكول Z-REX الموصوف هنا على تعبير POI خارج الرحم الذي يحركه mRNA. الإجراء سريع مقارنة باستخدام / توليد سلالات الأسماك المعدلة وراثيا. التعبير الذي يحركه mRNA موجود في كل مكان وعابر ، ويستمر لمدة 2 أيام على الأقل ل mRNAs المستخدمة في هذا البروتوكول. ومع ذلك ، من المرجح أن تختلف مدة التعبير في حالات أخرى. وبالتالي ، يوفر هذا النهج نافذة تحقيق سريعة وأكثر عالمية في تأثيرات حدث معين لوضع العلامات الكهربائية ، متوافق مع العديد من المقايسات عالية الإنتاجية / عالية المحتوى. الخطوط المعدلة وراثيا مع تعبير Halo-POI المستقر في أنسجة معينة متوافقة أيضا مع Z-REX11. من الأفضل استخدام هذه الخطوط عند الحاجة إلى طرح سؤال أكثر دقة ، على سبيل المثال ، عندما يتم التنبؤ بنمط ظاهري في عضو معين من بيانات زراعة الخلايا ، أو عندما يتنبأ الفحص من تجارب حقن mRNA بأن عضوا معينا حساسا لحدث وضع العلامات الكهربائية. تم إثبات تحريض استجابة مضادات الأكسدة الخاصة بالقلب من خلال Z-REX باستخدام أسماك Tg (gstp1: GFP ؛ DsRed-P2A-myl7: Halo-TeV-Keap1) في منشورنا السابق11. قد يكون من الممكن أيضا إجراء Z-REX على الأسماك المعدلة وراثيا التي يزيد عمرها عن 2 dpf.
Disclosures
تم تقديم مثبطات كيناز الجزيئات الصغيرة الخاصة بالنظائر ، والتي تم تمكين اكتشافها بواسطة تقنيات REX ، لطلب براءة الاختراع
Acknowledgements
التمويل: نوفارتيس فرينوفيشن ، NCCR ، و EPFL.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
References
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved