Method Article
Мониторинг целевых сигнальных реакций у личинок рыбок данио-рерио - Z-REX раскрывает точные механизмы электрофильных препаратов и метаболитов
В этой статье
Резюме
Рыбки данио-рерио, нацеленные на реактивные электрофилы и окислители (Z-REX), представляют собой основанный на химической биологии метод исследования реактивной низкомолекулярной сигнализации. Эта техника может быть применена к живым рыбам разных стадий развития. Здесь мы объединяем стандартные анализы рыбок данио-рерио с Z-REX для анализа сигнального пути.
Аннотация
Реактивные метаболиты и связанные с ними электрофильные препараты являются одними из самых сложных малых молекул для изучения. Традиционные подходы к деконструкции механизма действия (MOA) таких молекул используют объемную обработку экспериментальных образцов с избытком определенного реакционноспособного вида. В этом подходе высокая реакционная способность электрофилов делает неизбирательную маркировку протеома в зависимости от времени и контекста; Окислительно-восстановительные белки и процессы также могут быть косвенно и часто необратимо затронуты. На таком фоне бесчисленных потенциальных целей и косвенных вторичных эффектов увязка фенотипа с конкретным целевым взаимодействием остается сложной задачей. Рыбки данио-рерио, нацеленные на реактивные электрофилы и окислители (Z-REX) - платформа доставки реактивного электрофила по требованию, адаптированная для использования у личинок рыбок данио, - предназначена для доставки электрофилов к определенному интересующему белку (POI) в невозмутимых эмбрионах живых рыб. Ключевые особенности этого метода включают низкий уровень инвазивности, а также прецизионную электрофильную доставку с дозировкой, хемотипом и пространственно-временным контролем. Таким образом, в сочетании с уникальным набором контрольных элементов этот метод позволяет избежать нецелевых эффектов и системной токсичности, которые в противном случае наблюдаются после неконтролируемого массового воздействия на животных реактивных электрофилов и плейотропных электрофильных препаратов. Используя Z-REX, исследователи могут закрепиться в понимании того, как изменяются индивидуальные реакции на стресс и сигнальные выходы в результате специфического взаимодействия реактивного лиганда с конкретным POI в почти физиологических условиях у интактных живых животных.
Введение
Мириады клеточных сигнальных событий включают реакции между небольшими реакционноспособными молекулами (эндогенно продуцируемыми в клетке или ксенобиотиками / ксенометаболитами, такими как лекарства) и их белковой мишенью. Во многих случаях субстехиометрический уровень таких ковалентных событий связывания может вызывать клеточные реакции, приводящие к изменениям, например, в развитии, метаболизме, апоптозе и/или иммунном ответе1. Однако деконструкция механизма действия (MOA) путем связывания конкретных событий связывания с их фенотипическими последствиями оказалась сложной задачей. Традиционные методы болюсного дозирования, которые включают введение высоких концентраций реакционноспособных веществ, часто приводят к модификации множества белков, а также к чрезмерной токсичности для модельного организма2. Такие условия далеки от идеала. Был разработан метод решения этих проблем в культуре клеток с использованием прецизионной локализованной доставки электрофилов в нативном клеточном контексте, названный T-REX (целевые реактивные электрофилы и окислители)3. В последующие годы основное внимание было уделено экспериментам на целых организмах, которые дают возможность изучать белки в определенных клеточных контекстах в нетрансформированных клетках. Таким образом, мы расширили технику, чтобы она была совместима с несколькими моделями, включая модели эмбрионов Danio rerio . Здесь мы представляем Z-REX (рыбки данио, нацеленные на реактивные электрофилы и окислители) (рис. 1).
Чтобы понять Z-REX, в этой статье сначала представлены технологии REX и лежащие в их основе концепции. По своей сути эти методы моделируют передачу сигналов эндогенных физиологических реактивных электрофильных частиц (RES), имитируя то, как природные электрофилы локально производятся in vivo с пространственно-временной точностью. Интересующий белок (POI) экспрессируется как слитая конструкция с Halo; последний закрепляет тканепроницаемый и инертный зонд, несущий РЭС в фотоклетке, в стехиометрии 1:1. Одним из таких эндогенных РЭС является 4-гидроксиноненаль (далее HNE), который фотоклетка в зонде Ht-PreHNE. Во многих случаях мы используем алкин-функционализированную версию HNE [т.е. HNE (алкин)], которая имеет по существу идентичные биологические свойства HNE, но может быть помечена клик-химией. Зонд, который также функционализирован хлоралканом для реакционной способности с Halo, называется Ht-PreHNE (алкин). Комплекс слияния Halo-POI и образованный таким образом зонд позволяют проксимально доставлять ВИЭ к расплавленному ПОИ при облучении ультрафиолетовым светом. Если POI быстро реагирует с высвобожденным RES, результирующая ковалентная маркировка POI с RES позволяет нам идентифицировать кинетически привилегированные цистеины.
Z-REX использует вышеупомянутые преимущества технологий REX и широко применяет их для изучения конкретных сигнальных путей у живой рыбы. Этот протокол был оптимизирован для рыбок данио-рерио (D. rerio), поскольку они являются генетически обрабатываемыми позвоночными организмами, которые прозрачны во время развития и, таким образом, идеально подходят для оптико-химических/генетических методов, таких как технологии REX. Тем не менее, аналогичная стратегия, вероятно, также будет хорошо работать на других генетически поддающихся лечению видах рыб, поскольку широкая применимость метода обусловлена псевдовнутримолекулярным механизмом доставки липидного электрофила (LDE). Действительно, процедура является высоко биосовместимой, поскольку рыбу можно обрабатывать фото-электрофилом Z-REX [например, Ht-PreHNE (алкин)] в течение не менее 48 часов без какого-либо заметного воздействия на развитие. Аналогичный протокол функционирует у C. elegans 4,5.
В протоколе впервые описывается использование инъекции мРНК для получения временной экспрессии ненативной конструкции слияния Halo-POI в эмбриональных моделях рыбок данио-рерио через 1-1,5 дня после оплодотворения (dpf). Это приводит к экспрессии эктопического белка в большинстве клеток рыбы (далее именуемых «вездесущими»), а не в определенных тканях или местах; Однако данные показывают, что в некоторых случаях могут наблюдаться клеточные эффекты. После инъекции эмбрионы инкубируют с низкой концентрацией [0,3-5 мкМ Ht-PreHNE (алкин)] зонда в течение 30,5 ч после оплодотворения (HPF). Затем, в заданное пользователем время, доставка ВИЭ в POI внутри рыбы достигается путем фотодемонтажа в течение 2-5 минут. После фотодемонтажа ВИЭ в течение следующих 2-10 часов могут быть выполнены различные последующие фенотипические анализы: 1) живое изображение репортерных линий (рис. 2А); 2) оценка маркировки мишеней методом вестерн-блоттинга (рис. 3); 3) транскриптомный анализ (рис. 4); или 4) иммунофлюоресценция всего массива (рис. 5).
В качестве примера живого изображения репортерных линий Z-REX демонстрируется в тандеме с живым изображением рыбных линий, Tg (lyz: TagRFP) и Tg (mpeg1: eGFP), чтобы измерить, как модификация RES конкретного электрофильного сенсора POI (а именно Keap1) снижает уровни нейтрофилов и макрофагов соответственно без наблюдаемого воздействия на другие клетки рыбы. Однако ранее мы показали, что POI-маркировка и последовательный путь передачи сигналов из исследований T-REX могут быть воспроизведены с использованием Z-REX для нескольких белков: Akt3 6, Keap17 и Ube2v26. В целом, с помощью Z-REX ученые могут изучать последствия ковалентной модификации POI с помощью ВИЭ в контексте нескольких сложных окислительно-восстановительных путей. Этот метод предназначен для точного определения мишеней и их функциональных остатков для дизайна ковалентного лекарственного средства и новых лекарственных механизмов в более контекстуально релевантной модели целого животного.
протокол
Процедуры разведения и обработки рыбок данио-рерио в Корнельском университете (США) проводились в соответствии с рекомендациями Национальных институтов здравоохранения (NIH) и одобрены Комитетом по институциональному уходу за животными и их использованию (IACUC). Процедуры содержания и обработки рыбок данио-рерио в подразделении рыбок данио-рерио Швейцарского федерального технологического института в Лозанне (EPFL, Швейцария) выполнялись в соответствии с Законом о защите животных SR 455 и Постановлением о защите животных SR 455.1 с кантональным ветеринарным разрешением VD-H23.
ПРИМЕЧАНИЕ: В этом протоколе для демонстрации Z-REX используются рыбные линии Tg( lyz:TagRFP) и Tg(mpeg1:EGFP), экспрессирующие Halo-TeV-Keap1. Метод может быть распространен на другие интересующие белки, трансгенные репортерные рыбные линии и последующие биологические анализы. Дополнительные буферы, использованные в этом исследовании, см. в Дополнительной таблице 1 . Все реагенты, инструменты, оборудование, антитела, плазмиды, штаммы рыбок данио-рерио и оборудование перечислены в Таблице материалов.
1. Подготовка мРНК
- Подготовьте мРНК Halo-TeV-Keap1-2xHA и Halo-2xHA-P2A-Keap1-2xHA с помощью набора для транскрипции mMessage mMachine SP6 in vitro .
ПРИМЕЧАНИЕ: Следуйте инструкциям производителя и выполняйте реакции в масштабе 40 мкл для каждой мРНК. Повторно растворите гранулу мРНК в 10 мкл воды, не содержащей нуклеаз. - Оцените качество мРНК и измерьте концентрацию с помощью микрообъемного спектрофотометра и электрофореза в агарозном геле. МРНК хорошего качества должна иметь соотношение A260/A280 около или выше 2,0.
- Разбавьте мРНК до 1-1,5 мг/мл водой, не содержащей нуклеаз.
- Аликвотируйте раствор мРНК (1-2 мкл на пробирку) и храните аликвоты при -80 ° C.
2. Производство эмбрионов рыб
- Вариант 1: Получение эмбрионов рыб дикого типа (WT).
- Установите 10 пар скрещивания рыб в 10 отдельных резервуарах, каждый из которых содержит разделитель между самцом и самкой родительской рыбы.
ПРИМЕЧАНИЕ: В общей сложности 10 скрещивающихся пар обычно обеспечивают достаточное количество эмбрионов для анализов. Количество скрещивающихся пар может быть скорректировано в соответствии с планом/потребностью эксперимента и плодовитостью родительской рыбы. - На следующее утро, после настройки инжектора, снимите разделители в пяти баках. Подождите 30 минут, пока рыба спарится.
- Переместите родительскую рыбу в другой резервуар, соберите эмбрионы, пропустив воду из аквариума через ситечко, а затем промойте эмбрионы из ситечка в 10-сантиметровую чашку Петри. Эти эмбрионы будут использоваться для первого раунда инъекций.
ПРИМЕЧАНИЕ: Если качество яиц из определенной партии низкое (например, яйца непрозрачны из-за агрегации белков), не объединяйте их с другими эмбрионами. - (Необязательно) Выполните аналогичные процедуры, описанные в этапах 2.1.2-2.1.3, на остальных пяти резервуарах для следующего раунда впрыска.
ПРИМЕЧАНИЕ: Лучше всего выполнять только один раунд инъекций, чтобы свести к минимуму разницу в возрасте между эмбрионами. Однако, если требуется больше эмбрионов, чем может быть введено в одной партии, рекомендуется выполнить два раунда инъекции, чтобы гарантировать, что эмбрионы остаются на стадии 1-4 клеток во время инъекции мРНК. Количество впрыскных патронов можно регулировать в соответствии с навыками впрыска оператора и дизайном эксперимента. Тем не менее, рекомендуется выполнить всю процедуру (от удаления первого делителя до инъекции последнего эмбриона) в течение 2 часов. Большая разница в возрасте между эмбрионами может ухудшить надежность и воспроизводимость результатов эксперимента.
- Установите 10 пар скрещивания рыб в 10 отдельных резервуарах, каждый из которых содержит разделитель между самцом и самкой родительской рыбы.
- Вариант 2: Получение гетерозиготных трансгенных эмбрионов рыб-репортеров нейтрофилов/макрофагов.
- Установите 10 пар скрещивания рыб в 10 отдельных резервуарах, в каждый из которых вставлен разделитель между самцами и самками родительских рыб: рыба WT против Tg (lyz: TagRFP) или рыба WT против Tg (mpeg1: eGFP).
ПРИМЕЧАНИЕ: Избегайте скрещивания между гетерозиготными трансгенными рыбами, которые могут повлиять на флуоресцентные показания ниже по течению, поскольку гомозиготные рыбы-репортеры демонстрируют более высокий флуоресцентный сигнал по сравнению с гетерозиготными рыбами. Трансгенные репортерные линии и эмбрионы WT можно легко различить при визуализации. Наличие смеси WT и гетерозиготных эмбрионов в одном пуле не является проблемой. lyz:TagRFP сообщает о нейтрофилах, а mpeg:eGFP сообщает о макрофагах. Этот протокол может быть применен и к другим репортерским лескам. - Выполните шаги 2.1.2-2.1.4.
- Установите 10 пар скрещивания рыб в 10 отдельных резервуарах, в каждый из которых вставлен разделитель между самцами и самками родительских рыб: рыба WT против Tg (lyz: TagRFP) или рыба WT против Tg (mpeg1: eGFP).
3. Настройка микроинжектора
- Включите источник воздуха, установите противодавление на 0.2-0.5 фунтов на квадратный дюйм и установите давление впрыска на 25-30 фунтов на квадратный дюйм. Обычно рекомендуется определенный диапазон давления.
ПРИМЕЧАНИЕ: Очень важно иметь стабильное противодавление, чтобы предотвратить обратный поток рыбной среды в иглу. При калибровке объема впрыска на шаге 3.8 следует изменять только время впрыска. Не изменяйте давление впрыска на следующих этапах; Низкое давление впрыска может привести к неудаче впрыска из-за поверхностного и межфазного натяжения, тогда как высокое давление впрыска может повредить эмбрионы. - Очистите оборудование и платформу для впрыска раствором для обеззараживания РНКазы.
ПРИМЕЧАНИЕ: РНКаза, которая разлагает мРНК, может поступать от оператора или оборудования. Необходимо выполнить уборку перед экспериментом, и надеть перчатки. - (Необязательно) При одновременном введении мРНК и морфолино предварительно смешайте их в пробирке объемом 0,2 мл.
ПРИМЕЧАНИЕ: Z-REX хорошо работает при использовании раствора мРНК Halo-TeV-Keap1-2xHA с концентрацией 250-1500 нг/мкл. Несколько морфолино также использовались у рыбок данио, и сообщалось об оптимальных концентрациях7. При использовании морфолино с неопубликованной последовательностью оператор должен сначала оценить токсичность и эффективность нокдауна генов морфолино, прежде чем использовать его в Z-REX. - Перенесите 1-2 мкл мРНК (и/или морфолино, если применимо7) в инъекционную иглу с помощью наконечника пипетки микрозагрузчика.
ПРИМЕЧАНИЕ: При подготовке игл с помощью съемника микропипеток Flaming/Brown настройка следующая. Теплота: 520 единиц; прочность на тягу: 60 единиц; скорость: 70 единиц; задержка: 155 единиц; давление: 550 единиц; Рампа: 530 единиц. - Установите иглу на микроинъекционный манипулятор.
ПРИМЕЧАНИЕ: Противодавление от источника воздуха должно подталкивать раствор мРНК (/ морфолино) к кончику иглы. - Используйте острые щипцы или лезвие бритвы, чтобы сломать кончик иглы, создав подходящее отверстие для инъекции.
- Погрузите кончик иглы в минеральное масло на ступенчатом микрометре.
- Нанесите два или три импульса впрыска, чтобы удалить пузырьки воздуха в наконечнике.
- Откалибруйте размер капли до 2 нл, изменив время впрыска.
ПРИМЕЧАНИЕ: Лучше всего это делать путем инъекции в минеральное масло (которое имитирует вязкость желточного мешка), наложенное на гемоцитометр. Используя микроскоп, используйте линии сетки гемоцитометра, чтобы оценить размер капли, образующейся во время инъекции, и соответствующим образом отрегулировать время инъекции. Хотя фенольный красный краситель иногда используется, необходимости в нем в описанной здесь процедуре инъекции мРНК не наблюдалось.
4. Микроинъекция
- Заполните инъекционную пластину свежей 10% средой сбалансированного солевого раствора Хэнка (HBSS) и выровняйте эмбрионы в канавках пластины тупыми щипцами.
ПРИМЕЧАНИЕ: Пластина для впрыска приготовлена из 2% агарозы в 10% среде HBSS; Бороздки формируются с помощью пластиковой формы. - Погрузите кончик иглы в 10% среду HBSS в инъекционную пластину.
- Нанесите два или три импульса впрыска, чтобы удалить пузырьки воздуха в наконечнике.
- Для каждой инъекции проникают в хорион и желточный мешок одним движением и прикладывают инъекционный импульс. Эту впрыскиваемую жидкость можно увидеть сразу после инъекции в виде небольшого сфероида в желточном мешке. Этот маленький сфероид рассеивается относительно быстро. Повторите этот шаг для других эмбрионов до тех пор, пока не будет получено достаточное количество инъецированных эмбрионов.
ПРИМЕЧАНИЕ: Выживаемость эмбрионов (как инъекционных, так и неинъекционных) обычно варьируется от 50% до 90%. Стремитесь ввести вдвое больше эмбрионов, необходимых для каждой контрольной/экспериментальной группы. В анализе вытягивания биотина для каждого состояния требуется 100-140 жизнеспособных эмбрионов. В анализе qRT-PCR для каждого состояния рекомендуется пять жизнеспособных эмбрионов. Размер выборки для визуализации живой рыбы и анализа иммунофлуоресцентного окрашивания на всю установку определяется пользователем; Рекомендуется иметь не менее 20 жизнеспособных эмбрионов для каждого состояния, чтобы получить хорошую статистическую мощность в анализе. - Промойте введенные эмбрионы в новую 10-сантиметровую чашку Петри, содержащую свежую 10% среду HBSS.
ПРИМЕЧАНИЕ: Эмбрионы можно легко вымыть из бороздок с помощью бутылки для брызг. - Объедините неинъецированные эмбрионы в другую пластину.
ПРИМЕЧАНИЕ: Неинъецированные эмбрионы могут служить для контроля качества здоровья рыбы, базовой экспрессии белка, фоновых уровней флуоресценции и т. Д., По мере необходимости. Если процедура инъекции сработала хорошо, и введенная мРНК / морфолино не смертельна для эмбрионов, инъецированные и неинъекционные эмбрионы должны иметь одинаковую жизнеспособность.
5. З-РЕКС
- Распределите введенные эмбрионы по 10-сантиметровым чашкам в соответствии с установкой эксперимента (т.е. номерами контрольной/экспериментальной групп).
- В темном помещении с красным светом замените среду 30 мл 10% HBSS с 1 мкМ Ht-PreHNE (алкин) или без него.
ПРИМЕЧАНИЕ: Ht-PreHNE (алкин) представляет собой легколабильное соединение. Эмбрионы следует держать в темноте в следующие этапы. - Инкубируют эмбрионы при температуре 28,5 °C в темноте.
- При 30,5 л.с. в темном помещении замените среду свежими 30 мл 10% HBSS.
ПРИМЕЧАНИЕ: При замене носителя удалите как можно больше старого носителя. Это имеет решающее значение для удаления несвязанного/избыточного количества Ht-PreHNE (алкина) из эмбрионов. - Инкубируют эмбрионы при температуре 28,5 °C в темноте в течение 30 мин.
- Повторите шаги 5.4-5.5 еще два раза.
- Включите УФ-лампу (365 нм, 3 мВт/см2) на 5 минут, чтобы предварительно разогреть лампу.
ПРИМЕЧАНИЕ: Этап предварительного прогрева лампы должен быть выполнен до шага 5.8. Мощность лампы ниже/нестабильна в первые несколько минут после включения. Мощность лампы следует регулярно измерять УФ-метром. - При 32 hpf подвергните эмбрионы воздействию ультрафиолетового света.
- Вариант 1: Для последующих считываний, таких как визуализация живой рыбы, иммунофлуоресцентное окрашивание целиком, флуоресцентный анализ в геле (щелчок с азидом Cy5), РНК-секвенирование или qRT-PCR, подвергайте эмбрионы ультрафиолетовому излучению в течение 3 минут, вращая планшеты каждые 30 с.
- Вариант 2: Для последующих считываний, таких как анализ вытягивания биотина, подвергайте эмбрионы ультрафиолетовому излучению в течение максимум 5 минут (и минимум 3 минут), вращая пластины каждые 30 с, и охлаждайте пластины на льду в течение 1 минуты.
ПРИМЕЧАНИЕ: При использовании разных зондов необходимо оптимизировать время воздействия света в зависимости от t1/2 фотодекажа для данного электрофильного зонда в фотоклетке и развернутого источника света. T1/2фотодемонтажа можно определить с использованием известных методик8. Для Ht-PreHNE(алкина) t1/2 составляет < 1мин3; Таким образом, указанного выше времени достаточно.
6. Последующие анализы
- Вариант 1: Фенотипический анализ. Репортер трансгенных нейтрофилов/макрофагов в реальном времени
рыбные лески, Tg(lyz:TagRFP) и Tg(mpeg1:eGFP) (рис. 2)- Обезболивают эмбрионы путем инкубации при 4 °C в течение 10 мин.
ПРИМЕЧАНИЕ: Рекомендуется иметь не менее 20 жизнеспособных эмбрионов на одно условие. - Удалите неоплодотворенные/мертвые эмбрионы из пластины.
ПРИМЕЧАНИЕ: Неоплодотворенные/мертвые эмбрионы мутные/непрозрачные и могут быть визуально идентифицированы. Если наблюдается высокий уровень смертности, вернитесь к процедуре инъекции или попробуйте снизить концентрацию мРНК или морфолино. - Дехорионируйте эмбрионы острыми щипцами. Держите хорион одной парой щипцов, не касаясь личинок рыбы, а другой парой щипцов оторвите хорион. Зародыш хрупкий. Прикасайтесь к хориону только при выполнении дехорионации.
ПРИМЕЧАНИЕ: Обычно, особенно у начинающих, некоторые эмбрионы повреждаются во время дехорионации. Поэтому всегда имейте больше эмбрионов, чем минимально необходимо. - Установите эмбрионы на 2%-ную агарозную пластину (приготовленную с 10%-ной средой HBSS) и сфотографируйте эмбрионы с помощью стереомикроскопа (светлое поле и соответствующие флуоресцентные каналы) (рис. 2A, C, G).
ПРИМЕЧАНИЕ: После Z-REX [комбинация инъекции мРНК Halo-TeV-Keap1-2xHA и лечения Ht-PreHNE (алкин)] было обнаружено, что истощение нейтрофилов (lyz: TagRFP) является наиболее значительным при 36 hpf (4 ч после Z-REX), тогда как снижение макрофагов (mpeg1: eGFP) было наиболее значительным через 34 hpf (2 ч после Z-REX) (рис. 2E, F). Другие моменты времени можно использовать при использовании разных репортерных линий, мРНК/морфолино или зондов. Время экспозиции и/или усиление должны быть оптимизированы для визуализации отдельных клеток или конкретных (ультра)структур желаемого. - Подсчитайте количество нейтрофилов/макрофагов каждой рыбы с помощью ImageJ (NIH) (рис. 2B, D-F, H). Используйте инструмент «Выделение от руки» в ImageJ, чтобы обвести всю рыбу, и используйте опцию «Найти максимумы», чтобы подсчитать флуоресцентные ячейки.
- Обезболивают эмбрионы путем инкубации при 4 °C в течение 10 мин.
- Вариант 2: Оценка целевой маркировки. Азидное соединение биотина и анализ вытягивания биотина (Рисунок 3)
- Анестезируют эмбрионы путем инкубации при 4 °C. Обычно это занимает 10 минут.
ПРИМЕЧАНИЕ: Чтобы получить достаточное количество лизата рыбы, для каждого состояния требуется 100-140 жизнеспособных эмбрионов. - Удалите неоплодотворенные/мертвые эмбрионы из пластины.
- Выполняют дехорионацию и дейоляцию. Выполните две манипуляции, удерживая хорион парой острых щипцов, используя другую пару щипцов, чтобы проникнуть в желточный мешок, а затем отделив желточный мешок, удалив хорион, чтобы белки желтка вышли.
ПРИМЕЧАНИЕ: На этом этапе очень важно удалить белки желтка. Обильные белки желтка в образце мешают последующему анализу. - Перенесите дежелтованные эмбрионы в пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Вращайте тарелку так, чтобы центрировать очищенные эмбрионы, что облегчает сбор. Более светлый мусор хориона отсеивается во время этого процесса. - После того, как эмбрионы осядут на дно пробирки, удалите надосадочную жидкость и добавьте 1 мл охлажденного физиологического раствора, буферизованного HEPES (pH 7,6).
- Повторите шаг 6.2.5 еще два раза.
- (Необязательно) Если вы не собираетесь немедленно переходить к следующему шагу, удалите буфер, заморозьте образцы в жидком азоте и храните их при температуре -80 °C.
ПРИМЕЧАНИЕ: Гранулы рыбы, очищенные от желтка, можно мгновенно заморозить в жидком азоте и хранить при температуре -80 °C. Замороженные образцы можно хранить при температуре -80 °C до 2 недель. - Ресуспендируйте рыбные гранулы в буфере лизиса.
ПРИМЕЧАНИЕ: Буфер для лизиса (рН 7,6) состоит из 50 мМ HEPES, 100 мМ NaCl, 1% Triton X-100, 0,3 мМ TCEP, 2x ингибиторов протеазы Roche cOmplete Mini EDTA и 0,1 мг / мл ингибитора трипсина из соевых бобов. Один эмбрион дает около 2 мкг лизата. Используйте 100 мкл буфера лизиса на каждые 120 эмбрионов. Два ингибитора протеазы Roche cOmplete Mini EDTA и ингибиторы трипсина из соевых бобов следует добавлять в буфер лизиса непосредственно перед использованием. - Добавьте в тюбик 20% шариков диоксида циркония v/v.
- Вихревая в течение 20 с, мгновенное замораживание в жидком азоте и размораживание на водяной бане при температуре 37 °C.
- Повторите шаг 6.2.10 еще два раза.
- Центрифугируют раствор при 21 000 x g при 4 °C в течение 10 мин.
- Перенесите надосадочную жидкость в новую, предварительно охлажденную пробирку объемом 1,5 мл.
- Измерьте концентрацию белка с помощью анализа Брэдфорда.
- Разбавьте лизат до 1 мг/мл.
- Для каждого состояния перенесите 170 мкг лизата в пробирку объемом 2 мл.
- Смешайте лизат из шага 6.2.16 с 0,2 мг / мл протеазы TeV (S219V) и инкубируйте раствор при 37 ° C в течение 30 мин.
ПРИМЕЧАНИЕ: Для групп, не получавших протеазу ТэВ, просто смешайте лизат с равным объемом буфера лизиса с раствором протеазы ТэВ, используемым в других группах. - Приготовьте 10-кратную мастер-смесь для реакции клика биотин-азид: 10% мас./об. SDS, 10 мМ CuSO4, 1 мМ Cu (TBTA), 1 мМ биотин-азида и 20 мМ TCEP.
ПРИМЕЧАНИЕ: Добавьте TCEP в смесь непосредственно перед шагом 6.2.19. - Добавьте 8,5 мкл t-BuOH и 17 мкл 10-кратной смеси реакционной смеси к лизату (расщепленному протеазой ТэВ) на этапе 6.2.17. Встряхните, центрифугу и инкубируйте раствор при 37 °C в течение 15 мин.
- Добавьте в раствор еще 1 мМ TCEP, а затем вихревую центрифугу и инкубируйте раствор при 37 °C еще 15 мин. Общее время инкубации для этапов 6.2.19-6.2.20 составляет 30 минут.
ПРИМЕЧАНИЕ: Эта добавка TCEP, восстанавливающего реагента для образования Cu (I), повышает эффективность реакции щелчка. - Добавьте 600 мкл этанола -20 °C в каждую пробирку, встряхните раствор и инкубируйте его при -80 ° C в течение ночи.
ПРИМЕЧАНИЕ: Образцы можно хранить при температуре -80 °C в течение 1 недели; Если нет, немедленно переходите к следующему шагу. - Центрифугируют раствор при 21 000 x g при 4 °C в течение 1 ч.
ПРИМЕЧАНИЕ: После центрифугирования на дне пробирки должна образоваться гранула, которая представляет собой желаемую фракцию. - Удалите надосадочную жидкость, добавьте 1 мл этанола с температурой -20 °C, встряхните и центрифугируйте раствор при 21 000 x g при 4 °C в течение 10 мин.
- Повторите шаг 6.2.23.
- Удалите надосадочную жидкость, добавьте 1 мл ацетона с температурой -20 °C, встряхните и центрифугируйте раствор при 21 000 x g при 4 °C в течение 10 мин.
- Удалите надосадочную жидкость. Дайте избытку остаточного ацетона испариться, хотя и не полностью до сухости.
- Ресуспендируйте гранулу в 100 мкл буфера ресуспендирования (8% по массе додецилсульфата лития [LDS], 1 мМ ЭДТА в 50 мМ физиологического раствора HEPES, pH 7,6), вихревите в течение 15 с и обрабатывайте ультразвуком до тех пор, пока гранула не растворится.
- Центрифугируют раствор при 21 000 x g при комнатной температуре (RT) в течение 5 мин.
- Перенесите надосадочную жидкость в новую пробирку объемом 2 мл и добавьте 1,5 мл физиологического раствора HEPES 50 мМ с pH 7,6.
ПРИМЕЧАНИЕ: Конечная концентрация СПД на этом этапе составляет 0,5%. Более высокие концентрации LDS могут подорвать эффективность вытягивания. Таким образом, хотя увеличение концентрации LDS может помочь уменьшить неспецифическое связывание, оно также может снизить эффективность вытягивания. Соответственно, рекомендуется не менять концентрацию СПД на этом этапе. - Соберите «входной» образец (рис. 3): перенесите 30 мкл лизата 1 мг/мл в новую пробирку объемом 1,5 мл и добавьте 10 мкл буфера для образца 4x Laemmli, содержащего 6% β-меркаптоэтанола (BME). Мгновенно заморозьте раствор и храните его при температуре -80 °C.
- Перенесите 100 мкл стрептавидиновой смолы большой емкости в новую пробирку объемом 2 мл. Добавьте 1 мл 0,5% LDS в 50 мМ физиологического раствора HEPES (рН 7,6), центрифугу при 1,500 x g при RT в течение 2 мин и удалите надосадочную жидкость. Повторите промывание с еще 1 мл 0,5% LDS в 50 мМ физиологического раствора HEPES (pH 7,6).
- Перенесите раствор со стадии 6.2.29 в пробирку, содержащую предварительно промытую смолу стрептавидина высокой емкости из стадии 6.2.31, и инкубируйте раствор на смесителе с концом при RT в течение 4-6 часов.
- Центрифугируйте смесь при 1,500 x g при RT в течение 2 мин, возьмите 30 мкл надосадочной жидкости и смешайте ее с 10 мкл буфера для образца 4x Laemmli, содержащего 6% BME для «проточной» пробы. Затем удалите остатки надосадочной жидкости.
ПРИМЕЧАНИЕ: «Проточные» образцы могут быть проанализированы методом вестерн-блоттинга для проверки эффективности вытягивания стрептавидина. Важно удалить как можно больше надосадочной жидкости, чтобы вымыть несвязанные белки. Сначала удалите большую часть надосадочной жидкости с помощью пипетки P-1000, а затем удалите оставшуюся надосадочную жидкость с помощью пипетки P-20 с наконечником для загрузки геля. - Добавьте 1 мл 0,5% LDS в 50 мМ физиологического раствора HEPES (pH 7,6) в смолу и инкубируйте смесь в течение 30 мин при RT с вращением из конца в конец.
- Центрифугируйте смесь при 1,500 x g при RT в течение 2 мин и удалите надосадочную жидкость.
ПРИМЕЧАНИЕ: Как правило, 0,5% LDS достаточно для удаления большинства неспецифических связывающих белков. Если неспецифические сигналы связывания все еще видны в более позднем анализе, концентрация LDS в буфере для промывки может быть увеличена. - Повторите шаги 6.2.34-6.2.35 еще два раза.
- Добавьте в смолу 40 мкл 2x буфера для образцов Laemmli, содержащего 6% BME.
- Вытеснить связанные белки путем инкубации смеси при 98 °C в течение 5 мин.
- Центрифугируйте смесь при 21 000 x g при RT в течение 5 мин и перенесите надосадочную жидкость в новую пробирку объемом 1,5 мл. Это и есть образец «элюции».
ПРИМЕЧАНИЕ: Непосредственная загрузка раствора, содержащего смолу из этапа 6.2.38, в гель может повлиять на анализ SDS-PAGE. - Загрузите 20 мкл в каждую лунку 10-полосного 10% полиакриламидного геля и запустите гель-электрофорез.
ПРИМЕЧАНИЕ: Запускайте гель при более низком напряжении (120 В), пока фронт красителя не достигнет рассасывающего геля, и измените напряжение на 170 В. Остановите программу после того, как фронт красителя выйдет. - Проведите вестерн-блоттинг с анти-HA, анти-Halo или другими антителами, обнаруживающими домашние белки (рис. 3).
- Анестезируют эмбрионы путем инкубации при 4 °C. Обычно это занимает 10 минут.
- Вариант 3: Транскриптомный анализ. РНК-секвенирование и qRT-ПЦР (рис. 4)
ПРИМЕЧАНИЕ: Для этого анализа настоятельно рекомендуется использовать эмбрионы, отложенные с интервалом в 15 минут друг от друга. Разница в возрасте эмбрионов существенно влияет на результаты анализа.- Анестезируют эмбрионы, инкубируя их при 4 ° C в течение 10 мин, через 2 ч после Z-REX.
- Выполните дехорионацию острыми щипцами (этап 6.1.3).
- (Необязательно) Выполните сегментацию щипцами (например, отделите голову от хвоста), если разные сегменты должны быть проанализированы отдельно.
- При извлечении РНК из целого эмбриона перенесите от трех до пяти эмбрионов в пробирку объемом 1,5 мл. При извлечении РНК из головы или хвоста перенесите 10-12 рассеченных сегментов в пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Рекомендуется проводить эксперимент с тремя-пятью биологическими репликами. - Добавьте в пробирку 1 мл реагента TRIzol и стеклянные шарики.
ПРИМЕЧАНИЕ: Было обнаружено, что стеклянные шарики работают лучше, чем шарики диоксида циркония для экстракции РНК. - Перемешивайте смесь в течение 30 с.
ПРИМЕЧАНИЕ: Если не приступить к следующему этапу немедленно, раствор можно хранить при -80 ° C в течение 1-3 недель. - Извлеките РНК в соответствии с инструкциями производителя.
- Оцените качество и концентрацию РНК с помощью микрообъемного спектрофотометра и электрофореза в агарозном геле.
ПРИМЕЧАНИЕ: РНК хорошего качества должна иметь соотношение A260/A280 около или выше 2,0. - Либо отправьте РНК для секвенирования, либо обработайте 1 мкг РНК амплификационной ДНКазой I и выполните обратную транскрибировку с использованием верхней индексной обратной транскриптазы III и олиго-(dT)20. Выполните этот шаг в соответствии с инструкциями производителя.
- Проведите qRT-PCR и проанализируйте данные методом ΔΔCT9 (рис. 4B-D).
- Вариант 4: Анализ экспрессии POI и колокализации. Иммунофлюоресцентный анализ окрашивания цельного типа (рис. 5)
ПРИМЕЧАНИЕ: Эмбрионы, фиксированные формальдегидом, хрупкие. Избегайте сильного встряхивания и обращайтесь с ним осторожно.- Дехорионат эмбрионов, выполнив шаги 6.1.1-6.1.3.
- Перенесите эмбрионы в пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: В каждой пробирке должно быть равное количество эмбрионов, и не более 40 эмбрионов. - После того, как эмбрионы осядут на дно пробирки, удалите надосадочную жидкость и добавьте 1 мл фосфатного буферного физиологического раствора (PBS) (pH 7,6).
- Повторите шаг 6.4.3 еще раз.
- Удалите надосадочную жидкость, добавьте 1 мл 4% формальдегида в PBS (pH 7,6) и инкубируйте пробирку при 4 ° C в течение ночи с легким покачиванием.
ПРИМЕЧАНИЕ: Образцы в растворе формальдегида можно хранить при температуре 4 °C в течение 1 недели. - Удалите надосадочную жидкость, добавьте 1 мл метанола с температурой -20 °C и инкубируйте пробирку на боку при -20 °C в течение не менее 18 часов.
ПРИМЕЧАНИЕ: Образцы можно хранить при температуре -20 °C в течение 1 месяца и более. - Удалите надосадочную жидкость и добавьте 1 мл буфера ФДТ (0,3% об./об. Triton X-100, 0,1% об./об. Tween-20 и 1% об./об. диметилсульфоксида [ДМСО] в буфер PBS).
- Повторите шаг 6.4.7 и инкубируйте пробирку при RT в течение 30 минут с легким покачиванием.
- Удалите надосадочную жидкость, добавьте 1 мл блокирующего буфера (10% инактивированной теплом эмбриональной бычьей сыворотки [FBS], 2% сывороточного альбумина крупного рогатого скота [BSA] и 0,1% v/v Tween-20 в буфере PBS) и инкубируйте пробирку при RT в течение 1 ч с легким покачиванием.
- Удалите надосадочную жидкость и добавьте 200 мкл раствора первичного антитела (разбавленного в блокирующем буфере).
- Удалите надосадочную жидкость, добавьте 500 мкл раствора первичного антитела (разбавленного в блокирующем буфере) и инкубируйте пробирку при температуре 4 ° C в течение ночи с легким покачиванием.
ПРИМЕЧАНИЕ: При использовании нового первичного антитела стоит включить некоторые образцы без окрашивания первичных антител, чтобы они служили отрицательным контролем. Однако, в идеале, морфолинонокдаун или сконструированные эмбрионы с нокаутом генов, или эмбрионы, в которых экспрессия целевого белка была стимулирована, являются более надежными средствами для проверки антител. - Удалите надосадочную жидкость, добавьте 1 мл буфера для ФДТ и инкубируйте пробирку при ЛТ в течение 30 минут с легким покачиванием.
- Повторите шаг 6.4.12.
- Удалите надосадочную жидкость, добавьте 1 мл блокирующего буфера и инкубируйте пробирку при RT в течение 1 ч с легким покачиванием.
ПРИМЕЧАНИЕ: Образцы должны быть защищены от света после этого этапа, чтобы предотвратить фотообесцвечивание флуорофора, конъюгированного с вторичным антителом. - Удалите надосадочную жидкость и добавьте 200 мкл вторичного раствора антител (разведенного в блокирующем буфере).
- Удалите надосадочную жидкость, добавьте 500 мкл раствора вторичных антител (разведенного в блокирующем буфере) и инкубируйте пробирку при RT в течение 1,5 ч с легким покачиванием.
- Удалите надосадочную жидкость, добавьте 1 мл буфера для ФДТ и инкубируйте пробирку при ЛТ в течение 30 минут с легким покачиванием.
- Повторите шаг 6.4.17.
- Установите эмбрионы на 2% агарозную пластину (изготовленную из PBS, pH 7,6) и сфотографируйте эмбрионы с помощью стереомикроскопа (яркое поле и соответствующие флуоресцентные каналы) (рис. 5A, B, D, F).
ПРИМЕЧАНИЕ: При использовании флуоресцентного стереомикроскопа Leica M165 FC используйте 25-кратное увеличение для получения изображений с хорошим разрешением. - Количественная оценка / анализ интенсивности флуоресцентного сигнала с помощью ImageJ (NIH). Используйте инструмент « Выделение от руки » в ImageJ для количественной оценки сигнала в интересующей области.
Результаты
Живая визуализация трансгенных рыб-репортеров нейтрофилов/макрофагов, обработанных Z-REX, Tg (lyz: TagRFP) и Tg (mpeg1: EGFP). Индукция апоптоза нейтрофилов/макрофагов посредством гнеилирования Keap1. (См. также рисунок 2). Влияние электрофильной маркировки Keap1 на уровни нейтрофилов и макрофагов оценивали путем инъекции гетерозиготных трансгенных эмбрионов, полученных из Tg (lyz: TagRFP) или Tg (mpeg1: EGFP) с мРНК, кодирующей Halo-Keap1, с последующей обработкой Ht-PreHNE (алкином). После процедур на этапе 6.1 - последующий анализ Вариант 1-HNE (алкин) был высвобожден, и Keap1 был помечен. Уровни нейтрофилов и макрофагов оценивали с помощью визуализации репортерных линий в реальном времени, Tg (lyz: TagRFP) и Tg (mpeg1: eGFP) соответственно. Уровень обоих типов клеток снизился на 30-40% после лечения Z-REX, при котором HNE был доставлен в Keap1. Напротив, в группах технического контроля Z-REX не наблюдалось потери нейтрофилов или макрофагов [без света и Ht-PreHNE (алкин), только света или только Ht-PreHNE (алкина)] (рис. 1D и рис. 2A-D).
Индукция апоптоза нейтрофилов/макрофагов указывала на успешную доставку HNE в Keap1 через Z-REX. Опубликованы подробные сведения об анализе путей и механизме апоптоза5. Для учета нецелевых эффектов HNE (алкина) было использовано несколько контрольных групп. (1) В тех же экспериментальных условиях вместо мРНК Halo-TeV-Keap1 эмбрионам вводили мРНК Halo-P2A-Keap1. Линкер P2A позволил белкам Halo и Keap1 экспрессироваться независимо друг от друга. В этом сценарии HNE (алкин), высвобожденный из Halo, не мог пометить Keap1, так как он больше не был проксимальен Halo (рис. 1D); следовательно, сигнальный путь апоптоза не был запущен. Никаких изменений в уровнях макрофагов или нейтрофилов в этой группе не наблюдалось (рис. 2А, Б). (2) Те же экспериментальные условия были выполнены с использованием мРНК, кодирующей Halo-TeV-Keap1 (C151S, C273W, C288E), мутанта Keap1, который не реагирует на HNE (алкин) (рис. 1D). Никаких изменений в уровнях макрофагов или нейтрофилов не наблюдалось (рис. 2G, H).
Соединение азида биотина и анализ вытягивания биотина. Оценка целевой маркировки. (См. также рисунок 3). Оценка мечения мишеней проводилась с использованием эмбрионов WT, которым вводили мРНК, кодирующую либо Halo-TeV-Keap1-2xHA (конструкция слияния Halo-POI), либо Halo-2xHA-P2A-Keap1-2xHA (P2A-сплит-конструкция, в которой Halo и Keap1 не сливаются; Рисунок 1D). Меченый белок Keap1 был вытянут только в группе, экспрессирующей слитый белок, и обработан Z-REX (вторая полоса в верхнем анти-HA блоттинге), но не в других контрольных группах (без инъекции мРНК, конструкция слияния без Z-REX или конструкция P2A-расщепления). Результаты показывают, что HNE (алкин) был успешно доставлен в Keap1, и модифицированный Keap1 впоследствии конъюгировали с биотином посредством реакции щелчка, а меченный биотином Keap1 был вытянут стрептавидиновой смолой.
Транскрипционный анализ. РНК-секвенирование и qRT-ПЦР. (См. также рисунок 4). Транскрипционные изменения после лечения Z-REX оценивали с помощью РНК-секвенирования и qRT-ПЦР. В RNA-seq несколько генов, связанных с иммунитетом, были подавлены после Z-REX. Напротив, многие гены, связанные с антиоксидантным ответом (AR), были повышены после Z-REX, что произошло в результате индукции пути Keap1-Nrf2-AR при HNEylation на Keap110 (рис. 4A). В анализе qRT-PCR аналогичные результаты были получены при анализе трех генов, связанных с иммунитетом (lyz, mpeg1.1 и coro1a) (рис. 4B). Повышающая и понижающая регуляция соответствующих генов показала успешную индукцию путей, опосредованных Keap1 HNEylation.
Цельный (ко)иммунофлуоресцентный анализ окрашивания и анализ колокализации. (См. также рисунок 5). Экзогенную экспрессию Halo-TeV-Keap1-2xHA и Halo-2xHA-P2A-Keap1-2xHA оценивали с помощью иммунофлуоресцентного окрашивания (ИФ) (рис. 5A, B). P2A-расщепленная конструкция имела в два раза больше тегов HA, чем TeV-fusion-конструкция, что соответствует в два раза более высокому сигналу анти-HA в инжектированной мРНК P2A-расщепленной конструкции, чем в другой, что указывает на то, что уровень экспрессии двух конструкций был одинаковым (рис. 5C). Уровни экспрессии Halo-TeV-Keap1 (wt) и Halo-TeV-Keap1 (C151S, C273W, C288E) также были обнаружены одинаковыми при зондировании с анти-Halo (рис. 5D, E). Колокализация нейтрофилов и активной каспазы 3 в Tg(lyz:TagRFP), обработанных Z-REX, наблюдалась при коиммуноокрашивании анти-RFP и антиактивной каспазой 3 (рис. 5F). Активная каспаза 3 является индикатором событий апоптоза.
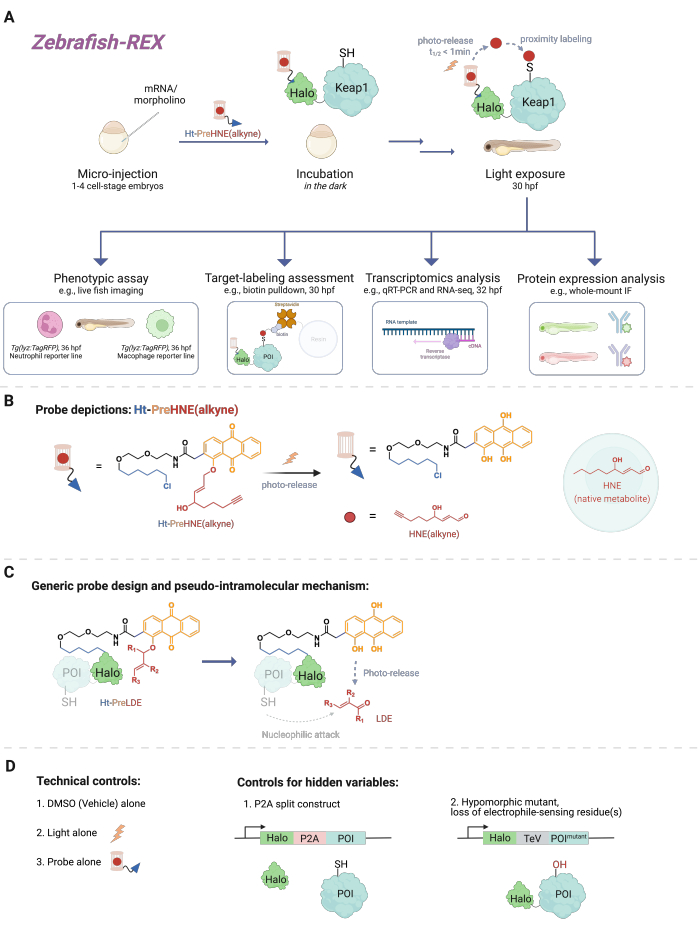
Рисунок 1: Рабочий процесс Z-REX. (A, B) Эмбриону рыбок данио-рерио на стадии 1-4 клеток вводят (морфолино и) мРНК, кодирующую Halo-POI (например, Halo-Keap1). Затем инъецированные эмбрионы обрабатывают зондом, состоящим из лиганда HaloTag и электрофила в фотоклетке, к которому добавляется алкиновая функциональная группа, такая как Ht-PreHNE (алкин) в B. После удаления избыточного количества зонда эмбрион подвергается воздействию света для высвобождения интересующего электрофила [например, HNE или его аналога, HNE (алкин)]. Последующий анализ выполняется в заданный/определяемый пользователем момент времени. (C) Конструкция и механизм зонда Ht-PreLDE, который применим к различным электрофилам липидного происхождения (LDE). (D) Отрицательные/технические контрольные группы для Z-REX. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
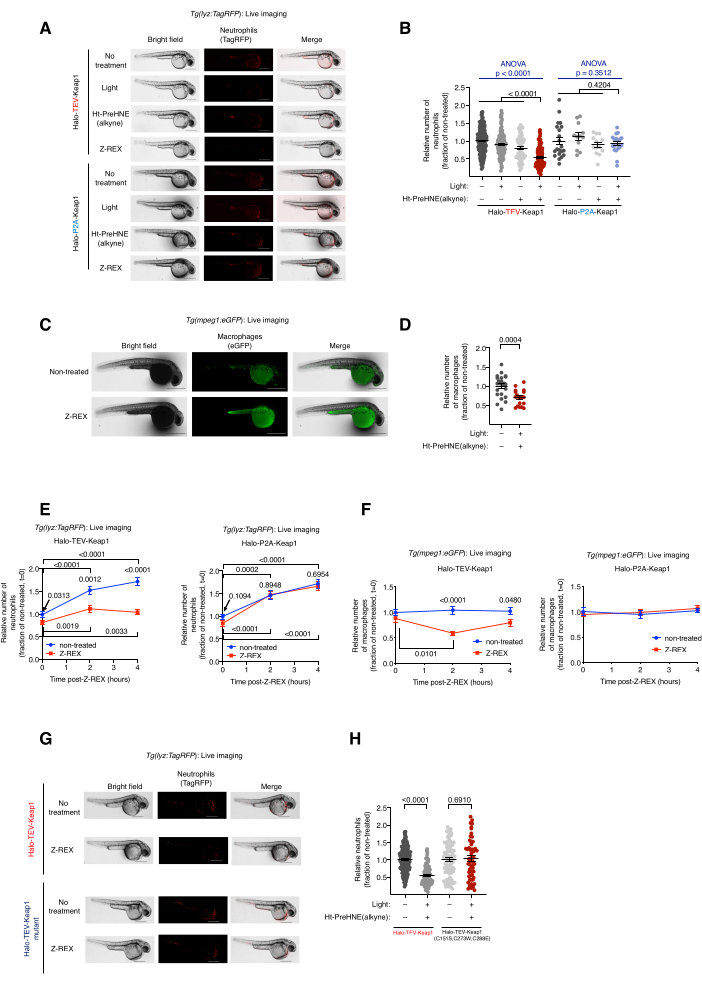
Рисунок 2: Живая визуализация трансгенных рыб-репортеров нейтрофилов/макрофагов, подвергшихся воздействию Z-REX. Z-REX-опосредованное кеap1 HNEylation индуцирует апоптоз нейтрофилов/макрофагов. (A) Репрезентативные изображения рыб Tg(lyz:TagRFP ), экспрессирующих либо Halo-TeV-Keap1 (термоядерная конструкция), либо Halo-P2A-Keap1 (расщепленная конструкция), и подвергнутых негативным контрольным условиям [без обработки, только свет или только Ht-PreHNE (алкин) или Z-REX]. Возраст эмбриона: 36 л.с. (B) Количественная оценка уровней нейтрофилов в А. (C) Репрезентативные изображения рыб Tg(mpeg1:eGFP), экспрессирующих Halo-TeV-Keap1 с обработкой Z-REX или без нее. Возраст эмбриона: 34 л.с. (D) Количественное определение уровней макрофагов в C. (Е,Ж) Измерение уровня нейтрофилов (E) и макрофагов (F) после лечения Z-REX. (G) Аналогичный эксперимент, как и в А , на рыбах, экспрессирующих либо Halo-TeV-Keap1 (WT), либо Halo-TeV-Keap1 (C151S, C273W, C288E), мутант, который не обладает способностью к HNE-зондированию. (H) Количественная оценка уровней нейтрофилов в G. Масштабные линейки: 500 мкм. Все графики представлены со средним значением ± SEM. Значения p были рассчитаны с помощью одностороннего ANOVA (синий) и двустороннего t-критерия Стьюдента (черный). Эта цифра была изменена по сравнению с Poganik et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Анализ вытягивания биотина. Эмбрионы WT, экспрессирующие Halo-TeV-Keap1-2XHA или Halo-2XHA-P2A-Keap1-2XHA, лечили Z-REX или соответствующими отрицательными контрольными условиями (в этом случае без зондового лечения). После сбора урожая эмбрионы лизировали и обрабатывали протеазой ТэВ перед анализом вытягивания биотина. Результаты были проанализированы методом вестерн-блоттинга. Эта цифра была изменена по сравнению с Huang et al. Z-REX: передание реакционноспособных электрофилов специфическим белкам, экспрессируемым либо тканеспецифично, либо повсеместно, и регистрация результирующих функциональных электрофильно-индуцированных окислительно-восстановительных реакций у личинок рыб. Эта цифра была изменена по сравнению с Huang et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
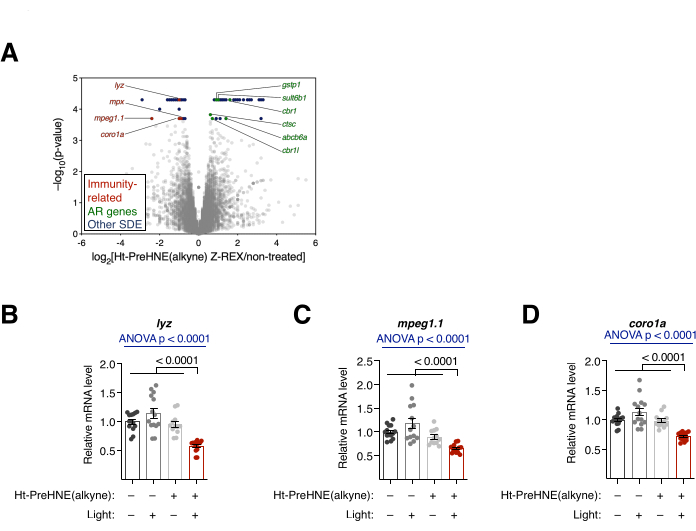
Рисунок 4: Транскрипционный анализ. (A) Результаты РНК-секвенирования эмбрионов, обработанных Z-REX, по сравнению с эмбрионами, не получавшими лечения. Выделены статистически значимые дифференциально экспрессируемые (SDE) гены. Гены SDE, связанные с иммунитетом, окрашены в красный цвет. Гены, связанные с антиоксидантным ответом (AR), окрашены в зеленый цвет. Другие гены SDE окрашены в синий цвет. Все значения p были рассчитаны с помощью CuffDiff. (Б-Д) Три связанных с иммунитетом гена SDE из A: (B) lyz, (C) mpeg1.1 и (D) coro1a были дополнительно проанализированы с помощью qRT-PCR, и только эмбрионы, обработанные Z-REX, показали подавление этих транскриптов. Все графики представлены со средним значением ± SEM. Значения p были рассчитаны с помощью одностороннего ANOVA (синий) и двустороннего t-критерия Стьюдента (черный). Эта цифра была изменена по сравнению с Poganik et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
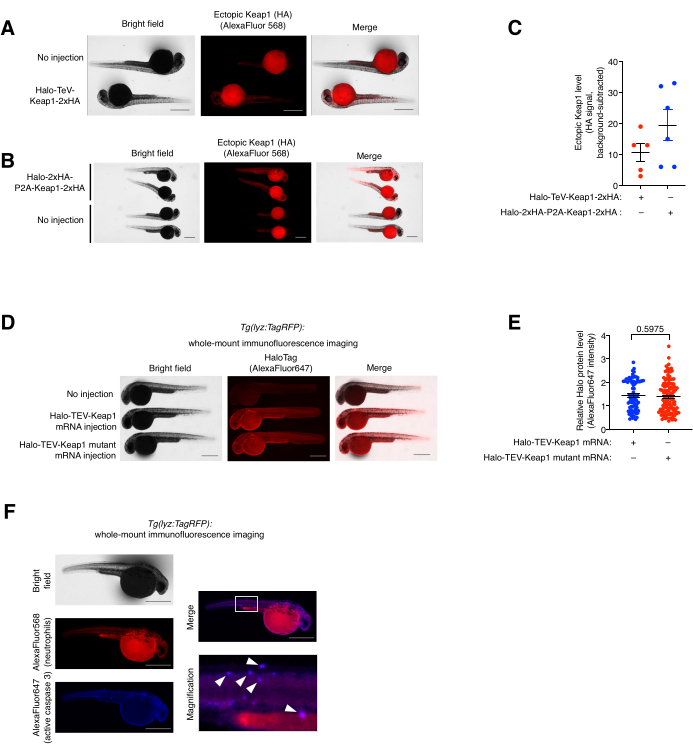
Рисунок 5: Анализ иммунофлуоресцентного окрашивания цельного монтажа. (A, B) Репрезентативные изображения эмбрионов, экспрессирующих либо (A) Halo-TeV-Keap1-2xHA, либо (B) Halo-2xHA-P2A-Keap1-2xHA, иммуноокрашенные анти-HA и вторичными антителами, конъюгированными с AlexaFluor568. Рыбу, введенную мРНК, сравнивали с рыбой, не вводимой мРНК того же возраста. (C) Количественная оценка сигнала анти-HA в (A, B). (D) Репрезентативные изображения эмбрионов, экспрессирующих Halo-TeV-Keap1 (WT) или Halo-TeV-Keap1 (C151S, C273W, C288E), иммуноокрашенных анти-Halo и вторичными антителами, конъюгированными с AlexaFluor647. Рыбу, введенную мРНК, сравнивали с рыбой, не вводимой мРНК того же возраста. (E) Количественная оценка антигало-сигнала в D. Значения p были рассчитаны с помощью двустороннего t-критерия Стьюдента. (Ф) Эмбрионы Tg(lyz:TagRFP), подвергнутые Z-REX, были коиммуноокрашены анти-RFP и антиактивной каспазой 3 и соответствующими флуорофор-конъюгированными вторичными антителами. Белая рамка отмечает увеличенную область. Белыми стрелками обозначены колокализации нейтрофилов и активной каспазы 3. Масштабные линейки: 500 мкм. Все графики представлены со средним значением ± SEM. Эта цифра была изменена по сравнению с Poganik et al.7. и Huang et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительная таблица 1: Список буферов, использованных в этом исследовании. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Z-REX, описанный в этом протоколе, демонстрирует надежную стратегию исследования пары электрофил-мишень и деконволюции сигнального пути у живой рыбы. Близкая доставка позволяет дозировать и пространственно контролировать обработку электрофильным соединением. В отличие от обычных методов болюсного дозирования, в которых супрафизиологические концентрации развернутого электрофила часто приводят к нецелевым проблемам, относительно небольшое количество электрофила, высвобождаемого в систему, делает Z-REX в значительной степени неинвазивным. Мы использовали 0,1-6 мкМ Ht-PreHNE (алкин) в эмбрионах рыбок данио, и результаты показали, что лечение не наносит вреда развитию эмбриона11.
Процедура Z-REX, как правило, длиннее, чем T-REX, метод скрининга / изучения электрофильных чувствительных белков в культивируемых клетках. Предположим, что целью эксперимента является скрининг взаимодействия электрофила с мишенью; мы предлагаем сначала провести обширный скрининг T-REX в культивируемых клетках и использовать Z-REX для проверки in vivo и фенотипического анализа / анализа путей. По сравнению с клеточными культурами, требования для выполнения Z-REX являются базовыми методами рыбоводства в дополнение к биохимическим экспериментальным навыкам, требуемым T-REX. Типичные временные рамки для Z-REX (от скрещивания рыбы до светоиндуцируемой электрофильной доставки) составляют 2-3 дня, что не более чем на 1 день больше, чем типичное время для эксперимента T-REX на трансфицированных живых клетках. Живая визуализация для фенотипического анализа может быть выполнена через 2-10 ч после светового освещения; Клик-соединение с биотин-азидом для анализа вытягивания занимает 3 дня; qRT-PCR для анализа транскрипционного ответа занимает 3 дня; Окрашивание IF занимает 5 дней. Эти этапы примерно аналогичны их эквивалентам в клеточных культурах, хотя интерпретация данных требует понимания физиологии рыб и репортерных штаммов.
В качестве процедуры12 с несколькими переменными для Z-REX необходимо несколько контрольных групп, чтобы исключить неопределенности в результатах (рис. 1D). Общими контрольными группами являются: (1) только обработка ДМСО/транспортного средства; (2) обработка зонда, но без светового освещения; (3) световое освещение, но без зондовой обработки; (4) P2A-сплит-конструкция, в которой Halo и POI выражаются отдельно, поэтому доставка близости удаляется; и (5) гипоморфные мутанты, чьи электрофильные остатки мутируют, такие как Akt3 (C119S)6 и Keap1 (C151S, C273W, C288E)5, которые мы использовали в предыдущих исследованиях.
Если последующие анализы включают анализ вестерн-блоттинга, перед сбором урожая необходимо провести дейолтинг. Белки желтка снижают точность оценок концентрации лизата и могут неспецифически связываться с антителами. При визуализации живой рыбы или окрашивании IF целиком мы также наблюдали неспецифические флуоресцентные сигналы в желточном мешке, вероятно, возникающие в результате аутофлуоресцентных белков в желточном мешке или неспецифического связывания самих антител. Если сигнал автофлуоресценции мешает сигналу, мы предлагаем исключить желточный мешок из количественного определения или количественно определить разные области отдельно. Дехоринация необходима для визуализации живой рыбы и анализа окрашивания IF целиком. Хорион может мешать визуализации, а затем и количественной оценке/подсчету клеток. Однако дехоринация применима только к эмбрионам старше 1 DPF; Более молодые эмбрионы на стадиях бластуляции/гаструляции/сегментации слишком хрупкие, чтобы их можно было дехорионировать.
Описанный здесь протокол Z-REX основан на экспрессии эктопических POI, управляемой мРНК. Процедура является быстрой по сравнению с использованием/созданием трансгенных рыбных линий. Экспрессия, управляемая мРНК, является повсеместной и преходящей и длится не менее 2 дней для мРНК, используемых в этом протоколе. Однако продолжительность экспрессии, вероятно, будет варьироваться в других случаях. Таким образом, этот подход обеспечивает быстрое и более глобальное окно исследования эффектов конкретного события электрофильной маркировки, совместимое с несколькими анализами с высокой пропускной способностью / высоким содержанием. Трансгенные линии со стабильной экспрессией Halo-POI в определенных тканях также совместимы с Z-REX11. Такие линии лучше всего использовать, когда необходимо задать более точный вопрос, например, когда фенотип в конкретном органе предсказывается на основе данных клеточных культур или когда скрининг из экспериментов по инъекции мРНК предсказывает, что конкретный орган чувствителен к событию электрофильной маркировки. Индукция антиоксидантного ответа, специфичная для сердца, через Z-REX была продемонстрирована с использованием рыбы Tg (gstp1: GFP; DsRed-P2A-myl7: Halo-TeV-Keap1) в нашей предыдущей публикации11. Также может быть возможно выполнить Z-REX на трансгенных рыбах старше 2 dpf.
Раскрытие информации
Поданы заявки на патент изоформ-специфические ингибиторы низкомолекулярных киназ, открытие которых стало возможным благодаря технологиям REX
Благодарности
Финансирование: Novartis FreeNovation, NCCR и EPFL.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
Ссылки
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены