Method Article
ניטור תגובות איתות ממוקדות בדגי זברה זחלים - Z-REX חושף מנגנונים מדויקים של תרופות אלקטרופיליות ומטבוליטים
In This Article
Summary
דגי זברה המכוונים לאלקטרופילים ומחמצנים תגובתיים (Z-REX) היא שיטה מבוססת ביולוגיה כימית לחקר איתות תגובתי של מולקולות קטנות. טכניקה זו יכולה להיות מיושמת על דגים חיים בשלבי התפתחות שונים. כאן, אנו משלבים בדיקות סטנדרטיות בדגי זברה עם Z-REX לניתוח מסלולי איתות.
Abstract
מטבוליטים תגובתיים ותרופות אלקטרופיליות קשורות הם בין המולקולות הקטנות המאתגרות ביותר למחקר. גישות קונבנציונליות לפירוק אופן הפעולה (MOA) של מולקולות כאלה ממנפות טיפול בתפזורת בדגימות ניסיוניות עם עודף של מין תגובתי מסוים. בגישה זו, התגובתיות הגבוהה של אלקטרופילים הופכת את התיוג של הפרוטאום ללא הבחנה באופן תלוי זמן והקשר; חלבונים ותהליכים רגישים לחמצון-חיזור יכולים גם להיות מושפעים בעקיפין ולעתים קרובות באופן בלתי הפיך. על רקע כזה של אינספור מטרות פוטנציאליות והשפעות משניות עקיפות, קישור פנוטיפ למעורבות מטרה ספציפית נותר משימה מורכבת. דגי זברה המכוונים לאלקטרופילים ומחמצנים תגובתיים (Z-REX) - פלטפורמת משלוח אלקטרופילים תגובתית לפי דרישה המותאמת לשימוש בדגי זברה זחלים - מתוכננת לספק אלקטרופילים לחלבון ספציפי בעל עניין (POI) בעוברי דגים חיים שאינם מוטרדים בדרך אחרת. המאפיינים העיקריים של טכניקה זו כוללים רמה נמוכה של פולשניות, יחד עם מתן אלקטרופילים מדויקים במינון, כימוטיפ וספיקת אלקטרופילים מבוקרת מרחבית. לפיכך, בשילוב עם חבילה ייחודית של בקרות, טכניקה זו עוקפת השפעות מחוץ למטרה ורעילות מערכתית, שנצפתה אחרת בעקבות חשיפה בלתי מבוקרת בתפזורת של בעלי חיים לאלקטרופילים תגובתיים ולתרופות אלקטרופיליות פליוטרופיות. באמצעות מינוף Z-REX, חוקרים יכולים לבסס דריסת רגל בהבנה כיצד תגובות לחץ אינדיבידואליות ותפוקות איתות משתנות כתוצאה ממעורבות ליגנד תגובתי ספציפי עם נקודת עניין ספציפית, בתנאים כמעט פיזיולוגיים בבעלי חיים שלמים.
Introduction
מספר עצום של אירועי איתות תאי כרוכים בתגובות בין מולקולות תגובתיות קטנות (המיוצרות אנדוגניות בתא או קסנוביוטים/קסנומטבוליטים, כגון תרופות) לבין מטרת החלבון שלהן. במקרים רבים, רמה סובסטויכיומטרית של אירועי קישור קוולנטיים כאלה יכולה לעורר תגובות תאיות, המובילות לשינויים בהתפתחות, חילוף חומרים, אפופטוזיס ו/או תגובה חיסונית1. עם זאת, פירוק אופן הפעולה (MOA) על ידי קישור אירועים מחייבים ספציפיים לתוצאותיהם הפנוטיפיות הוכח כמאתגר. שיטות מינון בולוס מסורתיות הכוללות הכנסת ריכוזים גבוהים של המינים הריאקטיביים גורמות לעתים קרובות לשינוי מספר רב של חלבונים, כמו גם רעילות מוגזמת לאורגניזם המודל2. תנאים כאלה רחוקים מלהיות אידיאליים. פותחה שיטה לפתרון בעיות אלה בתרביות תאים באמצעות העברה אלקטרופילית מקומית מדויקת בהקשר תאי מקורי, בשם T-REX (אלקטרופילים ומחמצנים תגובתיים הניתנים למטרה)3. בשנים שחלפו, המוקד עבר לניסויים באורגניזמים שלמים, המאפשרים הזדמנות לחקור חלבונים בהקשרים תאיים ספציפיים בתאים שלא עברו טרנספורמציה. לכן, הרחבנו את הטכניקה כך שתתאים למספר מודלים, כולל מודלים עובריים של Danio rerio . כאן אנו מציגים Z-REX (דגי זברה המכוונים לאלקטרופילים ומחמצנים תגובתיים) (איור 1).
כדי להבין את Z-REX, מאמר זה מציג תחילה את טכנולוגיות REX ואת המושגים העומדים בבסיסן. בבסיסן, טכניקות אלה מדגימות איתות של מינים אלקטרופיליים תגובתיים פיזיולוגיים אנדוגניים (RES) על ידי חיקוי האופן שבו אלקטרופילים טבעיים מיוצרים באופן מקומי in vivo בדיוק מרחבי-זמני. חלבון העניין (POI) מבוטא כמבנה היתוך להילה; האחרון מעגן את הגשושית החדירה לרקמות והאינרטית הנושאת את RES הפוטוכלוב בסטואיכיומטריה של 1:1. RES אנדוגני אחד כזה הוא 4-hydroxynonenal (HNE להלן), אשר photocaged בבדיקה Ht-PreHNE. במקרים רבים, אנו משתמשים בגרסה מתפקדת אלקין של HNE [כלומר, HNE(אלקין)], שיש לה תכונות ביולוגיות זהות במהותן ל-HNE, אך ניתן לתייג אותה באמצעות כימיית קליקים. הגשושית, שמתפקדת גם עם כלורואלקן לתגובתיות עם Halo, מכונה Ht-PreHNE (אלקין). הקומפלקס של היתוך Halo-POI והגשושית שנוצרה כך מאפשר העברה פרוקסימלית של RES לנקודת העניין המאוחה עם הקרנה עם אור UV. אם נקודת העניין מגיבה במהירות עם RES המשוחרר, התיוג הקוולנטי המתקבל של נקודת העניין עם RES מאפשר לנו לזהות ציסטאין מיוחס מבחינה קינטית .
Z-REX לוקח את היתרונות הנ"ל של טכנולוגיות REX ומיישם אותם באופן נרחב כדי לחקור מסלולי איתות ספציפיים בדגים חיים. פרוטוקול זה הותאם לדגי זברה (D. rerio), מכיוון שהם אורגניזמים בעלי חוליות הניתנים למשיכה גנטית ושקופים במהלך ההתפתחות, ולכן אידיאליים לטכניקות אופטו-כימיות/גנטיות כמו טכנולוגיות REX. אף על פי כן, אסטרטגיה דומה עשויה לעבוד היטב גם על מיני דגים אחרים הניתנים למשיכה גנטית, שכן הישימות הרחבה של השיטה נובעת מהמנגנון הפסאודו-תוך-מולקולרי של העברת אלקטרופילים שמקורם בשומנים (LDE). אכן, ההליך תואם ביולוגית מאוד, שכן ניתן לטפל בדגים עם אלקטרופיל פוטו-רקס Z-REX [למשל, Ht-PreHNE (אלקין)] במשך 48 שעות לפחות ללא השפעות ניכרות על ההתפתחות. פרוטוקול דומה פועל ב- C. elegans 4,5.
הפרוטוקול מתאר תחילה את השימוש בהזרקת mRNA כדי לייצר ביטוי חולף של מבנה היתוך Halo-POI שאינו יליד במודלים של דגי זברה עובריים, 1-1.5 ימים לאחר ההפריה (dpf). התוצאה היא ביטוי של החלבון החוץ רחמי ברוב התאים בתוך הדג (להלן "בכל מקום"), ולא ברקמות או באזורים ספציפיים; עם זאת, הנתונים מראים כי השפעות ספציפיות לתא ניתן לראות במקרים מסוימים. לאחר ההזרקה, העוברים מודגרים עם ריכוז נמוך [0.3-5 מיקרומטר Ht-PreHNE (אלקין)] של הבדיקה עד 30.5 שעות לאחר ההפריה (hpf). לאחר מכן, בזמן שנקבע על ידי המשתמש, משלוח של RES לנקודת העניין בתוך דגים מושגת על ידי דיקור במשך 2-5 דקות. לאחר דיקור ה-RES, ניתן לבצע מגוון בדיקות פנוטיפיות במורד הזרם במהלך 2-10 השעות הבאות: 1) הדמיה חיה של קווי כתב (איור 2A); 2) הערכת סימון מטרות על ידי ניתוח כתמים מערביים (איור 3); 3) ניתוח תעתיק (איור 4); או 4) אימונופלואורסנציה של הר שלם (איור 5).
כדוגמה להדמיה חיה של קווי כתבים, Z-REX מודגם יחד עם הדמיה חיה של קווי דגים, Tg (lyz:TagRFP) ו-Tg (mpeg1:eGFP), כדי למדוד כיצד שינוי RES של נקודת עניין ספציפית של חיישן אלקטרופיל (כלומר Keap1) מפחית את רמות הנויטרופילים והמקרופאגים, בהתאמה, ללא השפעות נצפות על תאים אחרים בדגים. עם זאת, הראינו בעבר שניתן לשחזר את תיוג נקודות העניין ואת איתות המסלול התוצאתי ממחקרי T-REX באמצעות Z-REX עבור מספר חלבונים: Akt3 6, Keap17 ו- Ube2v26. בסך הכל, עם Z-REX, מדענים יכולים לחקור את ההשלכות של שינוי קוולנטי של נקודות עניין על ידי RES בהקשר של מספר מסלולי חמצון-חיזור מורכבים. טכניקה זו נועדה לאתר מטרות ואת השאריות הפונקציונליות שלהן עבור תכנון תרופות קוולנטיות ומנגנוני תרופות חדשניים במודל רלוונטי יותר להקשר של בעלי חיים שלמים.
Protocol
הליכי גידול וטיפול בדגי זברה באוניברסיטת קורנל (ארצות הברית) בוצעו בהתאם להנחיות המכונים הלאומיים לבריאות (NIH) ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC). הליכי גידול וטיפול בדגי זברה ביחידת דגי הזברה של המכון הפדרלי השוויצרי לטכנולוגיה לוזאן (EPFL, שוויץ) בוצעו בעקבות חוק רווחת בעלי חיים SR 455 ופקודת רווחת בעלי חיים SR 455.1, עם אישור וטרינרי קנטונלי VD-H23.
הערה: בפרוטוקול זה, קווי דגים Tg (lyz:TagRFP) ו-Tg (mpeg1:EGFP) המבטאים Halo-TeV-Keap1 משמשים להדגמת Z-REX. ניתן להרחיב את השיטה לחלבונים אחרים בעלי עניין, קווי דגים של כתבים טרנסגניים ובדיקות ביולוגיות במורד הזרם. עיין בטבלה משלימה 1 עבור המאגרים ששימשו במחקר זה. כל הריאגנטים, המכשירים, הציוד, הנוגדנים, הפלסמידים, זני דגי הזברה והציוד מפורטים בטבלת החומרים.
1. הכנת mRNA
- הכן את Halo-TeV-Keap1-2xHA ואת Halo-2xHA-P2A-Keap1-2xHA mRNA באמצעות ערכת התמלול mMessage mMachine SP6 in vitro .
הערה: בצע את הוראות היצרן ובצע תגובות בקנה מידה של 40 μL עבור כל mRNA. להמיס מחדש את גלולת ה-mRNA ב-10 מיקרוליטר של מים נטולי נוקלאז. - להעריך את איכות mRNA ולמדוד את הריכוז על ידי ספקטרופוטומטר microvolume ואלקטרופורזה ג'ל agarose. mRNA באיכות טובה צריך להיות יחס A260/A280 של סביב או מעל 2.0.
- לדלל את ה-mRNA ל-1-1.5 מ"ג/מ"ל במים נטולי נוקלאז.
- Aliquot תמיסת mRNA (1-2 μL לכל צינור), ולאחסן את aliquots ב -80 ° C.
2. ייצור עוברי דגים
- אפשרות 1: ייצור עוברי דגים מסוג בר (WT).
- הציבו 10 זוגות דגים ב-10 מכלים נפרדים, כאשר כל מכל מכיל מחיצה בין דג האב הזכר לנקבה.
הערה: סך של 10 זוגות חוצים מספק בדרך כלל מספר מספיק של עוברים לבדיקה. ניתן לכוונן את מספר זוגות ההצלבה בהתאם לתכנון/צורך הניסוי ולפוריות של דגי ההורה. - למחרת בבוקר, לאחר התקנת המזרק, הסירו את המחיצות בחמישה מהמכלים. המתן 30 דקות עד שהדג יזדווג.
- העבירו את דג האב למכל אחר, אספו עוברים על ידי העברת מי המיכל דרך מסננת, ולאחר מכן שטפו את העוברים מהמסננת לצלחת פטרי בקוטר 10 ס"מ. עוברים אלה ישמשו לסבב הראשון של הזריקות.
הערה: אם איכות הביציות מאצווה מסוימת ירודה (למשל, הביציות אטומות עקב הצטברות חלבונים), אל תאגרו אותן עם העוברים האחרים. - (אופציונלי) בצע הליכים דומים כמתואר בשלבים 2.1.2-2.1.3 בחמשת המכלים האחרים לסבב ההזרקה הבא.
הערה: עדיף לבצע רק סבב אחד של הזרקה, כדי למזער את הפרש הגילאים בין העוברים. עם זאת, אם נדרשים יותר עוברים ממה שניתן להזריק במנה אחת, מומלץ לבצע שני סבבי הזרקה כדי להבטיח שהעוברים יישארו בשלב של 1-4 תאים במהלך הזרקת mRNA. ניתן להתאים את מספר סבבי ההזרקה בהתאם למיומנות ההזרקה של המפעיל ולתכנון הניסוי. עם זאת, מומלץ לבצע את כל ההליך (מהסרת המחיצה הראשונה ועד הזרקת העובר האחרון) תוך שעתיים. הפרש גילאים גדול בין עוברים עלול לפגוע באמינות וביכולת השחזור של תוצאות הניסוי.
- הציבו 10 זוגות דגים ב-10 מכלים נפרדים, כאשר כל מכל מכיל מחיצה בין דג האב הזכר לנקבה.
- אפשרות 2: ייצור עוברי דגים הטרוזיגוטיים טרנסגניים מסוג נויטרופילים/מקרופאגים.
- הגדירו 10 זוגות דגים חוצים ב-10 מכלים נפרדים, כאשר כל מכל מוכנס עם מחיצה בין דגי הורה זכרים ונקבות: דגי WT לעומת Tg( lyz:TagRFP), או דגי WT לעומת Tg(mpeg1:eGFP).
הערה: הימנע מהצלבות בין דגים טרנסגניים הטרוזיגוטיים, שעלולים להשפיע על קריאות פלואורסצנטיות במורד הזרם, מכיוון שדגי כתב הומוזיגוטיים מראים אות פלואורסצנטי גבוה יותר בהשוואה לדגים הטרוזיגוטיים. קווי כתב טרנסגניים ועוברי WT ניתן להבחין בקלות בעת הדמיה. קיום תערובת של עוברים WT והטרוזיגוטים באותו מאגר אינו מהווה בעיה. lyz:TagRFP מדווח על נויטרופילים, ו-mpeg:eGFP מדווח על מקרופאגים. פרוטוקול זה יכול להיות מיושם גם על שורות דגים אחרות של כתבים. - בצע את שלבים 2.1.2-2.1.4.
- הגדירו 10 זוגות דגים חוצים ב-10 מכלים נפרדים, כאשר כל מכל מוכנס עם מחיצה בין דגי הורה זכרים ונקבות: דגי WT לעומת Tg( lyz:TagRFP), או דגי WT לעומת Tg(mpeg1:eGFP).
3. הגדרת מיקרו-מזרק
- הפעל את מקור האוויר, הגדר את הלחץ האחורי ל- 0.2-0.5 psi והגדר את לחץ ההזרקה ל- 25-30 psi. טווח הלחץ הספציפי המוצג מומלץ בדרך כלל.
הערה: חיוני שיהיה לחץ גב יציב כדי למנוע זרימה חוזרת של מדיה של דגים לתוך המחט. בעת כיול נפח ההזרקה בשלב 3.8, יש לשנות רק את זמן ההזרקה. אין לשנות את לחץ ההזרקה בשלבים הבאים; לחץ הזרקה נמוך עלול להוביל לכישלון הזרקה עקב מתח פני השטח והפנים, בעוד לחץ הזרקה גבוה עלול לפגוע בעוברים. - נקה את הציוד ואת פלטפורמת ההזרקה עם פתרון טיהור RNase.
הערה: RNase, אשר מפרק mRNA, יכול להגיע מהמפעיל או מהציוד. יש צורך לבצע את הניקוי לפני הניסוי, וללבוש כפפות. - (אופציונלי) אם מזריקים יחד mRNA ומורפולינו, מערבבים מראש את השניים בצינור של 0.2 מ"ל.
הערה: Z-REX פועל היטב באמצעות תמיסת ה-mRNA Halo-TeV-Keap1-2xHA בריכוז של 250-1500 ננוגרם/מיקרוליטר. מספר מורפולינואים שימשו גם בדגי זברה, ודווח על ריכוזים אופטימליים7. אם משתמשים במורפולינו עם רצף שלא פורסם, על המפעיל להעריך תחילה את הרעילות ואת יעילות פירוק הגנים של המורפולינו לפני השימוש בו ב- Z-REX. - מעבירים 1-2 μL של mRNA (ו/או מורפולינו במידת הצורך7) למחט הזרקה עם קצה פיפטה מיקרו-מעמיס.
הערה: אם מכינים מחטים עם מושך מיקרופיפטה Flaming/Brown, ההתקנה היא כדלקמן. חום: 520 יחידות; כוח משיכה: 60 יחידות; מהירות: 70 יחידות; עיכוב: 155 יחידות; לחץ: 550 יחידות; רמפה: 530 יחידות. - התקן את המחט על מניפולטור microinjection.
הערה: לחץ אחורי ממקור האוויר אמור לדחוף את תמיסת mRNA (/morpholino) לקצה המחט. - השתמש במלקחיים חדים או סכין גילוח כדי לשבור את קצה המחט, וליצור פתח מתאים להזרקה.
- השקיעו את קצה המחט בשמן מינרלי על מיקרומטר שלב.
- יש להפעיל שתיים או שלוש פעימות הזרקה כדי להסיר בועות אוויר בקצה.
- כייל את גודל הטיפה ל- 2 nL על ידי שינוי זמן ההזרקה.
הערה: זה מבוצע בצורה הטובה ביותר על ידי הזרקה לתוך שמן מינרלי (אשר מחקה את צמיגות שק החלמון) מונח על המוציטומטר. באמצעות מיקרוסקופ, השתמש בקווי הרשת של ההמוציטומטר כדי להעריך את גודל הטיפה שנוצרה במהלך ההזרקה, ולהתאים את זמן ההזרקה בהתאם. למרות שלעתים משתמשים בצבע אדום פנול, הצורך בו בהליך הזרקת mRNA המתואר כאן לא נצפתה.
4. מיקרו-הזרקה
- ממלאים צלחת הזרקה בתווך 10% תמיסת מלח מאוזנת טרייה של האנק (HBSS), ומיישרים את העוברים בחריצי הצלחת במלקחיים קהים.
הערה: צלחת ההזרקה מוכנה עם 2% אגרוז ב 10% HBSS בינוני; החריצים נוצרים באמצעות תבנית פלסטיק. - יש לטבול את קצה המחט בתווך HBSS 10% בצלחת ההזרקה.
- יש להפעיל שתיים או שלוש פעימות הזרקה כדי להסיר בועות אוויר בקצה.
- בכל זריקה חודרים לכוריון ולשק החלמון בתנועה אחת ומדביקים פולס הזרקה. נוזל מוזרק זה ניתן לראות מיד לאחר ההזרקה כספרואיד קטן בתוך שק החלמון. ספרואיד קטן זה מתפוגג במהירות יחסית. חזור על שלב זה עבור עוברים אחרים, עד לקבלת מספר מספיק של עוברים מוזרקים.
הערה: שיעור ההישרדות של עוברים (הן מוזרקים והן לא מוזרקים) נע בדרך כלל בין 50%-90%. המטרה היא להזריק מספר כפול של עוברים הדרושים לכל קבוצת ביקורת/ניסוי. בבדיקת משיכת ביוטין, נדרשים 100-140 עוברים ברי קיימא לכל מצב. בבדיקת qRT-PCR, חמישה עוברים ברי קיימא מומלצים לכל מצב. גודל הדגימה עבור הדמיית דגים חיים ובדיקת צביעה אימונופלואורסצנטית מלאה מוגדר על-ידי המשתמש; מומלץ שיהיו לפחות 20 עוברים ברי קיימא בכל מצב כדי להניב כוח סטטיסטי טוב בניתוח. - שטפו את העוברים המוזרקים לצלחת פטרי חדשה בקוטר 10 ס"מ המכילה מדיה טרייה של 10% HBSS.
הערה: ניתן לשטוף את העוברים בקלות מהחריצים באמצעות בקבוק שפריץ. - אגרו את העוברים שלא הוזרקו לצלחת אחרת.
הערה: העוברים שאינם מוזרקים יכולים לשמש כבקרות איכות לבריאות הדג, ביטוי חלבון בסיסי, רמות פלואורסצנטיות רקע וכו ', לפי הצורך. אם הליך ההזרקה עבד היטב, והזרקת mRNA/מורפולינו אינה קטלנית לעוברים, עוברים מוזרקים ולא מוזרקים צריכים להיות בעלי כדאיות דומה.
5. Z-REX
- יש לפזר את העוברים המוזרקים לכלים בקוטר 10 ס"מ, בהתאם למערך הניסוי (כלומר, מספר קבוצות הביקורת/ניסוי).
- בחדר חשוך עם תאורת אור אדום, החלף את המדיה ב- 30 מ"ל של 10% HBSS עם או בלי 1 מיקרומטר Ht-PreHNE (אלקין).
הערה: Ht-PreHNE (אלקין) היא תרכובת בהירה. עוברים צריכים להישמר בחושך בשלבים הבאים. - לדגור על העוברים ב 28.5 מעלות צלזיוס בחושך.
- ב 30.5 hpf, בחדר חשוך, להחליף את המדיה עם 30 מ"ל טרי של 10% HBSS.
הערה: בעת החלפת המדיום, הסר כמה שיותר מהמדיום הישן. זה קריטי להסרת כמות לא קשורה / עודפת של Ht-PreHNE (אלקין) מן העוברים. - לדגור על העוברים ב 28.5 ° C בחושך במשך 30 דקות.
- חזור על שלבים 5.4-5.5 פעמיים נוספות.
- הפעל את מנורת UV (365 ננומטר, 3 mW / cm2) למשך 5 דקות כדי לחמם מראש את המנורה.
הערה: יש לבצע את שלב החימום המקדים של המנורה לפני שלב 5.8. עוצמת המנורה נמוכה יותר/לא יציבה בדקות הראשונות לאחר הפעלתה. עוצמת המנורה צריכה להימדד על ידי מד UV באופן קבוע. - ב 32 hpf, לחשוף את העוברים לאור UV.
- אפשרות 1: עבור קריאות במורד הזרם, כגון הדמיית דגים חיים, צביעה אימונופלואורסצנטית בהר שלם, ניתוח פלואורסצנטי בג'ל (צימוד קליקים עם Cy5 azide), RNA-seq או qRT-PCR, חשוף את העוברים לאור UV במשך 3 דקות, מערבל את הלוחות כל 30 שניות.
- אפשרות 2: לקריאות במורד הזרם, כגון בדיקת משיכת ביוטין, חשוף את העוברים לאור UV למשך 5 דקות לכל היותר (ומינימום 3 דקות), ערבל את הצלחות כל 30 שניות, וצנן את הצלחות על קרח במשך דקה אחת.
הערה: אם משתמשים בבדיקות שונות, יש למטב את זמן החשיפה לאור, בהתאם ל-t1/2 של דיקור עבור בדיקה אלקטרופילית בכלוב פוטו-כלוב נתון ומקור אור שנפרס. T1/2photouncaging ניתן לקבוע באמצעות הליכים ידועים8. עבור Ht-PreHNE (אלקין), t1/2 הוא < 1 דקות3; לפיכך, הזמן המצוין לעיל מספיק.
6. מבחני במורד הזרם
- אפשרות 1: בדיקה פנוטיפית. הדמיה חיה של כתב נויטרופילים/מקרופאגים טרנסגניים
קווי דגים, Tg (lyz:TagRFP) ו-Tg (mpeg1:eGFP) (איור 2)- מרדימים את העוברים על ידי דגירה ב 4 ° C במשך 10 דקות.
הערה: מומלץ שיהיו לפחות 20 עוברים ברי קיימא בכל מצב. - הוציאו את העוברים הלא מופרים/מתים מהצלחת.
הערה: העוברים הלא מופרים/מתים הם עכורים/לא שקופים, וניתן לזהותם באופן חזותי. אם נראה שיעור תמותה גבוה, חזור להליך ההזרקה או נסה להפחית את ריכוז mRNA או מורפולינו. - Dechorionate את העוברים עם מלקחיים חדים. החזיקו את הכוריון עם זוג מלקחיים אחד, מבלי לגעת בדגי הזחל, והשתמשו בזוג המלקחיים השני כדי לקרוע את הכוריון. העובר שביר. גע בכוריון רק בעת ביצוע דכוריון.
הערה: זה נפוץ, במיוחד אצל מתחילים, לפגוע בעוברים מסוימים במהלך dechorionation. לכן, תמיד יש יותר עוברים מהמינימום הדרוש. - הרכיבו את העוברים על צלחת אגרוז 2% (שהוכנה עם 10% HBSS בינוני) ודמיינו את העוברים באמצעות סטריאומיקרוסקופ (שדה בהיר ותעלות פלואורסצנטיות בהתאמה) (איור 2A, C, G).
הערה: לאחר Z-REX [שילוב של הזרקת mRNA Halo-TeV-Keap1-2xHA וטיפול ב-Ht-PreHNE (אלקין)], דלדול הנויטרופילים (lyz:TagRFP) נמצא כמשמעותי ביותר ב-36 HPF (4 שעות לאחר Z-REX), בעוד שההפחתה של המקרופאגים (mpeg1:eGFP) הייתה המשמעותית ביותר ב-34 HPF (שעתיים לאחר Z-REX) (איור 2E,F). ניתן להשתמש בנקודות זמן אחרות אם משתמשים בקווי כתב שונים, mRNA/מורפולינו או גשושיות. זמן החשיפה ו/או הרווח חייבים להיות אופטימליים להדמיה של תאים בודדים או המבנים הספציפיים (אולטרה) הרצויים. - ספרו את מספר הנויטרופילים/המקרופאגים של כל דג לפי ImageJ (NIH) (איור 2B, D-F, H). השתמשו בכלי בחירה חופשית ב-ImageJ כדי להקיף את הדג כולו, והשתמשו באפשרות Find Maxima כדי לספור את התאים הפלואורסצנטיים.
- מרדימים את העוברים על ידי דגירה ב 4 ° C במשך 10 דקות.
- אפשרות 2: הערכת תיוג יעדים. צימוד ביוטין אזיד-קליק ובדיקת ביוטין נפתחת (תרשים 3)
- מרדימים את העוברים על ידי דגירה ב 4 ° C. פעולה זו נמשכת בדרך כלל 10 דקות.
הערה: כדי להשיג מספיק ליזט דגים, נדרשים 100-140 עוברים ברי קיימא לכל מצב. - הוציאו את העוברים הלא מופרים/מתים מהצלחת.
- בצע dechorionation ו deyolking. בצעו את שתי המניפולציות על ידי החזקת הכוריון עם זוג מלקחיים חדים, שימוש בזוג המלקחיים השני כדי לחדור לשק החלמון, ולאחר מכן הפרדת שק החלמון תוך הסרת הכוריון כדי לאפשר לחלבוני החלמון לצאת.
הערה: קריטי להסיר את חלבוני החלמון בשלב זה. חלבוני החלמון השופעים בדגימה מפריעים לניתוח מאוחר יותר. - מעבירים את העוברים החלמונים לתוך צינור של 1.5 מ"ל.
הערה: מערבלים את הצלחת כדי למרכז את העוברים החלמונים, מה שמקל על האיסוף. פסולת הכוריון הקלה יותר מתפוגגת במהלך תהליך זה. - לאחר שהעוברים מתיישבים לתחתית הצינור, הסירו את הסופרנטנט והוסיפו 1 מ"ל של מלח חצוי HEPES צונן (pH 7.6).
- חזור על שלב 6.2.5 פעמיים נוספות.
- (אופציונלי) אם אינך מתכוון להמשיך לשלב הבא באופן מיידי, הסר את החיץ, הקפיא במהירות הבזק את הדגימות בחנקן נוזלי ואחסן אותן בטמפרטורה של -80 מעלות צלזיוס.
הערה: כדורי דגים חלמונים ניתנים להקפאה מהירה בחנקן נוזלי ומאוחסנים בטמפרטורה של -80°C. דגימות הבזק קפואות ניתן לאחסן ב -80 ° C עד שבועיים. - משעים מחדש את כדורי הדג בחיץ ליזיס.
הערה: חיץ ליזיס (pH 7.6) מורכב מ-50 mM HEPES, 100 mM NaCl, 1% Triton X-100, 0.3 mM TCEP, 2x מעכבי פרוטאז נטולי Roche cOmplete Mini EDTA, ומעכב טריפסין 0.1 מ"ג/מ"ל מפולי סויה. עובר אחד נותן בערך 2 מיקרוגרם של ליזט. השתמש 100 μL של חיץ ליזה עבור כל 120 עוברים. יש להוסיף שני מעכבי פרוטאז ללא EDTA של Roche cOmplete Mini ומעכבי טריפסין מפולי סויה למאגר הליזה ממש לפני השימוש. - הוסף 20% חרוזי זירקוניה v/v לצינור.
- מערבולת במשך 20 שניות, להקפיא הבזק בחנקן נוזלי, ולהפשיר באמבט מים 37 מעלות צלזיוס.
- חזור על שלב 6.2.10 פעמיים נוספות.
- צנטריפוגה את התמיסה ב 21,000 x גרם ב 4 ° C במשך 10 דקות.
- מעבירים את הסופרנאטנט לצינור חדש בנפח 1.5 מ"ל.
- למדוד את ריכוז החלבון על ידי בדיקת ברדפורד.
- לדלל את הליזט ל 1 מ"ג / מ"ל.
- עבור כל מצב, להעביר 170 מיקרוגרם של ליזט לתוך צינור 2 מ"ל.
- ערבבו את הליזט משלב 6.2.16 עם פרוטאז TeV במינון 0.2 מ"ג/מ"ל (S219V), ודגרו על התמיסה בטמפרטורה של 37°C למשך 30 דקות.
הערה: עבור קבוצות שאינן מטופלות בפרוטאז TeV, פשוט ערבבו את הליזט עם חיץ ליזה שווה לתמיסת פרוטאז TeV המשמשת בקבוצות אחרות. - הכינו תערובת מאסטר 10x לתגובת קליק ביוטין-אזיד: 10% עם SDS, 10 mM CuSO4, 1 mM Cu(TBTA), 1 mM ביוטין-אזיד ו-20 mM TCEP.
הערה: הוסף TCEP לתערובת ממש לפני שלב 6.2.19. - הוסף 8.5 μL של t-BuOH ו- 17 μL של תערובת מאסטר תגובת לחיצה 10x לליזט (TeV מעוכל פרוטאז) משלב 6.2.17. מערבול, צנטריפוגה, לדגור את התמיסה ב 37 ° C במשך 15 דקות.
- הוסף עוד 1 mM TCEP לתמיסה, ולאחר מכן מערבול, צנטריפוגה, ודגר על התמיסה ב 37 ° C במשך 15 דקות נוספות. זמן הדגירה של שלבים 6.2.19-6.2.20 הוא 30 דקות בסך הכל.
הערה: תוספת זו של TCEP, מגיב מקטין ליצירת Cu(I), משפרת את יעילות תגובת הלחיצה. - הוסף 600 μL של -20 ° C אתנול לכל צינור, מערבל את התמיסה, ולדגור אותו ב -80 ° C במשך הלילה.
הערה: ניתן לאחסן את הדגימות ב -80 °C למשך שבוע אחד; אם לא, המשך לשלב הבא באופן מיידי. - צנטריפוגה התמיסה ב 21,000 x גרם ב 4 ° C במשך 1 שעות.
הערה: גלולה צריכה להיווצר בתחתית הצינור לאחר צנטריפוגה, שהוא החלק הרצוי. - הסר את supernatant, להוסיף 1 מ"ל של -20 ° C אתנול, מערבולת, וצנטריפוגה את התמיסה ב 21,000 x גרם ב 4 ° C במשך 10 דקות.
- חזור על שלב 6.2.23.
- הסר את supernatant, להוסיף 1 מ"ל של -20 ° C אצטון, מערבולת, וצנטריפוגה את התמיסה ב 21,000 x גרם ב 4 ° C במשך 10 דקות.
- הסר את supernatant. יש לאפשר לשאריות אצטון עודפות להתאדות, אם כי לא ליובש מלא.
- יש להשהות מחדש את הגלולה ב-100 μL של חיץ השעיה (8% w/v ליתיום דודציל סולפט [LDS], 1 mM EDTA ב-50 mM HEPES מלוחים, pH 7.6), מערבולת למשך 15 שניות, וסוניקט עד להמסת הכדורית.
- צנטריפוגה את התמיסה ב 21,000 x גרם בטמפרטורת החדר (RT) במשך 5 דקות.
- מעבירים את הסופרנאטנט לצינור חדש של 2 מ"ל, ומוסיפים 1.5 מ"ל של מי מלח HEPES 50 מ"מ, pH 7.6.
הערה: הריכוז הסופי של LDS בשלב זה הוא 0.5%. ריכוזי LDS גבוהים יותר עלולים לפגוע ביעילות המשיכה. לכן, למרות שהגדלת ריכוז LDS יכולה לסייע בהפחתת קשירה לא ספציפית, היא עשויה גם להפחית את יעילות המשיכה. לפיכך, מומלץ לא לשנות את ריכוז LDS בשלב זה. - אספו את דגימת ה"קלט" (איור 3): העבירו 30 מיקרוליטר של 1 מ"ג/מ"ל ליזט לצינור חדש של 1.5 מ"ל, והוסיפו 10 מיקרוליטר של מאגר דגימת 4x Laemmli המכיל 6% β-מרקפטואתנול (BME). הבזק להקפיא את הפתרון, ולאחסן אותו ב -80 ° C.
- העבר 100 μL של שרף סטרפטאבידין בנפח מיטה בקיבולת גבוהה לצינור חדש של 2 מ"ל. הוסף 1 מ"ל של 0.5% LDS במי מלח HEPES של 50 מ"מ (pH 7.6), צנטריפוגה ב- 1,500 x גרם ב- RT למשך 2 דקות, והסר את הסופרנטנט. חזור על הכביסה עם עוד 1 מ"ל של 0.5% LDS ב 50 mM HEPES מלוחים (pH 7.6).
- העבירו את התמיסה משלב 6.2.29 לצינור המכיל שרף סטרפטאווידין בעל קיבולת גבוהה שנשטף מראש משלב 6.2.31, ודגרו על התמיסה במיקסר מקצה לקצה ב- RT למשך 4-6 שעות.
- צנטריפוגו את התערובת ב 1,500 x גרם ב RT במשך 2 דקות, לקחת 30 μL של supernatant, ולערבב אותו עם 10 μL של 4x מאגר דגימת Laemmli המכיל 6% BME עבור הדגימה "flowthrough". לאחר מכן, הסר את הסופרנאטנט שנותר.
הערה: ניתן לנתח דגימות "זרימה" על ידי כתם מערבי כדי לבדוק את יעילות משיכת הסטרפטאווידין כלפי מטה. חיוני להסיר כמה שיותר מהסופרנאטנט כדי לשטוף את החלבונים הבלתי קשורים. ראשית, הסר את רוב הסופרנאטנט באמצעות פיפטה P-1000, ולאחר מכן הסר את הסופרנאטנט הנותר באמצעות פיפטה P-20 עם קצה העמסת ג'ל. - הוסיפו 1 מ"ל של 0.5% LDS במי מלח HEPES של 50 מ"מ (pH 7.6) לשרף, ודגרו על התערובת במשך 30 דקות ב-RT עם סיבוב מקצה לקצה.
- צנטריפוגו את התערובת ב 1,500 x גרם ב RT במשך 2 דקות, ולהסיר את supernatant.
הערה: בדרך כלל, 0.5% LDS מספיק להסרת רוב חלבוני הקישור שאינם ספציפיים. אם אותות קשירה לא ספציפיים עדיין נראים בניתוח מאוחר יותר, ניתן להגדיל את ריכוז LDS במאגר הכביסה. - חזור על שלב 6.2.34-6.2.35 פעמיים נוספות.
- הוסף 40 μL של חיץ דגימה 2x Laemmli המכיל 6% BME לשרף.
- יש להאיר את החלבונים הקשורים על ידי דגירה על התערובת בטמפרטורה של 98°C למשך 5 דקות.
- צנטריפוגו את התערובת במהירות של 21,000 x גרם ב-RT למשך 5 דקות, והעבירו את הסופרנאטנט לצינור חדש של 1.5 מ"ל. זהו מדגם "elute".
הערה: טעינה ישירה של תמיסה המכילה שרף משלב 6.2.38 לתוך הג'ל עשויה להשפיע על ניתוח SDS-PAGE. - יש להעמיס 20 μL לכל באר של ג'ל 10% פוליאקרילאמיד בעל 10 נתיבים, ולהפעיל אלקטרופורזה בג'ל.
הערה: הפעל את הג'ל במתח נמוך יותר (120 V) עד שחזית הצבע תגיע לג'ל הפתרון, ושנה את המתח ל- 170 V. עצור את התוכנית לאחר שחזית הצבע יוצאת. - בצעו הדבקה מערבית עם נוגדנים נגד HA, אנטי-הילה או נוגדנים אחרים המזהים חלבוני משק בית (איור 3).
- מרדימים את העוברים על ידי דגירה ב 4 ° C. פעולה זו נמשכת בדרך כלל 10 דקות.
- אפשרות 3: ניתוח תמלול. RNA-seq ו-qRT-PCR (איור 4)
הערה: מומלץ מאוד להשתמש בעוברים שהונחו בהפרש של 15 דקות זה מזה לבדיקה זו. הפרש הגילאים של העוברים משפיע באופן משמעותי על תוצאות הבדיקה.- מרדימים את העוברים על ידי דגירה שלהם ב 4 ° C במשך 10 דקות, 2 שעות לאחר Z-REX.
- בצע dechorionation עם מלקחיים חדים (שלב 6.1.3).
- (אופציונלי) בצע סגמנטציה עם מלקחיים (למשל, להפריד את הראש מהזנב) אם יש לנתח מקטעים שונים בנפרד.
- אם מוציאים RNA מעובר שלם, מעבירים שלושה עד חמישה עוברים לצינור של 1.5 מ"ל. אם מחלצים RNA מהראש או מהזנב, מעבירים 10-12 מקטעים חתוכים לצינור של 1.5 מ"ל.
הערה: מומלץ לבצע את הניסוי עם שלושה עד חמישה שכפולים ביולוגיים. - הוסף 1 מ"ל של מגיב TRIzol וחרוזי זכוכית לצינור.
הערה: נמצא כי חרוזי זכוכית עובדים טוב יותר מחרוזי זירקוניה למיצוי RNA. - מערבבים את התערובת במשך 30 שניות.
הערה: אם לא ממשיכים לשלב הבא באופן מיידי, ניתן לאחסן את התמיסה בטמפרטורה של -80°C למשך 1-3 שבועות. - חלצו את הרנ"א בהתאם להוראות היצרן.
- להעריך את האיכות והריכוז של הרנ"א על ידי ספקטרופוטומטר מיקרו-נפח ואלקטרופורזה של ג'ל אגרוז.
הערה: RNA באיכות טובה צריך להיות יחס A260/A280 של סביב או מעל 2.0. - או להגיש את הרנ"א לריצוף, או לטפל ב-1 מיקרוגרם של RNA עם DNase I בדרגת הגברה, ולבצע תעתיק הפוך באמצעות כתב עילי III שעתוק הפוך ואוליגו-(dT)20. בצע שלב זה בהתאם להוראות היצרן.
- בצעו qRT-PCR ונתחו את הנתונים בשיטת ΔΔCT9 (איור 4B-D).
- אפשרות 4: ביטוי POI וניתוח לוקליזציה. בדיקת צביעה אימונופלואורסצנטית בהר שלם (איור 5)
הערה: עוברים קבועים בפורמלדהיד הם שבירים. הימנעו מטלטול נמרץ, וטפלו בזהירות.- Dechorionate את העוברים על ידי ביצוע שלבים 6.1.1-6.1.3.
- מעבירים את העוברים לצינור של 1.5 מ"ל.
הערה: בכל צינור צריך להיות מספר שווה של עוברים, ולא יותר מ-40 עוברים. - לאחר שהעוברים מתיישבים לתחתית הצינור, הסירו את הסופרנטנט והוסיפו 1 מ"ל של מלח חוצץ פוספט (PBS) (pH 7.6).
- חזור על שלב 6.4.3 פעם נוספת.
- הסר את הסופרנטנט, הוסף 1 מ"ל של פורמלדהיד 4% ב- PBS (pH 7.6), ודגר על הצינור ב- 4 ° C למשך הלילה עם נדנוד עדין.
הערה: הדגימות בתמיסת פורמלדהיד ניתן לאחסן ב 4 ° C במשך שבוע אחד. - הסר את supernatant, להוסיף 1 מ"ל של -20 ° C מתנול, לדגור את הצינור על הצד שלה ב -20 ° C במשך לפחות 18 שעות.
הערה: ניתן לאחסן את הדגימות בטמפרטורה של -20°C למשך חודש אחד או יותר. - הסר את הסופרנטנט והוסף 1 מ"ל של מאגר PDT (0.3% v/v Triton X-100, 0.1% v/v Tween-20 ו-1% v/v dimethyl sulfoxide [DMSO] במאגר PBS).
- חזור על שלב 6.4.7, ודגר על הצינור ב- RT במשך 30 דקות עם נדנוד עדין.
- הסר את הסופרנטנט, הוסף 1 מ"ל של חיץ חוסם (10% v/v סרום בקר עוברי מומת בחום [FBS], 2% אלבומין בסרום בקר [BSA], ו- 0.1% v/v Tween-20 במאגר PBS), ודגור על הצינור ב- RT למשך שעה אחת עם נדנוד עדין.
- הסר את supernatant, ולהוסיף 200 μL של תמיסת נוגדנים ראשונית (מדולל במאגר חוסם).
- הסר את הסופרנטנט, הוסף 500 μL של תמיסת נוגדנים ראשונית (מדולל בחיץ חוסם), ודגר על הצינור ב -4 מעלות צלזיוס למשך הלילה עם נדנוד עדין.
הערה: אם משתמשים בנוגדן ראשוני חדש, כדאי לכלול כמה דגימות ללא צביעת נוגדנים ראשונית שישמשו כבקרות שליליות. עם זאת, באופן אידיאלי, עוברים מורפולינו או עוברים מהונדסים גנטיים, או עוברים שבהם ביטוי של חלבון המטרה עורר, הם אמצעים אמינים יותר לאמת את הנוגדן. - הסר את הסופרנטנט, הוסף 1 מ"ל של חיץ PDT, ודגר על הצינור ב- RT למשך 30 דקות עם נדנוד עדין.
- חזור על שלב 6.4.12.
- הסר את supernatant, להוסיף 1 מ"ל של חיץ חוסם, לדגור את הצינור ב RT במשך 1 שעה עם נדנוד עדין.
הערה: הדגימות צריכות להיות מוגנות מפני אור לאחר שלב זה, כדי למנוע הלבנה של הפלואורופור המצומד על הנוגדן המשני. - הסר את supernatant, ולהוסיף 200 μL של תמיסת נוגדנים משנית (מדולל במאגר חוסם).
- הסר את הסופרנטנט, הוסף 500 μL של תמיסת נוגדנים משנית (מדוללת בחיץ חוסם), ודגר על הצינור ב- RT למשך 1.5 שעות עם נדנוד עדין.
- הסר את הסופרנטנט, הוסף 1 מ"ל של חיץ PDT, ודגר על הצינור ב- RT למשך 30 דקות עם נדנוד עדין.
- חזור על שלב 6.4.17.
- הרכיבו את העוברים על לוחית אגרוז 2% (עשויה PBS, pH 7.6) ודמיינו את העוברים באמצעות סטריאומיקרוסקופ (שדה בהיר ותעלות פלואורסצנטיות מתאימות) (איור 5A,B,D,F).
הערה: אם אתה משתמש בסטריאומיקרוסקופ פלואורסצנטי Leica M165 FC, השתמש בהגדלה של פי 25 כדי לקבל תמונות ברזולוציה טובה. - כמת/נתח את עוצמת האות הפלואורסצנטי על ידי ImageJ (NIH). השתמש בכלי בחירה חופשית ב- ImageJ כדי לכמת את האות באזור העניין.
תוצאות
הדמיה חיה של דגי נויטרופילים/מקרופאגים טרנסגניים שטופלו ב-Z-REX, Tg (lyz:TagRFP) ו-Tg (mpeg1:EGFP). אינדוקציה של אפופטוזיס נויטרופילים/מקרופאגים באמצעות Keap1 HNEylation. (ראו גם איור 2). ההשפעה של סימון אלקטרופילים של Keap1 על רמות נויטרופילים ומקרופאגים הוערכה על ידי הזרקת עוברים טרנסגניים הטרוזיגוטיים שמקורם ב- Tg (lyz:TagRFP) או Tg (mpeg1:EGFP) עם mRNA המקודד Halo-Keap1, ולאחר מכן טיפול ב- Ht-PreHNE (אלקין). בעקבות ההליכים לבדיקת שלב 6.1 במורד הזרם, אפשרות 1-HNE (אלקין) שוחררה ו- Keap1 סומן. רמות נויטרופילים ומקרופאגים הוערכו על ידי הדמיה חיה של קווי כתבים, Tg (lyz:TagRFP) ו- Tg (mpeg1:eGFP), בהתאמה. רמתם של שני סוגי התאים ירדה ב-30%-40% לאחר טיפול Z-REX, שבו HNE הועבר ל-Keap1. להיפך, לא נצפה אובדן של נויטרופילים או מקרופאגים בקבוצות הבקרה הטכניות של Z-REX [ללא אור ו-Ht-PreHNE (אלקין), אור בלבד, או Ht-PreHNE (אלקין) בלבד] (איור 1D ואיור 2A-D).
השראת אפופטוזיס נויטרופילים/מקרופאגים הצביעה על העברת HNE מוצלחת ל-Keap1 דרך Z-REX. פורסמו פרטים על ניתוח המסלול ומנגנון אפופטוזיס5. כדי להסביר השפעות מחוץ למטרה של HNE (אלקין), נעשה שימוש במספר בקרות. (1) באותם תנאי ניסוי, במקום ה-mRNA Halo-TeV-Keap1, הוזרקו לעוברים ה-mRNA Halo-P2A-Keap1. מקשר P2A איפשר לחלבוני Halo ו-Keap1 להתבטא באופן עצמאי. בתרחיש זה, HNE(אלקין) ששוחרר מ-Halo לא יכול היה לתייג את Keap1, מכיוון שהוא כבר לא היה קרוב ל-Halo (איור 1D); לפיכך, מסלול איתות אפופטוזיס לא הופעל. בקבוצה זו לא נצפו שינויים ברמות המקרופאגים או הנויטרופילים (איור 2A,B). (2) אותם תנאי ניסוי בוצעו באמצעות mRNA המקודד Halo-TeV-Keap1(C151S,C273W,C288E), מוטציה של Keap1 שאינה מגיבה ל-HNE (אלקין) (איור 1D). לא נצפו שינויים ברמות המקרופאגים או הנויטרופילים (איור 2G,H).
צימוד ביוטין אזיד-קליק ובדיקת ביוטין נפתחת. הערכת תיוג יעדים. (ראו גם איור 3). הערכת תיוג המטרה בוצעה באמצעות עוברי WT, שהוזרקו להם mRNA המקודד Halo-TeV-Keap1-2xHA (מבנה היתוך Halo-POI) או Halo-2xHA-P2A-Keap1-2xHA (מבנה מפוצל P2A, שבו Halo ו-Keap1 אינם מתמזגים; איור 1D). חלבון Keap1 שכותרתו נמשך מטה רק בקבוצה המבטאת חלבון היתוך וטופל ב-Z-REX (נתיב שני בכתם האנטי-HA העליון), אך לא בקבוצות ביקורת אחרות (ללא הזרקת mRNA, מבנה היתוך ללא Z-REX, או מבנה מפוצל P2A). התוצאות מצביעות על כך שה-HNE(אלקין) הועבר בהצלחה ל-Keap1, וה-Keap1 שעבר שינוי צומד לאחר מכן לביוטין באמצעות תגובת קליק, וה-Keap1 שכותרתו ביוטין נמשך מטה על ידי שרף סטרפטאבידין.
ניתוח תמלול. RNA-seq ו- qRT-PCR. (ראו גם איור 4). שינוי השעתוק לאחר טיפול Z-REX הוערך על ידי RNA-seq ו- qRT-PCR. ב-RNA-seq, מספר גנים הקשורים למערכת החיסון עברו ירידה ברגולציה לאחר Z-REX. לעומת זאת, גנים רבים הקשורים לתגובה נוגדת חמצון (AR) היו מווסתים לאחר Z-REX, כתוצאה מהשראת מסלול Keap1-Nrf2-AR על HNEylation על Keap110 (איור 4A). בניתוח qRT-PCR נמצאו תוצאות דומות בעת ניתוח שלושה גנים הקשורים למערכת החיסון (lyz, mpeg1.1 ו-coro1a) (איור 4B). הרגולציה למעלה ולמטה של הגנים בהתאמה הראתה השראות מוצלחות של מסלולים בתיווך Keap1 HNEylation.
בדיקת צביעת אימונופלואורסנציה מלאה (co-)וניתוח קולוקליזציה. (ראו גם איור 5). הביטוי האקסוגני Halo-TeV-Keap1-2xHA וביטוי Halo-2xHA-P2A-Keap1-2xHA הוערכו על-ידי צביעה של אימונופלואורסנציה (IF) בהר שלם (איור 5A,B). למבנה המפוצל P2A היה מספר גדול פי שניים של תגי HA מאשר למבנה TeV-fusion, אשר מתאים לאות אנטי-HA גבוה פי שניים בקבוצה P2A-split-construct-mRNA המוזרקת מאשר הקבוצה השנייה, מה שמצביע על כך שרמת הביטוי של שני המבנים הייתה דומה (איור 5C). רמות הביטוי של Halo-TeV-Keap1 (wt) ו-Halo-TeV-Keap1(C151S,C273W,C288E) נמצאו דומות גם כאשר חיטטו עם אנטי-הילה (איור 5D,E). קולוקליזציה של נויטרופילים וקספז פעיל 3 ב-Tg שטופל ב-Z-REX (lyz:TagRFP) נצפתה על-ידי שיתוף אימונוסטיין עם אנטי-RFP ואנטי-אקטיבי-קספז 3 (איור 5F). קספז פעיל 3 הוא אינדיקטור לאירועי אפופטוזיס.
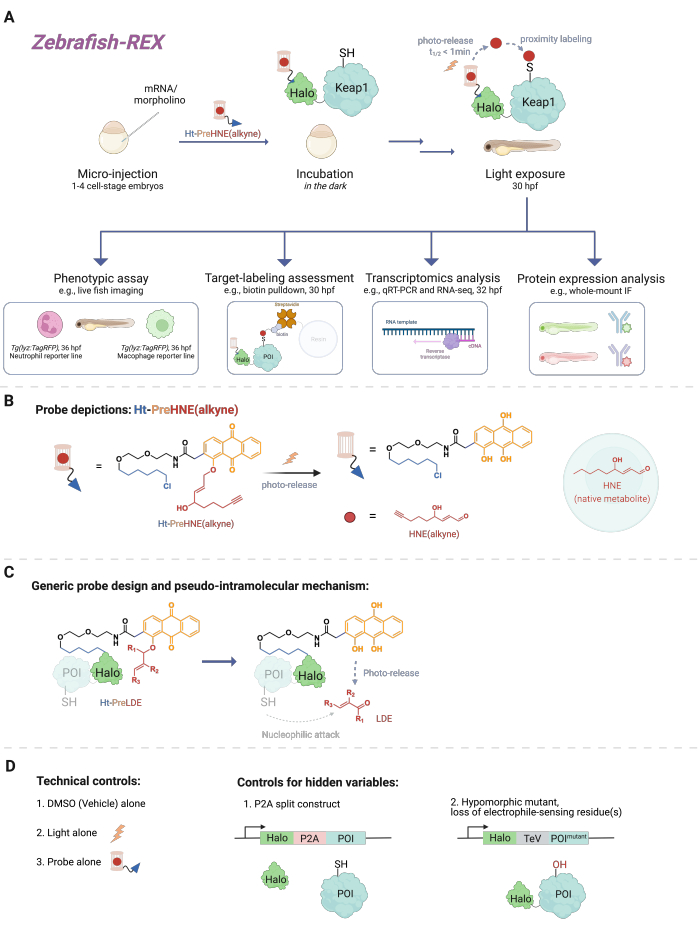
איור 1: זרימת עבודה של Z-REX. (A,B) לעובר דג זברה בשלב התא 1-4 מוזרק mRNA המקודד Halo-POI (למשל, Halo-Keap1). עוברים מוזרקים מטופלים לאחר מכן באמצעות בדיקה המורכבת מליגנד HaloTag ואלקטרופיל בכלוב פוטו-כלוב המצורף לקבוצה פונקציונלית אלקין, כגון Ht-PreHNE (אלקין) ב-B. לאחר הסרת הכמות העודפת של הגשוש, העובר נחשף לאור כדי לשחרר את האלקטרופיל המעניין [למשל, HNE או האנלוגי שלו, HNE (אלקין)]. הניתוח במורד הזרם מתבצע בנקודת זמן נתונה/מוגדרת על ידי המשתמש. (C) תכנון ומנגנון של הגשושית Ht-PreLDE, אשר ישימה לאלקטרופילים שונים שמקורם בשומנים (LDE). (D) קבוצות בקרה שליליות/טכניות עבור Z-REX. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
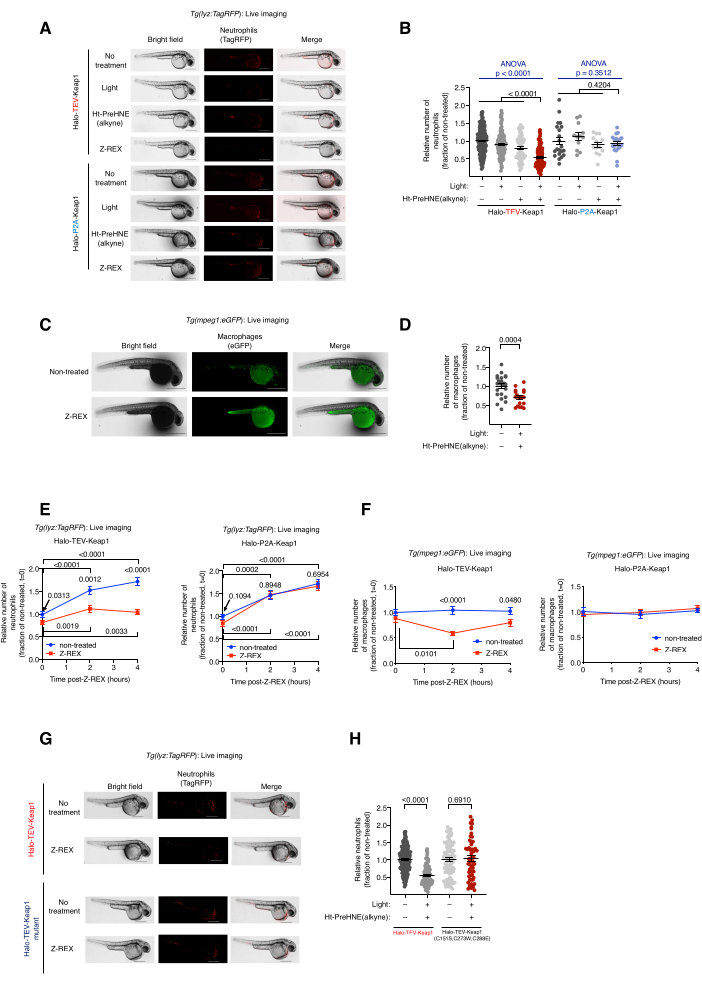
איור 2: הדמיה חיה של דגי נויטרופילים/מקרופאגים טרנסגניים שנחשפו ל-Z-REX. Z-REX-mediated Keap1 HNEylation גורם אפופטוזיס נויטרופילים/מקרופאגים. (A) תמונות מייצגות של דגי Tg (lyz:TagRFP ) המבטאים Halo-TeV-Keap1 (מבנה היתוך) או Halo-P2A-Keap1 (מבנה מפוצל), ונתונים לתנאי בקרה שליליים [ללא טיפול, אור בלבד, או Ht-PreHNE (אלקין) בלבד או Z-REX]. גיל העובר: 36 כ"ס. (B) כימות רמות נויטרופילים ב-A. (C) תמונות מייצגות של דגי Tg(mpeg1:eGFP) המבטאים את Halo-TeV-Keap1 עם או בלי טיפול Z-REX. גיל העובר: 34 כ"ס. (D) כימות רמות המקרופאגים ב-C. (ה,ו) מדידת מסלול זמן של (E) נויטרופילים ו-(F) רמות מקרופאגים לאחר טיפול ב-Z-REX. (G) ניסוי דומה כמו ב-A בדגים המבטאים Halo-TeV-Keap1 (WT) או Halo-TeV-Keap1 (C151S, C273W, C288E), מוטנט שאין לו יכולת חישת HNE. (H) כימות רמות נויטרופילים ב-G. פסי קנה מידה: 500 מיקרומטר. כל הגרפים מוצגים עם ממוצע ± SEM. ערכי p חושבו באמצעות מבחן ANOVA חד-כיווני (כחול) ומבחן t של סטודנט דו-זנבי (שחור). נתון זה שונה מ- Poganik et al.7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: בדיקת משיכת ביוטין. עוברי WT המבטאים Halo-TeV-Keap1-2XHA או Halo-2XHA-P2A-Keap1-2XHA טופלו ב-Z-REX או בתנאי בקרה שליליים מתאימים (ללא טיפול בדיקה במקרה זה). לאחר הקציר, עוברים עברו ליזה וטופלו בפרוטאז TeV לפני בדיקת משיכת הביוטין. התוצאות נותחו על ידי Western Blotting. נתון זה שונה מהואנג ואחרים. Z-REX: רעיית אלקטרופילים תגובתיים לחלבונים ספציפיים המבוטאים באופן ספציפי לרקמות או בכל מקום, ורישום תגובות חמצון-חיזור תפקודיות המושרות על ידי אלקטרופילים בדגי זחל. נתון זה שונה מהואנג ואחרים.11. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
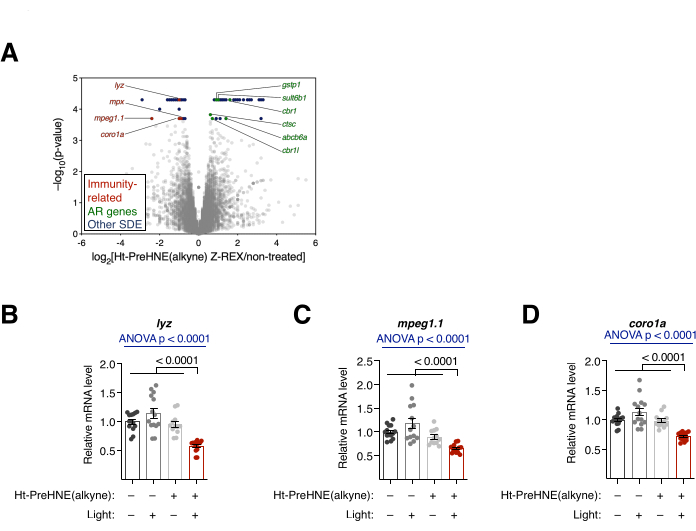
איור 4: ניתוח שעתוק. (A) תוצאות RNA-seq של עוברים שטופלו ב-Z-REX לעומת עוברים שלא טופלו. גנים בעלי ביטוי דיפרנציאלי מובהק סטטיסטית (SDE) מודגשים. גנים הקשורים למערכת החיסון SDE צבועים באדום. גנים הקשורים לתגובה נוגדת חמצון (AR) צבועים בירוק. גנים אחרים של SDE צבועים בכחול. כל ערכי p חושבו באמצעות CuffDiff. (ב-ד) שלושה גנים הקשורים למערכת החיסון SDE מ-A: (B) lyz, (C) mpeg1.1 ו-(D) coro1a נותחו עוד יותר עם qRT-PCR, ורק העוברים שטופלו ב-Z-REX הראו דיכוי של תעתיקים אלה. כל הגרפים מוצגים עם ממוצע ± SEM. ערכי p חושבו באמצעות מבחן ANOVA חד-כיווני (כחול) ומבחן t של סטודנט דו-זנבי (שחור). נתון זה שונה מ- Poganik et al.7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
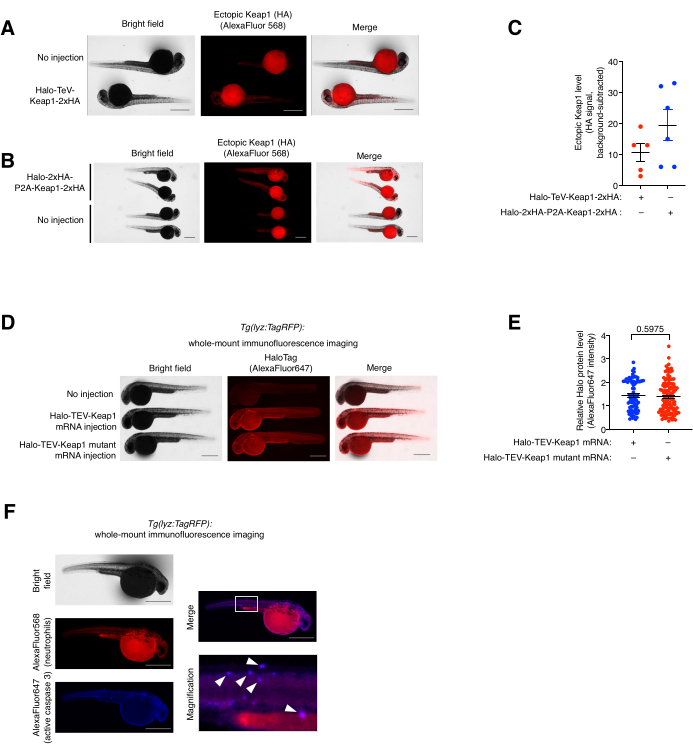
איור 5: בדיקת צביעה אימונופלואורסצנטית בהרכבה מלאה . (A,B) תמונות מייצגות של עוברים המבטאים (A) Halo-TeV-Keap1-2xHA או (B) Halo-2xHA-P2A-Keap1-2xHA המוכתמים עם אנטי-HA ונוגדן משני מצומד עם AlexaFluor568. דגים שהוזרקו באמצעות mRNA הושוו לדגים שלא הוזרקו לפי גילם. (C) כימות אות אנטי-HA ב-(A,B). (D) תמונות מייצגות של עוברים המבטאים Halo-TeV-Keap1 (WT) או Halo-TeV-Keap1 (C151S, C273W, C288E) המוכתמים במערכת החיסון עם נוגדן אנטי-Halo ונוגדן משני מצומד עם AlexaFluor647. דגים שהוזרקו באמצעות mRNA הושוו לדגים שלא הוזרקו לפי גילם. (E) כימות אות אנטי-הילה ב-D. ערכי p חושבו באמצעות מבחן t דו-זנבי של סטודנט. (ו) עוברי Tg (lyz:TagRFP) שנחשפו ל-Z-REX עברו חיסון משותף עם נוגדנים אנטי-RFP ואנטי-אקטיביים קספז 3, ונוגדנים משניים מצומדים פלואורופורים בהתאמה. התיבה הלבנה מסמנת את האזור המוגדל. חיצים לבנים מצביעים על קולוקליזציה של נויטרופילים וקספז פעיל 3. פסי קנה מידה: 500 מיקרומטר. כל הגרפים מוצגים עם ממוצע ± SEM. נתון זה שונה מ- Poganik et al.7. והואנג ואחרים.11. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: רשימת המאגרים ששימשו במחקר זה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
Z-REX המתואר בפרוטוקול זה מדגים אסטרטגיה איתנה לחקירת זוגות מטרות אלקטרופיליות ולאיתות על פירוק מסלול בדגים חיים. ההעברה מכוונת הקרבה מאפשרת מינון ובקרה מרחבית של הטיפול בתרכובת האלקטרופילית. בניגוד לשיטות מינון בולוס קונבנציונליות, שבהן הריכוזים העל-פיזיולוגיים של אלקטרופילים שנפרסו מובילים לעתים קרובות לבעיות מחוץ למטרה, הכמות הקטנה יחסית של אלקטרופיל המשתחררת למערכת הופכת את Z-REX לבלתי פולשני במידה רבה. השתמשנו ב-0.1-6 מיקרומטר Ht-PreHNE (אלקין) בעוברים של דגי זברה, והתוצאות הראו שהטיפול אינו מזיק להתפתחות העובר11.
הליך Z-REX הוא בדרך כלל ארוך יותר מאשר T-REX, טכניקה לסינון/מחקר חלבונים בעלי חישה אלקטרופילית בתאים בתרבית. נניח שמטרת הניסוי היא לסנן אינטראקציות אלקטרופילים-מטרה; אנו מציעים תחילה לבצע סינון מקיף על ידי T-REX בתאים בתרבית ולהשתמש ב- Z-REX לאימות in vivo וניתוח פנוטיפי/מסלולי. בהשוואה לתרבית תאים, הדרישות לביצוע Z-REX הן טכניקות בסיסיות לגידול דגים בנוסף למיומנויות ניסוי ביוכימיות הנדרשות על ידי T-REX. מסגרת זמן טיפוסית עבור Z-REX (מחציית דגים ועד להעברת אלקטרופילים המושרים באור) היא 2-3 ימים, שהם לא יותר מיום אחד יותר מהזמן הטיפוסי לניסוי T-REX בתאים חיים נגועים. הדמיה חיה לניתוח פנוטיפי יכולה להתבצע 2-10 שעות לאחר תאורת אור; צימוד קליקים עם ביוטין-אזיד לבדיקה נפתחת אורך 3 ימים; qRT-PCR להערכת תגובת תמלול לוקח 3 ימים; אם הצביעה נמשכת 5 ימים. צעדים אלה דומים פחות או יותר למקביליהם בתרביות תאים, אם כי פירוש הנתונים דורש הבנה של הפיזיולוגיה של הדגים וזני המדווחים.
כפרוצדורה מרובת משתנים12, מספר קבוצות ביקורת נחוצות כדי ש-Z-REX לא יכלול אי-ודאות בתוצאות (איור 1D). קבוצות בקרה נפוצות הן: (1) DMSO/טיפול ברכב בלבד; (2) טיפול בדיקה, אך ללא תאורת אור; (3) תאורת אור, אך ללא טיפול בדיקה; (4) מבנה מפוצל P2A, שבו הילה ונקודת העניין מבוטאות בנפרד, כך שמסירת הקרבה היא אבלאט; ו-(5) מוטנטים היפומורפיים, ששאריות החישה האלקטרופילית שלהם הן/הן מוטציות, כגון Akt3 (C119S)6 ו-Keap1 (C151S, C273W, C288E)5, שבהם השתמשנו במחקרים קודמים.
אם בדיקות במורד הזרם כוללות ניתוח כתמים מערביים, יש לבצע deyolking לפני הקציר. חלבוני החלמון מפחיתים את הנאמנות של הערכות ריכוז הליזט ועשויים להיקשר באופן לא ספציפי לנוגדנים. בעת ביצוע הדמיית דגים חיים או צביעת IF בהרכבה מלאה, ראינו גם אותות פלואורסצנטיים לא ספציפיים בשק החלמון, ככל הנראה כתוצאה מחלבונים אוטופלואורסצנטיים בשק החלמון, או קשירה לא ספציפית של הנוגדנים עצמם. אם האות האוטופלואורסצנטי מפריע לאות, אנו מציעים להוציא את שק החלמון מכימות או לכמת אזורים שונים בנפרד. דכורינציה נחוצה להדמיית דגים חיים ולבדיקת צביעת IF בהרכבה מלאה. הכוריון יכול להפריע להדמיה, ובהמשך לכימות / ספירת תאים. עם זאת, dechorination חל רק על עוברים מעל 1 dpf; עוברים צעירים יותר בשלבי פיצוץ/גסטרולציה/סגמנטציה הם שבירים מכדי לעבור דה-כוריון.
פרוטוקול Z-REX המתואר כאן מבוסס על ביטוי POI חוץ רחמי מונחה mRNA. ההליך מהיר בהשוואה לשימוש / יצירת קווי דגים טרנסגניים. ביטוי מונחה mRNA נמצא בכל מקום וחולף, ונמשך לפחות יומיים עבור mRNA המשמשים בפרוטוקול זה. עם זאת, משך הביטוי עשוי להשתנות במקרים אחרים. לפיכך, גישה זו מספקת חלון חקירה מהיר וגלובלי יותר להשפעות של אירוע ספציפי של תיוג אלקטרופילים, התואם למספר מבדקים בעלי תפוקה גבוהה/תוכן גבוה. קווים טרנסגניים עם ביטוי Halo-POI יציב ברקמות ספציפיות תואמים גם ל-Z-REX11. קווים כאלה משמשים בצורה הטובה ביותר כאשר יש צורך לשאול שאלה מדויקת יותר, למשל, כאשר פנוטיפ באיבר מסוים נחזה מנתוני תרבית תאים, או כאשר סינון מניסויים בהזרקת mRNA מנבא שאיבר מסוים רגיש לאירוע תיוג אלקטרופילים. השראת תגובה נוגדת חמצון ספציפית ללב באמצעות Z-REX הודגמה באמצעות דגי Tg (gstp1:GFP;DsRed-P2A-myl7:Halo-TeV-Keap1) בפרסום הקודם שלנו11. ייתכן שניתן יהיה גם לבצע Z-REX על דגים טרנסגניים מעל 2 dpf.
Disclosures
מעכבי קינאז של מולקולות קטנות ספציפיות לאיזופורם, שגילוים התאפשר על ידי טכנולוגיות REX, הוגשו לבקשת פטנט
Acknowledgements
מימון: Novartis FreeNovation, NCCR ו-EPFL.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
References
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved