Method Article
ゼブラフィッシュ仔魚のオンターゲットシグナル伝達応答のモニタリング - Z-REXは求電子薬と代謝物の正確なメカニズムを明らかにします
要約
反応性求電子試薬および酸化剤を標的とするゼブラフィッシュ(Z-REX)は、反応性低分子シグナル伝達の調査のためのケミカルバイオロジーベースの方法です。この技術は、さまざまな発達段階の生きた魚に適用できます。ここでは、ゼブラフィッシュの標準アッセイとZ-REXを組み合わせてシグナル伝達経路を解析します。
要約
反応性代謝物および関連する求電子薬は、研究が最も困難な小分子の1つです。このような分子の作用機序(MOA)を分解するための従来のアプローチは、特定の反応種が過剰である実験標本のバルク処理を利用しています。このアプローチでは、求電子試薬の高い反応性により、時間的および状況依存的な方法でプロテオームを無差別に標識します。酸化還元感受性タンパク質およびプロセスも、間接的かつしばしば不可逆的な影響を受ける可能性があります。このような無数の潜在的な標的と間接的な二次的効果を背景に、表現型を特定の標的の関与に結び付けることは依然として複雑な課題です。反応性求電子試薬および酸化剤を標的とするゼブラフィッシュ(Z-REX)は、幼虫ゼブラフィッシュでの使用に適したオンデマンドの反応性求電子試薬送達プラットフォームであり、他の点では摂動されていない生きた魚の胚の特定の目的タンパク質(POI)に求電子物質を送達するように設計されています。この技術の主な特徴には、低レベルの侵襲性、および投与量、化学療法、および時空間的に制御された精密求電子試薬送達が含まれます。したがって、独自の一連の対照と組み合わせて、この技術は、反応性求電子物質および多面的求電子薬物への動物の制御されていないバルク曝露後に観察されるオフターゲット効果および全身毒性を回避します。Z-REXを活用することで、研究者は、無傷の生きている動物の生理学的に近い条件下で、特定のPOIとの特定の反応性リガンドの関与の結果として個々のストレス応答とシグナル出力がどのように変化するかを理解するための足がかりを確立できます。
概要
無数の細胞シグナル伝達イベントには、小さな反応性分子(細胞内で内因的に産生される、または薬物などの生体異物/異種代謝物)とそのタンパク質標的との間の反応が含まれます。多くの場合、このような共有結合事象のサブ化学量論的レベルは、細胞応答を引き起こし、例えば、発生、代謝、アポトーシス、および/または免疫応答の変化をもたらす可能性があります1。しかし、特定の結合事象を表現型の結果に結びつけることによって作用機序(MOA)を分解することは困難であることが証明されています。高濃度の活性種の導入を伴う従来のボーラス投与法は、しばしば多数のタンパク質の修飾をもたらし、モデル生物に対する過度の毒性をもたらす2。そのような条件は理想からかけ離れています。T-REX(標的化可能な反応性求電子試薬および酸化剤)3と名付けられた、天然の細胞コンテキストでの精密局所的な求電子試薬送達を使用して、細胞培養におけるこれらの問題を解決する方法が開発されました。その間、焦点は生物全体での実験に向けられ、形質転換されていない細胞の特定の細胞コンテキストでタンパク質を研究する機会が可能になりました。したがって、 我々は、Danio rerio 胚モデルを含むいくつかのモデルと互換性があるように技術を拡張しました。ここでは、Z-REX(反応性求電子試薬および酸化剤を標的とするゼブラフィッシュ)を紹介します(図1)。
Z-REXを理解するために、この記事では最初にREXテクノロジーとその基礎となる概念を紹介します。これらの手法の核となるのは、天然の親電子物質が in vivoで 局所的に時空間的に生成される方法を模倣することにより、内因性の生理学的反応性求電子種(RES)シグナル伝達をモデル化することです。目的のタンパク質(POI)は、Haloへの融合構築物として発現されます。後者は、光ケージRESを担持する組織透過性で不活性なプローブを1:1の化学量論で固定します。そのような内因性RESの1つは4-ヒドロキシノネナール(以下HNE)であり、これはプローブHt-PreHNEに光ケージされています。多くの場合、HNEと本質的に同一の生物学的特性を有するが、クリックケミストリーで標識することができるHNEのアルキン官能化バージョン[すなわち、HNE(アルキン)]を使用する。Haloとの反応性のためにクロロアルカンでも官能基化されているプローブは、Ht-PreHNE(アルキン)と呼ばれます。このようにして形成されたHalo−POI融合およびプローブの複合体は、UV光の照射時に融合POIへのRESの近位送達を可能にする。POIが解放されたRESと迅速に反応する場合、結果として生じるPOIとRESの共有結合標識により、速度論的に特権のあるシステインを同定することができます。
Z-REXは、REX技術の前述の利点を利用して、生きた魚の特定のシグナル伝達経路を研究するためにそれらを広く適用します。このプロトコルは、ゼブラフィッシュ(D. rerio)は発生中に透明であり、遺伝的に扱いやすい脊椎動物であり、REX技術などの光化学/遺伝学的手法に理想的であるため、最適化されています。それにもかかわらず、同様の戦略は、この方法の幅広い適用性が脂質由来求電子試薬(LDE)送達の擬似分子内メカニズムによるものであるため、他の遺伝的に扱いやすい魚種でもうまく機能する可能性があります。実際、魚はZ-REXフォトケージ求電子試薬(Ht-PreHNE(アルキン)など)で少なくとも48時間処理でき、発育に目立った影響を与えることなく処理できるため、この手順は生体適合性が高いです。同様のプロトコルがC.エレガンス4,5で機能します。
このプロトコルでは、最初に、受精後1〜1.5日(dpf)の胚ゼブラフィッシュモデルで非ネイティブのHalo-POI融合コンストラクトの一時的な発現を生成するためのmRNA注射の使用について説明します。これにより、特定の組織や場所ではなく、魚類内の大部分の細胞(以下、「ユビキタス」と呼びます)で異所性タンパク質が発現します。ただし、データは、特定の場合に細胞特異的な効果が観察されることを示しています。注射後、胚を低濃度[0.3-5 μM Ht-PreHNE(アルキン)]のプローブで受精後最大30.5時間(hpf)インキュベートします。次いで、ユーザが規定した時間に、魚類内のPOIへのRESの送達は、2〜5分間のフォトアンケージングによって達成される。RESのフォトアンケージングに続いて、さまざまな下流表現型アッセイを次の2〜10時間にわたって実行できます:1)レポーターラインのライブイメージング(図2A);2)ウェスタンブロット分析による標的標識評価(図3)。3)トランスクリプトーム解析(図4);または4)全マウント免疫蛍光法(図5)。
レポーターラインのライブイメージングの例として、Z-REXを魚系統のライブイメージングTg(lyz:TagRFP)およびTg(mpeg1:eGFP)と組み合わせてデモンストレーションし、特定の求電子センサーPOI(すなわちKeap1)のRES修飾が、魚の他の細胞に観察可能な影響を及ぼさずに、好中球とマクロファージのレベルをそれぞれ低下させる方法を測定します。しかし、T-REX研究からのPOI標識とその結果的な経路シグナル伝達は、いくつかのタンパク質(Akt3 6、Keap17、およびUbe2v26)に対してZ-REXを使用して再現できることを以前に示しました。全体として、Z-REXを使用すると、科学者はいくつかの複雑な酸化還元経路のコンテキストでRESによるPOIの共有結合修飾の結果を研究することができます。この技術は、より文脈的に関連性のある全動物モデルにおいて、共有結合性薬物設計および新規薬物メカニズムの標的とその機能的残基を特定するように準備されています。
プロトコル
コーネル大学(米国)でのゼブラフィッシュの飼育および取り扱い手順は、国立衛生研究所(NIH)のガイドラインに従って実施され、施設動物管理および使用委員会(IACUC)によって承認されました。スイス連邦工科大学ローザンヌ校(EPFL、スイス)のゼブラフィッシュユニットでのゼブラフィッシュの飼育および取り扱い手順は、動物福祉法SR 455および動物福祉条例SR 455.1に従って、州の獣医認可VD-H23で実施されました。
注:このプロトコルでは、Z-REXを実証するために、Halo-TeV-Keap1を発現する Tg(lyz:TagRFP )および Tg(mpeg1:EGFP) 魚類系統が使用されます。この方法は、目的の他のタンパク質、トランスジェニックレポーターフィッシュ系統、および下流の生物学的アッセイに拡張できます。本試験で使用したバッファーについては、 補足表1 を参照してください。すべての試薬、機器、機器、抗体、プラスミド、ゼブラフィッシュ株および機器は、 材料表に記載されています。
1. mRNAの調製
- mMessage mMachine SP6 in vitro 転写キットを使用して、Halo-TeV-Keap1-2xHA および Halo-2xHA-P2A-Keap1-2xHA mRNA を調製します。
注:製造元の指示に従って、各mRNAに対して40 μLスケールの反応を実行します。mRNAペレットを10 μLのヌクレアーゼフリー水に再溶解します。 - mRNAの品質を評価し、マイクロボリューム分光光度計とアガロースゲル電気泳動で濃度を測定します。良質のmRNAは、A260/A280 比が約2.0以上である必要があります。
- mRNAをヌクレアーゼフリー水で1-1.5 mg/mLに希釈します。
- mRNA溶液をアリコートし(チューブあたり1〜2 μL)、アリコートを-80°Cで保存します。
2. 魚類の胚の産生
- オプション1:野生型(WT)魚の胚を産生する。
- 10の別々のタンクに10の魚の交配ペアを設定し、各タンクにはオスとメスの親魚の間の仕切りが含まれています。
注:合計10の交差ペアは、通常、アッセイに十分な数の胚を提供します。交配ペアの数は、実験デザイン/必要性および親魚の繁殖力に応じて調整することができる。 - 翌朝、インジェクターを設置した後、5つのタンクの仕切りを取り外します。魚が交尾するまで30分待ちます。
- 親魚を別の水槽に移し、水槽の水をストレーナーに通して胚を採取し、ストレーナーから10cmのシャーレに胚を洗い流します。これらの胚は注射の最初のラウンドに使用されます。
注:特定のバッチからの卵の品質が悪い場合(たとえば、タンパク質の凝集のために卵が不透明である場合)、それらを他の胚とプールしないでください。 - (オプション)次の注入ラウンドのために、他の5つのタンクで手順2.1.2-2.1.3で説明されているのと同様の手順を実行します。
注:胚間の年齢差を最小限に抑えるために、1回の注射のみを行うのが最善です。ただし、1ロットで注入できるよりも多くの胚が必要な場合は、mRNA注入中に胚が1〜4細胞段階にとどまるように、2ラウンドの注入を行うことをお勧めします。射出ラウンドの数は、オペレーターの射出スキルと実験計画に応じて調整できます。しかしながら、2時間以内に全手順(最初の仕切りの除去から最後の胚の注入まで)を実行することが推奨される。胚間の年齢差が大きいと、実験結果の信頼性と再現性が損なわれる可能性があります。
- 10の別々のタンクに10の魚の交配ペアを設定し、各タンクにはオスとメスの親魚の間の仕切りが含まれています。
- オプション2:ヘテロ接合性トランスジェニック好中球/マクロファージレポーター魚胚の産生。
- 10の別々のタンクに10の魚の交配ペアを設定し、各タンクにオスとメスの親魚の間に仕切りを挿入します:WT魚対 Tg(lyz:TagRFP)、またはWT魚対 Tg(mpeg1:eGFP)。
注:ホモ接合型レポーター魚はヘテロ接合型魚と比較して高い蛍光シグナルを示すため、下流の蛍光読み出しに影響を与える可能性のあるヘテロ接合型トランスジェニック魚間の交配は避けてください。トランスジェニックレポーターラインとWT胚は、イメージング時に容易に区別することができる。同じプール内にWTとヘテロ接合胚の混合物があることは問題ではありません。 lyz:TagRFP は好中球を報告し、 mpeg:eGFP はマクロファージを報告します。このプロトコルは、他のレポーターフィッシュラインにも適用できます。 - 手順 2.1.2-2.1.4 に従います。
- 10の別々のタンクに10の魚の交配ペアを設定し、各タンクにオスとメスの親魚の間に仕切りを挿入します:WT魚対 Tg(lyz:TagRFP)、またはWT魚対 Tg(mpeg1:eGFP)。
3.マイクロインジェクターのセットアップ
- 空気源をオンにし、背圧を0.2〜0.5psiに設定し、射出圧力を25〜30psiに設定します。示されている圧力の特定の範囲は、通常推奨されます。
注意: 魚培地が針に逆流するのを防ぐために、安定した背圧を持つことが不可欠です。ステップ3.8で注入量を校正するときは、射出時間のみを変更する必要があります。次の手順では、射出圧力を変更しないでください。低い注入圧力は表面および界面張力による注入の失敗につながる可能性がありますが、高い注入圧力は胚を損傷する可能性があります。 - 装置と注入プラットフォームをRNase除染溶液で洗浄します。
注:mRNAを分解するRNaseは、オペレーターまたは機器から発生する可能性があります。実験前にクリーンアップを行い、手袋を着用する必要があります。 - (オプション)mRNAとモルホリノを同時注入する場合は、0.2 mLチューブで2つをプレミックスします。
注:Z-REXは、250-1500 ng/μLの濃度のHalo-TeV-Keap1-2xHA mRNA溶液を使用することでうまく機能します。ゼブラフィッシュにはいくつかのモルホリノも使用されており、最適な濃度が報告されています7。未発表配列のモルホリノを使用する場合、オペレーターはZ-REXで使用する前に、まずモルホリノの毒性と遺伝子ノックダウン効率を評価する必要があります。 - 1〜2 μLのmRNA(および/または該当する場合はモルホリノ7)をマイクロローダーピペットチップを備えた注射針に移します。
注意: フレーミング/ブラウンマイクロピペットプーラーで針を準備する場合、セットアップは次のとおりです。熱:520ユニット;引張強度:60ユニット;速度:70単位;遅延:155ユニット。圧力:550単位;ランプ:530ユニット。 - マイクロインジェクションマニピュレーターに針を取り付けます。
注:空気源からの背圧により、mRNA(/モルホリノ)溶液が針先に押し込まれます。 - 鋭利な鉗子またはかみそりの刃を使用して針先を壊し、注射に適した開口部を作成します。
- 針先をステージマイクロメーター上の鉱物油に浸します。
- 2つまたは3つの注入パルスを適用して、チップの気泡を取り除きます。
- 射出時間を変更して、液滴サイズを2 nLに校正します。
注:これは、血球計算盤に置かれた鉱油(卵黄嚢の粘度を模倣する)に注入することによって最もよく実行されます。顕微鏡を使用して、血球計算盤のグリッド線を使用して、注射中に形成される液滴のサイズを推定し、それに応じて注入時間を調整します。フェノールレッド色素が用いられることもあるが、ここに記載のmRNA注入手順においてその必要性は観察されていない。
4.マイクロインジェクション
- 注入プレートに新しい10%ハンクス平衡塩溶液(HBSS)培地を満たし、プレートの溝内の胚を鈍い鉗子で整列させます。
注:注入プレートは、10%HBSS培地中の2%アガロースで調製されます。溝はプラスチック金型を使用して形成されます。 - 注射プレートの針先を10%HBSS培地に浸します。
- 2つまたは3つの注入パルスを適用して、チップの気泡を取り除きます。
- 注射ごとに、絨毛膜と卵黄嚢を1回の動きで貫通し、注入パルスを適用します。この注入された液体は、注射直後に卵黄嚢内の小さな回転楕円体として見ることができます。この小さな回転楕円体は比較的急速に消散します。十分な数の注入された胚が得られるまで、他の胚についてもこの手順を繰り返します。
注:胚の生存率(注射された胚と注射されていない胚の両方)は、通常、50%〜90%の範囲で変動します。各対照/実験グループに必要な胚の数を2倍に注入することを目指します。ビオチンプルダウンアッセイでは、各条件に対して100〜140個の生存可能な胚が必要です。qRT-PCRアッセイでは、各条件に対して5つの生存可能な胚が推奨されます。生きた魚のイメージングとホールマウント免疫蛍光染色アッセイのサンプルサイズはユーザー定義です。分析において良好な統計的検出力を得るためには、条件ごとに少なくとも20個の生存可能な胚を有することが推奨される。 - 注入された胚を、新鮮な10%HBSS培地を含む新しい10cmのペトリ皿に洗い流します。
注:胚は、噴出ボトルを使用して溝から簡単に洗い流すことができます。 - 注入されていない胚を別のプレートにプールします。
注:注射されていない胚は、必要に応じて、魚の健康、ベースラインタンパク質発現、バックグラウンド蛍光レベルなどの品質管理として役立ちます。注射手順がうまく機能し、注入されたmRNA/モルホリノが胚に致命的でない場合、注入された胚と注入されていない胚は同様の生存率を持つはずです。
5. Z-レックス
- 注入した胚を、実験のセットアップ(対照群/実験群の数)に従って10cmの皿に分配します。
- 赤色光照明のある暗い部屋で、培地を1 μM Ht-PreHNE(アルキン)の有無にかかわらず、30 mLの10%HBSSと交換します。
注:Ht-PreHNE(アルキン)は軽質に不安定な化合物です。胚は以下のステップで暗所に保たれるべきです。 - 胚を暗所で28.5°Cでインキュベートします。
- 30.5 hpfで、暗い部屋で、培地を新しい30 mLの10%HBSSと交換します。
メモ: メディアを交換するときは、できるだけ古いメディアを取り外してください。これは、胚から非結合/過剰量のHt-PreHNE(アルキン)を除去するために重要です。 - 胚を28.5°Cの暗所で30分間インキュベートします。
- 手順5.4〜5.5をさらに2回繰り返します。
- UVランプ(365 nm、3 mW / cm2)を5分間オンにして、ランプを予熱します。
注意: lamp 事前加温手順は、手順5.8の前に実行する必要があります。ランプの電力は、電源を入れてから最初の数分で低下/不安定になります。ランプの電力は、UVメーターで定期的に測定する必要があります。 - 32 hpfで、胚を紫外線にさらします。
- オプション1:生きた魚のイメージング、全マウント免疫蛍光染色、ゲル内蛍光分析(Cy5アジドとのクリックカップリング)、RNA-seq、qRT-PCRなどのダウンストリーム読み出しでは、胚をUV光に3分間さらし、30秒ごとにプレートを旋回させます。
- オプション2:ビオチンプルダウンアッセイなどの下流の読み出しでは、胚をUV光に最大5分間(最小3分間)さらし、30秒ごとにプレートを旋回させ、プレートを氷上で1分間冷却します。
注:異なるプローブを使用する場合は、特定のフォトケージ付き求電子プローブと展開された光源のフォトアンケージングの t1/2 に応じて、光露光時間を最適化する必要があります。 t1/2フォトアンケージング は、公知の手順8を用いて決定することができる。Ht-PreHNE(アルキン)の場合、 t1/2 は1分3<。したがって、上記の時間で十分です。
6. ダウンストリームアッセイ
- オプション1:表現型アッセイ。トランスジェニック好中球/マクロファージレポーターのライブイメージング
フィッシュライン、Tg(lyz:TagRFP)およびTg(mpeg1:eGFP)(図2)- 胚を4°Cで10分間インキュベートして麻酔します。
注:条件ごとに少なくとも20個の生存可能な胚を持つことが推奨されます。 - 未受精/死んだ胚をプレートから取り除きます。
注:未受精/死んだ胚は曇っている/不透明であり、視覚的に識別することができます。高い死亡率が見られる場合は、注射手順に戻るか、mRNAまたはモルホリノの濃度を下げるようにしてください。 - 鋭い鉗子で胚を脱振膜します。幼虫の魚に触れずに1組の鉗子で絨毛膜を持ち、もう一方の鉗子を使用して絨毛膜をはぎ取ります。胚は壊れやすいです。デコリオンを行うときだけ絨毛膜に触れてください。
注:特に初心者では、デコリオン中にいくつかの胚を損傷するのが一般的です。したがって、常に必要最低限よりも多くの胚を持っています。 - 胚を2%アガロースプレート(10%HBSS培地で調製)にマウントし、実体顕微鏡(明視野およびそれぞれの蛍光チャネル)で胚を画像化します(図2A、C、G)。
注:Z-REX [Halo-TeV-Keap1-2xHA mRNA 注射と Ht-PreHNE(アルキン)治療の組み合わせ]後、好中球の枯渇(lyz:TagRFP)は36 hpf(Z-REX後4時間)で最も顕著であることがわかりましたが、マクロファージ(mpeg1:eGFP)の減少は34 hpf(Z-REX後2時間)で最も顕著でした(図2E、F)。異なるレポーターライン、mRNA/モルホリノ、またはプローブを使用する場合は、他の時点を使用できます。露光時間および/またはゲインは、単一細胞または所望の特定の(超)構造を視覚化するために最適化する必要があります。 - ImageJ(NIH)によって各魚の好中球/マクロファージ数を数えます(図2B、D-F、H)。ImageJのフリーハンド選択ツールを使用して魚全体を丸で囲み、オプション[最大値の検索]を使用して蛍光細胞をカウントします。
- 胚を4°Cで10分間インキュベートして麻酔します。
- オプション2:ターゲットラベリング評価。ビオチンアジドクリックカップリングおよびビオチンプルダウンアッセイ(図 3)
- 4°Cで培養して胚を麻酔します。 これには通常10分かかります。
注:十分な魚の溶解物を得るには、各条件に100〜140個の生存可能な胚が必要です。 - 未受精/死んだ胚をプレートから取り除きます。
- デコリオンと脱黄を行います。絨毛膜を一対の鋭い鉗子で保持し、もう一方の鉗子を使用して卵黄嚢を貫通し、次に絨毛膜を除去しながら卵黄嚢を分離して卵黄タンパク質が出てくるようにすることで、2つの操作を実行します。
注:このステップでは、卵黄タンパク質を除去することが重要です。サンプル中の豊富な卵黄タンパク質は、後の分析を妨げます。 - 脱卵胚を1.5 mLチューブに移します。
注:プレートを回転させて脱卵胚を中央に配置すると、収集が容易になります。このプロセス中に、軽い絨毛膜の破片が消えます。 - 胚がチューブ底に落ち着いたら、上清を取り除き、冷やしたHEPES緩衝生理食塩水(pH 7.6)を1 mL加えます。
- 手順 6.2.5 をさらに 2 回繰り返します。
- (オプション)すぐに次のステップに進むつもりがない場合は、バッファーを除去し、サンプルを液体窒素で瞬間凍結し、-80°Cで保存します。
注意: 脱卵魚のペレットは、液体窒素で瞬間冷凍し、-80°Cで保存できます。 瞬間凍結サンプルは、-80°Cで最大2週間保存できます。 - 魚のペレットを溶解バッファーに再懸濁します。
注:溶解バッファー(pH 7.6)は、50 mM HEPES、100 mM NaCl、1% Triton X-100、0.3 mM TCEP、2x Roche cOmplete Mini EDTAフリープロテアーゼ阻害剤、および大豆由来の0.1 mg/mLトリプシン阻害剤で構成されています。1つの胚は約2μgの溶解物を与えます。120個の胚ごとに100 μLの溶解バッファーを使用します。大豆由来の2つのロシュcOmplete Mini EDTAフリープロテアーゼ阻害剤およびトリプシン阻害剤は、使用直前に溶解バッファーに添加する必要があります。 - 20%v/vジルコニアビーズをチューブに追加します。
- 20秒間ボルテックスし、液体窒素中で瞬間凍結し、37°Cの水浴中で解凍する。
- 手順 6.2.10 をさらに 2 回繰り返します。
- 溶液を21,000 x g で4°Cで10分間遠心分離します。
- 上清を新しい予冷した1.5 mLチューブに移します。
- ブラッドフォードアッセイによりタンパク質濃度を測定する。
- ライセートを1 mg/mLに希釈します。
- 各条件について、170 μgのライセートを2 mLチューブに移します。
- ステップ6.2.16のライセートを0.2 mg/mL TeVプロテアーゼ(S219V)と混合し、溶液を37°Cで30分間インキュベートします。
注:TeVプロテアーゼ処理されていないグループの場合は、ライセートを他のグループで使用されているTeVプロテアーゼ溶液と同等の体積の溶解バッファーと混合するだけです。 - ビオチン-アジドクリック反応用の10xマスターミックスを調製します:10% w/v SDS、10 mM CuSO4、1 mM Cu(TBTA)、1 mM ビオチン-アジド、および20 mM TCEP。
メモ: ステップ 6.2.19 の直前に TCEP をミックスに追加します。 - ステップ6.2.17の(TeVプロテアーゼ消化)ライセートに8.5 μLのt-BuOHと17 μLの10xクリック反応マスターミックスを加えます。ボルテックス、遠心分離機、および溶液を37°Cで15分間インキュベートします。
- さらに1 mM TCEPを溶液に加え、ボルテックス、遠心分離、37°Cでさらに15分間インキュベートします。ステップ6.2.19-6.2.20のインキュベーション時間は合計30分です。
注:Cu(I)を生成するための還元試薬であるTCEPのこのサプリメントは、クリック反応効率を向上させます。 - 各チューブに600 μLの-20°Cエタノールを加え、溶液をボルテックスし、-80°Cで一晩インキュベートします。
注:サンプルは-80°Cで1週間保存できます。そうでない場合は、すぐに次の手順に進みます。 - 溶液を21,000 x g で4°Cで1時間遠心分離します。
注:ペレットは、遠心分離後にチューブの底に形成されるはずであり、これは所望の画分である。 - 上清を取り除き、1 mLの-20°Cエタノール、ボルテックスを加え、溶液を21,000 x g で4°Cで10分間遠心分離します。
- 手順 6.2.23 を繰り返します。
- 上清を除去し、1 mLの-20°Cアセトン、ボルテックスを加え、溶液を21,000 x g で4°Cで10分間遠心分離します。
- 上清を除去する。余分な残留アセトンを蒸発させますが、完全に乾くわけではありません。
- ペレットを100μLの再懸濁バッファー(8%w / vドデシル硫酸リチウム[LDS]、50mM HEPES生理食塩水中の1mM EDTA、pH 7.6)に再懸濁し、15秒間ボルテックスし、ペレットが溶解するまで超音波処理します。
- 溶液を室温(RT)で21,000 x g で5分間遠心分離します。
- 上清を新しい2 mLチューブに移し、1.5 mLの50 mM HEPES生理食塩水、pH 7.6を加えます。
注:このステップでのLDSの最終濃度は0.5%です。LDS濃度が高いと、プルダウン効率が低下する可能性があります。したがって、LDS濃度を増加させることは非特異的結合の減少を助けることができるが、それはまたプルダウンの効率を低下させる可能性がある。したがって、このステップではLDS濃度を変更しないことをお勧めします。 - 「インプット」サンプルを収集します(図3):30 μLの1 mg/mLライセートを新しい1.5 mLチューブに移し、6%β-メルカプトエタノール(BME)を含む10 μLの4x Laemmliサンプルバッファーを追加します。溶液を瞬間凍結し、-80°Cで保存します。
- 床容量のストレプトアビジン大容量樹脂100 μLを新しい2 mLチューブに移します。50 mM HEPES生理食塩水(pH 7.6)に0.5% LDS1 mLを加え、RTで1,500 x g で2分間遠心分離し、上清を除去します。50 mM HEPES生理食塩水(pH 7.6)中の0.5%LDSをさらに1 mLで洗浄を繰り返します。
- ステップ6.2.29の溶液をステップ6.2.31で予備洗浄したストレプトアビジン大容量樹脂を含むチューブに移し、RTのエンドオーバーエンドミキサーで4〜6時間インキュベートします。
- 混合物をRTで1,500 x g で2分間遠心分離し、30 μLの上清を取り、「フロースルー」サンプル用に6%BMEを含む10 μLの4x Laemmliサンプルバッファーと混合します。その後、残った上清を除去する。
注:「フロースルー」サンプルは、ストレプトアビジンのプルダウン効率を確認するためにウェスタンブロッティングで分析できます。結合していないタンパク質を洗い流すために、できるだけ多くの上清を除去することが不可欠です。まず、P-1000ピペットを用いて上清の大部分を除去し、次いでゲルローディングチップ付きP-20ピペットを用いて残りの上清を除去する。 - 50 mM HEPES生理食塩水(pH 7.6)中の0.5% LDS1 mLを樹脂に加え、エンドオーバーエンド回転しながらRTで30分間インキュベートします。
- 混合物をRTで1,500 x g で2分間遠心分離し、上清を除去します。
注:通常、0.5%LDSは、ほとんどの非特異的結合タンパク質を除去するのに十分です。後の分析で非特異的結合シグナルが依然として見られる場合は、洗浄バッファー中のLDS濃度を高めることができます。 - 手順 6.2.34-6.2.35 をさらに 2 回繰り返します。
- 6%BMEを含む40 μLの2x Laemmliサンプルバッファーをレジンに加えます。
- 結合タンパク質を溶出するには、混合物を98°Cで5分間インキュベートします。
- 混合物を21,000 x g でRTで5分間遠心分離し、上清を新しい1.5 mLチューブに移します。これは「溶出」サンプルです。
注:ステップ6.2.38の樹脂を含む溶液をゲルに直接ロードすると、SDS-PAGE分析に影響を与える可能性があります。 - 10レーン10%ポリアクリルアミドゲルの各ウェルに20 μLをロードし、ゲル電気泳動を実行します。
注:染料前面が分離ゲルに達するまでゲルをより低い電圧(120 V)で実行し、電圧を170 Vに変更します。 - ハウスキーピングタンパク質を検出する抗HA、抗Halo、またはその他の抗体を用いてウェスタンブロッティングを行います(図3)。
- 4°Cで培養して胚を麻酔します。 これには通常10分かかります。
- オプション3:トランスクリプトーム解析。RNA-seq および qRT-PCR (図4)
注:このアッセイには、互いに15分以内に産卵された胚を使用することを強くお勧めします。胚の年齢差はアッセイ結果に大きく影響します。- Z-REXの2時間後に胚を4°Cで10分間インキュベートして麻酔します。
- 鋭い鉗子でデコリオンを実行します(ステップ6.1.3)。
- (オプション)異なるセグメントを別々に分析する場合は、鉗子を使用してセグメンテーションを実行します(たとえば、頭を尾から分離します)。
- 胚全体からRNAを抽出する場合は、3〜5個の胚を1.5 mLチューブに移します。頭部または尾部からRNAを抽出する場合は、10〜12個の解剖セグメントを1.5 mLチューブに移します。
注:3〜5回の生物学的複製で実験を行うことをお勧めします。 - 1 mLのTRIzol試薬とガラスビーズをチューブに加えます。
注:ガラスビーズは、RNA抽出においてジルコニアビーズよりもうまく機能することがわかった。 - 混合物を30秒間ボルテックスします。
注:次のステップにすぐに進まない場合は、溶液を-80°Cで1〜3週間保存できます。 - 製造元の指示に従ってRNAを抽出します。
- 微量分光光度計とアガロースゲル電気泳動によりRNAの品質と濃度を評価します。
注:良質のRNAは、A260/A280 比が約2.0以上である必要があります。 - RNAをシーケンシングのために提出するか、1 μgのRNAを増幅グレードのDNase Iで処理し、上付き文字III逆転写酵素およびオリゴ(dT)20を使用して逆転写します。製造元の指示に従ってこの手順を実行してください。
- qRT-PCRを行い、ΔΔCT法9(図4B-D)によりデータを解析する。
- オプション4:POI発現と共局在解析。ホールマウント免疫蛍光染色アッセイ(図5)
注:ホルムアルデヒド固定胚は壊れやすいです。激しい揺れを避け、取り扱いには注意してください。- ステップ6.1.1-6.1.3に従って胚を脱絨毛させます。
- 胚を1.5 mLチューブに移します。
注:各チューブには、同数の胚と40個以下の胚が必要です。 - 胚がチューブの底に落ち着いたら、上清を取り除き、1 mLのリン酸緩衝生理食塩水(PBS)(pH 7.6)を加えます。
- 手順 6.4.3 をもう一度繰り返します。
- 上清を除去し、PBS(pH 7.6)に4%ホルムアルデヒド1 mLを加え、チューブを4°Cで一晩穏やかに揺らしながらインキュベートします。
注:ホルムアルデヒド溶液中のサンプルは、4°Cで1週間保存できます。 - 上清を除去し、1 mLの-20°Cメタノールを加え、チューブの側面を-20°Cで少なくとも18時間インキュベートします。
注:サンプルは-20°Cで1ヶ月以上保存できます。 - 上清を除去し、1 mLのPDTバッファー(PBSバッファーに0.3%v/vトリトンX-100、0.1%v/vトゥイーン-20、および1%v/vジメチルスルホキシド[DMSO])を加えます。
- ステップ6.4.7を繰り返し、チューブをRTで30分間、穏やかに揺らしながらインキュベートします。
- 上清を除去し、1 mLのブロッキングバッファー(10%v/v熱不活化ウシ胎児血清[FBS]、2%w/vウシ血清アルブミン[BSA]、および0.1%v/v Tween-20PBSバッファー)を加え、穏やかに揺らしながらRTで1時間チューブをインキュベートします。
- 上清を除去し、200 μLの一次抗体溶液(ブロッキングバッファーで希釈)を加える。
- 上清を除去し、500 μLの一次抗体溶液(ブロッキングバッファーで希釈)を加え、チューブを4°Cで一晩、穏やかに揺らしながらインキュベートします。
注:新しい一次抗体を使用する場合は、一次抗体染色のないサンプルをネガティブコントロールとして含める価値があります。しかし、理想的には、モルホリノノックダウンまたは遺伝子ノックアウト胚、または標的タンパク質の発現が刺激された胚は、抗体を検証するためのより信頼性の高い手段です。 - 上清を除去し、1 mLのPDTバッファーを加え、チューブをRTで30分間、穏やかに揺り動かしながらインキュベートします。
- 手順 6.4.12 を繰り返します。
- 上清を除去し、1 mLのブロッキングバッファーを加え、チューブをRTで1時間、穏やかに揺動しながらインキュベートします。
注:二次抗体に結合した蛍光色素の光退色を防ぐために、このステップの後、サンプルを光から保護する必要があります。 - 上清を除去し、二次抗体溶液200 μL(ブロッキングバッファーで希釈)を加えます。
- 上清を除去し、500 μLの二次抗体溶液(ブロッキングバッファーで希釈)を加え、チューブをRTで1.5時間、穏やかに揺らしながらインキュベートします。
- 上清を除去し、1 mLのPDTバッファーを加え、チューブをRTで30分間、穏やかに揺り動かしながらインキュベートします。
- 手順 6.4.17 を繰り返します。
- 胚を2%アガロースプレート(PBS製、pH 7.6)にマウントし、実体顕微鏡(明視野およびそれぞれの蛍光チャネル)で胚を画像化します(図5A、B、D、F)。
注意: Leica M165 FC蛍光実体顕微鏡を使用する場合は、25倍の倍率を使用して、良好な解像度の画像を取得します。 - ImageJ(NIH)による蛍光シグナル強度の定量化/解析ImageJの フリーハンド選択 ツールを使用して、関心領域の信号を定量化します。
結果
Z-REX処理トランスジェニック好中球/マクロファージレポーターフィッシュ、Tg(lyz:TagRFP)およびTg(mpeg1:EGFP)のライブイメージング。Keap1 HNEイル化による好中球/マクロファージアポトーシスの誘導。(図 2 も参照)。好中球およびマクロファージレベルに対するKeap1の求電子標識の効果は、Tg(lyz:TagRFP)またはTg(mpeg1:EGFP)に由来するヘテロ接合トランスジェニック胚にHalo-Keap1をコードするmRNAを注入し、Ht-PreHNE(アルキン)で処理することによって評価されました。ステップ6.1-ダウンストリームアッセイの手順に従って、オプション1-HNE(アルキン)を遊離し、Keap1を標識しました。好中球およびマクロファージレベルは、それぞれレポーター株Tg(lyz:TagRFP)およびTg(mpeg1:eGFP)のライブイメージングによって評価されました。両方の細胞タイプのレベルは、HNEがKeap1に送達されたZ-REX処理後に30%〜40%減少しました。それどころか、Z-REXテクニカルコントロールグループ[光とHt-PreHNE(アルキン)なし、光のみ、またはHt-PreHNE(アルキン)のみ]では好中球またはマクロファージの損失は見られませんでした(図1Dおよび図2A-D)。
好中球/マクロファージアポトーシスの誘導は、Z-REXを介したKeap1へのHNE送達の成功を示しました。パスウェイ解析とアポトーシス機構の詳細が公開されています5。HNE(アルキン)のオフターゲット効果を説明するために、いくつかのコントロールを使用した。(1)同様の実験条件下で、Halo-TeV-Keap1 mRNAの代わりに、Halo-P2A-Keap1 mRNAを胚に注入した。P2Aリンカーにより、Haloタンパク質とKeap1タンパク質を独立して発現させることができました。このシナリオでは、Haloから放出されたHNE(アルキン)は、Haloの近位ではなくなったため、Keap1を標識できませんでした(図1D)。したがって、アポトーシスシグナル伝達経路は引き起こされなかった。この群では、マクロファージまたは好中球レベルの変化は観察されませんでした(図2A、B)。(2)HNE(アルキン)に応答しないKeap1の変異体であるHalo-TeV-Keap1(C151S,C273W,C288E)をコードするmRNAを用いて、同様の実験条件を行った(図1D)。マクロファージまたは好中球レベルの変化は観察されなかった(図2G、H)。
ビオチンアジドクリックカップリングおよびビオチンプルダウンアッセイ。ターゲットラベリング評価。(図 3 も参照)。標的標識評価は、Halo-TeV-Keap1-2xHA(Halo-POI融合コンストラクト)またはHalo-2xHA-P2A-Keap1-2xHA(HaloとKeap1が融合していないP2Aスプリットコンストラクト)のいずれかをコードするmRNAを注入したWT胚を用いて実施した。図1D)。標識Keap1タンパク質は、融合タンパク質を発現する群でのみプルダウンされ、Z-REX(上部の抗HAブロットの2番目のレーン)で処理されましたが、他の対照群(mRNA注入なし、Z-REXを含まない融合コンストラクト、またはP2Aスプリットコンストラクト)では処理されませんでした。その結果、HNE(アルキン)はKeap1に送達され、修飾Keap1はクリック反応によってビオチンと結合し、ビオチン標識Keap1はストレプトアビジン樹脂によってプルダウンされたことが示されました。
転写解析。RNA-seq および qRT-PCR. ( 図 4 も参照)。Z-REX処理後の転写変化をRNA-seqおよびqRT-PCRにより評価した。RNA-seqでは、Z-REX後にいくつかの免疫関連遺伝子がダウンレギュレーションされました。対照的に、多くの抗酸化応答(AR)関連遺伝子は、Keap110 上のHNEylation時にKeap1-Nrf2-AR経路が誘導された結果、Z-REX後にアップレギュレーションされました(図4A)。qRT-PCR解析では、3つの免疫関連遺伝子(lyz、 mpeg1.1、および coro1a)を解析しても同様の結果が得られました(図4B)。それぞれの遺伝子のアップレギュレーションとダウンレギュレーションは、Keap1 HNEylationによって媒介される経路の誘導に成功したことを示しました。
ホールマウント(共)免疫蛍光染色アッセイおよび共局在解析。 ( 図5も参照)。外因性Halo-TeV-Keap1-2xHAおよびHalo-2xHA-P2A-Keap1-2xHAの発現を全マウント免疫蛍光(IF)染色によって評価した(図5A、B)。P2Aスプリットコンストラクトは、TeV融合コンストラクトの2倍のHAタグを有し、これはP2AスプリットコンストラクトmRNA注入群の抗HAシグナルが他のコンストラクトよりも2倍高いことに対応し、2つのコンストラクトの発現レベルが類似していたことを示しています(図5C)。Halo-TeV-Keap1(wt)とHalo-TeV-Keap1(C151S、C273W、C288E)の発現レベルも、抗Haloでプロービングした場合に類似していることがわかりました(図5D、E)。Z-REX処理 Tg(lyz:TagRFP) における好中球と活性カスパーゼ3の共局在は、抗RFPおよび抗活性カスパーゼ3との共免疫染色によって観察されました(図5F)。活性カスパーゼ3は、アポトーシスイベントの指標である。
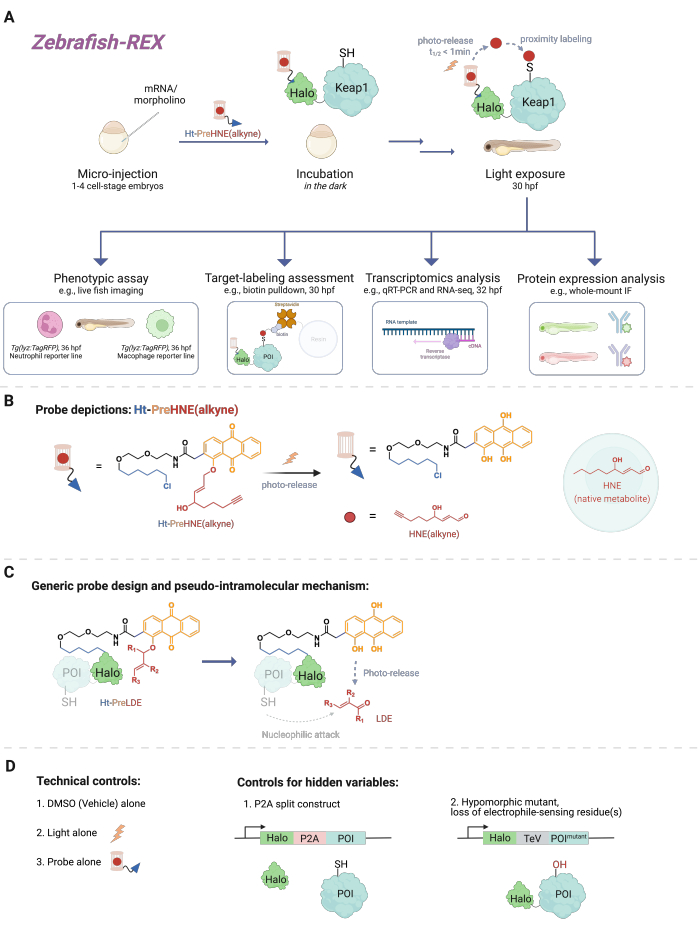
図1:Z-REXのワークフロー 。 (A、B)1〜4細胞期のゼブラフィッシュ胚に、Halo−POIをコードする(モルホリノおよび)mRNA(例えば、Halo−Keap1)を注入する。次に、注入された胚を、HaloTagリガンドと、 BのHt-PreHNE(アルキン)などのアルキン官能基が付加された光ケージ型求電子試薬で構成されるプローブで処理します。過剰量のプローブを除去した後、胚を光にさらして目的の求電子剤[例えば、HNEまたはその類似体、HNE(アルキン)]を放出します。下流の分析は、特定の/ユーザー定義の時点で実行されます。(C)さまざまな脂質由来求電子試薬(LDE)に適用可能なHt-PreLDEプローブの設計とメカニズム。(D)Z-REXの陰性/技術対照群。 この図の拡大版を表示するには、ここをクリックしてください。
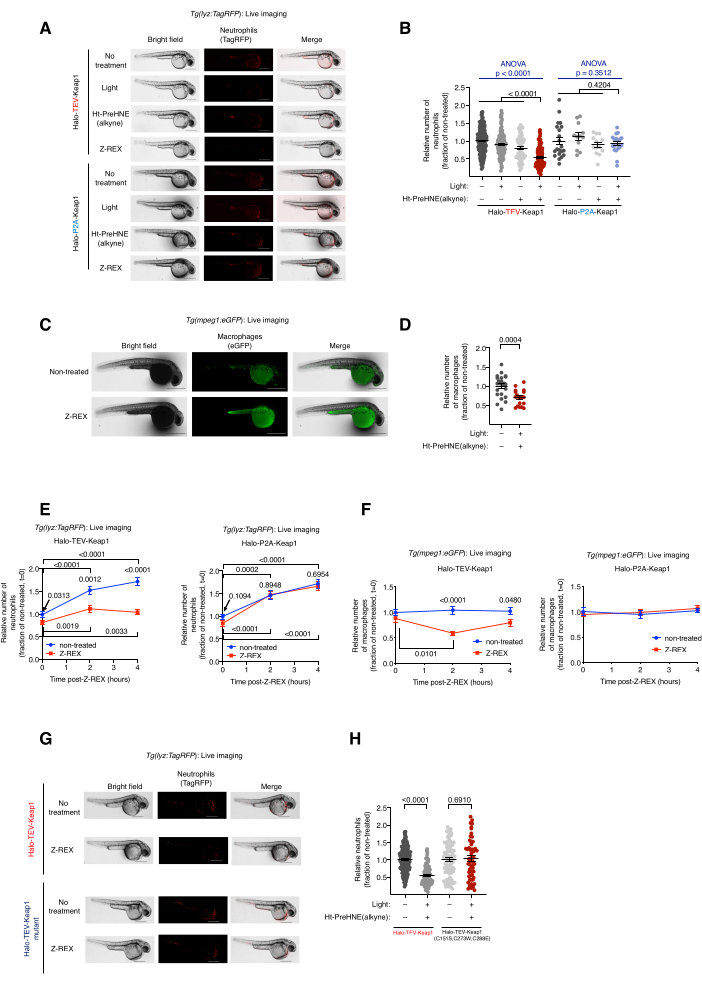
図2:Z-REXを投与したトランスジェニック好中球/マクロファージレポーター魚のライブイメージング。Z-REXを介したKeap1 HNE化は好中球/マクロファージのアポトーシスを誘導します。(A)Halo-TeV-Keap1(融合コンストラクト)またはHalo-P2A-Keap1(スプリットコンストラクト)のいずれかを発現し、ネガティブコントロール条件[無処理、光のみ、またはHt-PreHNE(アルキン)単独またはZ-REX]にかけたTg(lyz:TagRFP)魚の代表的な画像。胚年齢:36馬力。(B)Aにおける好中球レベルの定量。(C) Z-REX処理の有無にかかわらずHalo-TeV-Keap1を発現するTg(mpeg1:eGFP)魚類の代表的な画像。胚年齢:34馬力。(D)Cにおけるマクロファージレベルの定量。(E,F)Z-REX治療後の(E)好中球および(F)マクロファージレベルの経時変化測定。(G)HNE感知能を持たない変異体であるHalo-TeV-Keap1(WT)またはHalo-TeV-Keap1(C151S、C273W、C288E)のいずれかを発現する魚類におけるAと同様の実験。(H)Gにおける好中球レベルの定量。スケールバー:500μm。すべてのグラフは平均±SEMで示されています。 p値は、一元配置分散分析(青)と両側スチューデントのt検定(黒)で計算されました。この図はPoganikら7から修正されています。この図の拡大版を表示するには、ここをクリックしてください。

図3:ビオチンプルダウンアッセイ。 Halo-TeV-Keap1-2XHAまたはHalo-2XHA-P2A-Keap1-2XHAを発現するWT胚をZ-REXまたはそれぞれの陰性対照条件で処理した(この場合はプローブ処理なし)。収穫後、胚を溶解し、ビオチンプルダウンアッセイの前にTeVプロテアーゼで処理しました。結果をウェスタンブロッティングにより解析した。この図はHuangらから修正されています。 Z-REX:組織特異的または遍在的に発現する特定のタンパク質に対する反応性求電子物質を羊飼いし、その結果得られた機能的求電子物質誘発酸化還元応答を仔魚で記録します。この図はHuangらから修正されています。11. この図の拡大版を表示するには、ここをクリックしてください。
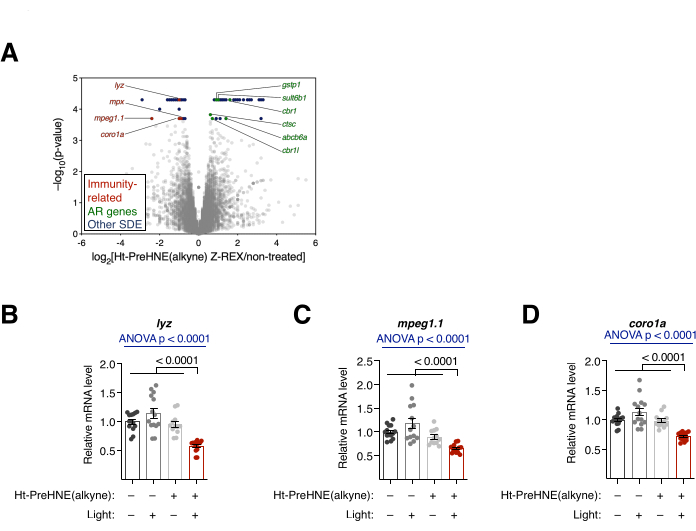
図4:転写解析。 (A)Z-REX処理胚と非処理胚のRNA-seq結果。統計的に有意な差次的発現(SDE)遺伝子が強調表示されています。免疫関連のSDE遺伝子は赤色に着色されています。抗酸化応答(AR)関連遺伝子は緑色に着色されています。他のSDE遺伝子は青色に着色されています。すべてのp値はCuffDiffで計算しました。(B-D)A由来の3つの免疫関連SDE遺伝子:(B)lyz、(C)mpeg1.1、および(D)coro1aをqRT-PCRでさらに解析したところ、Z-REX処理された胚のみがこれらの転写産物の抑制を示しました。すべてのグラフは平均±SEMで示されています。 p値は、一元配置分散分析(青)と両側スチューデントのt検定(黒)で計算されました。この図はPoganikら7から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
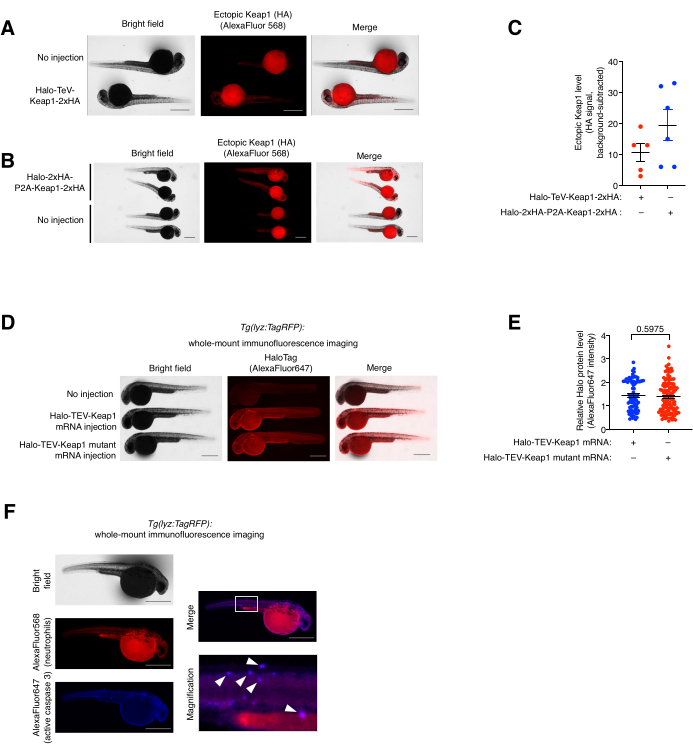
図5:ホールマウント免疫蛍光染色アッセイ 。 (A、B)抗HAおよびAlexaFluor568を結合させた二次抗体で免疫染色した(A)Halo-TeV-Keap1-2xHAまたは(B)Halo-2xHA-P2A-Keap1-2xHAのいずれかを発現する胚の代表的な画像。mRNAを注入した魚を、年齢を一致させた非注射した魚と比較した。(C)(A,B)における抗HA信号の定量化。(D)抗HaloおよびAlexaFluor647と結合した二次抗体で免疫染色されたHalo-TeV-Keap1(WT)またはHalo-TeV-Keap1(C151S、C273W、C288E)を発現する胚の代表的な画像。mRNAを注入した魚を、年齢を一致させた非注射した魚と比較した。(E) Dにおける抗Haloシグナルの定量化。 p 値は両側スチューデントのt検定で計算した。(F)Z-REXに供した Tg(lyz:TagRFP) 胚を抗RFPおよび抗活性カスパーゼ3、ならびにそれぞれの蛍光色素標識二次抗体で共免疫染色した。白いボックスは拡大された領域を示しています。白い矢印は好中球と活性カスパーゼ3の共局在を示す。スケールバー:500μm。すべてのグラフは、SEM±平均で表示されます。この図はPoganikら7から修正されています。と黄ら。11. この図の拡大版を表示するには、ここをクリックしてください。
補足表1:この研究で使用されたバッファーのリスト。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルに記載されているZ-REXは、生きた魚の求電子剤-標的ペアの調査とシグナル伝達経路のデコンボリューションのための堅牢な戦略を示しています。近接指向送達により、求電子化合物処理の投与量と空間制御が可能になります。展開された求電子試薬の超生理学的濃度がしばしばオフターゲットの問題を引き起こす従来のボーラス投与方法とは異なり、システムに放出される比較的少量の求電子剤はZ-REXをほとんど非侵襲的にします。ゼブラフィッシュ胚に0.1-6 μM Ht-PreHNE(アルキン)を使用しましたが、その結果、処理は胚発生に有害ではないことが示されました11。
Z-REX手順は、培養細胞中の求電子性感知タンパク質をスクリーニング/研究するための技術であるT-REXよりも一般的に長くなります。実験の目的が求電子剤と標的の相互作用をスクリーニングすることであるとします。まず、培養細胞でT-REXによる広範なスクリーニングを行い、 in vivo 検証と表現型/パスウェイ解析にZ-REXを使用することをお勧めします。Z-REXを実施するための要件は、細胞培養と比較して、T-REXに必要な生化学的実験技術に加えて、基本的な魚の飼育技術です。Z-REXの典型的な時間枠(魚の交配から光誘導性求電子試薬の送達まで)は2〜3日であり、トランスフェクトされた生細胞でのT-REX実験の典型的な時間より1日以内です。表現型分析のためのライブイメージングは、光照射の2〜10時間後に実行できます。プルダウンアッセイのためのビオチン-アジドとのクリックカップリングには3日かかります。転写応答をアッセイするためのqRT-PCRには3日かかります。IF染色には5日かかります。これらのステップは、同等の細胞培養とほぼ同じですが、データの解釈には魚の生理学とレポーター系統の理解が必要です。
多重変数手順12として、Z−REXが結果の不確実性を除外するためにいくつかの対照群が必要である(図1D)。一般的な対照群は次のとおりです:(1)DMSO /車両治療のみ。(2)プローブ処理、ただし光照明なし。(3)光照明、ただしプローブ処理なし。(4)P2A分割構造、HaloとPOIが別々に表現されているため、近接配信が省略されます。(5)Akt3(C119S)6 やKeap1(C151S、C273W、C288E)5など、求電子感知残基が変異している/変異している低型変異体。
ダウンストリームアッセイにウェスタンブロット分析が含まれる場合、脱黄は収穫前に実施する必要があります。卵黄タンパク質は、ライセート濃度評価の忠実度を低下させ、抗体に非特異的に結合する可能性があります。生きた魚のイメージングやホールマウントIF染色を行った場合、卵黄嚢内の自己蛍光タンパク質に起因すると思われる卵黄嚢内の非特異的蛍光シグナル、または抗体自体の非特異的結合も観察されています。自家蛍光シグナルがシグナルに干渉する場合は、卵黄嚢を定量から除外するか、異なる領域を個別に定量することをお勧めします。デコリネーションは、生きた魚のイメージングとホールマウントIF染色アッセイに必要です。絨毛膜はイメージングを妨げ、後で定量/細胞カウントを妨げる可能性があります。ただし、デコリン化は1 dpfより古い胚にのみ適用されます。胞胚形成/原腸形成/セグメンテーション段階の若い胚は、繊毛除去するには脆弱すぎます。
ここで説明するZ-REXプロトコルは、mRNA駆動の異所性POI発現に基づいています。この手順は、トランスジェニックフィッシュラインを使用/生成する場合と比較して迅速です。mRNA駆動型発現は遍在的かつ一過性であり、このプロトコルで使用されるmRNAでは少なくとも2日間持続します。ただし、発現の持続時間は他の場合には異なる可能性があります。したがって、このアプローチは、特定の求電子試薬標識イベントの影響に関する迅速でよりグローバルな調査ウィンドウを提供し、いくつかのハイスループット/ハイコンテントアッセイと互換性があります。特定の組織で安定したHalo-POI発現を示すトランスジェニック株もZ-REX11と互換性があります。このような系統は、特定の臓器の表現型が細胞培養データから予測される場合や、mRNA注入実験からのスクリーニングで特定の臓器が求電子標識イベントに敏感であると予測される場合など、より正確な質問をする必要がある場合に最適です。Z-REXを介した心臓特異的抗酸化応答誘導は、以前の出版物11でTg(gstp1:GFP;DsRed-P2A-myl7:Halo-TeV-Keap1)魚を用いて実証されました。また、2dpf以上のトランスジェニック魚に対してZ-REXを行うことも可能かもしれません。
開示事項
REX技術によって発見が可能となったアイソフォーム特異的低分子キナーゼ阻害剤が特許出願されています
謝辞
資金調達:ノバルティス・フリーノベーション、NCCR、EPFL
資料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
参考文献
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved