Method Article
Surveillance des réponses de signalisation ciblée chez les larves de poisson-zèbre - Z-REX démasque les mécanismes précis des médicaments électrophiles et des métabolites
Dans cet article
Résumé
Le poisson zèbre ciblant les électrophiles et les oxydants réactifs (Z-REX) est une méthode basée sur la biologie chimique pour l’étude de la signalisation réactive des petites molécules. Cette technique peut être appliquée à des poissons vivants de différents stades de développement. Ici, nous associons des tests standard chez le poisson zèbre avec Z-REX pour l’analyse de la voie de signalisation.
Résumé
Les métabolites réactifs et les médicaments électrophiles apparentés sont parmi les petites molécules les plus difficiles à étudier. Les approches conventionnelles pour déconstruire le mode d’action (MOA) de ces molécules tirent parti du traitement en vrac de spécimens expérimentaux avec un excès d’une espèce réactive spécifique. Dans cette approche, la forte réactivité des électrophiles rend l’étiquetage non discriminant du protéome d’une manière dépendante du temps et du contexte; Les protéines et les processus sensibles à l’oxydoréduction peuvent également être affectés indirectement et souvent de manière irréversible. Dans un tel contexte d’innombrables cibles potentielles et d’effets secondaires indirects, lier le phénotype à l’engagement cible spécifique reste une tâche complexe. Zebrafish targeting reactive electrophiles and oxidants (Z-REX) - une plate-forme d’administration réactive électrophile à la demande adaptée à une utilisation chez les larves de poisson-zèbre - est conçue pour délivrer des électrophiles à une protéine d’intérêt spécifique (POI) dans des embryons de poissons vivants autrement non perturbés. Les principales caractéristiques de cette technique comprennent un faible niveau d’invasivité, ainsi qu’une administration électrophile de précision contrôlée par dosage, chémotype et spatio-temporel. Ainsi, en conjonction avec une suite unique de témoins, cette technique évite les effets hors cible et la toxicité systémique, autrement observés après une exposition en vrac incontrôlée des animaux aux électrophiles réactifs et aux médicaments électrophiles pléiotropes. En tirant parti de Z-REX, les chercheurs peuvent prendre pied dans la compréhension de la façon dont les réponses individuelles au stress et les sorties de signalisation sont modifiées à la suite de l’engagement spécifique du ligand réactif avec un point d’intérêt spécifique, dans des conditions quasi physiologiques chez des animaux vivants intacts.
Introduction
Une myriade d’événements de signalisation cellulaire impliquent des réactions entre de petites molécules réactives (produites de manière endogène dans la cellule ou xénobiotiques/xénométabolites, tels que des médicaments) et leur cible protéique. Dans de nombreux cas, un niveau substœchiométrique de tels événements de liaison covalents peut déclencher des réponses cellulaires, entraînant des changements, par exemple, dans le développement, le métabolisme, l’apoptose et / ou la réponse immunitaire1. Cependant, déconstruire le mode d’action (MOA) en reliant des événements de liaison spécifiques à leurs conséquences phénotypiques s’est avéré difficile. Les méthodes traditionnelles de dosage en bolus qui impliquent l’introduction de concentrations élevées de l’espèce réactive entraînent souvent la modification d’une multitude de protéines, ainsi qu’une toxicité excessive pour l’organisme modèle2. De telles conditions sont loin d’être idéales. Une méthode a été développée pour résoudre ces problèmes en culture cellulaire en utilisant la livraison électrophile localisée de précision dans un contexte cellulaire natif, appelée T-REX (targetable reactive electrophiles and oxidants)3. Dans les années qui ont suivi, l’accent a été mis sur des expériences sur des organismes entiers, ce qui permet d’étudier des protéines dans des contextes cellulaires spécifiques dans des cellules non transformées. Ainsi, nous avons étendu la technique pour être compatible avec plusieurs modèles, y compris les modèles d’embryons Danio rerio . Nous présentons ici le Z-REX (poisson zèbre ciblant les électrophiles et oxydants réactifs) (Figure 1).
Pour comprendre Z-REX, cet article présente d’abord les technologies REX et leurs concepts sous-jacents. À la base, ces techniques modélisent la signalisation endogène des espèces électrophiles réactives physiologiques (SER) en imitant la façon dont les électrophiles naturels sont produits localement in vivo avec une précision spatio-temporelle. La protéine d’intérêt (POI) est exprimée comme une construction de fusion vers Halo; cette dernière ancre la sonde perméable et inerte portant le RES photocagé dans une stœchiométrie 1:1. L’un de ces RES endogènes est le 4-hydroxynonénal (HNE ci-après), qui est photocagé dans la sonde Ht-PreHNE. Dans de nombreux cas, nous utilisons une version fonctionnalisée en alcyne de HNE [c’est-à-dire HNE (alcyne)], qui a essentiellement des propriétés biologiques identiques à HNE, mais peut être étiquetée par chimie de clic. La sonde, qui est également fonctionnalisée avec un chloroalcane pour la réactivité avec Halo, est appelée Ht-PreHNE (alcyne). Le complexe de la fusion Halo-POI et de la sonde ainsi formée permet l’administration proximale de RES au POI fusionné lors de l’irradiation à la lumière UV. Si le POI réagit rapidement avec le RES libéré, l’étiquetage covalent résultant du POI avec RES nous permet d’identifier les cystéines cinétiquement privilégiées.
Z-REX prend les avantages susmentionnés des technologies REX et les applique largement pour étudier des voies de signalisation spécifiques chez les poissons vivants. Ce protocole a été optimisé pour le poisson-zèbre (D. rerio), car ce sont des organismes vertébrés génétiquement traitables qui sont transparents pendant le développement, et donc idéaux pour les techniques opto-chimiques / génétiques comme les technologies REX. Néanmoins, une stratégie similaire est également susceptible de bien fonctionner sur d’autres espèces de poissons génétiquement traitables, car la large applicabilité de la méthode est due au mécanisme pseudo-intramoléculaire de l’administration électrophile dérivée des lipides (LDE). En effet, la procédure est hautement biocompatible, puisque les poissons peuvent être traités avec le Z-REX photocaged-électrophile [par exemple, Ht-PreHNE (alcyne)] pendant au moins 48 heures sans impact notable sur le développement. Un protocole similaire fonctionne dans C. elegans 4,5.
Le protocole décrit d’abord l’utilisation de l’injection d’ARNm pour produire une expression transitoire d’une construction de fusion Halo-POI non native dans des modèles embryonnaires de poissons-zèbres, 1 à 1,5 jours après la fécondation (dpf). Il en résulte l’expression de la protéine ectopique dans la majorité des cellules du poisson (ci-après appelée « ubiquitaire »), plutôt que dans des tissus ou des lieux spécifiques; Cependant, les données montrent que des effets spécifiques aux cellules peuvent être observés dans certains cas. Après injection, les embryons sont incubés avec une faible concentration [0,3-5 μM Ht-PreHNE (alcyne)] de la sonde jusqu’à 30,5 h après la fécondation (hpf). Ensuite, à un moment prescrit par l’utilisateur, la livraison du RES au POI dans le poisson est réalisée par photodéfocalisation pendant 2-5 min. Après la photodéfocalisation du RES, divers essais phénotypiques en aval peuvent être effectués au cours des 2 à 10 prochaines heures : 1) imagerie en direct des lignées rapporteures (figure 2A); 2) évaluation de l’étiquetage des cibles par transfert Western (figure 3); 3) analyse transcriptomique (figure 4); ou 4) immunofluorescence sur support entier (figure 5).
À titre d’exemple d’imagerie en direct de lignées rapporteures, Z-REX est démontré en tandem avec l’imagerie en direct de lignées de poissons, Tg (lyz: TagRFP) et Tg (mpeg1: eGFP), pour mesurer comment la modification RES d’un POI de capteur électrophile spécifique (à savoir Keap1) diminue les niveaux de neutrophiles et de macrophages, respectivement, sans effets observables sur d’autres cellules du poisson. Cependant, nous avons montré précédemment que le marquage POI et la signalisation de la voie consécutive des études T-REX peuvent être reproduits à l’aide de Z-REX pour plusieurs protéines: Akt3 6, Keap17 et Ube2v26. Dans l’ensemble, avec Z-REX, les scientifiques peuvent étudier la ou les conséquences de la modification covalente des points d’intérêt par les RES dans le contexte de plusieurs voies redox complexes. Cette technique est conçue pour identifier les cibles et leurs résidus fonctionnels pour la conception de médicaments covalents et les nouveaux mécanismes médicamenteux dans un modèle animal entier plus pertinent sur le plan contextuel.
Protocole
Les procédures d’élevage et de manipulation du poisson zèbre à l’Université Cornell (États-Unis) ont été effectuées conformément aux directives des National Institutes of Health (NIH) et approuvées par l’Institutional Animal Care and Use Committee (IACUC). Les procédures d’élevage et de manipulation du poisson zèbre de l’Unité de la polytechnique fédérale de Lausanne (EPFL, Suisse) ont été effectuées conformément à la loi sur la protection des animaux RS 455 et à l’ordonnance sur la protection des animaux RS 455.1, avec autorisation vétérinaire cantonale VD-H23.
NOTE: Dans ce protocole, les lignées de poissons Tg( lyz:TagRFP ) et Tg(mpeg1:EGFP) exprimant Halo-TeV-Keap1 sont utilisées pour démontrer Z-REX. La méthode peut être étendue à d’autres protéines d’intérêt, à des lignées de poissons rapporteurs transgéniques et à des essais biologiques en aval. Voir le tableau supplémentaire 1 pour connaître les tampons utilisés dans la présente étude. Tous les réactifs, instruments, équipements, anticorps, plasmides, souches de poisson zèbre et équipements sont énumérés dans le tableau des matériaux.
1. Préparation de l’ARNm
- Préparez l’ARNm Halo-TeV-Keap1-2xHA et Halo-2xHA-P2A-Keap1-2xHA à l’aide du kit de transcription in vitro mMessage mMachine SP6.
REMARQUE : Suivez les instructions du fabricant et effectuez des réactions à l’échelle de 40 μL pour chaque ARNm. Redissoudre la pastille d’ARNm dans 10 μL d’eau exempte de nucléase. - Évaluer la qualité de l’ARNm et mesurer la concentration par spectrophotomètre de microvolume et électrophorèse sur gel d’agarose. Un ARNm de bonne qualité devrait avoir un rapport A260/A280 d’environ ou plus de 2,0.
- Diluer l’ARNm à 1-1,5 mg/mL avec de l’eau sans nucléase.
- Aliquote la solution d’ARNm (1-2 μL par tube) et stocker les aliquotes à -80 °C.
2. Production d’embryons de poissons
- Option 1 : Production d’embryons de poissons de type sauvage (WT).
- Mettre en place 10 paires de poissons croisés dans 10 bassins distincts, chaque réservoir contenant un séparateur entre les poissons parents mâles et femelles.
NOTE: Un total de 10 paires croisées fournit généralement un nombre suffisant d’embryons pour les essais. Le nombre de couples croisés peut être ajusté en fonction de la conception ou du besoin de l’expérience et de la fécondité du poisson parent. - Le lendemain matin, après avoir installé l’injecteur, retirez les séparateurs dans cinq des réservoirs. Attendez 30 minutes pour que le poisson s’accouple.
- Déplacez le poisson parent dans un autre réservoir, collectez les embryons en faisant passer l’eau du réservoir dans une passoire, puis rincez les embryons de la passoire dans une boîte de Petri de 10 cm. Ces embryons seront utilisés pour la première série d’injections.
REMARQUE : Si la qualité des œufs d’un certain lot est médiocre (p. ex., les œufs sont opaques en raison de l’agrégation des protéines), ne les mettez pas en commun avec les autres embryons. - (Facultatif) Effectuer des procédures similaires à celles décrites aux étapes 2.1.2 à 2.1.3 sur les cinq autres réservoirs pour le prochain cycle d’injection.
REMARQUE: Il est préférable de n’effectuer qu’une seule série d’injection, afin de minimiser la différence d’âge entre les embryons. Cependant, si plus d’embryons que ce qui peut être injecté dans un lot est nécessaire, il est recommandé d’effectuer deux cycles d’injection pour s’assurer que les embryons restent à un stade de 1 à 4 cellules pendant l’injection d’ARNm. Le nombre de cycles d’injection peut être ajusté en fonction de la compétence d’injection de l’opérateur et de la conception de l’expérience. Cependant, il est suggéré d’effectuer toute la procédure (du retrait du premier diviseur à l’injection du dernier embryon) dans les 2 heures. Une grande différence d’âge entre les embryons peut nuire à la fiabilité et à la reproductibilité des résultats de l’expérience.
- Mettre en place 10 paires de poissons croisés dans 10 bassins distincts, chaque réservoir contenant un séparateur entre les poissons parents mâles et femelles.
- Option 2 : Produire des embryons de poissons rapporteurs hétérozygotes transgéniques neutrophiles/macrophages.
- Mettez en place 10 paires de poissons croisés dans 10 bassins distincts, chaque réservoir étant inséré avec un séparateur entre les poissons parents mâles et femelles : WT fish versus Tg( lyz:TagRFP), ou WT fish versus Tg(mpeg1:eGFP).
REMARQUE : Évitez les croisements entre poissons transgéniques hétérozygotes, qui peuvent affecter les lectures fluorescentes en aval, car les poissons rapporteurs homozygotes présentent un signal fluorescent plus élevé que les poissons hétérozygotes. Les lignées rapporteures transgéniques et les embryons WT peuvent être facilement distingués lors de l’imagerie. Avoir un mélange d’embryons WT et hétérozygotes dans le même pool n’est pas un problème. lyz:TagRFP signale les neutrophiles, et mpeg:eGFP rapporte les macrophages. Ce protocole peut également être appliqué à d’autres lignées de poissons rapporteurs. - Suivez les étapes 2.1.2-2.1.4.
- Mettez en place 10 paires de poissons croisés dans 10 bassins distincts, chaque réservoir étant inséré avec un séparateur entre les poissons parents mâles et femelles : WT fish versus Tg( lyz:TagRFP), ou WT fish versus Tg(mpeg1:eGFP).
3. Configuration du micro-injecteur
- Allumez la source d’air, réglez la contre-pression sur 0,2-0,5 psi et réglez la pression d’injection sur 25-30 psi. La plage spécifique de pression indiquée est généralement recommandée.
REMARQUE: Il est essentiel d’avoir une contre-pression stable pour empêcher le reflux du milieu de poisson dans l’aiguille. Lors de l’étalonnage du volume d’injection à l’étape 3.8, seul le temps d’injection doit être modifié. Ne modifiez pas la pression d’injection dans les étapes suivantes; Une faible pression d’injection peut entraîner un échec de l’injection en raison de la tension superficielle et interfaciale, tandis qu’une pression d’injection élevée peut endommager les embryons. - Nettoyez l’équipement et la plateforme d’injection avec la solution de décontamination RNase.
REMARQUE: La RNase, qui dégrade l’ARNm, peut provenir de l’opérateur ou de l’équipement. Il est nécessaire d’effectuer le nettoyage avant l’expérience et de porter des gants. - (Facultatif) Si vous co-injectez de l’ARNm et du morpholino, prémélangez les deux dans un tube de 0,2 mL.
REMARQUE: Z-REX fonctionne bien en utilisant une solution d’ARNm Halo-TeV-Keap1-2xHA avec une concentration de 250-1500 ng / μL. Plusieurs morpholinos ont également été utilisés chez le poisson zèbre, et les concentrations optimales ont été rapportées7. En cas d’utilisation d’un morpholino dont la séquence n’a pas été publiée, l’opérateur doit d’abord évaluer la toxicité et l’efficacité du gène knockdown du morpholino avant de l’utiliser dans Z-REX. - Transférer 1 à 2 μL d’ARNm (et/ou de morpholino, le cas échéant7) dans une aiguille d’injection à l’aide d’une pointe de pipette à microchargeur.
REMARQUE: Si vous préparez des aiguilles avec un extracteur de micropipettes Flaming/Brown, la configuration est la suivante. Chaleur: 520 unités; force de traction: 60 unités; vélocité: 70 unités; retard : 155 unités; pression: 550 unités; Rampe : 530 unités. - Installez l’aiguille sur le manipulateur de micro-injection.
REMARQUE: La contre-pression de la source d’air doit pousser la solution d’ARNm (/ morpholino) à la pointe de l’aiguille. - Utilisez une pince tranchante ou une lame de rasoir pour casser la pointe de l’aiguille, créant ainsi une ouverture appropriée pour l’injection.
- Immergez la pointe de l’aiguille dans de l’huile minérale sur un micromètre de scène.
- Appliquez deux ou trois impulsions d’injection pour éliminer les bulles d’air dans la pointe.
- Calibrer la taille de la goutte à 2 nL en modifiant le temps d’injection.
REMARQUE: Ceci est mieux effectué en injectant dans de l’huile minérale (qui imite la viscosité du sac vitellin) posée sur un hémocytomètre. À l’aide d’un microscope, utilisez le quadrillage de l’hémocytomètre pour estimer la taille de la gouttelette formée pendant l’injection et ajustez le temps d’injection en conséquence. Bien que le colorant rouge de phénol soit parfois utilisé, sa nécessité dans la procédure d’injection d’ARNm décrite ici n’a pas été observée.
4. Micro-injection
- Remplir une plaque d’injection avec un milieu frais de solution saline équilibrée (HBSS) à 10 % et aligner les embryons dans les rainures de la plaque avec une pince émoussée.
NOTE: La plaque d’injection est préparée avec de l’agarose à 2% dans un milieu HBSS à 10%; Les rainures sont formées à l’aide d’un moule en plastique. - Immerger l’extrémité de l’aiguille dans un milieu HBSS à 10% dans la plaque d’injection.
- Appliquez deux ou trois impulsions d’injection pour éliminer les bulles d’air dans la pointe.
- Pour chaque injection, pénétrez le chorion et le sac vitellin en un seul mouvement et appliquez une impulsion d’injection. Ce liquide injecté peut être vu juste après l’injection comme un petit sphéroïde dans le sac vitellin. Ce petit sphéroïde se dissipe relativement rapidement. Répétez cette étape pour les autres embryons, jusqu’à ce qu’un nombre suffisant d’embryons injectés ait été obtenu.
REMARQUE: Le taux de survie des embryons (injectés et non injectés) varie généralement de 50% à 90%. Viser à injecter le double du nombre d’embryons nécessaires pour chaque groupe témoin/expérimental. Dans le test d’extraction de biotine, 100 à 140 embryons viables sont nécessaires pour chaque condition. Dans le test qRT-PCR, cinq embryons viables sont recommandés pour chaque condition. La taille de l’échantillon pour l’imagerie des poissons vivants et le test de coloration par immunofluorescence à montage entier est définie par l’utilisateur; Il est recommandé d’avoir au moins 20 embryons viables par condition pour donner une bonne puissance statistique dans l’analyse. - Rincer les embryons injectés dans une nouvelle boîte de Petri de 10 cm contenant des milieux frais HBSS à 10%.
REMARQUE: Les embryons peuvent être facilement rincés des rainures à l’aide d’un flacon à gicler. - Mettez en commun les embryons non injectés dans une autre plaque.
REMARQUE : Les embryons non injectés peuvent servir de contrôles de qualité pour la santé du poisson, l’expression des protéines de base, les niveaux de fluorescence de fond, etc., au besoin. Si la procédure d’injection a bien fonctionné et que l’ARNm/morpholino injecté n’est pas mortel pour les embryons, les embryons injectés et non injectés devraient avoir une viabilité similaire.
5. Z-REX
- Répartir les embryons injectés dans des boîtes de 10 cm, selon la configuration de l’expérience (c.-à-d. le nombre de groupes témoins/expérimentaux).
- Dans une pièce sombre avec éclairage rouge, remplacez le média par 30 ml d’HBSS à 10 % avec ou sans 1 μM de Ht-PreHNE (alcyne).
REMARQUE: Ht-PreHNE (alcyne) est un composé labile à la lumière. Les embryons doivent être conservés dans l’obscurité dans les étapes suivantes. - Incuber les embryons à 28,5 °C dans l’obscurité.
- À 30,5 hpf, dans une pièce sombre, remplacez le média par un nouveau 30 ml de HBSS à 10%.
REMARQUE: Lorsque vous remplacez le support, retirez autant que possible l’ancien support. Ceci est essentiel pour éliminer la quantité non liée / excessive de Ht-PreHNE (alcyne) des embryons. - Incuber les embryons à 28,5 °C dans l’obscurité pendant 30 min.
- Répétez les étapes 5.4-5.5 deux fois de plus.
- Allumez la lampe UV (365 nm, 3 mW/cm2) pendant 5 min pour préchauffer la lampe.
NOTA: L’étape de préchauffage de la lampe doit être effectuée avant l’étape 5.8. La puissance de la lampe est plus faible/instable dans les premières minutes après avoir été allumée. La puissance de la lampe doit être mesurée régulièrement par un compteur UV. - À 32 hpf, exposer les embryons à la lumière UV.
- Option 1 : Pour les lectures en aval, telles que l’imagerie de poissons vivants, la coloration par immunofluorescence à montage entier, l’analyse de fluorescence dans le gel (couplage de clic avec azoture de Cy5), le séquençage de l’ARN ou la qRT-PCR, exposez les embryons à la lumière UV pendant 3 minutes, en faisant tourbillonner les plaques toutes les 30 s.
- Option 2 : Pour les lectures en aval, comme le test d’extraction de biotine, exposer les embryons à la lumière UV pendant un maximum de 5 minutes (et au moins 3 minutes), en faisant tourbillonner les plaques toutes les 30 s et refroidir les plaques sur de la glace pendant 1 min.
REMARQUE: Si vous utilisez différentes sondes, le temps d’exposition à la lumière doit être optimisé, en fonction de la t1/2 de photodécancage pour une sonde électrophile photocage donnée et une source lumineuse déployée. Laphotodécancage t 1/2 peut être déterminée à l’aide des procédures connues8. Pour Ht-PreHNE(alcyne), t 1/2 est < 1 min3 ; Ainsi, le temps indiqué ci-dessus est suffisant.
6. Essais en aval
- Option 1 : Dosage phénotypique. Imagerie en direct d’un rapporteur de neutrophiles/macrophages transgéniques
lignées de poissons, Tg(lyz:TagRFP) et Tg(mpeg1:eGFP) (Figure 2)- Anesthésier les embryons par incubation à 4 °C pendant 10 min.
NOTE: Il est recommandé d’avoir au moins 20 embryons viables par condition. - Retirez les embryons non fécondés/morts de l’assiette.
REMARQUE: Les embryons non fécondés / morts sont nuageux / non transparents et peuvent être identifiés visuellement. Si un taux de mortalité élevé est observé, revenez à la procédure d’injection ou essayez de réduire la concentration d’ARNm ou de morpholino. - Déchorioner les embryons avec une pince tranchante. Tenez le chorion avec une paire de pinces, sans toucher le poisson larvaire, et utilisez l’autre paire de pinces pour arracher le chorion. L’embryon est fragile. Ne touchez le chorion que lors de la dechorionation.
NOTE: Il est fréquent, surtout chez les débutants, d’endommager certains embryons pendant la dérorionation. Par conséquent, ayez toujours plus d’embryons que le minimum nécessaire. - Montez les embryons sur une plaque d’agarose à 2% (préparée avec 10% de milieu HBSS) et imagez les embryons avec un stéréomicroscope (champ lumineux et canaux fluorescents respectifs) (Figure 2A, C, G).
NOTE: Après Z-REX [combinaison de Halo-TeV-Keap1-2xHA injection d’ARNm et Ht-PreHNE (alcyne)], la déplétion des neutrophiles (lyz:TagRFP) s’est avérée plus significative à 36 hpf (4 h après Z-REX), tandis que la réduction des macrophages (mpeg1:eGFP) était plus significative à 34 hpf (2 h après Z-REX) (Figure 2E,F). D’autres points temporels peuvent être utilisés si vous utilisez différentes lignes rapporteures, ARNm/morpholino ou sondes. Le temps d’exposition et/ou le gain doivent être optimisés pour visualiser des cellules individuelles ou les (ultra)structures spécifiques souhaitées. - Compter le nombre de neutrophiles/macrophages de chaque poisson par ImageJ (NIH) (Figure 2B, D-F, H). Utilisez l’outil Sélection à main levée dans ImageJ pour encercler le poisson entier et utilisez l’option Trouver des maxima pour compter les cellules fluorescentes.
- Anesthésier les embryons par incubation à 4 °C pendant 10 min.
- Option 2 : Évaluation de l’étiquetage des cibles. Couplage azoté-clic à l’azoture de biotine et dosage de l’abaissement de la biotine (Graphique 3)
- Anesthésier les embryons par incubation à 4 °C. Cela prend généralement 10 min.
REMARQUE: Pour obtenir suffisamment de lysat de poisson, 100 à 140 embryons viables sont nécessaires pour chaque condition. - Retirez les embryons non fécondés/morts de l’assiette.
- Effectuer la déchorionation et le déyolking. Effectuez les deux manipulations en tenant le chorion avec une paire de pinces tranchantes, en utilisant l’autre paire de forceps pour pénétrer dans le sac vitellin, puis en séparant le sac vitellin tout en retirant le chorion pour permettre aux protéines vitelliniques de sortir.
REMARQUE: Il est essentiel d’éliminer les protéines vitellines dans cette étape. Les protéines vitellines abondantes dans l’échantillon interfèrent avec une analyse ultérieure. - Transférer les embryons ébilolés dans un tube de 1,5 mL.
REMARQUE: Remuez la plaque pour centrer les embryons éblôlés, ce qui facilite la collecte. Les débris de chorion plus légers disparaissent au cours de ce processus. - Une fois que les embryons se sont installés au fond du tube, retirez le surnageant et ajoutez 1 mL de solution saline refroidie tamponnée HEPES (pH 7,6).
- Répétez l’étape 6.2.5 deux fois de plus.
- (Facultatif) Si vous n’avez pas l’intention de passer immédiatement à l’étape suivante, retirez le tampon, congelez les échantillons dans de l’azote liquide et conservez-les à -80 °C.
NOTE: Les granulés de poisson éblouis peuvent être surgelés dans de l’azote liquide et stockés à -80 ° C. Les échantillons surgelés peuvent être conservés à -80 °C jusqu’à 2 semaines. - Remettez en suspension les granulés de poisson dans un tampon de lyse.
REMARQUE : Le tampon de lyse (pH 7,6) est composé de 50 mM HEPES, 100 mM de NaCl, 1 % de Triton X-100, 0,3 mM de PTCE, 2 inhibiteurs de la protéase sans EDTA Roche cOmplete Mini et 0,1 mg/mL d’inhibiteur de trypsine de soja. Un embryon donne environ 2 μg de lysat. Utilisez 100 μL de tampon de lyse pour 120 embryons. Deux inhibiteurs de la protéase sans EDTA Roche cOmplete Mini et inhibiteurs de trypsine de soja doivent être ajoutés au tampon de lyse juste avant utilisation. - Ajouter 20% de billes de zircone v/v dans le tube.
- Vortex pendant 20 s, congélation instantanée dans de l’azote liquide et décongélation au bain-marie à 37 °C.
- Répétez l’étape 6.2.10 deux fois de plus.
- Centrifuger la solution à 21 000 x g à 4 °C pendant 10 min.
- Transférer le surnageant dans un nouveau tube prérefroidi de 1,5 mL.
- Mesurer la concentration en protéines par le test de Bradford.
- Diluer le lysat à 1 mg/mL.
- Pour chaque condition, transférer 170 μg de lysat dans un tube de 2 mL.
- Mélanger le lysat de l’étape 6.2.16 avec 0,2 mg/mL de protéase TeV (S219V) et incuber la solution à 37 °C pendant 30 min.
REMARQUE: Pour les groupes non traités par protéase TeV, il suffit de mélanger le lysat avec un volume égal de tampon de lyse à la solution de protéase TeV utilisée dans d’autres groupes. - Préparer un mélange maître 10x pour la réaction de clic biotine-azoture : 10 % p/v SDS, 10 mM CuSO4, 1 mM Cu(TBTA), 1 mM biotin-azide, et 20 mM TCEP.
REMARQUE : Ajouter le PTCE au mélange juste avant l’étape 6.2.19. - Ajouter 8,5 μL de t-BuOH et 17 μL de mélange maître de réaction 10x clic au lysat (TeV digéré par la protéase) de l’étape 6.2.17. Vortex, centrifuger et incuber la solution à 37 °C pendant 15 min.
- Ajouter un autre PTCE de 1 mM à la solution, puis vortex, centrifuger et incuber la solution à 37 °C pendant encore 15 minutes. Le temps d’incubation pour les étapes 6.2.19-6.2.20 est de 30 min au total.
REMARQUE: Ce supplément de TCEP, un réactif réducteur pour générer du Cu (I), améliore l’efficacité de la réaction au clic. - Ajouter 600 μL d’éthanol à -20 °C dans chaque tube, vortex la solution et l’incuber à -80 °C pendant la nuit.
NOTE: Les échantillons peuvent être conservés à -80 ° C pendant 1 semaine; Si ce n’est pas le cas, passez immédiatement à l’étape suivante. - Centrifuger la solution à 21 000 x g à 4 °C pendant 1 h.
REMARQUE: Une pastille doit se former dans le fond du tube après centrifugation, qui est la fraction désirée. - Retirer le surnageant, ajouter 1 mL d’éthanol à -20 °C, vortex et centrifuger la solution à 21 000 x g à 4 °C pendant 10 min.
- Répétez l’étape 6.2.23.
- Retirer le surnageant, ajouter 1 mL d’acétone -20 °C, vortex, et centrifuger la solution à 21 000 x g à 4 °C pendant 10 min.
- Retirez le surnageant. Laisser l’excès d’acétone résiduelle s’évaporer, mais pas complètement sec.
- Resuspendre la pastille dans 100 μL de tampon de remise en suspension (8 % p/v de sulfate de dodécyle de lithium [LDS], 1 mM d’EDTA dans une solution saline HEPES 50 mM, pH 7,6), vortex pendant 15 s et soniquer jusqu’à dissolution de la pastille.
- Centrifuger la solution à 21 000 x g à température ambiante (RT) pendant 5 min.
- Transférer le surnageant dans un nouveau tube de 2 mL et ajouter 1,5 mL de solution saline HEPES 50 mM, pH 7,6.
NOTE: La concentration finale de LDS dans cette étape est de 0,5%. Des concentrations plus élevées de LDS peuvent nuire à l’efficacité de la descente. Ainsi, bien que l’augmentation de la concentration LDS puisse aider à réduire la liaison non spécifique, elle peut également réduire l’efficacité du pulldown. Par conséquent, il est recommandé de ne pas modifier la concentration de LDS à cette étape. - Prélever l’échantillon « d’entrée » (figure 3) : transférer 30 μL de lysat à 1 mg/mL dans un nouveau tube de 1,5 mL et ajouter 10 μL de 4x tampon d’échantillon Laemmli contenant 6 % de β-mercaptoéthanol (BME). Congelez la solution et conservez-la à -80 °C.
- Transférer 100 μL de résine de streptavidine haute capacité à volume de lit dans un nouveau tube de 2 mL. Ajouter 1 mL de LDS à 0,5 % dans une solution saline HEPES de 50 mM (pH 7,6), centrifuger à 1 500 x g à TA pendant 2 min et retirer le surnageant. Répétez le lavage avec 1 mL de LDS à 0,5 % dans une solution saline HEPES de 50 mM (pH 7,6).
- Transférer la solution de l’étape 6.2.29 dans le tube contenant la résine de streptavidine haute capacité prélavée de l’étape 6.2.31 et incuber la solution sur un mélangeur bout à bout à TA pendant 4 à 6 h.
- Centrifuger le mélange à 1 500 x g à TA pendant 2 min, prélever 30 μL du surnageant et le mélanger avec 10 μL de tampon d’échantillon de Laemmli 4x contenant 6 % de BME pour l’échantillon « à flux continu ». Ensuite, retirez le surnageant restant.
REMARQUE : Les échantillons « à flux continu » peuvent être analysés par transfert Western pour vérifier l’efficacité de l’abaissement de la streptavidine. Il est essentiel d’éliminer autant de surnageant que possible pour éliminer les protéines non liées. Tout d’abord, retirez la majeure partie du surnageant à l’aide d’une pipette P-1000, puis retirez le surnageant restant à l’aide d’une pipette P-20 munie d’un embout de chargement en gel. - Ajouter 1 mL de LDS à 0,5 % dans une solution saline HEPES 50 mM (pH 7,6) à la résine et incuber le mélange pendant 30 minutes à TA avec rotation de bout en bout.
- Centrifuger le mélange à 1 500 x g à TA pendant 2 min, et retirer le surnageant.
REMARQUE: En règle générale, 0,5% LDS est suffisant pour éliminer la plupart des protéines de liaison non spécifiques. Si des signaux de liaison non spécifiques sont encore observés dans l’analyse ultérieure, la concentration de LDS dans le tampon de lavage peut être augmentée. - Répétez l’étape 6.2.34-6.2.35 deux fois de plus.
- Ajouter 40 μL de 2x tampon d’échantillon Laemmli contenant 6% de BME à la résine.
- Éluer les protéines liées en incubant le mélange à 98 °C pendant 5 min.
- Centrifuger le mélange à 21 000 x g à TA pendant 5 minutes et transférer le surnageant dans un nouveau tube de 1,5 mL. C’est l’échantillon « élu ».
NOTE: Le chargement direct de la solution contenant de la résine de l’étape 6.2.38 dans le gel peut affecter l’analyse SDS-PAGE. - Charger 20 μL dans chaque puits de gel de polyacrylamide à 10 % à 10 voies et exécuter l’électrophorèse sur gel.
REMARQUE: Exécutez le gel à une tension inférieure (120 V) jusqu’à ce que le front de colorant atteigne le gel de résolution et modifiez la tension à 170 V. Arrêtez le programme après la sortie du front de colorant. - Effectuez le Western blot avec des anticorps anti-HA, anti-Halo ou autres détectant les protéines ménagères (Figure 3).
- Anesthésier les embryons par incubation à 4 °C. Cela prend généralement 10 min.
- Option 3 : Analyse transcriptomique. RNA-seq et qRT-PCR (Figure 4)
NOTE: Il est fortement recommandé d’utiliser des embryons pondus à moins de 15 minutes les uns des autres pour ce test. La différence d’âge des embryons affecte de manière significative les résultats du test.- Anesthésier les embryons en les incubant à 4 °C pendant 10 min, 2 h après Z-REX.
- Effectuer la déchorionation à l’aide d’une pince tranchante (étape 6.1.3).
- (Facultatif) Effectuer une segmentation à l’aide d’une pince (p. ex., séparer la tête de la queue) si différents segments doivent être analysés séparément.
- Si vous extrayez de l’ARN d’un embryon entier, transférez trois à cinq embryons dans un tube de 1,5 mL. Si vous extrayez l’ARN de la tête ou de la queue, transférer 10 à 12 segments disséqués dans un tube de 1,5 mL.
NOTE: Il est recommandé d’effectuer l’expérience avec trois à cinq répétitions biologiques. - Ajouter 1 mL de réactif TRIzol et de billes de verre dans le tube.
REMARQUE: Il a été constaté que les billes de verre fonctionnent mieux que les perles de zircone pour l’extraction de l’ARN. - Vortex le mélange pendant 30 s.
REMARQUE: Si vous ne passez pas immédiatement à l’étape suivante, la solution peut être conservée à -80 ° C pendant 1 à 3 semaines. - Extraire l’ARN selon les instructions du fabricant.
- Évaluer la qualité et la concentration de l’ARN par spectrophotomètre de microvolume et électrophorèse sur gel d’agarose.
REMARQUE: L’ARN de bonne qualité doit avoir un rapport A260/A280 d’environ ou plus de 2,0. - Soit soumettre l’ARN pour séquençage, soit traiter 1 μg d’ARN avec de la DNase I de qualité amplification, et transcrire en inverse en exposant III transcriptase inverse et oligo-(dT)20. Effectuez cette étape conformément aux instructions du fabricant.
- Effectuer la qRT-PCR et analyser les données par la méthode ΔΔCT9 (Figure 4B-D).
- Option 4 : Analyse de l’expression et de la colocalisation des POI. Essai de coloration par immunofluorescence à montage entier (Figure 5)
NOTE: Les embryons fixés au formaldéhyde sont fragiles. Évitez les secousses vigoureuses et manipulez avec précaution.- Déchorioner les embryons en suivant les étapes 6.1.1-6.1.3.
- Transférer les embryons dans un tube de 1,5 mL.
NOTE: Chaque tube doit avoir un nombre égal d’embryons, et pas plus de 40 embryons. - Une fois que les embryons se sont déposés au fond du tube, retirez le surnageant et ajoutez 1 mL de solution saline tamponnée au phosphate (PBS) (pH 7,6).
- Répétez l’étape 6.4.3 une fois de plus.
- Retirer le surnageant, ajouter 1 mL de formaldéhyde à 4 % dans du PBS (pH 7,6) et incuber le tube à 4 °C pendant une nuit en berçant doucement.
NOTE: Les échantillons dans une solution de formaldéhyde peuvent être conservés à 4 ° C pendant 1 semaine. - Retirer le surnageant, ajouter 1 mL de méthanol à -20 °C et incuber le tube sur le côté à -20 °C pendant au moins 18 h.
REMARQUE: Les échantillons peuvent être conservés à -20 ° C pendant 1 mois ou plus. - Retirer le surnageant et ajouter 1 mL de tampon PDT (0,3 % v/v Triton X-100, 0,1 % v/v Tween-20 et 1 % v/v diméthylsulfoxyde [DMSO] dans le tampon PBS).
- Répétez l’étape 6.4.7 et incuber le tube à TA pendant 30 min en berçant doucement.
- Retirer le surnageant, ajouter 1 mL de tampon bloquant (sérum fœtal bovin inactivé par la chaleur à 10 % v/v, albumine sérique bovine [BSA] à 2 % p/v et Tween-20 à 0,1 % v/v dans un tampon PBS) et incuber le tube à TA pendant 1 h en balançant doucement.
- Retirer le surnageant et ajouter 200 μL de solution d’anticorps primaires (diluée dans un tampon de blocage).
- Retirer le surnageant, ajouter 500 μL de solution d’anticorps primaires (diluée dans un tampon de blocage) et incuber le tube à 4 °C pendant une nuit en berçant doucement.
REMARQUE: Si vous utilisez un nouvel anticorps primaire, il vaut la peine d’inclure certains échantillons sans coloration d’anticorps primaire pour servir de témoins négatifs. Cependant, idéalement, les embryons morpholino-knockdown ou modifiés, ou les embryons dans lesquels l’expression de la protéine cible a été stimulée, sont des moyens plus fiables de valider l’anticorps. - Retirer le surnageant, ajouter 1 mL de tampon PDT et incuber le tube à TA pendant 30 min en balançant doucement.
- Répétez l’étape 6.4.12.
- Retirer le surnageant, ajouter 1 mL de tampon bloquant et incuber le tube à TA pendant 1 h en berçant doucement.
REMARQUE: Les échantillons doivent être protégés de la lumière après cette étape, afin d’éviter le photoblanchiment du fluorophore conjugué sur l’anticorps secondaire. - Retirer le surnageant et ajouter 200 μL de solution d’anticorps secondaires (diluée dans un tampon bloquant).
- Retirer le surnageant, ajouter 500 μL de solution d’anticorps secondaires (diluée dans un tampon de blocage) et incuber le tube à TA pendant 1,5 h en berçant doucement.
- Retirer le surnageant, ajouter 1 mL de tampon PDT et incuber le tube à TA pendant 30 min en balançant doucement.
- Répétez l’étape 6.4.17.
- Montez les embryons sur une plaque d’agarose à 2% (faite avec PBS, pH 7,6) et imagez les embryons avec un stéréomicroscope (champ lumineux et canaux fluorescents respectifs) (Figure 5A,B,D,F).
REMARQUE: Si vous utilisez le stéréomicroscope à fluorescence Leica M165 FC, utilisez un grossissement de 25x pour obtenir des images avec une bonne résolution. - Quantifier/analyser l’intensité du signal fluorescent par ImageJ (NIH). Utilisez l’outil Freehand Selection dans ImageJ pour quantifier le signal dans la région d’intérêt.
Résultats
Imagerie en direct de poissons rapporteurs transgéniques neutrophiles/macrophages traités au Z-REX, Tg(lyz:TagRFP) et Tg(mpeg1:EGFP). Induction de l’apoptose des neutrophiles/macrophages par HNEylation Keap1. (Voir aussi la figure 2). L’effet du marquage électrophile de Keap1 sur les niveaux de neutrophiles et de macrophages a été évalué en injectant des embryons transgéniques hétérozygotes dérivés de Tg(lyz:TagRFP) ou Tg(mpeg1:EGFP) avec de l’ARNm codant pour Halo-Keap1, puis en traitant avec Ht-PreHNE (alcyne). Conformément aux procédures de l’étape 6.1 - essai en aval, l’option 1-HNE (alcyne) a été libérée et Keap1 a été étiqueté. Les niveaux de neutrophiles et de macrophages ont été évalués par imagerie en direct des lignées rapporteures, Tg(lyz:TagRFP) et Tg(mpeg1:eGFP), respectivement. Le niveau des deux types de cellules a diminué de 30% à 40% après le traitement par Z-REX, dans lequel HNE a été administré à Keap1. Au contraire, aucune perte de neutrophiles ou de macrophages n’a été observée dans les groupes témoins techniques Z-REX [sans lumière et Ht-PreHNE (alcyne), lumière seule, ou Ht-PreHNE (alcyne) seul] (Figure 1D et Figure 2A-D).
L’induction de l’apoptose des neutrophiles/macrophages a indiqué une administration réussie d’ENH à Keap1 par Z-REX. Les détails de l’analyse de la voie et du mécanisme d’apoptose ont été publiés5. Pour tenir compte des effets hors cible de l’HNE(alcyne), plusieurs témoins ont été utilisés. (1) Dans les mêmes conditions expérimentales, au lieu de l’ARNm Halo-TeV-Keap1, les embryons ont été injectés avec l’ARNm Halo-P2A-Keap1. Le linker P2A a permis aux protéines Halo et Keap1 d’être exprimées indépendamment. Dans ce scénario, HNE (alcyne) libéré par Halo ne pouvait pas étiqueter Keap1, car il n’était plus proche de Halo (Figure 1D); Par conséquent, la voie de signalisation de l’apoptose n’a pas été déclenchée. Aucun changement dans les concentrations de macrophages ou de neutrophiles n’a été observé dans ce groupe (Figure 2A,B). (2) Les mêmes conditions expérimentales ont été réalisées en utilisant l’ARNm codant pour Halo-TeV-Keap1(C151S,C273W,C288E), un mutant de Keap1 qui ne répond pas à HNE (alcyne) (Figure 1D). Aucun changement dans les concentrations de macrophages ou de neutrophiles n’a été observé (Figure 2G,H).
Couplage azoture-clic de biotine et dosage de biotine pull-down. Évaluation de l’étiquetage des cibles. (Voir aussi la figure 3). L’évaluation du marquage de la cible a été réalisée à l’aide d’embryons WT, injectés avec de l’ARNm codant soit pour Halo-TeV-Keap1-2xHA (construction de fusion Halo-POI) ou Halo-2xHA-P2A-Keap1-2xHA (construction P2A-split, dans laquelle Halo et Keap1 ne sont pas fusionnés; Figure 1D). La protéine Keap1 marquée n’a été retirée que dans le groupe exprimant la protéine de fusion et traitée avec Z-REX (deuxième voie dans le transfert anti-HA supérieur), mais pas dans les autres groupes témoins (pas d’injection d’ARNm, construction de fusion sans Z-REX ou construction P2A-split). Les résultats indiquent que le HNE (alcyne) a été livré avec succès à Keap1, et le Keap1 modifié a ensuite été conjugué avec la biotine par réaction de clic, et le Keap1 marqué à la biotine a été tiré vers le bas par la résine streptavidine.
Analyse transcriptionnelle. RNA-seq et qRT-PCR. (Voir aussi la figure 4). Le changement transcriptionnel après le traitement par Z-REX a été évalué par RNA-seq et qRT-PCR. Dans le séquençage de l’ARN, plusieurs gènes liés au système immunitaire ont été régulés à la baisse après Z-REX. En revanche, de nombreux gènes liés à la réponse antioxydante (RA) ont été régulés à la hausse après Z-REX, ce qui a résulté de l’induction de la voie Keap1-Nrf2-AR lors de la HNEylation sur Keap110 (Figure 4A). Dans l’analyse qRT-PCR, des résultats similaires ont été trouvés lors de l’analyse de trois gènes liés au système immunitaire (lyz, mpeg1.1 et coro1a) (Figure 4B). La régulation ascendante et négative des gènes respectifs a montré l’induction réussie de voies médiées par la HNEylation Keap1.
Essai de coloration par (co)immunofluorescence et analyse de colocalisation en montage entier. (Voir aussi la figure 5). L’expression exogène de Halo-TeV-Keap1-2xHA et de Halo-2xHA-P2A-Keap1-2xHA a été évaluée par coloration par immunofluorescence (FI) sur support entier (Figure 5A,B). La construction P2A-split-build avait deux fois plus de balises HA que la construction de fusion TeV, ce qui correspond à un signal anti-HA deux fois plus élevé dans le groupe P2A-split-construct-mRNA-injecté que l’autre, indiquant que le niveau d’expression des deux constructions était similaire (Figure 5C). Les niveaux d’expression du Halo-TeV-Keap1 (wt) et du Halo-TeV-Keap1 (C151S,C273W,C288E) ont également été trouvés similaires lors du sondage avec anti-Halo (Figure 5D,E). La colocalisation des neutrophiles et de la caspase active 3 dans la Tg traitée par Z-REX (lyz:TagRFP) a été observée par co-immunomarquage avec la caspase 3 anti-RFP et anti-active (Figure 5F). Active Caspase 3 est un indicateur d’événements d’apoptose.
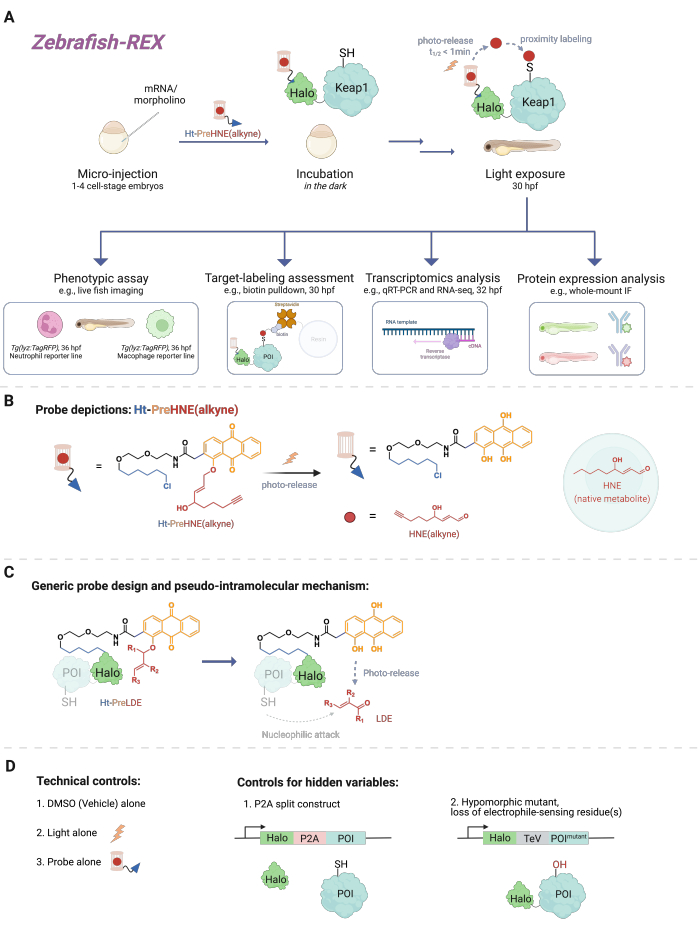
Figure 1 : flux de travail Z-REX. (A,B) Un embryon de poisson-zèbre au stade 1-4 cellules est injecté avec (morpholino et) ARNm codant pour Halo-POI (par exemple, Halo-Keap1). Les embryons injectés sont ensuite traités avec une sonde composée d’un ligand HaloTag et d’un électrophile photocagé additionné d’un groupe fonctionnel alcyne, tel que Ht-PreHNE(alcyne) chez B. Après avoir retiré l’excès de sonde, l’embryon est exposé à la lumière pour libérer l’électrophile d’intérêt [p. ex., HNE ou son analogue, HNE (alcyne)]. L’analyse en aval est effectuée à un moment donné/défini par l’utilisateur. (C) Conception et mécanisme de la sonde Ht-PreLDE, applicable à différents électrophiles dérivés de lipides (LDE). (D) Groupes témoins négatifs/techniques pour Z-REX. Veuillez cliquer ici pour voir une version agrandie de cette figure.
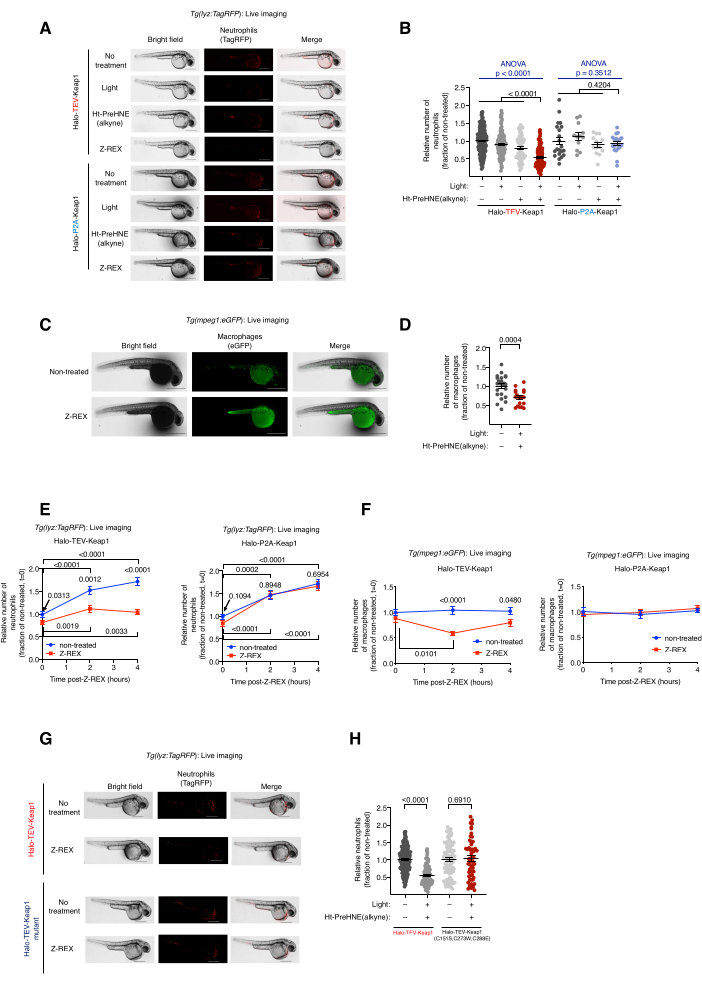
Figure 2 : Imagerie en direct de poissons rapporteurs transgéniques de neutrophiles/macrophages soumis au Z-REX. La HNEylation Keap1 médiée par Z-REX induit l’apoptose des neutrophiles/macrophages. (A) Images représentatives de poissons Tg(lyz:TagRFP) exprimant soit Halo-TeV-Keap1 (construction de fusion) ou Halo-P2A-Keap1 (construction divisée), et soumis à des conditions de contrôle négatives [pas de traitement, lumière seule, ou Ht-PreHNE (alcyne) seul ou Z-REX]. Âge de l’embryon: 36 hpf. (B) Quantification des niveaux de neutrophiles dans A. (C) Images représentatives de poissons Tg(mpeg1:eGFP) exprimant Halo-TeV-Keap1 avec ou sans traitement au Z-REX. Âge de l’embryon: 34 hpf. D) Quantification des concentrations de macrophages en C. (E,F) Mesure temporelle des niveaux de (E) neutrophiles et (F) de macrophages après traitement par Z-REX. (G) Expérience similaire à celle de A chez des poissons exprimant soit Halo-TeV-Keap1 (WT) ou Halo-TeV-Keap1 (C151S, C273W, C288E), un mutant qui n’a pas de capacité de détection HNE. H) Quantification des niveaux de neutrophiles en G. Barres d’échelle : 500 μm. Tous les graphiques sont présentés avec la moyenne ± les valeurs de SEM. p ont été calculées avec l’ANOVA unidirectionnelle (bleu) et le test t de Student bilatéral (noir). Cette figure a été modifiée à partir de Poganik et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Dosage de la biotine. Les embryons WT exprimant Halo-TeV-Keap1-2XHA ou Halo-2XHA-P2A-Keap1-2XHA ont été traités avec Z-REX ou des conditions de contrôle négatives respectives (pas de traitement par sonde dans ce cas). Après la récolte, les embryons ont été lysés et traités avec de la protéase TeV avant le test d’extraction de la biotine. Les résultats ont été analysés par Western blotting. Ce chiffre a été modifié à partir de Huang et al. Z-REX : guidage des électrophiles réactifs vers des protéines spécifiques exprimées spécifiquement dans les tissus ou de manière ubiquitaire, et enregistrement des réponses redox fonctionnelles induites par les électrophiles résultantes chez les larves de poissons. Ce chiffre a été modifié à partir de Huang et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
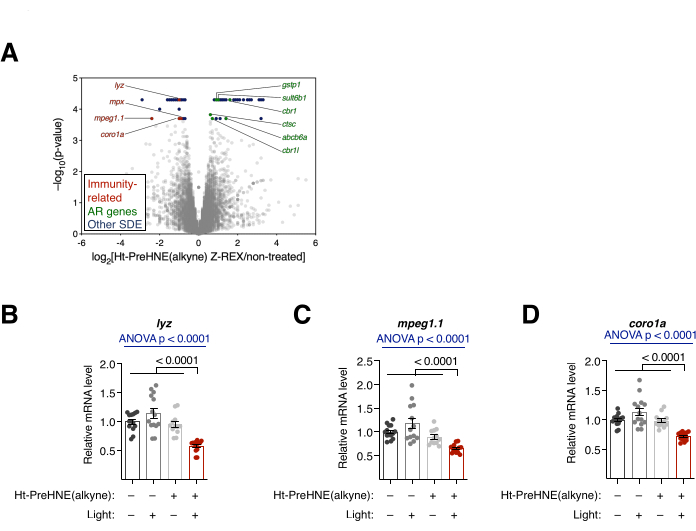
Figure 4 : Analyse transcriptionnelle. (A) Résultats du séquençage de l’ARN des embryons traités par Z-REX par rapport aux embryons non traités. Les gènes exprimés différentiellement significatifs (SDE) statistiquement significatifs sont mis en évidence. Les gènes SDE liés à l’immunité sont colorés en rouge. Les gènes liés à la réponse antioxydante (RA) sont colorés en vert. Les autres gènes SDE sont colorés en bleu. Toutes les valeurs p ont été calculées avec CuffDiff. (B-D) Trois gènes SDE liés à l’immunité de A: (B) lyz, (C) mpeg1.1 et (D) coro1a ont été analysés plus en détail avec qRT-PCR, et seuls les embryons traités par Z-REX ont montré la suppression de ces transcrits. Tous les graphiques sont présentés avec la moyenne ± les valeurs de SEM. p ont été calculées avec l’ANOVA unidirectionnelle (bleu) et le test t de Student bilatéral (noir). Cette figure a été modifiée à partir de Poganik et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
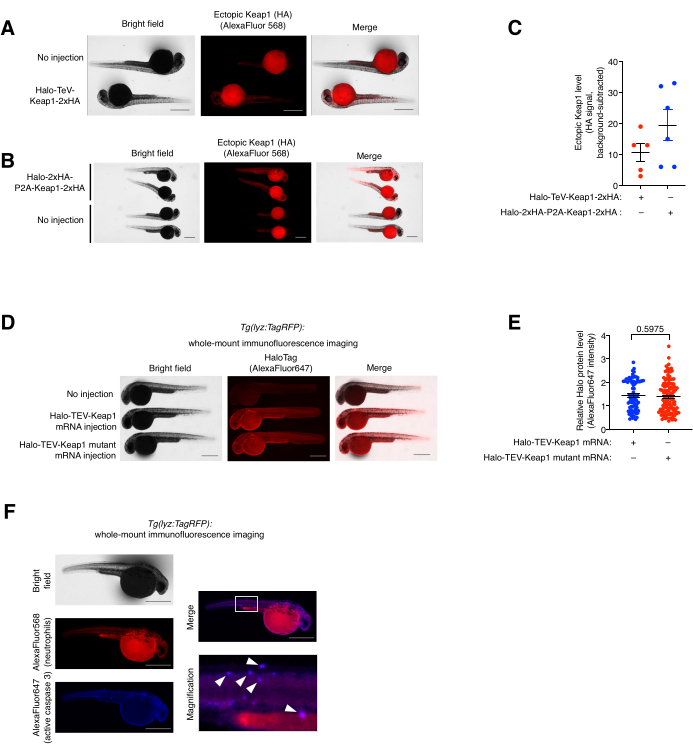
Figure 5 : Essai de coloration par immunofluorescence à montage entier. (A,B) Images représentatives d’embryons exprimant soit (A) Halo-TeV-Keap1-2xHA ou (B) Halo-2xHA-P2A-Keap1-2xHA immunocoloré avec un anticorps anti-HA et un anticorps secondaire conjugué avec AlexaFluor568. Les poissons injectés d’ARNm ont été comparés aux poissons non injectés appariés selon l’âge. (C) Quantification du signal anti-HA en (A,B). (D) Images représentatives d’embryons exprimant Halo-TeV-Keap1 (WT) ou Halo-TeV-Keap1 (C151S, C273W, C288E) immunocolorés avec un anticorps anti-Halo et d’anticorps secondaires conjugués avec AlexaFluor647. Les poissons injectés d’ARNm ont été comparés aux poissons non injectés appariés selon l’âge. e) Quantification du signal antihalo en D. Les valeurs p ont été calculées à l’aide du test t de Student bilatéral. (F) Les embryons Tg(lyz:TagRFP) soumis au Z-REX ont été co-immunocolorés avec de la Caspase 3 anti-RFP et anti-active, et des anticorps secondaires conjugués au fluorophore. La case blanche marque la zone agrandie. Les flèches blanches indiquent les colocalisations des neutrophiles et de Caspases 3 actives. Barres d’échelle : 500 μm. Tous les graphiques sont présentés avec la moyenne ± SEM. Cette figure a été modifiée à partir de Poganik et al.7. et Huang et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Liste des tampons utilisés dans cette étude. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le Z-REX décrit dans ce protocole démontre une stratégie robuste pour l’étude de paires électrophile-cible et la déconvolution de la voie de signalisation chez les poissons vivants. L’administration dirigée à proximité permet le dosage et le contrôle spatial du traitement composé électrophile. Contrairement aux méthodes conventionnelles de dosage en bolus, dans lesquelles les concentrations supraphysiologiques d’électrophile déployées conduisent souvent à des problèmes hors cible, la quantité relativement faible d’électrophile libérée dans le système rend Z-REX largement non invasif. Nous avons utilisé 0,1-6 μM Ht-PreHNE (alcyne) dans des embryons de poisson zèbre, et les résultats ont montré que le traitement n’est pas préjudiciable au développement embryonnaire11.
La procédure Z-REX est généralement plus longue que T-REX, une technique de criblage / étude des protéines de détection électrophile dans les cellules en culture. Supposons que le but de l’expérience soit de dépister les interactions électrophile-cible; nous suggérons d’abord d’effectuer un criblage approfondi par T-REX dans des cellules en culture et d’utiliser Z-REX pour la validation in vivo et l’analyse phénotypique/pathique. Par rapport à la culture cellulaire, les exigences pour effectuer Z-REX sont des techniques d’élevage de poissons de base en plus des compétences expérimentales biochimiques requises par T-REX. Un délai typique pour Z-REX (de la traversée du poisson à l’administration électrophile inductible par la lumière) est de 2-3 jours, ce qui n’est pas plus de 1 jour de plus que le temps typique pour une expérience T-REX sur des cellules vivantes transfectées. L’imagerie en direct pour l’analyse phénotypique peut être effectuée 2-10 h après l’éclairage de la lumière; le couplage de clics avec l’azoture de biotine pour le test déroulant prend 3 jours; qRT-PCR pour tester la réponse transcriptionnelle prend 3 jours; SI la coloration prend 5 jours. Ces étapes sont à peu près similaires à leurs équivalents de culture cellulaire, bien que l’interprétation des données nécessite une compréhension de la physiologie des poissons et des souches rapporteures.
En tant que procédure à variables multiples12, plusieurs groupes témoins sont nécessaires pour que Z-REX exclue les incertitudes dans les résultats (Figure 1D). Les groupes témoins communs sont les suivants : (1) traitement DMSO/véhicule seulement; 2° le traitement par sonde, mais sans éclairage lumineux; 3° l’éclairage lumineux, mais sans traitement par sonde; (4) la construction P2A-split, dans laquelle Halo et le POI sont exprimés séparément, de sorte que la livraison de proximité est ablée; et (5) les mutants hypomorphes, dont les résidus électrophiles sont mutés, tels que Akt3 (C119S)6 et Keap1 (C151S, C273W, C288E)5, que nous avons utilisés dans des études antérieures.
Si les essais en aval comprennent une analyse par transfert Western, le dyolking doit être effectué avant la récolte. Les protéines vitellines réduisent la fidélité des évaluations de la concentration de lysat et peuvent se lier de manière non spécifique aux anticorps. Lors de l’imagerie de poissons vivants ou de la coloration IF à montage entier, nous avons également observé des signaux fluorescents non spécifiques dans le sac vitellin, résultant probablement de protéines autofluorescentes dans le sac vitellin, ou d’une liaison non spécifique des anticorps eux-mêmes. Si le signal d’autofluorescence interfère avec le signal, nous suggérons d’exclure le sac vitellin de la quantification, ou de quantifier différentes régions séparément. La déchorination est nécessaire pour l’imagerie des poissons vivants et le dosage de coloration IF à montage entier. Le chorion peut interférer avec l’imagerie, et plus tard avec la quantification / comptage cellulaire. Cependant, la déchorination n’est applicable qu’aux embryons âgés de plus de 1 dpf; Les embryons plus jeunes aux stades de blastulation/gastrulation/segmentation sont trop fragiles pour être déchorionnés.
Le protocole Z-REX décrit ici est basé sur l’expression de POI ectopiques pilotée par l’ARNm. La procédure est rapide par rapport à l’utilisation / génération de lignées de poissons transgéniques. L’expression pilotée par l’ARNm est omniprésente et transitoire, et dure au moins 2 jours pour les ARNm utilisés dans ce protocole. Cependant, la durée d’expression est susceptible de varier dans d’autres cas. Ainsi, cette approche fournit une fenêtre d’investigation rapide et plus globale sur les effets d’un événement spécifique de marquage électrophile, compatible avec plusieurs tests à haut débit / contenu élevé. Les lignées transgéniques avec une expression stable de Halo-POI dans des tissus spécifiques sont également compatibles avec le Z-REX11. De telles lignes sont mieux utilisées lorsqu’une question plus précise doit être posée, par exemple, lorsqu’un phénotype dans un organe spécifique est prédit à partir de données de culture cellulaire, ou lorsque le dépistage à partir d’expériences d’injection d’ARNm prédit qu’un organe spécifique est sensible à un événement de marquage électrophile. Une induction de réponse antioxydante spécifique au cœur par Z-REX a été démontrée en utilisant Tg(gstp1:GFP;DsRed-P2A-myl7:Halo-TeV-Keap1) poisson dans notre publication précédente11. Il peut également être possible d’effectuer Z-REX sur des poissons transgéniques âgés de plus de 2 dpf.
Déclarations de divulgation
Des inhibiteurs de kinases à petites molécules spécifiques aux isoformes, dont la découverte a été rendue possible par les technologies REX, ont été déposés pour demande de brevet
Remerciements
Financement : Novartis FreeNovation, PRN et EPFL.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
Références
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon