Method Article
Larva Zebra Balıklarında Hedef Sinyalizasyon Yanıtlarının İzlenmesi - Z-REX Elektrofilik İlaçların ve Metabolitlerin Hassas Mekanizmalarının Maskesini Çıkarır
Bu Makalede
Özet
Reaktif elektrofilleri ve oksidanları (Z-REX) hedefleyen zebra balığı, reaktif küçük moleküllü sinyalizasyonun araştırılması için kimyasal biyoloji tabanlı bir yöntemdir. Bu teknik, farklı gelişim aşamalarındaki canlı balıklara uygulanabilir. Burada, zebra balığındaki standart tahlilleri sinyal yolu analizi için Z-REX ile birleştiriyoruz.
Özet
Reaktif metabolitler ve ilgili elektrofilik ilaçlar, incelenmesi en zor küçük moleküller arasındadır. Bu tür moleküllerin etki tarzını (MOA) yapıbozumuna uğratmaya yönelik geleneksel yaklaşımlar, deneysel örneklerin belirli bir reaktif türün fazlalığı ile toplu muamelesinden yararlanır. Bu yaklaşımda, elektrofillerin yüksek reaktivitesi, proteomun zamana ve bağlama bağlı bir şekilde ayrım gözetmeksizin etiketlenmesini sağlar; Redoksa duyarlı proteinler ve süreçler de dolaylı olarak ve sıklıkla geri dönüşü olmayan bir şekilde etkilenebilir. Sayısız potansiyel hedefin ve dolaylı ikincil etkilerin böyle bir zemininde, fenotipi spesifik hedef katılımına bağlamak karmaşık bir görev olmaya devam etmektedir. Larva zebra balıklarında kullanılmak üzere uyarlanmış isteğe bağlı bir reaktif-elektrofil dağıtım platformu olan reaktif elektrofilleri ve oksidanları (Z-REX) hedefleyen zebra balığı, elektrofilleri aksi takdirde bozulmamış canlı balık embriyolarında belirli bir ilgi alanına (POI) ulaştırmak için tasarlanmıştır. Bu tekniğin temel özellikleri, dozaj, kemotip ve mekansal olarak kontrol edilen hassas elektrofil dağıtımı ile birlikte düşük bir invazivlik seviyesini içerir. Bu nedenle, benzersiz bir kontrol paketi ile birlikte, bu teknik, hayvanların reaktif elektrofillere ve pleiotropik elektrofilik ilaçlara kontrolsüz toplu maruz kalmasını takiben gözlemlenen, hedef dışı etkilerden ve sistemik toksisiteden kaçınır. Z-REX'ten yararlanan araştırmacılar, bireysel stres tepkilerinin ve sinyal çıktılarının, bozulmamış canlı hayvanlarda fizyolojik koşullara yakın koşullar altında, belirli bir POI ile spesifik reaktif ligand etkileşiminin bir sonucu olarak nasıl değiştiğinin anlaşılmasında bir dayanak noktası oluşturabilirler.
Giriş
Sayısız hücresel sinyal olayı, küçük reaktif moleküller (hücrede endojen olarak üretilen veya ilaçlar gibi ksenobiyotikler / ksenometabolitler) ile protein hedefleri arasındaki reaksiyonları içerir. Birçok durumda, bu tür kovalent bağlanma olaylarının substokiyometrik bir seviyesi, hücresel yanıtları tetikleyebilir, bu da örneğin gelişim, metabolizma, apoptoz ve / veya bağışıklık tepkisinde değişikliklere yol açabilir1. Bununla birlikte, spesifik bağlanma olaylarını fenotipik sonuçlarına bağlayarak etki tarzını (MOA) yapıbozuma uğratmanın zor olduğu kanıtlanmıştır. Reaktif türlerin yüksek konsantrasyonlarının uygulanmasını içeren geleneksel bolus dozlama yöntemleri, genellikle çok sayıda proteinin modifiye edilmesine ve model organizma2'ye aşırı toksisiteye neden olur. Bu koşullar ideal olmaktan uzaktır. Hücre kültüründeki bu sorunları, T-REX (hedeflenebilir reaktif elektrofiller ve oksidanlar)3 olarak adlandırılan doğal bir hücresel bağlamda hassas lokalize elektrofil dağıtımı kullanarak çözmek için bir yöntem geliştirilmiştir. Aradan geçen yıllarda, odak noktası, dönüştürülmemiş hücrelerde belirli hücresel bağlamlarda proteinleri inceleme fırsatı veren tüm organizmalardaki deneylere yöneldi. Bu nedenle, tekniği Danio rerio embriyo modelleri de dahil olmak üzere çeşitli modellerle uyumlu olacak şekilde genişlettik. Burada Z-REX (reaktif elektrofilleri ve oksidanları hedef alan zebra balığı) sunulmuştur (Şekil 1).
Z-REX'i anlamak için, bu makale ilk olarak REX teknolojilerini ve bunların altında yatan kavramları sunmaktadır. Özünde, bu teknikler, doğal elektrofillerin mekansal zamansal hassasiyetle in vivo olarak nasıl yerel olarak üretildiğini taklit ederek endojen fizyolojik reaktif elektrofilik türlerin (RES) sinyalini modellemektedir. İlgilenilen protein (POI), Halo'ya bir füzyon yapısı olarak ifade edilir; ikincisi, fotokafesli RES'i taşıyan doku geçirgen ve inert probu 1: 1 stokiyometride sabitler. Böyle bir endojen RES, Ht-PreHNE probunda fotokaged olan 4-hidroksinonenaldir (bundan böyle HNE olarak anılacaktır). Birçok durumda, HNE ile temelde aynı biyolojik özelliklere sahip, ancak tıklama kimyası ile etiketlenebilen HNE'nin alkin işlevli bir versiyonunu [yani, HNE (alkin)] kullanıyoruz. Halo ile reaktivite için bir kloroalkan ile de işlevselleştirilen prob, Ht-PreHNE (alkin) olarak adlandırılır. Halo-POI füzyonunun kompleksi ve bu şekilde oluşan prob, RES'in UV ışığı ile ışınlandıktan sonra kaynaşmış POI'ye proksimal olarak verilmesini sağlar. POI, serbest bırakılan RES ile hızlı bir şekilde reaksiyona girerse, POI'nin RES ile kovalent olarak etiketlenmesi, kinetik olarak ayrıcalıklı sisteinleri tanımlamamıza izin verir.
Z-REX, REX teknolojilerinin yukarıda belirtilen avantajlarını alır ve bunları canlı balıklarda belirli sinyal yollarını incelemek için geniş çapta uygular. Bu protokol, zebra balığı (D. rerio) için optimize edilmiştir, çünkü bunlar gelişim sırasında şeffaf olan genetik olarak izlenebilir omurgalı organizmalardır ve bu nedenle REX teknolojileri gibi opto-kimyasal / genetik teknikler için idealdir. Bununla birlikte, benzer bir stratejinin diğer genetik olarak izlenebilir balık türleri üzerinde de iyi çalışması muhtemeldir, çünkü yöntemin geniş uygulanabilirliği, lipit kaynaklı elektrofil (LDE) dağıtımının psödo-moleküler mekanizmasından kaynaklanmaktadır. Gerçekten de, prosedür oldukça biyouyumludur, çünkü balıklar Z-REX fotokafesli-elektrofil [örneğin, Ht-PreHNE (alkin)] ile en az 48 saat boyunca gelişim üzerinde gözle görülür bir etki yaratmadan tedavi edilebilir. Benzer bir protokol C. elegans 4,5'te de işlev görür.
Protokol ilk olarak, embriyonik zebra balığı modellerinde, döllenmeden 1-1.5 gün sonra (dpf) doğal olmayan bir Halo-POI füzyon yapısının geçici bir ekspresyonunu üretmek için mRNA enjeksiyonunun kullanımını açıklar. Bu, ektopik proteinin belirli dokularda veya lokalizasyonlarda değil, balık içindeki hücrelerin çoğunda (bundan böyle 'her yerde 'her yerde bulunan' olarak anılacaktır) ekspresyonuyla sonuçlanır; Bununla birlikte, veriler belirli durumlarda hücreye özgü etkilerin gözlenebileceğini göstermektedir. Enjeksiyondan sonra, embriyolar döllenme sonrası 30.5 saate kadar (hpf) probun düşük konsantrasyonu [0.3-5 μM Ht-PreHNE (alkin)] ile inkübe edilir. Daha sonra, kullanıcı tarafından öngörülen bir zamanda, RES'in balık içindeki POI'ye verilmesi, 2-5 dakika boyunca fotouncaging ile gerçekleştirilir. RES'in fotounksajını takiben, önümüzdeki 2-10 saat içinde çeşitli aşağı akış fenotipik tahliller yapılabilir: 1) muhabir hatlarının canlı görüntülenmesi (Şekil 2A); 2) batı leke analizi ile hedef etiketleme değerlendirmesi (Şekil 3); 3) transkriptomik analiz (Şekil 4); veya 4) tam montajlı immünofloresan (Şekil 5).
Muhabir hatlarının canlı görüntülenmesine bir örnek olarak, Z-REX, belirli bir elektrofil sensörü POI'sinin (yani Keap1) RES modifikasyonunun sırasıyla nötrofil ve makrofaj seviyelerini nasıl azalttığını ölçmek için balık hatlarının, Tg (lyz: TagRFP) ve Tg (mpeg1: eGFP) canlı görüntülemesi ile birlikte gösterilmiştir. Bununla birlikte, daha önce POI etiketlemesinin ve T-REX çalışmalarından elde edilen sonuç yol sinyalinin, birkaç protein için Z-REX kullanılarak çoğaltılabileceğini gösterdik: Akt3 6, Keap17 ve Ube2v26. Genel olarak, Z-REX ile bilim adamları, POI'lerin RES tarafından kovalent modifikasyonunun sonuçlarını, birkaç karmaşık redoks yolu bağlamında inceleyebilirler. Bu teknik, kovalent ilaç tasarımı ve yeni ilaç mekanizmaları için hedefleri ve fonksiyonel kalıntılarını daha bağlamsal olarak alakalı bir bütün hayvan modelinde belirlemek için hazırlanmıştır.
Protokol
Cornell Üniversitesi'nde (Amerika Birleşik Devletleri) zebra balığı yetiştiriciliği ve elleçleme prosedürleri, Ulusal Sağlık Enstitüleri'nin (NIH) yönergelerine uygun olarak gerçekleştirilmiş ve Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır. İsviçre Federal Teknoloji Enstitüsü Lozan'ın (EPFL, İsviçre) zebra balığı birimindeki zebra balığı yetiştiriciliği ve elleçleme prosedürleri, kanton veterinerlik izni VD-H23 ile Hayvan Refahı Yasası SR 455 ve Hayvan Refahı Yönetmeliği SR 455.1'e göre gerçekleştirilmiştir.
NOT: Bu protokolde, Halo-TeV-Keap1'i ifade eden Tg (lyz:TagRFP ) ve Tg(mpeg1:EGFP) balık çizgileri Z-REX'i göstermek için kullanılır. Yöntem, ilgilenilen diğer proteinlere, transgenik muhabir balık hatlarına ve aşağı akış biyolojik tahlillerine genişletilebilir. Bu çalışmada kullanılan tamponlar için Ek Tablo 1'e bakınız. Tüm reaktifler, aletler, ekipmanlar, antikorlar, plazmidler, zebra balığı suşları ve ekipmanları Malzeme Tablosunda listelenmiştir.
1. mRNA hazırlığı
- mMessage mMachine SP6 in vitro transkripsiyon kitini kullanarak Halo-TeV-Keap1-2xHA ve Halo-2xHA-P2A-Keap1-2xHA mRNA'yı hazırlayın.
NOT: Üreticinin talimatlarını izleyin ve her mRNA için 40 μL ölçekli reaksiyonlar gerçekleştirin. mRNA peletini 10 μL nükleaz içermeyen suda yeniden çözün. - mRNA kalitesini değerlendirin ve konsantrasyonu mikrohacim spektrofotometresi ve agaroz jel elektroforezi ile ölçün. İyi kalitede bir mRNA,2.0 civarında veya üzerinde bir A260 / A 280 oranına sahip olmalıdır.
- mRNA'yı nükleaz içermeyen su ile 1-1.5 mg / mL'ye seyreltin.
- mRNA çözeltisini (tüp başına 1-2 μL) aliquot edin ve aliquotları -80 ° C'de saklayın.
2. Balık embriyolarının üretilmesi
- Seçenek 1: Vahşi tip (WT) balık embriyolarının üretilmesi.
- 10 ayrı tankta 10 balık geçiş çifti kurun, her tank erkek ve dişi ebeveyn balıklar arasında bir bölücü içerir.
NOT: Toplam 10 çapraz çift tipik olarak tahliller için yeterli sayıda embriyo sağlar. Geçiş çiftlerinin sayısı, deney tasarımına / ihtiyacına ve ana balığın doğurganlığına göre ayarlanabilir. - Ertesi sabah, enjektörü kurduktan sonra, tankların beşindeki bölücüleri çıkarın. Balıkların çiftleşmesi için 30 dakika bekleyin.
- Ana balığı başka bir tanka taşıyın, tank suyunu bir süzgeçten geçirerek embriyoları toplayın ve ardından embriyoları süzgeçten 10 cm'lik bir Petri kabına durulayın. Bu embriyolar enjeksiyonların ilk turu için kullanılacaktır.
NOT: Belirli bir partideki yumurta kalitesi zayıfsa (örneğin, proteinlerin toplanması nedeniyle yumurtalar opaktır), bunları diğer embriyolarla bir araya getirmeyin. - (İsteğe bağlı) Bir sonraki enjeksiyon turu için diğer beş tankta 2.1.2-2.1.3 adımlarında açıklandığı gibi benzer prosedürleri uygulayın.
NOT: Embriyolar arasındaki yaş farkını en aza indirmek için sadece bir tur enjeksiyon yapmak en iyisidir. Bununla birlikte, bir partide enjekte edilebilenden daha fazla embriyo gerekiyorsa, embriyoların mRNA enjeksiyonu sırasında 1-4 hücreli bir aşamada kalmasını sağlamak için iki tur enjeksiyon yapılması önerilir. Enjeksiyon turlarının sayısı, operatörün enjeksiyon becerisine ve deney tasarımına göre ayarlanabilir. Bununla birlikte, tüm prosedürün (ilk bölücünün çıkarılmasından son embriyonun enjeksiyonuna kadar) 2 saat içinde yapılması önerilir. Embriyolar arasındaki büyük yaş farkı, deney sonuçlarının güvenilirliğini ve tekrarlanabilirliğini bozabilir.
- 10 ayrı tankta 10 balık geçiş çifti kurun, her tank erkek ve dişi ebeveyn balıklar arasında bir bölücü içerir.
- Seçenek 2: Heterozigot transgenik nötrofil / makrofaj muhabiri balık embriyolarının üretilmesi.
- 10 ayrı tankta 10 balık geçiş çifti ayarlayın, her tank erkek ve dişi ebeveyn balıklar arasında bir bölücü ile yerleştirilir: WT balığına karşı Tg ( lyz: TagRFP) veya WT balıklarına karşı Tg (mpeg1: eGFP).
NOT: Homozigot muhabir balıklar heterozigot balıklara kıyasla daha yüksek floresan sinyali gösterdiğinden, aşağı akış floresan okumalarını etkileyebilecek heterozigot transgenik balıklar arasındaki geçişlerden kaçının. Transgenik muhabir çizgileri ve WT embriyoları görüntüleme sırasında kolayca ayırt edilebilir. WT ve heterozigot embriyoların aynı havuzda karışımının olması sorun değildir. lyz: TagRFP nötrofilleri bildirir ve mpeg: eGFP makrofajları bildirir. Bu protokol diğer muhabir balık hatlarına da uygulanabilir. - 2.1.2-2.1.4 adımlarını izleyin.
- 10 ayrı tankta 10 balık geçiş çifti ayarlayın, her tank erkek ve dişi ebeveyn balıklar arasında bir bölücü ile yerleştirilir: WT balığına karşı Tg ( lyz: TagRFP) veya WT balıklarına karşı Tg (mpeg1: eGFP).
3. Mikroenjektör kurulumu
- Hava kaynağını açın, geri basıncı 0.2-0.5 psi'ye ayarlayın ve enjeksiyon basıncını 25-30 psi'ye ayarlayın. Gösterilen spesifik basınç aralığı tipik olarak tavsiye edilir.
NOT: Balık ortamının iğneye geri akışını önlemek için sabit bir geri basınca sahip olmak önemlidir. Adım 3.8'de enjeksiyon hacmini kalibre ederken, sadece enjeksiyon süresi değiştirilmelidir. Aşağıdaki adımlarda enjeksiyon basıncını değiştirmeyin; Düşük enjeksiyon basıncı, yüzey ve ara yüzey gerginliği nedeniyle enjeksiyon başarısızlığına neden olabilirken, yüksek enjeksiyon basıncı embriyolara zarar verebilir. - Ekipmanı ve enjeksiyon platformunu RNase dekontaminasyon çözeltisi ile temizleyin.
NOT: mRNA'yı bozan RNase, operatörden veya ekipmandan gelebilir. Deneyden önce temizliği yapmak ve eldiven giymek gerekir. - (İsteğe bağlı) mRNA ve morfolinoyu birlikte enjekte ediyorsanız, ikisini 0.2 mL'lik bir tüpte önceden karıştırın.
NOT: Z-REX, 250-1500 ng / μL konsantrasyonda Halo-TeV-Keap1-2xHA mRNA çözeltisini kullanarak iyi çalışır. Zebra balıklarında çeşitli morfolinolar da kullanılmıştır ve optimal konsantrasyonlarbildirilmiştir 7. Yayınlanmamış bir diziye sahip bir morfolino kullanılıyorsa, operatör önce Z-REX'te kullanmadan önce morfolino'nun toksisitesini ve gen yıkma verimliliğini değerlendirmelidir. - 1-2 μL mRNA'yı (ve/veya uygulanabilir olduğunda morfolinoyu7) mikro yükleyici pipet ucu olan bir enjeksiyon iğnesine aktarın.
NOT: Alevli/Kahverengi mikropipet çektirici ile iğne hazırlanıyorsa, kurulum aşağıdaki gibidir. Isı: 520 adet; çekme mukavemeti: 60 adet; hız: 70 birim; gecikme: 155 birim; basınç: 550 birim; rampa: 530 adet. - İğneyi mikroenjeksiyon manipülatörüne takın.
NOT: Hava kaynağından gelen geri basınç, mRNA (/ morfolino) çözeltisini iğne ucuna itmelidir. - İğne ucunu kırmak için keskin forseps veya tıraş bıçağı kullanın ve enjeksiyon için uygun bir açıklık oluşturun.
- İğne ucunu bir sahne mikrometresinde mineral yağa batırın.
- Uçtaki hava kabarcıklarını gidermek için iki veya üç enjeksiyon darbesi uygulayın.
- Enjeksiyon süresini değiştirerek damla boyutunu 2 nL'ye kalibre edin.
NOT: Bu en iyi şekilde, bir hemositometre üzerine serilmiş mineral yağa (yumurta sarısı kesesinin viskozitesini taklit eden) enjekte edilerek gerçekleştirilir. Bir mikroskop kullanarak, enjeksiyon sırasında oluşan damlacığın boyutunu tahmin etmek için hemositometrenin kılavuz çizgilerini kullanın ve enjeksiyon süresini buna göre ayarlayın. Fenol kırmızısı boya bazen kullanılsa da, burada tarif edilen mRNA enjeksiyon prosedüründe buna duyulan ihtiyaç gözlenmemiştir.
4. Mikroenjeksiyon
- Bir enjeksiyon plakasını taze% 10 Hank'in dengeli tuz çözeltisi (HBSS) ortamı ile doldurun ve embriyoları plakanın oluklarında künt forsepslerle hizalayın.
NOT: Enjeksiyon plakası %10 HBSS ortamında %2 agaroz ile hazırlanır; Oluklar plastik bir kalıp kullanılarak oluşturulur. - İğne ucunu enjeksiyon plakasında% 10 HBSS ortamına batırın.
- Uçtaki hava kabarcıklarını gidermek için iki veya üç enjeksiyon darbesi uygulayın.
- Her enjeksiyon için, koryon ve yumurta sarısı kesesine tek bir hareketle nüfuz edin ve bir enjeksiyon darbesi uygulayın. Bu enjekte edilen sıvı, enjeksiyondan hemen sonra yumurta sarısı kesesi içinde küçük bir sferoid olarak görülebilir. Bu küçük küre nispeten hızlı bir şekilde dağılır. Yeterli sayıda enjekte edilen embriyo elde edilene kadar bu adımı diğer embriyolar için tekrarlayın.
NOT: Embriyoların hayatta kalma oranı (hem enjekte edilen hem de enjekte edilmeyen) tipik olarak% 50 -% 90 arasında değişmektedir. Her kontrol/deney grubu için gereken embriyo sayısının iki katını enjekte etmeyi hedefleyin. Biyotin aşağı çekme tahlilinde, her durum için 100-140 canlı embriyo gereklidir. qRT-PCR tahlilinde, her durum için beş canlı embriyo önerilir. Canlı balık görüntüleme ve tüm montajlı immünofloresan boyama testi için numune büyüklüğü kullanıcı tarafından tanımlanmıştır; Analizde iyi istatistiksel güç sağlamak için koşul başına en az 20 canlı embriyoya sahip olunması önerilir. - Enjekte edilen embriyoları, taze% 10 HBSS ortamı içeren yeni bir 10 cm'lik Petri kabına durulayın.
NOT: Embriyolar bir fışkırtma şişesi kullanılarak oluklardan kolayca durulanabilir. - Enjekte edilmeyen embriyoları başka bir plakada toplayın.
NOT: Enjekte edilmeyen embriyolar, gerektiğinde balığın sağlığı, temel protein ekspresyonu, arka plan floresan seviyeleri vb. İçin kalite kontrolleri olarak hizmet edebilir. Enjeksiyon prosedürü iyi çalıştıysa ve enjekte edilen mRNA / morfolino embriyolar için ölümcül değilse, enjekte edilen ve enjekte edilmeyen embriyolar benzer canlılığa sahip olmalıdır.
5. Z-REX
- Enjekte edilen embriyoları, deney kurulumuna göre 10 cm'lik tabaklara dağıtın (yani, kontrol / deney gruplarının sayısı).
- Kırmızı ışık aydınlatmalı karanlık bir odada, ortamı 1 μM Ht-PreHNE (alkin) olsun veya olmasın 30 mL% 10 HBSS ile değiştirin.
NOT: Ht-PreHNE (alkin) hafif kararsız bir bileşiktir. Aşağıdaki adımlarda embriyolar karanlıkta tutulmalıdır. - Embriyoları karanlıkta 28.5 ° C'de inkübe edin.
- 30,5 hpf'de, karanlık bir odada, medyayı yeni bir 30 mL% 10 HBSS ile değiştirin.
NOT: Ortamı değiştirirken, eski ortamın mümkün olduğunca çoğunu çıkarın. Bu, embriyolardan bağlanmamış / fazla miktarda Ht-PreHNE (alkin) çıkarmak için kritik öneme sahiptir. - Embriyoları karanlıkta 28.5 ° C'de 30 dakika boyunca inkübe edin.
- 5.4-5.5 arasındaki adımları iki kez daha yineleyin.
- Lambayı önceden ısıtmak için UV lambasını (365 nm, 3 mW/cm2) 5 dakika boyunca açın.
NOT: Lamba ön ısıtma adımı, adım 5.8'den önce gerçekleştirilmelidir. Lamba gücü, açıldıktan sonraki ilk birkaç dakika içinde daha düşük/kararsızdır. Lamba gücü düzenli olarak bir UV metre ile ölçülmelidir. - 32 hpf'de, embriyoları UV ışığına maruz bırakın.
- Seçenek 1: Canlı balık görüntüleme, tam montajlı immünofloresan boyama, jel içi floresan analizi (Cy5 azid ile tıklama bağlantısı), RNA-seq veya qRT-PCR gibi aşağı akış okumaları için, embriyoları 3 dakika boyunca UV ışığına maruz bırakın ve plakaları her 30 saniyede bir döndürün.
- Seçenek 2: Biyotin aşağı çekme testi gibi aşağı akış okumaları için, embriyoları en fazla 5 dakika (ve en az 3 dakika) boyunca UV ışığına maruz bırakın, plakaları her 30 saniyede bir döndürün ve plakaları buz üzerinde 1 dakika soğutun.
NOT: Farklı problar kullanılıyorsa, ışığa maruz kalma süresinin, belirli bir fotokaged elektrofil probu ve konuşlandırılan ışık kaynağı için fotouncaging'in t1/2'sine bağlı olarak optimize edilmesi gerekir. t1/2fotouncaging bilinen prosedürler kullanılarak belirlenebilir8. Ht-PreHNE (alkin) için t1/2 < 1 dakika3'tür; Bu nedenle, yukarıda belirtilen süre yeterlidir.
6. Aşağı akış tahlilleri
- Seçenek 1: Fenotipik tahlil. Transgenik nötrofil/makrofaj muhabirinin canlı görüntülenmesi
balık hatları, Tg( lyz:TagRFP ) ve Tg(mpeg1:eGFP ) (Şekil 2)- Embriyoları 4 °C'de 10 dakika boyunca inkübasyona tabi tutarak uyuşturun.
NOT: Koşul başına en az 20 canlı embriyoya sahip olunması önerilir. - Döllenmemiş/ölü embriyoları plakadan çıkarın.
NOT: Döllenmemiş/ölü embriyolar bulutlu/saydam değildir ve görsel olarak tanımlanabilir. Yüksek bir ölüm oranı görülürse, enjeksiyon prosedürüne geri dönün veya mRNA veya morfolino konsantrasyonunu azaltmaya çalışın. - Embriyoları keskin forsepslerle dekoryonlayın. Koryonu larva balıklarına dokunmadan bir çift forseps ile tutun ve koryonu sökmek için diğer forseps çiftini kullanın. Embriyo kırılgandır. Sadece dekoryon yaparken koryona dokunun.
NOT: Özellikle yeni başlayanlarda, dekoryonasyon sırasında bazı embriyolara zarar vermek yaygındır. Bu nedenle, her zaman gereken minimumdan daha fazla embriyoya sahip olun. - Embriyoları %2'lik bir agaroz plakasına (%10 HBSS ortamı ile hazırlanmış) monte edin ve embriyoları stereomikroskopla (parlak alan ve ilgili floresan kanallar) görüntüleyin (Şekil 2A, C, G).
NOT: Z-REX [Halo-TeV-Keap1-2xHA mRNA enjeksiyonu ve Ht-PreHNE (alkin) tedavisinin kombinasyonu] sonrasında, nötrofillerin tükenmesi (lyz: TagRFP) 36 hpf'de (Z-REX'den 4 saat sonra) en anlamlı bulunurken, makrofajların azalması (mpeg1: eGFP) 34 hpf'de (Z-REX'den 2 saat sonra) en anlamlı bulunmuştur (Şekil 2E, F). Farklı muhabir çizgileri, mRNA / morfolino veya problar kullanılıyorsa diğer zaman noktaları kullanılabilir. Maruz kalma süresi ve / veya kazancı, tek hücreleri veya istenen spesifik (ultra) yapıları görselleştirmek için optimize edilmelidir. - Her balığın nötrofil/makrofaj sayısını ImageJ (NIH) ile sayın (Şekil 2B, D-F, H). Tüm balığın etrafında dönmek için ImageJ'deki Serbest Seçim aracını kullanın ve floresan hücreleri saymak için Find Maxima seçeneğini kullanın.
- Embriyoları 4 °C'de 10 dakika boyunca inkübasyona tabi tutarak uyuşturun.
- 2. Seçenek: Hedef etiketleme değerlendirmesi. Biotin azid tıklama kuplajı ve biyotin pull-down testi (Şekil 3)
- Embriyoları 4 °C'de inkübasyonla uyuşturun. Bu genellikle 10 dakika sürer.
NOT: Yeterli balık lizatı elde etmek için, her durum için 100-140 canlı embriyo gereklidir. - Döllenmemiş/ölü embriyoları plakadan çıkarın.
- Dekoryonasyon ve deyolking yapın. Koryonu bir çift keskin forseps ile tutarak, yumurta sarısı kesesine nüfuz etmek için diğer forseps çiftini kullanarak ve daha sonra yumurta sarısı proteinlerinin dışarı çıkmasına izin vermek için koryonu çıkarırken yumurta sarısı kesesini ayırarak iki manipülasyonu gerçekleştirin.
NOT: Bu adımda yumurta sarısı proteinlerinin çıkarılması çok önemlidir. Numunedeki bol miktarda yumurta sarısı proteinleri daha sonraki analizlere müdahale eder. - Deyolklanmış embriyoları 1.5 mL'lik bir tüpe aktarın.
NOT: Yumurta sarısı çıkarılmış embriyoları ortalamak için plakayı döndürün, bu da toplanmasını kolaylaştırır. Daha hafif koryon kalıntıları bu işlem sırasında kazanır. - Embriyolar tüp tabanına yerleştikten sonra, süpernatanı çıkarın ve 1 mL soğutulmuş HEPS tamponlu salin (pH 7.6) ekleyin.
- Adım 6.2.5'i iki kez daha yineleyin.
- (İsteğe bağlı) Bir sonraki adıma hemen geçmek istemiyorsanız, arabelleği çıkarın, numuneleri sıvı azotta dondurun ve -80 ° C'de saklayın.
NOT: Sarısı çıkarılmış balık peletleri sıvı azotta flaş dondurulabilir ve -80 °C'de saklanabilir. Flaş dondurulmuş numuneler -80 °C'de 2 haftaya kadar saklanabilir. - Balık topaklarını lizis tamponunda tekrar askıya alın.
NOT: Lizis tamponu (pH 7.6), soya fasulyesinden 50 mM HEPES, 100 mM NaCl, %1 Triton X-100, 0.3 mM TCEP, 2x Roche cOmplete Mini EDTA içermeyen proteaz inhibitörleri ve 0.1 mg/mL tripsin inhibitöründen oluşur. Bir embriyo yaklaşık 2 μg lizat verir. Her 120 embriyo için 100 μL lizis tamponu kullanın. İki Roche cOmplete Mini EDTA içermeyen proteaz inhibitörü ve soya fasulyesinden tripsin inhibitörleri, kullanımdan hemen önce lizis tamponuna eklenmelidir. - Tüpe %20 v/v zirkonya boncuk ekleyin.
- 20 sn boyunca vorteks, sıvı azotta flaş donma ve 37 ° C'lik bir su banyosunda çözülme.
- Adım 6.2.10'u iki kez daha yineleyin.
- Çözeltiyi 21.000 x g'de 4 °C'de 10 dakika boyunca santrifüjleyin.
- Süpernatantı yeni, önceden soğutulmuş 1,5 mL'lik bir tüpe aktarın.
- Bradford testi ile protein konsantrasyonunu ölçün.
- Lizatı 1 mg / mL'ye seyreltin.
- Her koşul için, 170 μg lizatı 2 mL'lik bir tüpe aktarın.
- Lizatı adım 6.2.16'dan itibaren 0.2 mg / mL TeV proteaz (S219V) ile karıştırın ve çözeltiyi 30 dakika boyunca 37 ° C'de inkübe edin.
NOT: TeV proteaz ile muamele edilmeyen gruplar için, lizatı diğer gruplarda kullanılan TeV proteaz çözeltisine eşit bir lizis tamponu voloumu ile karıştırmanız yeterlidir. - Biotin-azide tıklama reaksiyonu için 10x ana karışım hazırlayın: SDS ile %10, 10 mM CuSO4, 1 mM Cu(TBTA), 1 mM biyotin-azid ve 20 mM TCEP.
NOT: Adım 6.2.19'dan hemen önce karışıma TCEP ekleyin. - Adım 6.2.17'den itibaren (TeV proteazla sindirilmiş) lizata 8,5 μL t-BuOH ve 17 μL 10x tıklama reaksiyonu ana karışımı ekleyin. Vorteks, santrifüj ve çözeltiyi 37 ° C'de 15 dakika boyunca inkübe edin.
- Çözeltiye 1 mM TCEP daha ekleyin ve ardından vorteks, santrifüj yapın ve çözeltiyi 37 ° C'de 15 dakika daha inkübe edin. 6.2.19-6.2.20 adımları için kuluçka süresi toplamda 30 dakikadır.
NOT: Cu(I) üretmek için indirgeyici bir reaktif olan TCEP'in bu eki, tıklama reaksiyonu verimliliğini artırır. - Her tüpe 600 μL -20 °C etanol ekleyin, çözeltiyi vorteksleyin ve gece boyunca -80 ° C'de inkübe edin.
NOT: Numuneler -80 °C'de 1 hafta saklanabilir; Değilse, hemen bir sonraki adıma geçin. - Çözeltiyi 21.000 x g'de 4 °C'de 1 saat boyunca santrifüj edin.
NOT: Santrifüj işleminden sonra tüpün dibinde istenen fraksiyon olan bir pelet oluşmalıdır. - Süpernatanı çıkarın, 1 mL -20 °C etanol, vorteks ekleyin ve çözeltiyi 10 dakika boyunca 4 ° C'de 21.000 x g'de santrifüj edin.
- Adım 6.2.23'ü yineleyin.
- Süpernatanı çıkarın, 1 mL -20 °C aseton, vorteks ekleyin ve çözeltiyi 10 dakika boyunca 4 ° C'de 21.000 x g'de santrifüj edin.
- Supernatan'ı çıkarın. Aşırı kalıntı asetonun buharlaşmasına izin verin, ancak tamamen kuruluğa değil.
- Peletin 100 μL resüspansiyon tamponunda (% 8 w / v lityum dodesil sülfat [LDS], 50 mM HEPES salininde 1 mM EDTA, pH 7.6), 15 s vorteks içinde tekrar askıya alın ve pelet çözülene kadar sonikleştirin.
- Çözeltiyi oda sıcaklığında (RT) 21.000 x g'de 5 dakika boyunca santrifüj edin.
- Süpernatantı yeni bir 2 mL tüpe aktarın ve 1.5 mL 50 mM HEPES salin, pH 7.6 ekleyin.
NOT: Bu adımdaki son LDS konsantrasyonu% 0.5'tir. Daha yüksek LDS konsantrasyonları, aşağı çekme verimliliğini zayıflatabilir. Bu nedenle, LDS konsantrasyonunun arttırılması, spesifik olmayan bağlanmanın azaltılmasına yardımcı olsa da, aşağı çekmenin verimliliğini de azaltabilir. Buna göre, bu adımda LDS konsantrasyonunun değiştirilmemesi önerilir. - "Giriş" örneğini toplayın (Şekil 3): 30 μL 1 mg/mL lizatı yeni bir 1,5 mL tüpe aktarın ve %6 β-Merkaptoetanol (BME) içeren 10 μL 4x Laemmli numune tamponu ekleyin. Flaş çözeltiyi dondurur ve -80 ° C'de saklar.
- 100 μL yatak hacimli streptavidin yüksek kapasiteli reçineyi yeni bir 2 mL tüpe aktarın. 50 mM HEPES salinine (pH 7.6) 1 mL% 0.5 LDS ekleyin, RT'de 1.500 x g'de 2 dakika boyunca santrifüj yapın ve süpernatanı çıkarın. Yıkamayı, 50 mM HEPES salin (pH 7.6) içinde 1 mL% 0.5 LDS ile tekrarlayın.
- Çözeltiyi adım 6.2.29'dan adım 6.2.31'den önceden yıkanmış streptavidin yüksek kapasiteli reçine içeren tüpe aktarın ve çözeltiyi RT'de uçtan uca bir karıştırıcı üzerinde 4-6 saat boyunca inkübe edin.
- Karışımı RT'de 1.500 x g'de 2 dakika boyunca santrifüj edin, 30 μL süpernatan alın ve "akış" numunesi için% 6 BME içeren 10 μL 4x Laemmli numune tamponu ile karıştırın. Ardından, kalan süpernatanı çıkarın.
NOT: "Flowthrough" numuneleri, streptavidin aşağı çekme verimliliğini kontrol etmek için batı lekeleme ile analiz edilebilir. Bağlanmamış proteinleri yıkamak için süpernatantın mümkün olduğunca çoğunu çıkarmak esastır. İlk olarak, bir P-1000 pipet kullanarak süpernatantın çoğunu çıkarın ve ardından jel yükleme ucu olan bir P-20 pipet kullanarak kalan süpernatantı çıkarın. - Reçineye 50 mM HEPES salin (pH 7.6) içinde 1 mL% 0.5 LDS ekleyin ve karışımı RT'de uçtan uca rotasyonla 30 dakika boyunca inkübe edin.
- Karışımı RT'de 1.500 x g'de 2 dakika boyunca santrifüj edin ve süpernatanı çıkarın.
NOT: Tipik olarak, spesifik olmayan bağlayıcı proteinlerin çoğunu çıkarmak için% 0.5 LDS yeterlidir. Daha sonraki analizlerde spesifik olmayan bağlanma sinyalleri hala görülüyorsa, yıkama tamponundaki LDS konsantrasyonu arttırılabilir. - Adım 6.2.34-6.2.35'i iki kez daha yineleyin.
- Reçineye %6 BME içeren 40 μL 2x Laemmli numune tamponu ekleyin.
- Karışımı 98 ° C'de 5 dakika boyunca inkübe ederek bağlı proteinleri boşaltın.
- Karışımı RT'de 21.000 x g'de 5 dakika boyunca santrifüj edin ve süpernatantı yeni bir 1,5 mL tüpe aktarın. Bu "elute" örneğidir.
NOT: Adım 6.2.38'den itibaren reçine içeren çözeltinin doğrudan jele yüklenmesi SDS-PAGE analizini etkileyebilir. - 10 şeritli% 10 poliakrilamid jelin her bir kuyucuğuna 20 μL yükleyin ve jel elektroforezi çalıştırın.
NOT: Boya cephesi çözme jeline ulaşana kadar jeli daha düşük bir voltajda (120 V) çalıştırın ve voltajı 170 V olarak değiştirin. - Anti-HA, anti-Halo veya temizlik proteinlerini tespit eden diğer antikorlarla batı lekelemesi yapın (Şekil 3).
- Embriyoları 4 °C'de inkübasyonla uyuşturun. Bu genellikle 10 dakika sürer.
- Seçenek 3: Transkriptomik analiz. RNA-seq ve qRT-PCR (Şekil 4)
NOT: Bu tahlil için birbirinden 15 dakika arayla atılan embriyoların kullanılması şiddetle tavsiye edilir. Embriyoların yaş farkı tahlil sonuçlarını önemli ölçüde etkilemektedir.- Embriyoları Z-REX'ten 2 saat sonra 10 dakika boyunca 4 ° C'de inkübe ederek anestezi altına alın.
- Keskin forseps ile dekoryonasyon yapın (adım 6.1.3).
- (İsteğe bağlı) Farklı segmentler ayrı ayrı analiz edilecekse, forseps ile segmentasyon yapın (örneğin, kafayı kuyruktan ayırın).
- RNA'yı bütün bir embriyodan çıkarıyorsanız, üç ila beş embriyoyu 1.5 mL'lik bir tüpe aktarın. RNA'yı kafadan veya kuyruktan çıkarıyorsanız, 10-12 disseke segmenti 1.5 mL'lik bir tüpe aktarın.
NOT: Deneyin üç ila beş biyolojik replika ile yapılması önerilir. - Tüpe 1 mL TRIzol reaktifi ve cam boncuklar ekleyin.
NOT: Cam boncukların RNA ekstraksiyonu için zirkonya boncuklarından daha iyi çalıştığı bulunmuştur. - Karışımı 30 s boyunca vorteks.
NOT: Bir sonraki adıma hemen geçilmezse, çözelti -80 ° C'de 1-3 hafta boyunca saklanabilir. - RNA'yı üreticinin talimatlarına göre çıkarın.
- RNA kalitesini ve konsantrasyonunu mikrohacim spektrofotometresi ve agaroz jel elektroforezi ile değerlendirin.
NOT: İyi kalitede RNA,2.0 civarında veya üzerinde bir A260 / A 280 oranına sahip olmalıdır. - RNA'yı dizileme için gönderin veya 1 μg RNA'yı amplifikasyon dereceli DNaz I ile tedavi edin ve üst simge III ters transkriptaz ve oligo-(dT)20 kullanarak ters transkripsiyon yapın. Bu adımı üreticinin talimatlarına göre gerçekleştirin.
- qRT-PCR gerçekleştirin ve verileri ΔΔCT yöntemi9 ile analiz edin (Şekil 4B-D).
- Seçenek 4: POI ekspresyonu ve kolokalizasyon analizi. Tam montajlı immünofloresan boyama testi (Şekil 5)
NOT: Formaldehit ile sabitlenmiş embriyolar kırılgandır. Güçlü sallamalardan kaçının ve dikkatli kullanın.- 6.1.1-6.1.3 adımlarını izleyerek embriyoları dekoryonlayın.
- Embriyoları 1.5 mL'lik bir tüpe aktarın.
NOT: Her tüpün eşit sayıda embriyosu olmalı ve 40'tan fazla embriyo olmamalıdır. - Embriyolar tüpün dibine yerleştikten sonra, süpernatanı çıkarın ve 1 mL fosfat tamponlu salin (PBS) (pH 7.6) ekleyin.
- Adım 6.4.3'ü bir kez daha yineleyin.
- Süpernatanı çıkarın, PBS'ye (pH 7.6) 1 mL% 4 formaldehit ekleyin ve tüpü gece boyunca 4 ° C'de hafif sallanma ile inkübe edin.
NOT: Formaldehit çözeltisi içindeki numuneler 1 hafta boyunca 4 °C'de saklanabilir. - Süpernatanı çıkarın, 1 mL -20 °C metanol ekleyin ve tüpü en az 18 saat boyunca -20 ° C'de yan tarafında inkübe edin.
NOT: Numuneler -20 °C'de 1 ay veya daha uzun süre saklanabilir. - Süpernatanı çıkarın ve PBS tamponuna 1 mL PDT tamponu ekleyin (PBS tamponuna %0,3 v/v Triton X-100, %0,1 v/v Tween-20 ve %1 v/v dimetil sülfoksit [DMSO]).
- Adım 6.4.7'yi tekrarlayın ve tüpü RT'de 30 dakika boyunca hafifçe sallayarak inkübe edin.
- Süpernatanı çıkarın, 1 mL bloke edici tampon ekleyin (% 10 v / v ısı ile inaktive edilmiş fetal sığır serumu [FBS], % 2 w / v sığır serum albümini [BSA] ve% 0.1 v / v Tween-20 PBS tamponu) ekleyin ve tüpü RT'de 1 saat boyunca hafif sallanma ile inkübe edin.
- Süpernatanı çıkarın ve 200 μL birincil antikor çözeltisi ekleyin (bloke edici tamponda seyreltilmiş).
- Süpernatanı çıkarın, 500 μL birincil antikor çözeltisi ekleyin (bloke edici tamponda seyreltilmiş) ve tüpü gece boyunca 4 ° C'de hafif sallanma ile inkübe edin.
NOT: Yeni bir primer antikor kullanılıyorsa, negatif kontroller olarak hizmet etmek için primer antikor boyaması olmayan bazı örnekleri dahil etmeye değer. Bununla birlikte, ideal olarak, morfolino-nakavt veya mühendislik gen nakavt embriyoları veya hedef proteinin ekspresyonunun uyarıldığı embriyolar, antikoru doğrulamak için daha güvenilir araçlardır. - Süpernatanı çıkarın, 1 mL PDT tamponu ekleyin ve tüpü RT'de 30 dakika boyunca hafifçe sallayarak inkübe edin.
- Adım 6.4.12'yi yineleyin.
- Süpernatanı çıkarın, 1 mL bloke edici tampon ekleyin ve tüpü RT'de 1 saat boyunca hafifçe sallayarak inkübe edin.
NOT: İkincil antikor üzerinde konjuge edilen floroforun fotobeyazlamasını önlemek için numuneler bu adımdan sonra ışıktan korunmalıdır. - Süpernatanı çıkarın ve 200 μL ikincil antikor çözeltisi ekleyin (bloke edici tamponda seyreltilmiş).
- Süpernatanı çıkarın, 500 μL ikincil antikor çözeltisi ekleyin (bloke edici tamponda seyreltilmiş) ve tüpü RT'de 1.5 saat boyunca hafifçe sallayarak inkübe edin.
- Süpernatanı çıkarın, 1 mL PDT tamponu ekleyin ve tüpü RT'de 30 dakika boyunca hafifçe sallayarak inkübe edin.
- Adım 6.4.17'yi yineleyin.
- Embriyoları %2'lik bir agaroz plakasına (PBS, pH 7.6 ile yapılmış) monte edin ve embriyoları stereomikroskopla (parlak alan ve ilgili floresan kanallar) görüntüleyin (Şekil 5A, B, D, F).
NOT: Leica M165 FC floresan stereomikroskop kullanıyorsanız, iyi çözünürlükte görüntüler elde etmek için 25x büyütme kullanın. - ImageJ (NIH) ile floresan sinyal yoğunluğunu ölçün/analiz edin. İlgilenilen bölgedeki sinyali ölçmek için ImageJ'deki Serbest Seçim aracını kullanın.
Sonuçlar
Z-REX ile tedavi edilen transgenik nötrofil / makrofaj muhabir balıkları, Tg (lyz: TagRFP) ve Tg (mpeg1: EGFP) canlı görüntüleme.Keap1 HNEilasyon yoluyla nötrofil/makrofaj apoptozunun indüksiyonu. (Ayrıca bakınız Şekil 2). Keap1'in elektrofil etiketlemesinin nötrofil ve makrofaj seviyeleri üzerindeki etkisi, Tg (lyz: TagRFP) veya Tg (mpeg1: EGFP) 'den türetilen heterozigot transgenik embriyoların Halo-Keap1'i kodlayan mRNA ile enjekte edilmesi ve daha sonra Ht-PreHNE (alkin) ile muamele edilmesiyle değerlendirildi. Adım 6.1-aşağı akış testi için prosedürler izlendikten sonra Seçenek 1-HNE (alkin) serbest bırakıldı ve Keap1 etiketlendi. Nötrofil ve makrofaj düzeyleri sırasıyla Tg(lyz:TagRFP) ve Tg(mpeg1:eGFP) muhabir hatlarının canlı görüntülenmesiyle değerlendirildi. Her iki hücre tipinin seviyesi, HNE'nin Keap1'e verildiği Z-REX tedavisinden sonra% 30-40 oranında azalmıştır. Aksine, Z-REX teknik kontrol gruplarında [ışık ve Ht-PreHNE (alkin), tek başına ışık veya tek başına Ht-PreHNE (alkin) olmadan] nötrofil veya makrofaj kaybı görülmedi (Şekil 1D ve Şekil 2A-D).
Nötrofil / makrofaj apoptozunun indüksiyonu, Z-REX yoluyla Keap1'e başarılı HNE dağıtımını gösterdi. Yol analizi ve apoptoz mekanizması ile ilgili detaylar yayınlanmıştır5. HNE'nin (alkin) hedef dışı etkilerini hesaba katmak için çeşitli kontroller kullanılmıştır. (1) Aynı deney koşulları altında, Halo-TeV-Keap1 mRNA yerine, embriyolara Halo-P2A-Keap1 mRNA enjekte edildi. P2A bağlayıcı, Halo ve Keap1 proteinlerinin bağımsız olarak ifade edilmesine izin verdi. Bu senaryoda, Halo'dan salınan HNE (alkin), artık Halo'ya yakın olmadığı için Keap1'i etiketleyemedi (Şekil 1D); Bu nedenle, apoptoz sinyal yolu tetiklenmedi. Bu grupta makrofaj veya nötrofil düzeylerinde herhangi bir değişiklik gözlenmedi (Şekil 2A,B). (2) Aynı deneysel koşullar, HNE'ye (alkin) cevap vermeyen bir Keap1 mutantı olan Halo-TeV-Keap1 (C151S, C273W, C288E) kodlayan mRNA kullanılarak gerçekleştirilmiştir (Şekil 1D). Makrofaj veya nötrofil düzeylerinde herhangi bir değişiklik gözlenmedi (Şekil 2G,H).
Biotin azide tıklama kuplajı ve biyotin aşağı çekme testi. Hedef etiketleme değerlendirmesi. (Ayrıca bakınız Şekil 3). Hedef etiketleme değerlendirmesi, Halo-TeV-Keap1-2xHA (Halo-POI füzyon yapısı) veya Halo-2xHA-P2A-Keap1-2xHA (Halo ve Keap1'in kaynaşmadığı P2A-bölünmüş yapı; Şekil 1D). Etiketli Keap1 proteini sadece füzyon proteinini ifade eden grupta aşağı çekildi ve Z-REX (üst anti-HA lekesinde ikinci şerit) ile muamele edildi, ancak diğer kontrol gruplarında (mRNA enjeksiyonu yok, Z-REX olmadan füzyon yapısı veya P2A-bölünmüş yapı) tedavi edilmedi. Sonuçlar, HNE'nin (alkin) Keap1'e başarıyla teslim edildiğini ve modifiye Keap1'in daha sonra tıklama reaksiyonu yoluyla biyotin ile konjuge edildiğini ve biyotin etiketli Keap1'in streptavidin reçinesi tarafından aşağı çekildiğini göstermektedir.
Transkripsiyonel analiz. RNA-seq ve qRT-PCR. (Ayrıca bakınız Şekil 4). Z-REX tedavisi sonrası transkripsiyonel değişiklik RNA-seq ve qRT-PCR ile değerlendirildi. RNA-seq'te, Z-REX'ten sonra immün ile ilgili birkaç gen aşağı regüle edildi. Buna karşılık, Z-REX'ten sonra birçok antioksidan yanıt (AR) ile ilişkili gen, Keap110 üzerinde HNEylation üzerine Keap1-Nrf2-AR yolunun indüksiyonundan kaynaklanan yukarı regüle edilmiştir (Şekil 4A). qRT-PCR analizinde, immün ile ilişkili üç gen (lyz, mpeg1.1 ve coro1a) analiz edildiğinde benzer sonuçlar bulunmuştur (Şekil 4B). İlgili genlerin yukarı ve aşağı regülasyonu, Keap1 HNEilasyonunun aracılık ettiği yolakların başarılı bir şekilde indüklendiğini göstermiştir.
Tam montajlı (ko-) immünofloresan boyama testi ve kolokalizasyon analizi. (Ayrıca bakınız Şekil 5). Eksojen Halo-TeV-Keap1-2xHA ve Halo-2xHA-P2A-Keap1-2xHA ekspresyonu tam montajlı immünofloresan (IF) boyaması ile değerlendirildi (Şekil 5A,B). P2A-split-construct, TeV-fusion-construct'tan iki kat daha fazla HA etiketine sahipti, bu da P2A-split-construct-mRNA-enjekte edilen grupta diğerinden iki kat daha yüksek bir anti-HA sinyaline karşılık geliyor ve bu da iki yapının ekspresyon seviyesinin benzer olduğunu gösteriyor (Şekil 5C). Halo-TeV-Keap1 (wt) ve Halo-TeV-Keap1'in (C151S, C273W, C288E) ekspresyon seviyeleri de anti-Halo ile sondalama yaparken benzer bulunmuştur (Şekil 5D, E). Z-REX ile tedavi edilen Tg'de (lyz:TagRFP) nötrofillerin ve aktif kaspaz 3'ün kolokalizasyonu, anti-RFP ve anti-aktif-Kaspaz 3 ile birlikte immünoboyama ile gözlendi (Şekil 5F). Aktif Kaspaz 3, apoptoz olaylarının bir göstergesidir.
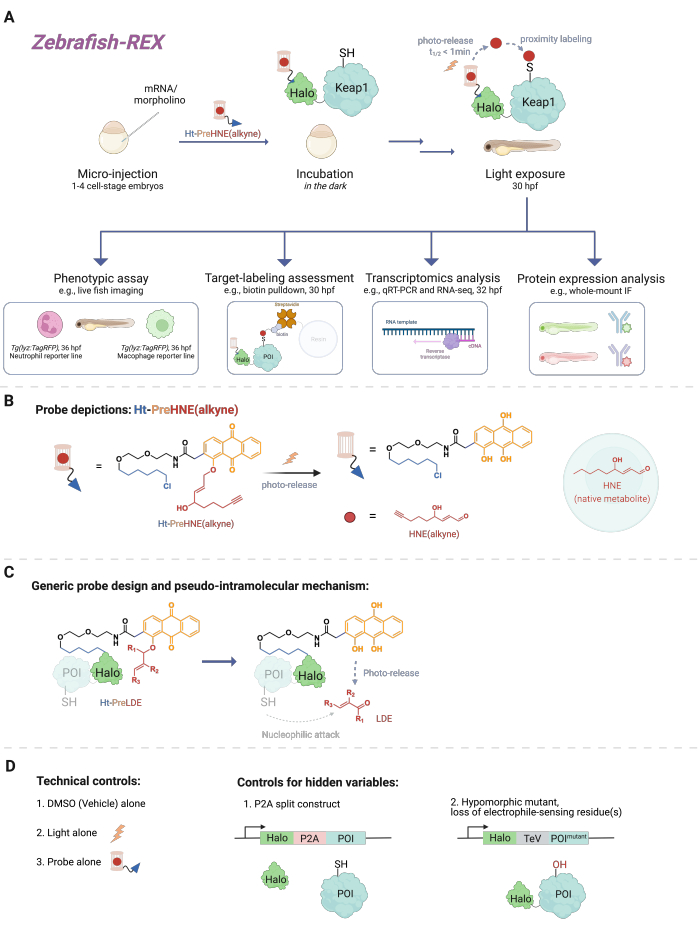
Şekil 1: Z-REX iş akışı. (A,B) 1-4 hücre evreli zebra balığı embriyosuna Halo-POI (örneğin, Halo-Keap1) kodlayan (morfolino ve) mRNA enjekte edilir. Enjekte edilen embriyolar daha sonra bir HaloTag ligandından oluşan bir prob ve B'deki Ht-PreHNE (alkin) gibi bir alkin fonksiyonel grubu ile eklenmiş bir fotokaged elektrofil ile tedavi edilir. Fazla miktarda probu çıkardıktan sonra, embriyo ilgilenilen elektrofili serbest bırakmak için ışığa maruz kalır [örneğin, HNE veya analogu, HNE (alkin)]. Aşağı akış analizi, verili/kullanıcı tanımlı bir zaman noktasında gerçekleştirilir. (C) Farklı lipit türevli elektrofillere (LDE) uygulanabilen Ht-PreLDE probunun tasarımı ve mekanizması. (D) Z-REX için negatif/teknik kontrol grupları. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
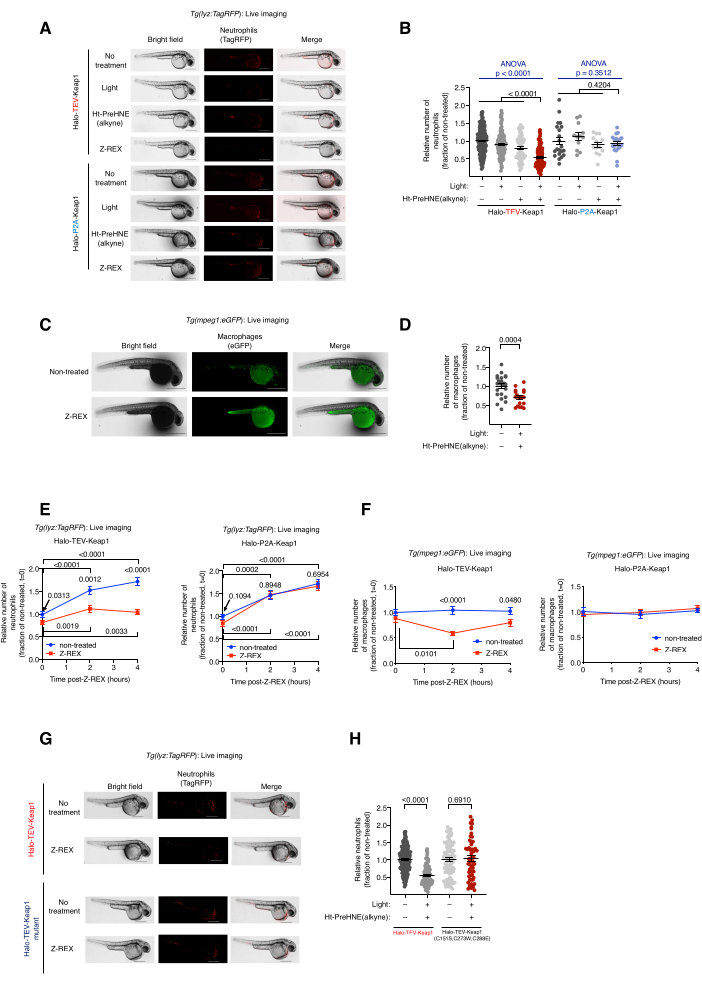
Resim 2: Z-REX'e tabi tutulan transgenik nötrofil/makrofaj muhabir balıklarının canlı görüntülemesi. Z-REX aracılı Keap1 HNEylation, nötrofil/makrofaj apoptozunu indükler. (A) Halo-TeV-Keap1 (füzyon yapısı) veya Halo-P2A-Keap1 (bölünmüş yapı) ifade eden ve negatif kontrol koşullarına maruz kalan Tg(lyz:TagRFP ) balıklarının temsili görüntüleri [tedavi yok, tek başına ışık veya tek başına Ht-PreHNE (alkin) veya Z-REX]. Embriyo yaşı: 36 hpf. (B) A'daki nötrofil seviyelerinin kantitasyonu. (C) Z-REX tedavisi olan veya olmayan Halo-TeV-Keap1'i ifade eden Tg(mpeg1:eGFP) balıklarının temsili görüntüleri. Embriyo yaşı: 34 hpf. (D) C'deki makrofaj seviyelerinin kantitasyonu. (E,F) Z-REX tedavisinden sonra (E) nötrofil ve (F) makrofaj seviyelerinin zaman boyu ölçümü. (G) HNE algılama yeteneğine sahip olmayan bir mutant olan Halo-TeV-Keap1 (WT) veya Halo-TeV-Keap1'i (C151S, C273W, C288E) ifade eden balıklardaki A'dakine benzer bir deney. (H) G'deki nötrofil seviyelerinin kantitasyonu. Ölçek çubukları: 500 μm. Tüm grafikler ortalama ± SEM ile sunulmuştur. p değerleri tek yönlü ANOVA (mavi) ve iki kuyruklu Student t-testi (siyah) ile hesaplanmıştır. Bu rakam Poganik ve ark.7'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: Biotin pull-down testi. Halo-TeV-Keap1-2XHA veya Halo-2XHA-P2A-Keap1-2XHA eksprese eden WT embriyoları Z-REX veya ilgili negatif kontrol koşulları ile tedavi edildi (bu durumda prob tedavisi yok). Hasattan sonra, embriyolar lize edildi ve biyotin aşağı çekme testinden önce TeV proteaz ile tedavi edildi. Sonuçlar batı lekelenmesi ile analiz edildi. Bu rakam Huang ve arkadaşlarından değiştirilmiştir. Z-REX: Reaktif elektrofilleri dokuya özgü veya her yerde ifade edilen spesifik proteinlere çobanlık yapmak ve larva balıklarında ortaya çıkan fonksiyonel elektrofil kaynaklı redoks tepkilerini kaydetmek. Bu rakam Huang ve arkadaşlarından değiştirilmiştir.11. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
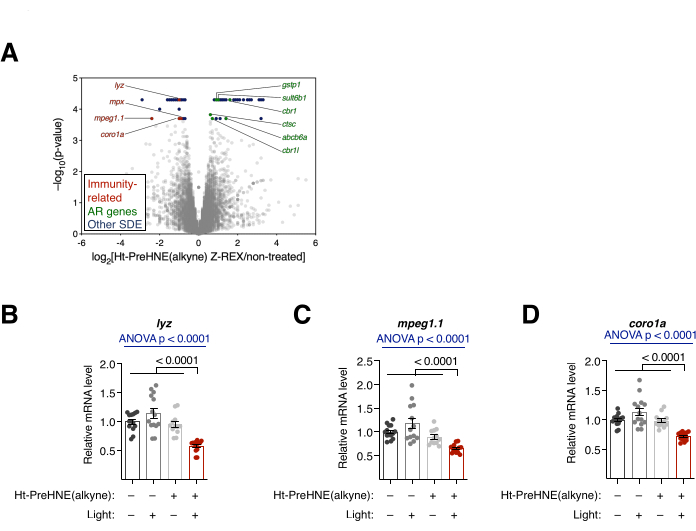
Şekil 4: Transkripsiyonel analiz. (A) Z-REX-ile tedavi edilen embriyoların RNA-seq sonuçları. İstatistiksel olarak anlamlı diferansiyel olarak eksprese edilen (SDE) genler vurgulanmıştır. Bağışıklık ile ilişkili SDE genleri kırmızı renktedir. Antioksidan yanıt (AR) ile ilişkili genler yeşil renktedir. Diğer SDE genleri mavi renklidir. Tüm p değerleri CuffDiff ile hesaplandı. (B-D) A: (B) lyz, (C) mpeg1.1 ve (D) coro1a'dan üç immünite ile ilişkili SDE geni qRT-PCR ile daha fazla analiz edildi ve sadece Z-REX ile tedavi edilen embriyolar bu transkriptlerin baskılandığını gösterdi. Tüm grafikler ortalama ± SEM ile sunulmuştur. p değerleri tek yönlü ANOVA (mavi) ve iki kuyruklu Student t-testi (siyah) ile hesaplanmıştır. Bu rakam Poganik ve ark.7'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
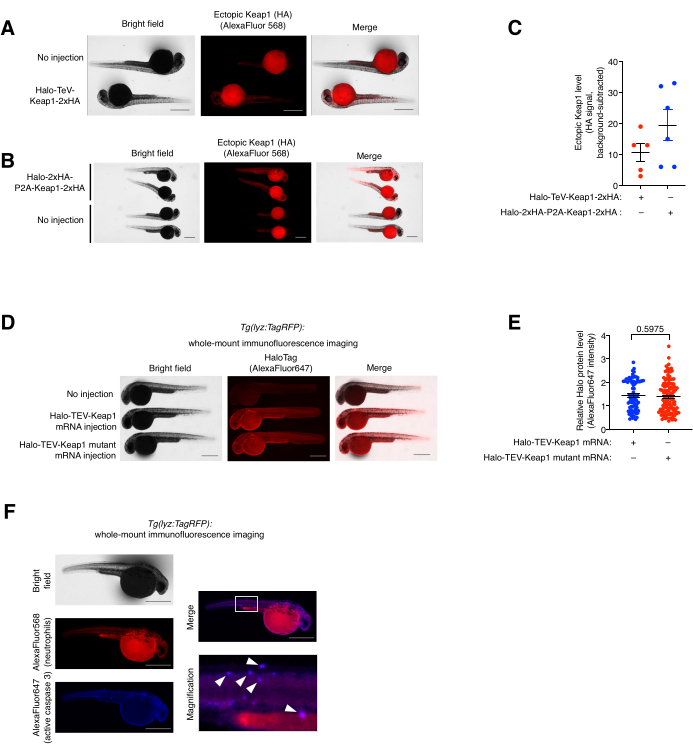
Şekil 5: Tam montajlı immünofloresan boyama testi . (A,B) (A) Halo-TeV-Keap1-2xHA veya (B) Anti-HA ile immün boyalı Halo-2xHA-P2A-Keap1-2xHA eksprese eden embriyoların temsili görüntüleri ve AlexaFluor568 ile konjuge edilmiş sekonder antikor. mRNA enjekte edilen balıklar, yaş uyumlu enjekte edilmemiş balıklarla karşılaştırıldı. (C) (A,B)'deki anti-HA sinyalinin nicelleştirilmesi. (D) Halo-TeV-Keap1 (WT) veya Halo-TeV-Keap1 (C151S, C273W, C288E) eksprese eden embriyoların anti-Halo ve AlexaFluor647 ile konjuge edilmiş sekonder antikor ile immün boyanmış temsili görüntüleri. mRNA enjekte edilen balıklar, yaş uyumlu enjekte edilmemiş balıklarla karşılaştırıldı. (E) Anti-Halo sinyalinin D cinsinden nicelleştirilmesi. p değerleri iki kuyruklu Student t-testi ile hesaplandı. (F) Z-REX'e maruz kalan Tg (lyz: TagRFP) embriyoları, anti-RFP ve anti-aktif Kaspaz 3 ve ilgili florofor konjuge sekonder antikorlarla birlikte immünoboya tabi tutuldu. Beyaz kutu büyütülmüş alanı işaretler. Beyaz oklar, nötrofillerin ve aktif Kaspaz 3'ün kolokalizasyonlarını gösterir. Ölçek çubukları: 500 μm. Tüm grafikler ortalama ± SEM ile sunulmuştur. Bu rakam Poganik ve ark.7'den değiştirilmiştir. ve Huang ve ark.11. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Ek Tablo 1: Bu çalışmada kullanılan tamponların listesi. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde açıklanan Z-REX, canlı balıklarda elektrofil-hedef çifti araştırması ve sinyal yolu dekonvolüsyonu için sağlam bir strateji göstermektedir. Yakınlığa yönelik dağıtım, elektrofilik bileşik tedavisinin dozajını ve mekansal kontrolünü sağlar. Konuşlandırılan elektrofilin suprafizyolojik konsantrasyonlarının sıklıkla hedef dışı sorunlara yol açtığı geleneksel bolus dozlama yöntemlerinden farklı olarak, sisteme salınan nispeten küçük elektrofil miktarı Z-REX'i büyük ölçüde invaziv olmayan hale getirir. Zebra balığı embriyolarında 0.1-6 μM Ht-PreHNE (alkin) kullandık ve sonuçlar tedavinin embriyo gelişimine zararlı olmadığını gösterdi11.
Z-REX prosedürü genellikle kültürlenmiş hücrelerde elektrofil algılayıcı proteinleri taramak / incelemek için kullanılan bir teknik olan T-REX'ten daha uzundur. Deneyin amacının elektrofil-hedef etkileşimlerini taramak olduğunu varsayalım; öncelikle kültürlenmiş hücrelerde T-REX ile kapsamlı tarama yapılmasını ve in vivo validasyon ve fenotipik/yolak analizi için Z-REX kullanılmasını öneriyoruz. Hücre kültürü ile karşılaştırıldığında, Z-REX gerçekleştirmek için gerekenler, T-REX'in gerektirdiği biyokimyasal deneysel becerilere ek olarak temel balık yetiştiriciliği teknikleridir. Z-REX için tipik bir zaman dilimi (balık geçişinden ışığa indüklenebilir elektrofil dağıtımına kadar) 2-3 gündür, bu da transfekte canlı hücreler üzerinde bir T-REX deneyi için tipik süreden 1 günden fazla değildir. Fenotipik analiz için canlı görüntüleme, ışık aydınlatmasından 2-10 saat sonra yapılabilir; aşağı çekme testi için biotin-azide ile tıklama bağlantısı 3 gün sürer; Transkripsiyonel yanıtın tahlili için qRT-PCR 3 gün sürer; IF boyama 5 gün sürer. Bu adımlar kabaca hücre kültürü eşdeğerlerine benzer, ancak verilerin yorumlanması balık fizyolojisi ve muhabir suşlarının anlaşılmasını gerektirir.
Çok değişkenli bir prosedür12 olarak, Z-REX'in sonuçlardaki belirsizlikleri dışlaması için birkaç kontrol grubu gereklidir (Şekil 1D). Yaygın kontrol grupları şunlardır: (1) Yalnızca DMSO/araç tedavisi; (2) prob tedavisi, ancak ışık aydınlatması olmadan; (3) ışık aydınlatması, ancak prob tedavisi olmadan; (4) Halo ve POI'nin ayrı ayrı ifade edildiği, böylece yakınlık dağıtımının ablatlandığı P2A-bölünmüş yapı; ve (5) önceki çalışmalarda kullandığımız Akt3 (C119S)6 ve Keap1 (C151S, C273W, C288E)5 gibi elektrofil algılama kalıntıları mutasyona uğramış / mutasyona uğramış hipomorfik mutantlar.
Aşağı akış testleri batı leke analizini içeriyorsa, hasattan önce deyolking yapılmalıdır. Yumurta sarısı proteinleri, lizat konsantrasyonu değerlendirmelerinin doğruluğunu azaltır ve spesifik olmayan antikorlara bağlanabilir. Canlı balık görüntüleme veya tam montajlı IF boyama yaparken, yumurta sarısı kesesinde, muhtemelen yumurta sarısı kesesindeki otofloresan proteinlerden veya antikorların kendilerinin spesifik olmayan bağlanmasından kaynaklanan spesifik olmayan floresan sinyalleri de gözlemledik. Otofloresan sinyali sinyale müdahale ederse, yumurta sarısı kesesini nicelemeden çıkarmanızı veya farklı bölgeleri ayrı ayrı ölçmenizi öneririz. Dekorinasyon, canlı balık görüntüleme ve tüm montajlı IF boyama testi için gereklidir. Koryon görüntülemeye ve daha sonra nicelleştirme / hücre sayımına müdahale edebilir. Bununla birlikte, dekorinasyon sadece 1 dpf'den daha eski embriyolar için geçerlidir; blastülasyon/gastrulasyon/segmentasyon aşamalarındaki genç embriyolar dekoryona edilemeyecek kadar kırılgandır.
Burada açıklanan Z-REX protokolü, mRNA güdümlü ektopik POI ekspresyonuna dayanmaktadır. Prosedür, transgenik balık hatlarının kullanılmasına/üretilmesine kıyasla hızlıdır. mRNA güdümlü ekspresyon her yerde bulunur ve geçicidir ve bu protokolde kullanılan mRNA'lar için en az 2 gün sürer. Bununla birlikte, ifade süresinin diğer durumlarda değişmesi muhtemeldir. Bu nedenle, bu yaklaşım, birkaç yüksek verimli / yüksek içerikli tahlille uyumlu, belirli bir elektrofil etiketleme olayının etkilerine yönelik hızlı ve daha küresel bir araştırma penceresi sağlar. Belirli dokularda stabil Halo-POI ekspresyonuna sahip transgenik çizgiler de Z-REX11 ile uyumludur. Bu tür çizgiler, daha kesin bir soru sorulması gerektiğinde, örneğin belirli bir organdaki bir fenotipin hücre kültürü verilerinden tahmin edildiğinde veya mRNA enjeksiyon deneylerinden tarama, belirli bir organın bir elektrofil etiketleme olayına duyarlı olduğunu öngördüğünde en iyi şekilde kullanılır. Z-REX yoluyla kalbe özgü bir antioksidan yanıt indüksiyonu, önceki yayınımız11'de Tg (gstp1: GFP; DsRed-P2A-myl7: Halo-TeV-Keap1) balıkları kullanılarak gösterilmiştir. Z-REX'i 2 dpf'den daha yaşlı transgenik balıklarda da yapmak mümkün olabilir.
Açıklamalar
Keşfi REX teknolojileri tarafından sağlanan izoforma özgü küçük moleküllü kinaz inhibitörleri patent başvurusu için dosyalanmıştır
Teşekkürler
Finansman: Novartis FreeNovation, NCCR ve EPFL.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
Referanslar
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır