Method Article
유충 제브라피쉬의 표적 신호 반응 모니터링 - Z-REX는 친전자성 약물 및 대사 산물의 정확한 메커니즘을 밝힙니다.
요약
반응성 친전자필 및 산화제(Z-REX)를 표적으로 하는 제브라피쉬는 반응성 소분자 신호 조사를 위한 화학 생물학 기반 방법입니다. 이 기술은 다양한 발달 단계의 활어에 적용 할 수 있습니다. 여기에서는 신호 전달 경로 분석을 위해 제브라피쉬의 표준 분석과 Z-REX를 결합합니다.
초록
반응성 대사 산물 및 관련 친전자성 약물은 연구하기 가장 어려운 소분자 중 하나입니다. 이러한 분자의 작용 방식(MOA)을 해체하기 위한 기존의 접근 방식은 특정 반응성 종을 과량으로 사용하여 실험 표본의 대량 처리를 활용합니다. 이 접근법에서, 친전성체의 높은 반응성은 시간 및 상황에 따라 방식으로 프로테옴의 비차별적 표지를 렌더링합니다. 산화 환원에 민감한 단백질과 공정은 간접적으로 그리고 종종 돌이킬 수 없는 영향을 받을 수 있습니다. 무수한 잠재적 표적과 간접적인 2차 효과를 배경으로 표현형을 특정 표적 참여에 연결하는 것은 여전히 복잡한 작업으로 남아 있습니다. 반응성 친전자필 및 산화제(Z-REX)를 표적으로 하는 제브라피쉬(유충 제브라피쉬에 사용하도록 개조된 주문형 반응성 친전자필 전달 플랫폼)는 교란되지 않은 활어 배아의 특정 관심 단백질(POI)에 친전자성을 전달하도록 설계되었습니다. 이 기술의 주요 특징은 낮은 수준의 침습성과 용량, 화학형 및 시공간적으로 제어되는 정밀 친전자성 전달을 포함합니다. 따라서 고유한 제어 제품군과 함께 이 기술은 반응성 친전자성 및 다면발현 친전자성 약물에 대한 동물의 통제되지 않은 대량 노출 후 관찰되는 표적 이탈 효과 및 전신 독성을 회피합니다. 연구자들은 Z-REX를 활용하여 온전한 살아있는 동물의 거의 생리학적 조건에서 특정 POI와의 특정 반응성 리간드 결합의 결과로 개별 스트레스 반응 및 신호 출력이 어떻게 변경되는지 이해하는 발판을 마련할 수 있습니다.
서문
무수히 많은 세포 신호 전달 사건은 작은 반응성 분자(세포에서 내인성으로 생성되거나 약물과 같은 생체이물/이종대사산물)와 단백질 표적 간의 반응을 포함합니다. 많은 경우에, 이러한 공유 결합 이벤트의 화학량론적 수준은 세포 반응을 촉발할 수 있고, 예를 들어, 발달, 대사, 세포자멸사 및/또는 면역 반응의 변화를 유도할 수 있다1. 그러나 특정 결합 이벤트를 표현형 결과와 연결하여 작용 방식(MOA)을 해체하는 것은 어려운 것으로 입증되었습니다. 고농도의 반응성 종을 도입하는 전통적인 볼루스 투여법은 종종 다수의 단백질을 변형시킬 뿐만 아니라 모델 유기체에 과도한 독성을 초래한다2. 이러한 조건은 이상적이지 않습니다. T-REX(표적화 가능한 반응성 친전필 및 산화제)3라고 하는 기본 세포 맥락에서 정밀하게 국소화된 친전자필 전달을 사용하여 세포 배양에서 이러한 문제를 해결하기 위한 방법이 개발되었습니다. 그 사이에 초점은 전체 유기체에 대한 실험으로 바뀌었고, 이를 통해 형질전환되지 않은 세포의 특정 세포 맥락에서 단백질을 연구할 수 있는 기회를 얻었습니다. 따라서 우리는 Danio rerio 배아 모델을 포함한 여러 모델과 호환되도록 기술을 확장했습니다. 여기에서는 Z-REX(반응성 친전필 및 산화제를 표적으로 하는 제브라피쉬)를 제시합니다(그림 1).
Z-REX를 이해하기 위해 이 기사에서는 먼저 REX 기술과 기본 개념을 제시합니다. 핵심적으로, 이러한 기술은 자연 친전성이 시공간 정밀도로 생체 내에서 국부적으로 생성되는 방식을 모방하여 내인성 생리학적 반응성 친전자성 종(RES) 신호 전달을 모델링합니다. 관심 단백질(POI)은 Halo에 대한 융합 구조로 표현됩니다. 후자는 광케이지 RES를 포함하는 조직 투과성 및 불활성 프로브를 1:1 화학량론에 고정합니다. 이러한 내인성 RES 중 하나는 4-하이드록시노네날(HNE)이며, 이는 프로브 Ht-PreHNE에서 광케이지됩니다. 많은 경우에, 우리는 HNE와 본질적으로 동일한 생물학적 특성을 갖지만 클릭 화학에 의해 라벨링될 수 있는 HNE의 알킨 기능화 버전[즉, HNE(알킨)]을 사용합니다. Halo와의 반응성을 위해 클로로알칸으로도 기능화된 프로브를 Ht-PreHNE(알킨)라고 합니다. 이렇게 형성된 Halo-POI 융합 및 프로브의 복합체는 UV 광을 조사할 때 융합된 POI에 RES의 근위 전달을 허용합니다. POI가 유리된 RES와 빠르게 반응하면 결과적으로 POI와 RES의 공유 결합 라벨링을 통해 동역학적으로 특권이 있는 시스테인을 식별할 수 있습니다.
Z-REX는 앞서 언급한 REX 기술의 장점을 활용하여 활어의 특정 신호 전달 경로를 연구하는 데 광범위하게 적용합니다. 이 프로토콜은 제브라피쉬(D. rerio)에 최적화되어 있는데, 이는 제브라피쉬가 발달 중에 투명하고 유전적으로 다루기 쉬운 척추동물 유기체이기 때문에 REX 기술과 같은 광화학/유전 기술에 이상적입니다. 그럼에도 불구하고, 유사한 전략은 유전적으로 다루기 쉬운 다른 어종에서도 잘 작동할 가능성이 높은데, 그 이유는 이 방법의 광범위한 적용 가능성이 지질 유래 친전자성(LDE) 전달의 유사 분자 내 메커니즘 때문이기 때문입니다. 실제로, 물고기는 발달에 눈에 띄는 영향 없이 최소 48시간 동안 Z-REX 광변성 친전성[예: Ht-PreHNE(알킨)]으로 처리할 수 있기 때문에 이 절차는 생체 적합성이 매우 높습니다. 유사한 프로토콜이 예쁜꼬마선충 4,5에서 기능합니다.
이 프로토콜은 먼저 수정 후 1-1.5일(dpf)에 배아 제브라피쉬 모델에서 비천연 Halo-POI 융합 구조의 일시적인 발현을 생성하기 위한 mRNA 주입의 사용을 설명합니다. 그 결과 특정 조직이나 지역이 아닌 물고기 내의 대부분의 세포(이하 '유비쿼터스'라고 함)에서 이소성 단백질이 발현됩니다. 그러나 데이터는 특정 경우에 세포 특이적 효과가 관찰될 수 있음을 보여줍니다. 주입 후, 배아는 수정 후 최대 30.5시간(hpf) 동안 프로브의 저농도[0.3-5μM Ht-PreHNE(알킨)]와 함께 배양됩니다. 그런 다음 사용자가 지정한 시간에 2-5분 동안 광경화하여 물고기 내 POI에 RES를 전달합니다. RES의 광융합 후, 다양한 다운스트림 표현형 분석이 다음 2-10시간 동안 수행될 수 있습니다: 1) 리포터 라인의 라이브 이미징(그림 2A); 2) 웨스턴 블롯 분석에 의한 표적 표지 평가(그림 3); 3) 전사체 분석(도 4); 또는 4) 전체 마운트 면역 형광 (그림 5).
리포터 라인의 라이브 이미징의 예로, Z-REX는 물고기 라인의 라이브 이미징, Tg(lyz:TagRFP) 및 Tg(mpeg1:eGFP)와 함께 시연되어 특정 친전자성 센서 POI(즉, Keap1)의 RES 변형이 물고기의 다른 세포에 관찰 가능한 영향 없이 각각 호중구 및 대식세포 수준을 각각 감소시키는 방법을 측정합니다. 그러나 우리는 이전에 T-REX 연구의 POI 표지 및 결과적 경로 신호 전달이 Akt3 6, Keap17 및 Ube2v26과 같은 여러 단백질에 대해 Z-REX를 사용하여 재현될 수 있음을 보여주었습니다. 전반적으로 Z-REX를 통해 과학자들은 여러 복잡한 산화 환원 경로의 맥락에서 RES에 의한 POI의 공유 변형 결과를 연구할 수 있습니다. 이 기술은 상황에 맞는 전체 동물 모델에서 공유 약물 설계 및 새로운 약물 메커니즘을 위한 표적과 기능적 잔류물을 정확히 찾아낼 준비가 되어 있습니다.
프로토콜
미국 코넬 대학교의 제브라피쉬 사육 및 취급 절차는 미국 국립보건원(NIH)의 지침에 따라 수행되었으며 IACUC(Institutional Animal Care and Use Committee)의 승인을 받았습니다. 스위스 연방 공과 대학 로잔 (EPFL, 스위스)의 제브라 피쉬 부서에서 제브라 피쉬 사육 및 취급 절차는 동물 복지법 SR 455 및 동물 복지 조례 SR 455.1에 따라 수행되었으며 주 수의사 승인 VD-H23이 있습니다.
참고: 이 프로토콜에서는 Halo-TeV-Keap1을 발현하는 Tg (lyz:TagRFP ) 및 Tg(mpeg1:EGFP) 피쉬 라인을 사용하여 Z-REX를 시연합니다. 이 방법은 다른 관심 단백질, 형질전환 리포터 낚싯줄 및 다운스트림 생물학적 분석으로 확장될 수 있습니다. 본 연구에 사용된 완충액에 대해서는 보충표 1 을 참조한다. 모든 시약, 기구, 장비, 항체, 플라스미드, 제브라피쉬 균주 및 장비는 재료 표에 나열되어 있습니다.
1. mRNA 준비
- mMessage mMachine SP6 in vitro transcription kit를 사용하여 Halo-TeV-Keap1-2xHA 및 Halo-2xHA-P2A-Keap1-2xHA mRNA를 준비합니다.
참고: 제조업체의 지침에 따라 각 mRNA에 대해 40μL 스케일 반응을 수행합니다. mRNA 펠릿을 뉴클레아제가 없는 물 10μL에 재용해합니다. - mRNA 품질을 평가하고 마이크로볼륨 분광광도계 및 아가로스 겔 전기영동으로 농도를 측정합니다. 좋은 품질의 mRNA는 약2.0 이상의 A 260/A280 비율을 가져야 합니다.
- 뉴클레아제가 없는 물로 mRNA를 1-1.5 mg/mL로 희석합니다.
- mRNA 용액을 분취하고(튜브당 1-2 μL), 분취액을 -80°C에서 보관한다.
2. 어류 배아 생산
- 옵션 1 : 야생형 (WT) 어류 배아 생산.
- 10개의 개별 수조에 10쌍의 물고기 횡단쌍을 설치하고, 각 수조에는 수컷과 암컷 부모 물고기 사이에 칸막이가 있습니다.
참고: 총 10개의 교차 쌍은 일반적으로 분석을 위한 충분한 수의 배아를 제공합니다. 교배 쌍의 수는 실험 설계/필요 및 부모 물고기의 번식력에 따라 조정할 수 있습니다. - 다음날 아침, 인젝터를 설치한 후 5개의 탱크에 있는 칸막이를 제거합니다. 물고기가 짝짓기를 할 때까지 30분 동안 기다립니다.
- 부모 물고기를 다른 수조로 옮기고 수조 물을 여과기에 통과시켜 배아를 채취한 다음 여과기에서 배아를 10cm 페트리 접시로 헹굽니다. 이 배아는 첫 번째 주사에 사용됩니다.
참고: 특정 배치의 난자 품질이 좋지 않은 경우(예: 단백질 응집으로 인해 난자가 불투명한 경우) 다른 배아와 함께 풀링하지 마십시오. - (선택 사항) 다음 주입을 위해 다른 5개의 탱크에서 2.1.2-2.1.3단계에 설명된 것과 유사한 절차를 수행합니다.
참고: 배아 간의 연령 차이를 최소화하기 위해 한 번만 주사하는 것이 가장 좋습니다. 그러나 한 로트에 주입할 수 있는 것보다 더 많은 배아가 필요한 경우 mRNA 주입 중에 배아가 1-4-세포 단계에 남아 있도록 두 차례의 주입을 수행하는 것이 좋습니다. 주입 라운드 수는 작업자의 주입 기술 및 실험 설계에 따라 조정할 수 있습니다. 그러나 2 시간 이내에 전체 절차 (첫 번째 분배기 제거에서 마지막 배아 주입까지)를 수행하는 것이 좋습니다. 배아에 따른 연령 차이가 크면 실험 결과의 신뢰성과 재현성이 손상될 수 있습니다.
- 10개의 개별 수조에 10쌍의 물고기 횡단쌍을 설치하고, 각 수조에는 수컷과 암컷 부모 물고기 사이에 칸막이가 있습니다.
- 옵션 2: 이형접합체 형질전환 호중구/대식세포 리포터 물고기 배아 생산.
- 10개의 개별 수조에 10개의 어종 교차 쌍을 설정하고 각 수조에는 수컷과 암컷 어미 어류 사이에 WT 물고기 대 Tg( lyz:TagRFP) 또는 WT 물고기 대 Tg(mpeg1:eGFP)와 같은 구분선이 삽입됩니다.
참고: 동형접합 리포터 물고기는 이형접합체 물고기에 비해 더 높은 형광 신호를 나타내므로 다운스트림 형광 판독값에 영향을 미칠 수 있는 이형접합 형질전환 물고기 사이의 교배를 피하십시오. 형질전환 리포터 라인과 WT 배아는 이미징 시 쉽게 구별할 수 있습니다. 동일한 풀에 WT와 이형 접합 배아가 혼합되어 있는 것은 문제가 되지 않습니다. lyz:TagRFP 는 호중구를 보고하고 mpeg:eGFP는 대식세포를 보고합니다. 이 프로토콜은 다른 리포터 낚싯줄에도 적용할 수 있습니다. - 2.1.2-2.1.4단계를 따릅니다.
- 10개의 개별 수조에 10개의 어종 교차 쌍을 설정하고 각 수조에는 수컷과 암컷 어미 어류 사이에 WT 물고기 대 Tg( lyz:TagRFP) 또는 WT 물고기 대 Tg(mpeg1:eGFP)와 같은 구분선이 삽입됩니다.
3. 마이크로 인젝터 설정
- 공기 공급원을 켜고 배압을 0.2-0.5psi로 설정하고 사출 압력을 25-30psi로 설정합니다. 표시된 특정 압력 범위가 일반적으로 권장됩니다.
알림: 물고기 매체가 바늘로 역류하는 것을 방지하기 위해 안정적인 배압을 갖는 것이 중요합니다. 3.8단계에서 주입량을 보정할 때 주입 시간만 변경해야 합니다. 다음 단계에서 사출 압력을 변경하지 마십시오. 낮은 주입 압력은 표면 및 계면 장력으로 인한 주입 실패로 이어질 수 있는 반면, 높은 주입 압력은 배아를 손상시킬 수 있습니다. - RNase 오염 제거 용액으로 장비와 주입 플랫폼을 청소하십시오.
참고: mRNA를 분해하는 RNase는 작업자 또는 장비에서 나올 수 있습니다. 실험 전에 청소를 수행하고 장갑을 착용해야합니다. - (선택 사항) mRNA와 모르폴리노를 함께 주입하는 경우 0.2mL 튜브에서 둘을 미리 혼합합니다.
참고: Z-REX는 250-1500ng/μL 농도의 Halo-TeV-Keap1-2xHA mRNA 용액을 사용하여 잘 작동합니다. 제브라피쉬에도 여러 모르폴리노가 사용되었으며, 최적의 농도가 보고되었다7. 미공개 염기서열을 가진 모르폴리노를 사용하는 경우, 작업자는 Z-REX에서 모르폴리노를 사용하기 전에 먼저 모르폴리노의 독성 및 유전자 녹다운 효율을 평가해야 합니다. - 1-2 μL의 mRNA(및/또는 해당되는 경우 모르폴리노7)를 마이크로 로더 피펫 팁이 있는 주사 바늘에 옮깁니다.
알림: Flaming/Brown 마이크로피펫 풀러로 바늘을 준비하는 경우 설정은 다음과 같습니다. 열: 520 단위; 잡아당기기 힘: 60 단위; 속도: 70 단위; 지연: 155 단위; 압력: 550 단위; 경사로: 530 단위. - 미세주입 매니퓰레이터에 바늘을 설치합니다.
알림: 공기 공급원의 배압은 mRNA(/morpholino) 용액을 바늘 끝으로 밀어 넣어야 합니다. - 날카로운 집게나 면도날을 사용하여 바늘 끝을 부러뜨리고 주사하기에 적합한 구멍을 만듭니다.
- 바늘 끝을 스테이지 마이크로미터의 미네랄 오일에 담그십시오.
- 팁의 기포를 제거하기 위해 두세 개의 주입 펄스를 적용합니다.
- 주입 시간을 변경하여 입자 크기를 2nL로 보정합니다.
참고: 이것은 혈구계에 놓인 미네랄 오일(난황낭의 점도를 모방함)에 주입하여 수행하는 것이 가장 좋습니다. 현미경을 사용하여 혈구계의 격자선을 사용하여 주입 중에 형성된 액적의 크기를 추정하고 그에 따라 주입 시간을 조정합니다. 페놀 레드 염료가 때때로 사용되지만, 여기에 설명 된 mRNA 주입 절차에서 그 필요성은 관찰되지 않았다.
4. 미세주입
- 주입 플레이트에 신선한 10% Hank's balanced salt solution(HBSS) 배지를 채우고 플레이트의 홈에 있는 배아를 뭉툭한 집게로 맞춥니다.
참고: 주입 플레이트는 10% HBSS 배지에서 2% 아가로스로 제조됩니다. 홈은 플라스틱 몰드를 사용하여 형성됩니다. - 주사판의 10% HBSS 배지에 바늘 끝을 담그십시오.
- 팁의 기포를 제거하기 위해 두세 개의 주입 펄스를 적용합니다.
- 각 주사에 대해 한 번의 움직임으로 융모막과 난황낭을 관통하고 주입 펄스를 적용합니다. 이 주입된 액체는 주사 직후 난황낭 내에 작은 스페로이드로 볼 수 있습니다. 이 작은 스페로이드는 비교적 빠르게 소멸됩니다. 충분한 수의 주입된 배아가 얻어질 때까지 다른 배아에 대해 이 단계를 반복합니다.
참고: 배아(주사 및 비주사 모두)의 생존율은 일반적으로 50%-90%입니다. 각 대조군/실험군에 필요한 배아 수의 두 배를 주입하는 것을 목표로 합니다. 비오틴 풀다운 분석에서, 100-140개의 생존 가능한 배아가 각 조건에 대해 요구된다. qRT-PCR 분석에서, 5개의 생존 가능한 배아가 각 조건에 대해 권장된다. 활어 이미징 및 전체 마운트 면역형광 염색 분석을 위한 샘플 크기는 사용자 정의됩니다. 분석에서 좋은 통계적 검정력을 산출하기 위해 조건당 최소 20개의 생존 가능한 배아를 갖는 것이 좋습니다. - 주입된 배아를 신선한 10% HBSS 배지가 들어 있는 새로운 10cm 페트리 접시에 헹굽니다.
참고: 배아는 물병을 사용하여 홈에서 쉽게 헹굴 수 있습니다. - 주입되지 않은 배아를 다른 접시에 모으십시오.
참고: 주입되지 않은 배아는 필요에 따라 물고기의 건강, 기준 단백질 발현, 배경 형광 수준 등에 대한 품질 관리 역할을 할 수 있습니다. 주사 절차가 잘 작동하고 주입된 mRNA/모르폴리노가 배아에 치명적이지 않은 경우 주사된 배아와 주입되지 않은 배아는 유사한 생존력을 가져야 합니다.
5. 지렉스
- 주입된 배아를 실험 설정(즉, 대조군/실험군 수)에 따라 10cm 접시에 분배합니다.
- 적색광 조명이 있는 어두운 방에서 배지를 1μM Ht-PreHNE(알킨)가 있거나 없는 10% HBSS 30mL로 교체합니다.
참고: Ht-PreHNE(알킨)는 가벼운 불안정성 화합물입니다. 배아는 다음 단계에서 어둠 속에 보관해야합니다. - 배아를 어둠 속에서 28.5°C에서 배양한다.
- 30.5hpf의 어두운 방에서 배지를 새 30mL의 10% HBSS로 교체합니다.
알림: 매체를 교체할 때 기존 매체를 가능한 한 많이 제거하십시오. 이것은 배아에서 결합되지 않은/과량의 Ht-PreHNE(알킨)를 제거하는 데 중요합니다. - 배아를 28.5°C의 어두운 곳에서 30분 동안 배양합니다.
- 5.4-5.5단계를 두 번 더 반복합니다.
- UV l을 켭니다amp (365nm, 3mW/cm2) 5분 동안 예열하여 램프를 예열합니다.
알림: lamp 예열 단계는 5.8단계 이전에 수행해야 합니다. 난amp 전원을 켠 후 처음 몇 분 동안 더 낮거나 불안정합니다. 램프 전력은 정기적으로 UV 미터로 측정해야 합니다. - 32hpf에서 배아를 자외선에 노출시킵니다.
- 옵션 1: 활어 이미징, 전체 마운트 면역형광 염색, 겔 내 형광 분석(Cy5 아지드와 클릭 결합), RNA-seq 또는 qRT-PCR과 같은 다운스트림 판독의 경우 배아를 3분 동안 자외선에 노출시키고 30초마다 플레이트를 소용돌이치게 합니다.
- 옵션 2: 비오틴 풀다운 분석과 같은 다운스트림 판독의 경우 배아를 최대 5분(최소 3분) 동안 자외선에 노출시키고 30초마다 플레이트를 소용돌이치게 한 다음 플레이트를 얼음에서 1분 동안 냉각합니다.
참고: 다른 프로브를 사용하는 경우 주어진 광케이지 친전성 프로브 및 배치된 광원에 대한 광경화의 t1/2에 따라 광 노출 시간을 최적화해야 합니다. t1/2광경화는 공지된 절차(8)를 사용하여 결정될 수 있다. Ht-PreHNE(알킨)의 경우 t 1/2는 < 1분3입니다. 따라서 위에 표시된 시간으로 충분합니다.
6. 다운스트림 분석
- 옵션 1: 표현형 분석. 형질전환 호중구/대식세포 리포터의 실시간 이미징
피라인, Tg(lyz:TagRFP) 및 Tg(mpeg1:eGFP)(그림 2)- 4°C에서 10분 동안 배양하여 배아를 마취시킨다.
참고: 조건당 최소 20개의 생존 가능한 배아를 갖는 것이 좋습니다. - 접시에서 수정되지 않은/죽은 배아를 제거합니다.
참고: 수정되지 않은/죽은 배아는 흐리거나 투명하지 않으며 육안으로 식별할 수 있습니다. 사망률이 높으면 주사 절차를 다시 확인하거나 mRNA 또는 모르폴리노의 농도를 낮추십시오. - 날카로운 집게로 배아를 Dechorionate. 애벌레 물고기를 건드리지 않고 한 쌍의 집게로 chorion을 잡고 다른 한 쌍의 집게를 사용하여 chorion을 뜯어냅니다. 배아는 연약합니다. chorionation을 수행 할 때만 chorion을 만지십시오.
참고: 특히 초보자의 경우 탈모막 중에 일부 배아가 손상되는 것이 일반적입니다. 따라서 항상 필요한 최소값보다 더 많은 배아를 가지십시오. - 배아를 2% 아가로스 플레이트(10% HBSS 배지로 준비)에 장착하고 실체현미경(명시야 및 각 형광 채널)으로 배아를 이미지화합니다(그림 2A, C, G).
참고: Z-REX[Halo-TeV-Keap1-2xHA mRNA 주입과 Ht-PreHNE(알킨) 처리의 조합] 후, 호중구의 고갈(lyz:TagRFP)은 36hpf(Z-REX 후 4시간)에서 가장 유의한 반면, 대식세포의 감소(mpeg1:eGFP)는 34hpf(Z-REX 후 2시간)에서 가장 유의한 것으로 나타났습니다(그림 2E,F). 다른 리포터 라인, mRNA/모르폴리노 또는 프로브를 사용하는 경우 다른 시점을 사용할 수 있습니다. 노출 시간 및/또는 게인은 단일 세포 또는 원하는 특정(초)구조를 시각화하기 위해 최적화되어야 합니다. - ImageJ(NIH)로 각 물고기의 호중구/대식세포 수를 계산합니다(그림 2B, DF, H). ImageJ의 자유형 선택 도구를 사용하여 전체 물고기에 동그라미를 치고 최대값 찾기 옵션을 사용하여 형광 세포의 수를 세십시오.
- 4°C에서 10분 동안 배양하여 배아를 마취시킨다.
- 옵션 2: 타겟 라벨링 평가. 비오틴 아자이드-클릭 커플링 및 비오틴 풀다운 분석(그림 3)
- 4°C에서 배양하여 배아를 마취시킨다. 보통 10분 정도 걸립니다.
참고: 충분한 물고기 용해물을 얻으려면 각 조건에 대해 100-140개의 생존 가능한 배아가 필요합니다. - 접시에서 수정되지 않은/죽은 배아를 제거합니다.
- dechorionation 및 deyolking을 수행하십시오. 한 쌍의 날카로운 집게로 융모막을 잡고 다른 쌍의 집게를 사용하여 난황낭을 관통한 다음 융모막을 제거하면서 난황낭을 분리하여 난황 단백질이 나오도록 하여 두 가지 조작을 수행합니다.
참고: 이 단계에서 노른자 단백질을 제거하는 것이 중요합니다. 샘플에 풍부한 노른자 단백질은 이후 분석을 방해합니다. - 탈노른자 배아를 1.5mL 튜브에 옮깁니다.
참고: 플레이트를 소용돌이 제거된 배아의 중앙에 놓으면 수집이 용이합니다. 이 과정에서 더 가벼운 chorion 파편이 사라집니다. - 배아가 튜브 바닥에 가라앉은 후 상층액을 제거하고 식힌 HEPES 완충 식염수(pH 7.6) 1mL를 추가합니다.
- 6.2.5단계를 두 번 더 반복합니다.
- (선택 사항) 다음 단계를 즉시 진행하지 않으려는 경우 버퍼를 제거하고 샘플을 액체 질소에서 급속 동결한 다음 -80°C에서 보관합니다.
알림: 노른자 제거 생선 알갱이는 액체 질소에서 급속 냉동하고 -80 °C에서 보관할 수 있습니다. 급속 냉동 시료는 -80°C에서 최대 2주 동안 보관할 수 있습니다. - 용해 완충액에 생선 알갱이를 다시 현탁합니다.
참고: 용해 완충액(pH 7.6)은 50mM HEPES, 100mM NaCl, 1% Triton X-100, 0.3mM TCEP, 2x Roche cOmplete Mini EDTA가 없는 프로테아제 억제제 및 대두에서 추출한 0.1mg/mL 트립신 억제제로 구성됩니다. 한 배아는 약 2 μg의 용해물을 제공합니다. 120개의 배아마다 100μL의 용해 완충액을 사용합니다. 두 가지 Roche cOmplete Mini EDTA-free 프로테아제 억제제와 대두의 트립신 억제제를 사용 직전에 용해 완충액에 첨가해야 합니다. - 튜브에 20% v/v 지르코니아 비드를 추가합니다.
- 20초 동안 소용돌이, 액체 질소에서 플래시 동결, 37°C 수조에서 해동.
- 6.2.10단계를 두 번 더 반복합니다.
- 용액을 4°C에서 21,000 x g 에서 10분 동안 원심분리합니다.
- 상층액을 미리 냉각된 새 1.5mL 튜브로 옮깁니다.
- Bradford assay로 단백질 농도를 측정합니다.
- 용해물을 1mg/mL로 희석합니다.
- 각 조건에 대해 170μg의 용해물을 2mL 튜브에 옮깁니다.
- 6.2.16단계의 용해물을 0.2mg/mL TeV 프로테아제(S219V)와 혼합하고 37°C에서 30분 동안 용액을 배양합니다.
참고: TeV를 사용하지 않는 프로테아제 처리 그룹의 경우 용해물을 다른 그룹에서 사용되는 TeV 프로테아제 용액에 동일한 양의 용해 완충액과 혼합하기만 하면 됩니다. - 비오틴-아자이드 클릭 반응을 위한 10x 마스터 믹스를 준비합니다: 10% w/v SDS, 10mM CuSO4, 1mM Cu(TBTA), 1mM 비오틴-아지드 및 20mM TCEP.
알림: 6.2.19 단계 직전에 믹스에 TCEP를 추가합니다. - 8.5 μL의 t-BuOH와 17 μL의 10x 클릭 반응 마스터 믹스를 6.2.17 단계의 (TeV 프로테아제 분해) 용해물에 추가합니다. 와동하고, 원심분리하고, 용액을 37°C에서 15분 동안 인큐베이션한다.
- 또 다른 1 mM TCEP를 용액에 첨가한 다음, 와동시키고, 원심분리하고, 용액을 37°C에서 15분 동안 추가로 인큐베이션한다. 6.2.19-6.2.20 단계의 배양 시간은 총 30분입니다.
참고 : Cu (I)를 생성하기위한 환원 시약 인 TCEP의 보충 교재는 클릭 반응 효율을 향상시킵니다. - -20°C 에탄올 600μL를 각 튜브에 넣고 용액을 와동시키고 -80°C에서 밤새 배양합니다.
참고: 샘플은 -80°C에서 1주일 동안 보관할 수 있습니다. 그렇지 않은 경우 즉시 다음 단계를 진행하십시오. - 용액을 21,000 x g 에서 4°C에서 1시간 동안 원심분리합니다.
알림: 원심분리 후 튜브 바닥에 펠릿이 형성되어야 하며, 이는 원하는 분획입니다. - 상층액을 제거하고, -20°C의 에탄올 1 mL를 첨가하고, 와동하고, 용액을 4°C에서 21,000 x g 에서 10분 동안 원심분리한다.
- 6.2.23단계를 반복합니다.
- 상층액을 제거하고, -20°C의 아세톤 1 mL를 첨가하고, 와동하고, 용액을 4°C에서 21,000 x g 에서 10분 동안 원심분리한다.
- 상청액을 제거합니다. 과도한 잔류 아세톤이 증발하도록 허용하되 완전히 건조되지는 않습니다.
- 펠릿을 100μL의 재현탁 완충액(8% w/v 리튬 도데실 설페이트[LDS], 50mM HEPES 식염수 중 1mM EDTA, pH 7.6)에 재현탁하고 15초 동안 소용돌이치고 펠릿이 용해될 때까지 초음파 처리합니다.
- 용액을 실온(RT)에서 21,000 x g 에서 5분 동안 원심분리합니다.
- 상청액을 새로운 2mL 튜브로 옮기고 50mM HEPES 식염수, pH 7.6 1.5mL를 추가합니다.
참고: 이 단계에서 LDS의 최종 농도는 0.5%입니다. LDS 농도가 높을수록 풀다운 효율이 저하될 수 있습니다. 따라서, LDS 농도를 증가시키는 것은 비특이적 결합의 감소를 도울 수 있지만, 또한 풀다운의 효율을 감소시킬 수 있다. 따라서 이 단계에서 LDS 농도를 변경하지 않는 것이 좋습니다. - "입력" 시료 수집(그림 3): 1mg/mL 용해물 30μL를 새로운 1.5mL 튜브로 옮기고 6% β-메르캅토에탄올(BME)이 포함된 4x Laemmli 시료 완충액 10μL을 추가합니다. 용액을 급속 동결하고 -80°C에서 보관합니다.
- 베드 부피 스트렙타비딘 고용량 수지 100μL를 새 2mL 튜브로 옮깁니다. 50mM HEPES 식염수(pH 7.6)에 0.5% LDS 1mL를 넣고 RT에서 1,500 x g 에서 2분 동안 원심분리하고 상층액을 제거합니다. 50mM HEPES 식염수(pH 7.6)에 0.5% LDS 1mL를 더 넣어 세척을 반복합니다.
- 단계 6.2.29의 용액을 단계 6.2.31의 사전 세척된 스트렙타비딘 고용량 수지가 들어 있는 튜브로 옮기고 RT에서 4-6시간 동안 엔드 오버 엔드 믹서에서 용액을 인큐베이션합니다.
- 혼합물을 RT에서 1,500 x g 에서 2분 동안 원심분리하고, 30 μL의 상청액을 취하고, 10 μL의 4x Laemmli와 혼합합니다.amp"유동" 샘플에 대해 6% BME를 함유하는 버퍼. 그런 다음 나머지 상층액을 제거합니다.
참고: "Flowthrough" 샘플은 스트렙타비딘 풀다운 효율을 확인하기 위해 웨스턴 블로팅으로 분석할 수 있습니다. 결합되지 않은 단백질을 씻어내기 위해 가능한 한 많은 상청액을 제거하는 것이 중요합니다. 먼저 P-1000 피펫을 사용하여 대부분의 상층액을 제거한 다음 겔 로딩 팁이 있는 P-20 피펫을 사용하여 나머지 상층액을 제거합니다. - 50mM HEPES 식염수(pH 7.6)에 0.5% LDS 1mL를 수지에 첨가하고 혼합물을 RT에서 30분 동안 종단 회전으로 인큐베이션합니다.
- 혼합물을 RT에서 1,500 x g 에서 2분 동안 원심분리하고, 상층액을 제거한다.
참고: 일반적으로 0.5% LDS는 대부분의 비특이적 결합 단백질을 제거하기에 충분합니다. 이후 분석에서 비특이적 결합 신호가 여전히 나타나는 경우 세척 완충액 내 LDS 농도를 증가시킬 수 있습니다. - 6.2.34-6.2.35단계를 두 번 더 반복합니다.
- 40μL의 2x Laemmli 샘플 버퍼(6% BME가 포함된 버퍼)를 수지에 추가합니다.
- 혼합물을 98°C에서 5분 동안 인큐베이션하여 결합된 단백질을 용출합니다.
- 혼합물을 실온에서 21,000 x g 에서 5분 동안 원심분리하고 상층액을 새로운 1.5mL 튜브로 옮깁니다. 이것은 "용리" 샘플입니다.
참고: 6.2.38단계의 수지가 포함된 용액을 겔에 직접 로드하면 SDS-PAGE 분석에 영향을 미칠 수 있습니다. - 20 μL를 10-레인 10% 폴리아크릴아미드 겔의 각 웰에 넣고 겔 전기영동을 실행합니다.
알림: 더 낮은 볼륨에서 젤을 실행하십시오.tage(120V) 염료 전면이 분해 젤에 도달할 때까지 전압을 170V로 변경합니다. 염료 전면이 나온 후 프로그램을 중지합니다. - 하우스키핑 단백질을 검출하는 anti-HA, anti-Halo 또는 기타 항체로 웨스턴 블로팅을 수행합니다(그림 3).
- 4°C에서 배양하여 배아를 마취시킨다. 보통 10분 정도 걸립니다.
- 옵션 3: 전사체 분석. RNA-seq 및 qRT-PCR(그림 4)
참고: 이 분석을 위해 서로 15분 이내에 놓인 배아를 사용하는 것이 좋습니다. 배아의 연령 차이는 분석 결과에 큰 영향을 미칩니다.- Z-REX 후 2시간 동안 4°C에서 10분 동안 배양하여 배아를 마취합니다.
- 날카로운 집게로 dechorionation을 수행하십시오 (6.1.3 단계).
- (선택 사항) 서로 다른 세그먼트를 개별적으로 분석해야 하는 경우 집게로 분할(예: 머리와 꼬리 분리)을 수행합니다.
- 전체 배아에서 RNA를 추출하는 경우 3-5개의 배아를 1.5mL 튜브에 옮깁니다. 머리 또는 꼬리에서 RNA를 추출하는 경우 10-12개의 해부된 세그먼트를 1.5mL 튜브에 옮깁니다.
참고: 3-5개의 생물학적 복제물로 실험을 수행하는 것이 좋습니다. - 1mL의 TRIzol 시약과 유리 비드를 튜브에 추가합니다.
참고: 유리 구슬은 RNA 추출을 위해 지르코니아 구슬보다 더 잘 작동하는 것으로 밝혀졌습니다. - 혼합물을 30 초 동안 소용돌이 치십시오.
참고: 다음 단계를 즉시 진행하지 않으면 용액을 -80°C에서 1-3주 동안 보관할 수 있습니다. - 제조업체의 지침에 따라 RNA를 추출합니다.
- 마이크로볼륨 분광광도계 및 아가로스 겔 전기영동으로 RNA 품질 및 농도를 평가합니다.
참고: 좋은 품질의 RNA는 약 2.0 이상의 A260/A 280 비율을 가져야 합니다. - 염기서열 분석을 위해 RNA를 제출하거나 1μg의 RNA를 증폭 등급 DNase I로 처리하고 위 첨자 III 역전사효소 및 oligo-(dT)20을 사용하여 역전사합니다. 제조업체의 지침에 따라 이 단계를 수행합니다.
- qRT-PCR을 수행하고, ΔΔCT 방법9에 의해 데이터를 분석한다(도 4B-D).
- 옵션 4: POI 발현 및 colocalization 분석. 전체 마운트 면역형광 염색 분석법(그림 5)
참고: 포름알데히드 고정 배아는 깨지기 쉽습니다. 격렬한 흔들림을 피하고 조심해서 다루십시오.- 6.1.1-6.1.3 단계에 따라 배아를 탈모합니다.
- 배아를 1.5mL 튜브로 옮깁니다.
참고: 각 튜브에는 동일한 수의 배아가 있어야 하며 40개 이하의 배아가 있어야 합니다. - 배아가 튜브 바닥에 가라앉은 후 상층액을 제거하고 1mL의 인산염 완충 식염수(PBS)(pH 7.6)를 추가합니다.
- 6.4.3단계를 한 번 더 반복합니다.
- 상층액을 제거하고 PBS(pH 7.6)에 4% 포름알데히드 1mL를 첨가하고 부드럽게 흔들면서 4°C에서 밤새 튜브를 배양합니다.
참고: 포름알데히드 용액의 샘플은 4°C에서 1주일 동안 보관할 수 있습니다. - 상청액을 제거하고, -20°C 메탄올 1mL를 첨가하고, -20°C에서 적어도 18시간 동안 튜브를 옆으로 눕혀 배양한다.
참고: 샘플은 -20°C에서 1개월 이상 보관할 수 있습니다. - 상층액을 제거하고 1mL의 PDT 완충액(PBS 완충액에 0.3% v/v Triton X-100, 0.1% v/v Tween-20 및 1% v/v 디메틸 설폭사이드[DMSO])을 추가합니다.
- 6.4.7 단계를 반복하고 부드럽게 흔들면서 30 분 동안 RT에서 튜브를 배양합니다.
- 상층액을 제거하고 1mL의 차단 완충액(10% v/v 열 비활성화 태아 소 혈청[FBS], 2% w/v 소 혈청 알부민[BSA] 및 PBS 완충액 중 0.1% v/v Tween-20)을 추가하고 부드럽게 흔들면서 RT에서 1시간 동안 튜브를 배양합니다.
- 상층액을 제거하고 200 μL의 1차 항체 용액(블로킹 완충액에 희석)을 첨가한다.
- 상층액을 제거하고 500μL의 1차 항체 용액(블로킹 완충액에 희석됨)을 첨가하고 부드럽게 흔들면서 4°C에서 밤새 튜브를 배양합니다.
참고: 새로운 1차 항체를 사용하는 경우 음성 대조군으로 사용하기 위해 1차 항체 염색이 없는 일부 샘플을 포함하는 것이 좋습니다. 그러나, 이상적으로는, 모르폴리노-녹다운 또는 조작된 유전자-녹아웃 배아, 또는 표적 단백질의 발현이 자극된 배아가 항체를 검증하는 보다 신뢰할 수 있는 수단이다. - 상층액을 제거하고, 1 mL의 PDT 완충액을 첨가하고, 부드럽게 흔들면서 30 분 동안 RT에서 튜브를 배양한다.
- 6.4.12단계를 반복합니다.
- 상층액을 제거하고, 블로킹 완충액 1mL를 첨가하고, 부드럽게 흔들면서 실온에서 1시간 동안 튜브를 배양한다.
참고: 샘플은 2차 항체에 접합된 형광단의 광표백을 방지하기 위해 이 단계 후에 빛으로부터 보호되어야 합니다. - 상층액을 제거하고 200 μL의 2차 항체 용액(블로킹 완충액에 희석)을 첨가한다.
- 상층액을 제거하고 500 μL의 2차 항체 용액(블로킹 완충액에 희석됨)을 첨가하고 부드럽게 흔들면서 RT에서 1.5시간 동안 튜브를 배양합니다.
- 상층액을 제거하고, 1 mL의 PDT 완충액을 첨가하고, 부드럽게 흔들면서 30 분 동안 RT에서 튜브를 배양한다.
- 6.4.17단계를 반복합니다.
- 2% 아가로스 플레이트(PBS, pH 7.6으로 제작)에 배아를 장착하고 실체현미경(명시야 및 각 형광 채널)으로 배아를 이미지화합니다(그림 5A,B,D,F).
참고: 라이카 M165 FC 형광 실체현미경을 사용하는 경우 25배의 배율을 사용하여 좋은 해상도의 이미지를 얻을 수 있습니다. - ImageJ(NIH)로 형광 신호 강도를 정량화/분석합니다. ImageJ의 [자유형 선택 ] 툴을 사용하여 관심 영역의 신호를 수량화할 수 있습니다.
결과
Z-REX 처리된 형질전환 호중구/대식세포 리포터 어류, Tg(lyz:TagRFP) 및 Tg(mpeg1:EGFP) 의 라이브 이미징.Keap1 HNEylation을 통한 호중구/대식세포 세포자멸사 유도. (그림 2 참조). 호중구 및 대식세포 수준에 대한 Keap1의 친전자성 표지의 효과는 Tg(lyz:TagRFP) 또는 Tg(mpeg1:EGFP)에서 유래한 이형접합체 형질전환 배아에 Halo-Keap1을 암호화하는 mRNA를 주입한 다음 Ht-PreHNE(알킨)로 처리하여 평가했습니다. 단계 6.1-다운스트림 분석에 대한 절차에 따라 옵션 1-HNE(알킨)를 유리하고 Keap1을 표지했습니다. 호중구 및 대식세포 수치는 각각 리포터 라인인 Tg(lyz:TagRFP) 및 Tg(mpeg1:eGFP)의 실시간 영상으로 평가되었습니다. 두 세포 유형의 수준은 HNE가 Keap1에 전달된 Z-REX 처리 후 30%-40% 감소했습니다. 반대로, Z-REX 기술 대조군[빛 및 Ht-PreHNE(알킨), 빛 단독 또는 Ht-PreHNE(알킨) 단독]에서 호중구 또는 대식세포의 손실이 관찰되지 않았습니다(그림 1D 및 그림 2A-D).
호중구/대식세포 세포자멸사의 유도는 Z-REX를 통해 Keap1에 대한 성공적인 HNE 전달을 나타냅니다. 경로 분석 및 세포자멸사 메커니즘에 대한 자세한 내용이 발표되었습니다5. HNE(알킨)의 타겟 이탈 효과를 설명하기 위해 몇 가지 대조군이 사용되었습니다. (1) 동일한 실험 조건에서 Halo-TeV-Keap1 mRNA 대신 배아에 Halo-P2A-Keap1 mRNA를 주입했습니다. P2A 링커는 Halo 및 Keap1 단백질이 독립적으로 발현되도록 했습니다. 이 시나리오에서 Halo에서 방출된 HNE(알킨)는 더 이상 Halo에 근접하지 않았기 때문에 Keap1에 레이블을 지정할 수 없습니다(그림 1D). 따라서, 세포자멸사 신호전달 경로가 촉발되지 않았다. 이 그룹에서는 대식세포 또는 호중구 수준의 변화가 관찰되지 않았습니다(그림 2A, B). (2) HNE(알킨)에 반응하지 않는 Keap1의 돌연변이인 Halo-TeV-Keap1(C151S,C273W,C288E)을 암호화하는 mRNA를 사용하여 동일한 실험 조건을 수행하였다(그림 1D). 대식세포 또는 호중구 수준의 변화는 관찰되지 않았습니다(그림 2G,H).
비오틴 아지드-클릭 커플링 및 비오틴 풀다운 분석. 목표 라벨링 평가. ( 그림 3 참조). 표적 표지 평가는 Halo-TeV-Keap1-2xHA(Halo-POI 융합 구조) 또는 Halo-2xHA-P2A-Keap1-2xHA(P2A-분할 구조, Halo와 Keap1이 융합되지 않음; 그림 1D). 표지된 Keap1 단백질은 융합 단백질을 발현하고 Z-REX로 처리한 그룹에서만 풀다운되었지만(상단 항-HA 블롯의 두 번째 레인), 다른 대조군(mRNA 주입 없음, Z-REX가 없는 융합 구조체 또는 P2A-분할 구조체)에서는 처리되지 않았습니다. 결과는 HNE(알킨)가 Keap1에 성공적으로 전달되었고, 변형된 Keap1은 클릭 반응을 통해 비오틴과 접합되었고, 비오틴 표지된 Keap1은 스트렙타비딘 수지에 의해 풀다운되었음을 나타냅니다.
전사 분석. RNA-seq 및 qRT-PCR. ( 그림 4 참조). Z-REX 처리 후의 전사 변화를 RNA-seq 및 qRT-PCR에 의해 평가하였다. RNA-seq에서 여러 면역 관련 유전자가 Z-REX 후에 하향 조절되었습니다. 대조적으로, 많은 항산화 반응(AR) 관련 유전자는 Z-REX 후에 상향 조절되었으며, 이는 Keap110 에서 HNEylation에 따라 Keap1-Nrf2-AR 경로의 유도로 인해 발생했습니다(그림 4A). qRT-PCR 분석에서 3개의 면역 관련 유전자(lyz, mpeg1.1 및 coro1a)를 분석했을 때 유사한 결과가 발견되었습니다(그림 4B). 각 유전자의 상향 및 하향 조절은 Keap1 HNEylation에 의해 매개되는 경로의 성공적인 유도를 보여주었습니다.
전체 마운트 (공동) 면역 형광 염색 분석 및 colocalization 분석. (그림 5 참조). 외인성 Halo-TeV-Keap1-2xHA 및 Halo-2xHA-P2A-Keap1-2xHA 발현은 전체 마운트 면역형광(IF) 염색으로 평가되었습니다(그림 5A,B). P2A-분할-구축물은 TeV-융합-구축물보다 2배 더 많은 HA 태그를 가졌으며, 이는 다른 것보다 P2A-분할-구축물-mRNA-주입 그룹에서 2배 더 높은 항-HA 신호에 해당하며, 이는 두 구축물의 발현 수준이 유사함을 나타낸다(도 5C). Halo-TeV-Keap1(wt) 및 Halo-TeV-Keap1(C151S,C273W,C288E)의 발현 수준도 anti-Halo로 프로빙할 때 유사한 것으로 나타났습니다(그림 5D,E). Z-REX 처리된 Tg(lyz:TagRFP)에서 호중구 및 활성 카스파제 3의 공동 국소화는 항-RFP 및 항-활성-카스파제 3과의 공동 면역염색에 의해 관찰되었습니다(그림 5F). 활성 카스파아제 3은 세포자멸사 사건의 지표입니다.
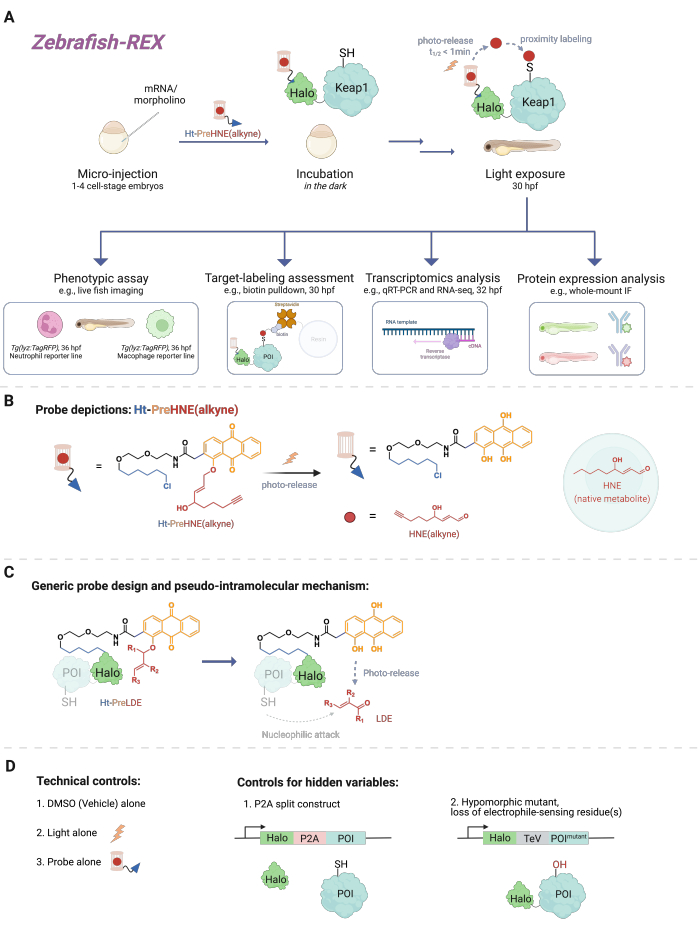
그림 1: Z-REX 워크플로우. (A,B) 1-4 세포 단계 제브라피쉬 배아에 Halo-POI(예: Halo-Keap1)를 인코딩하는 mRNA를 주입합니다. 그런 다음 주입된 배아는 HaloTag 리간드로 구성된 프로브와 B의 Ht-PreHNE(알킨)와 같은 알킨 작용기가 추가된 광케이지 친전성체로 처리됩니다. 과량의 프로브를 제거한 후, 배아는 관심있는 친 전자성 [예 : HNE 또는 그 유사체, HNE (알킨)]을 방출하기 위해 빛에 노출됩니다. 다운스트림 분석은 지정된/사용자 정의 시점에 수행됩니다. (C) 다양한 지질 유래 친전성기(LDE)에 적용할 수 있는 Ht-PreLDE 프로브의 설계 및 메커니즘. (D) Z-REX에 대한 음성/기술적 대조군. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
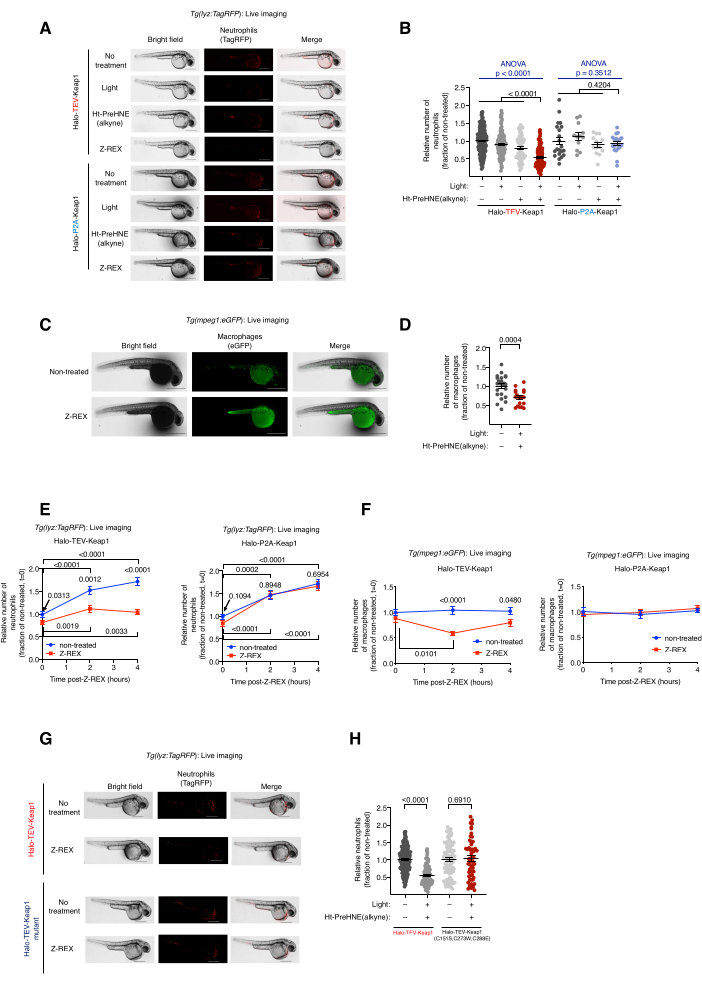
그림 2: Z-REX에 노출된 형질전환 호중구/대식세포 리포터 물고기의 라이브 이미징. Z-REX 매개 Keap1 HNEylation은 호중구/대식세포 세포자멸사를 유도합니다. (A) Halo-TeV-Keap1(융합 구조체) 또는 Halo-P2A-Keap1(분할 구조체)을 발현하고 음성 대조 조건[무처리, 빛 단독 또는 Ht-PreHNE(알킨) 단독 또는 Z-REX]. 배아 연령 : 36 hpf. (B) A의 호중구 수준의 정량화. (C) Z-REX 처리 유무에 관계없이 Halo-TeV-Keap1을 발현하는 Tg(mpeg1:eGFP) 물고기의 대표 이미지. 배아 연령 : 34 hpf. (D) C의 대식세포 수준의 정량화. (E,에프) Z-REX 처리 후 (E) 호중구 및 (F) 대식세포 수준의 시간 경과 측정. (G) HNE 감지 능력이 없는 돌연변이인 Halo-TeV-Keap1(WT) 또는 Halo-TeV-Keap1(C151S, C273W, C288E)을 발현하는 어류에서 A에서와 유사한 실험. (H) G의 호중구 수준 정량화. 스케일 바: 500 μm. 모든 그래프는 평균 ± SEM으로 제시됩니다. p 값은 일원 분산 분석(파란색)과 양측 스튜던트 t-검정(검은색)으로 계산되었습니다. 이 수치는 Poganik et al.7에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 비오틴 풀다운 분석. Halo-TeV-Keap1-2XHA 또는 Halo-2XHA-P2A-Keap1-2XHA를 발현하는 WT 배아를 Z-REX 또는 각각의 음성 대조군 조건(이 경우 프로브 처리 없음)으로 처리했습니다. 수확 후, 배아를 용해시키고 비오틴 풀다운 분석 전에 TeV 프로테아제로 처리했습니다. 그 결과를 웨스턴 블랏팅으로 분석하였다. 이 그림은 Huang et al.에서 수정되었습니다. Z-REX: 조직 특이적 또는 유비쿼터스적으로 발현되는 특정 단백질에 반응성 친전필을 투여하고 애벌레 물고기에서 결과적인 기능적 친전자성 유도 산화 환원 반응을 기록합니다. 이 그림은 Huang et al.에서 수정되었습니다.11. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
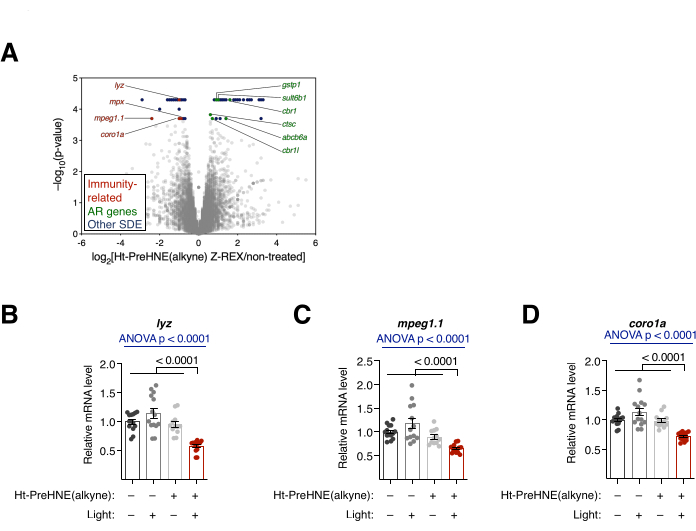
그림 4: 전사 분석. (A) Z-REX 처리 대 처리되지 않은 배아의 RNA-seq 결과. 통계적으로 유의한 차등적 발현(SDE) 유전자가 강조 표시됩니다. 면역 관련 SDE 유전자는 빨간색으로 표시됩니다. 항산화 반응(AR) 관련 유전자는 녹색으로 표시됩니다. 다른 SDE 유전자는 파란색으로 표시됩니다. 모든 p 값은 CuffDiff로 계산되었습니다. (B-D) A의 3가지 면역 관련 SDE 유전자: (B) lyz, (C) mpeg1.1 및 (D) coro1a를 qRT-PCR로 추가로 분석한 결과, Z-REX 처리된 배아만이 이러한 전사체의 억제를 보여주었습니다. 모든 그래프는 평균 ± SEM으로 제시됩니다. p 값은 일원 분산 분석(파란색) 및 양측 스튜던트 t-검정(검은색)으로 계산되었습니다. 이 수치는 Poganik et al.7에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
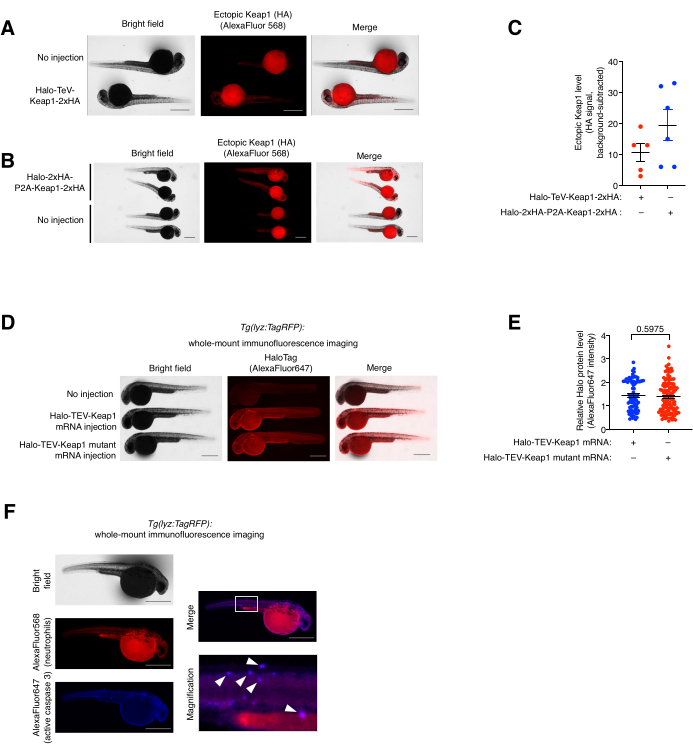
그림 5: 전체 마운트 면역형광 염색 분석. (A,B) 항-HA 및 AlexaFluor568과 접합된 2차 항체로 면역염색된 (A) Halo-TeV-Keap1-2xHA 또는 (B) Halo-2xHA-P2A-Keap1-2xHA를 발현하는 배아의 대표 이미지. mRNA가 주입된 물고기는 연령이 일치하는 주사되지 않은 물고기와 비교되었습니다. (C) (A,B)에서 항-HA 신호의 정량화. (D) 항-Halo 및 AlexaFluor647과 접합된 2차 항체로 면역염색된 Halo-TeV-Keap1(WT) 또는 Halo-TeV-Keap1(C151S, C273W, C288E)을 발현하는 배아의 대표 이미지. mRNA가 주입된 물고기는 연령이 일치하는 주사되지 않은 물고기와 비교되었습니다. (E) D에서 안티 헤일로 신호의 정량화. p 값은 양측 스튜던트 t-검정으로 계산되었습니다. (에프) Z-REX를 투여받은 Tg(lyz:TagRFP) 배아는 항-RFP 및 항활성 카스파제 3 및 각각의 형광단 접합 2차 항체와 함께 면역염색되었습니다. 흰색 상자는 확대된 영역을 표시합니다. 흰색 화살표는 호중구와 활성 카스파아제 3의 colocalizations를 나타냅니다. 스케일 바: 500 μm. 모든 그래프는 평균 ± SEM으로 표시됩니다. 이 수치는 Poganik et al.7에서 수정되었습니다. 및 Huang et al.11. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 본 연구에 사용된 완충액 목록. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜에 설명된 Z-REX는 활어의 친전자성-표적 쌍 조사 및 신호 전달 경로 디콘볼루션을 위한 강력한 전략을 보여줍니다. 근접 지향 전달은 친전자성 화합물 처리의 투여량 및 공간 제어를 가능하게 합니다. 배치된 친전필의 초생리학적 농도가 종종 표적 이탈 문제를 유발하는 기존의 볼루스 투여 방법과 달리, 시스템에 방출되는 친전자성의 상대적으로 적은 양은 Z-REX를 대체로 비침습적으로 만듭니다. 우리는 제브라피쉬 배아에 0.1-6μM Ht-PreHNE(알킨)를 사용했으며, 그 결과 치료가 배아 발달에 해롭지 않은 것으로 나타났다11.
Z-REX 절차는 일반적으로 배양된 세포에서 친전자성 감지 단백질을 스크리닝/연구하는 기술인 T-REX보다 깁니다. 실험의 목적이 친전자성-표적 상호작용을 스크리닝하는 것이라고 가정합니다. 먼저 배양된 세포에서 T-REX에 의한 광범위한 스크리닝을 수행하고 생체 내 검증 및 표현형/경로 분석을 위해 Z-REX를 사용하는 것이 좋습니다. 세포 배양과 비교할 때, Z-REX를 수행하기 위한 요구 사항은 T-REX가 요구하는 생화학적 실험 기술 외에 기본적인 어류 사육 기술입니다. Z-REX의 일반적인 기간(물고기 교배에서 광유도성 친전성 전달까지)은 2-3일이며, 이는 형질주입된 살아있는 세포에 대한 T-REX 실험의 일반적인 시간보다 1일 이상 길지 않습니다. 표현형 분석을 위한 라이브 이미징은 조명 조명 후 2-10시간 후에 수행할 수 있습니다. 풀다운 분석을 위한 비오틴-아지드와의 클릭 커플링은 3일이 소요됩니다. 전사 반응을 분석하기 위한 qRT-PCR은 3일이 걸립니다. IF 염색에는 5 일이 걸립니다. 이러한 단계는 세포 배양 단계와 거의 유사하지만 데이터를 해석하려면 어류 생리학 및 리포터 균주에 대한 이해가 필요합니다.
다중 변수 절차(12)로서, Z-REX가 결과의 불확실성을 배제하기 위해 여러 대조군이 필요하다(도 1D). 일반적인 대조군은 다음과 같다: (1) DMSO/비히클 치료만; (2) 프로브 처리, 그러나 조명 없음; (3) 조명 조명이지만 프로브 처리가 필요하지 않습니다. (4) P2A-분할 구성물, 헤일로와 POI가 별도로 표현되어, 근접 전달이 제거된다; 및 (5) 이전 연구에서 사용한 Akt3(C119S)6 및 Keap1(C151S, C273W, C288E)5와 같이 친전자성 감지 잔기가 돌연변이된 하이포모픽 돌연변이체.
다운스트림 분석에 웨스턴 블롯 분석이 포함되는 경우 수확 전에 디노킹을 수행해야 합니다. 노른자 단백질은 용해물 농도 평가의 충실도를 감소시키고 항체에 비특이적으로 결합할 수 있습니다. 활어 이미징 또는 전체 마운트 IF 염색을 수행할 때 난황낭의 자가형광 단백질 또는 항체 자체의 비특이적 결합으로 인해 난황낭에서 비특이적 형광 신호도 관찰했습니다. 자가형광 신호가 신호를 방해하는 경우 난황낭을 정량화에서 제외하거나 다른 영역을 별도로 정량화하는 것이 좋습니다. Dechorination은 활어 이미징 및 전체 마운트 IF 염색 분석에 필요합니다. chorion은 이미징을 방해할 수 있으며 나중에 정량화/세포 계수를 방해할 수 있습니다. 그러나 dechorination은 1dpf 이상의 배아에만 적용됩니다. blastulation/gastrulation/segmentation 단계의 어린 배아는 너무 약해서 융모막을 제거할 수 없습니다.
여기에 설명된 Z-REX 프로토콜은 mRNA 기반 이소성 POI 발현을 기반으로 합니다. 이 절차는 형질전환 낚싯줄을 사용/생성하는 것에 비해 빠릅니다. mRNA 기반 발현은 유비쿼터스이고 일시적이며 이 프로토콜에 사용되는 mRNA의 경우 최소 2일 동안 지속됩니다. 그러나 발현 기간은 다른 경우에 다를 수 있습니다. 따라서 이 접근 방식은 여러 고처리량/고함량 분석과 호환되는 특정 친전자성 표지 이벤트의 효과에 대한 빠르고 보다 글로벌한 조사 창을 제공합니다. 특정 조직에서 안정적인 Halo-POI 발현을 갖는 형질전환 계통도 Z-REX11과 호환됩니다. 이러한 라인은 예를 들어 특정 장기의 표현형이 세포 배양 데이터에서 예측되거나 mRNA 주입 실험에서 스크리닝하여 특정 장기가 친전자성 표지 이벤트에 민감하다고 예측할 때와 같이 보다 정확한 질문이 필요할 때 가장 잘 사용됩니다. Z-REX를 통한 심장 특이적 항산화 반응 유도는 이전 간행물11에서 Tg(gstp1:GFP;DsRed-P2A-myl7:Halo-TeV-Keap1) 물고기를 사용하여 입증되었습니다. 2dpf보다 오래된 형질전환 어류에 대해 Z-REX를 수행하는 것도 가능할 수 있습니다.
공개
REX 기술에 의해 발견된 동형 특이적 소분자 키나제 억제제가 특허 출원을 위해 출원되었습니다
감사의 말
자금 지원: Novartis FreeNovation, NCCR 및 EPFL.
자료
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol (BME) | Sigma-Aldrich | M6250 | |
| 1.5-mL microcentrifuge tube | Axygen | MCT-150-C-S | |
| 10-cm Petri dishes | Celltreat | 229692 | |
| 2-mL microcentrifuge tube | Axygen | MCT-200-C-S | |
| 30% Acrylamide and bis-acrylamide solution | BioRad | 1610154 | |
| 6-well plate | Celltreat | 229506 | |
| Acetone | Fisher | A/0600/15 | |
| Agarose | GoldBio | A201-100 | |
| All Blue Prestained Protein Standards | BioRad | 1610373 | |
| Ammonium persulfate | Sigma | A3678 | |
| Biotin-dPEG11-azide | Quanta Biodesign | 102856-142 | |
| Bradford Dye | BioRad | 5000205 | |
| BSA | Fisher | BP1600-100 | |
| Capillary tubes | VWR | HARV30-00200 | |
| Chloroform | Supelco, Inc | 1.02445.1000 | |
| cOmplete, Mini, EDTA-free Protease Inhibitor Cocktail | Roche | 11836170001 | |
| Cu(TBTA) | Lumiprobe | 21050 | |
| CuSO4 | Sigma | 209198 | |
| DMSO | Fisher | D128-500 | |
| Donkey anti-mouse-Alexa Fluor 647 | Abcam | ab150107 | 1:800 (IF) |
| Donkey anti-rabbit-Alexa Fluor 647 | Abcam | ab150075 | 1:1000 (IF) |
| Donkey anti-rat-AlexaFluor 568 | Abcam | ab175475 | 1:1000 (IF) |
| ECL substrate | Thermo Fisher Scientific | 32106 | |
| ECL-Plus substrate | Thermo Fisher Scientific | 32132 | |
| End-to-end rotator | FinePCR | Rotator AG | |
| Ethanol | Fisher | E/0650DF/15 | |
| Ethidium bromide | Sigma | E1510 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument Co. | P-97 | |
| Fluorescence stereomicroscope | Leica | M165 FC | |
| Forceps (blunt) | self made | self made by blunting sharp forceps (Fine Science Tools, Dumont #5, 11252-40) | |
| Forceps (sharp) | Fine Science Tools | Dumont #5, 11252-40 | |
| Gel loading tip | Fisher | 02-707-181 | |
| Gel/blot imager | Vilber | Fusion FX imager | |
| Glass beads | Sigma | 45-G1145 | |
| Glass stage micrometer | Meiji Techno. | MA285 | |
| Heat inactivated FBS | Sigma | F2442 | |
| Heated ultrasonic bath | VWR | 89375-470 | |
| HEPES | Fisher | BP310-1 | |
| High capacity streptavidin agarose | Thermo Fisher Scientific | 20359 | |
| Ht-PreHNE alkyne probe | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Imaging plate (10% HBSS buffer, for live embryos) | Made with Petri dish, and 2% agarose in 10% HBSS buffer | ||
| Imaging plate (PBS, for formaldehyde-fixed embryos) | Made with Petri dish, and 2% agarose in PBS | ||
| Injection plate | Made with microinjection mold, Petri dish, and 2% agarose in 10% HBSS buffer | ||
| LDS | Apollo | APOBI3331 | |
| Methanol | VWR | 20864.32 | |
| Microinjection mold | Adaptive Science Tools | TU-1 | |
| Microloader tips | Eppendorf | 930001007 | |
| Micromanipulator | Narishige | MN-153 | |
| Microscope for micro-injection | Olympus | SZ61 | |
| Microscope light source | Olympus | KL 1600 LED | |
| Mineral oil | Sigma | M3516 | |
| mMessage mMachine SP6 Transcription Kit | Ambion | AM1340 | |
| Mouse anti- β-actin-HRP | Sigma | A3854 | 1:20000 (WB) |
| Mouse anti-HaloTag | Promega | G921A | 1:500 (IF) |
| Multi-mode reader | BioTek Instruments | Cytation 5 | |
| Nucleic acid agarose gel electrophoresis apparatus | Biorad | Mini-Sub Cell GT Systems | |
| Oligo(dT)20 | Integrated DNA Technologies | customized: (dT)20 | |
| Orange G | Sigma | O3756 | |
| Paraformaldehyde | Sigma | P6148 | |
| PBS | Gibco | 14190144 | |
| pCS2+8 Halo-2XHA-P2A-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| pCS2+8 Halo-TeV-Keap1-2xHA | self-cloned | - | Available from Prof. Yimon AYE's group at EPFL |
| Pneumatic PicoPump | WPI | SYS-PV820 | |
| Protein electrophoresis equipment and supplies | Biorad | Mini-PROTEAN Tetra Vertical Electrophoresis | |
| Rabbit anti-active Caspase-3 | BD Pharmingen | 559565 | 1:800 (IF) |
| Rat anti-HA-HRP | Sigma | H3663 | 1:500 (IF and WB) |
| Rat anti-RFP | ChromoTek | 5F8 | 1:800 (IF) |
| Refrigerated centrifuge | Eppendorf | 5417R | |
| RNAseOUT recombinant ribonuclease inhibitor | ThermoFisher Scientific | 10777019 | |
| RnaseZap RNA decontamination solution | ThermoFisher Scientific | AM9780 | |
| Rocking Shaker | DLAB | SK-R1807-S | |
| SDS | Teknova | S9974 | |
| SuperScript III reverse transcriptase | ThermoFisher Scientific | 18080085 | |
| t-Butanol | Sigma | 471712 | |
| TCEP-HCl | Gold Biotechnology | TCEP1 | |
| TeV protease (S219V) | self-made | - | Parvez, S. et al. T-REX on-demand redox targeting in live cells. Nat Protoc. 11 (12), 2328-2356, (2016). |
| Tg(lyz:TagRFP) | Zebrafish International Resource Center (ZIRC) | uwm11Tg (ZFIN) | - |
| Tg(mpeg1:eGFP) | Zebrafish International Resource Center (ZIRC) | gl22Tg (ZFIN) | - |
| Thermal cycler | Analytik Jana | 846-x-070-280 | |
| TMEDA | Sigma | T7024 | |
| Transfer pipets | Fisher | 13-711-9D | |
| Tris | Apollo | APOBI2888 | |
| Triton X-100 | Fisher | BP151-100 | |
| TRIzol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T9003 | |
| Tween 20 | Fisher | BP337-500 | |
| UV lamp with 365-nm light | Spectroline | ENF 240C | |
| UV meter | Spectroline | XS-365 | |
| Vortexer | Scientific Industries, Inc. | Vortex-Genie 2 | |
| Western Blotting Transfer equipment and supplies | Biorad | Mini Trans-Blot or Criterion Blotter | |
| Zebrafish husbandry and breeding equipment | in house | ||
| Zirconia beads | BioSpec | 11079107zx |
참고문헌
- Long, M. J. C., Ly, P., Aye, Y. A primer on harnessing non-enzymatic post-translational modifications for drug design. RSC Medicinal Chemistry. 12 (11), 1797-1807 (2021).
- Parvez, S., Long, M. J. C., Poganik, J. R., Aye, Y. Redox signaling by reactive electrophiles and oxidants. Chemical Reviews. 118 (18), 8798-8888 (2018).
- Parvez, S., et al. T-REX on-demand redox targeting in live cells. Nature Protocols. 11 (12), 2328-2356 (2016).
- Long, M. J. C., et al. Precision electrophile tagging in Caenorhabditis elegans. Biochemistry. 57 (2), 216-220 (2018).
- Van Hall-Beauvais, A., Zhao, Y., Urul, D. A., Long, M. J. C., Aye, Y. Single-protein-specific redox targeting in live mammalian cells and C. elegans. Current Protocols in Chemical Biology. 10 (3), 43 (2018).
- Long, M. J. C., et al. Akt3 is a privileged first responder in isozyme-specific electrophile response. Nature Chemical Biology. 13 (3), 333-338 (2017).
- Poganik, J. R., et al. Wdr1 and cofilin are necessary mediators of immune-cell-specific apoptosis triggered by Tecfidera. Nature Communications. 12 (1), 5736 (2021).
- Lin, H. -. Y., Haegele, J. A., Disare, M. T., Lin, Q., Aye, Y. A generalizable platform for interrogating target- and signal-specific consequences of electrophilic modifications in redox-dependent cell signaling. Journal of the American Chemical Society. 137 (19), 6232-6244 (2015).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Wakabayashi, N., et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nature Genetics. 35 (3), 238-245 (2003).
- Huang, K. -. T., et al. Z-REX: Shepherding reactive electrophiles to specific proteins expressed either tissue-specifically or ubiquitously, and recording the resultant functional electrophile-induced redox responses in larval fish. Nature Protocols. , (2023).
- Long, M. J. C., Assari, M., Aye, Y. Hiding in plain sight: The issue of hidden variables. ACS Chemical Biology. 17 (6), 1285-1292 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유