A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل وثقافة البلاعم الزليلية الأولية والخلايا الليفية من أنسجة التهاب المفاصل الفئران
In This Article
Summary
توفر الدراسة الحالية بروتوكولا معدلا لعزل الضامة الزليلية والخلايا الليفية من أنسجة التهاب المفاصل الالتهابي في الفئران.
Abstract
التهاب المفاصل الروماتويدي هو أحد أمراض المناعة الذاتية التي تؤدي إلى التهاب مزمن في المفاصل. تلعب البلاعم الزليلية والخلايا الليفية الزليلية أدوارا مركزية في التسبب في التهاب المفاصل الروماتويدي. من المهم فهم وظائف كل من مجموعات الخلايا للكشف عن الآليات الكامنة وراء التقدم المرضي والمغفرة في التهاب المفاصل الالتهابي. بشكل عام ، يجب أن تحاكي الظروف التجريبية في المختبر البيئة في الجسم الحي قدر الإمكان. تم استخدام الخلايا المشتقة من الأنسجة الأولية في التجارب التي تميز الخلايا الليفية الزليلية في التهاب المفاصل. في المقابل ، في التجارب التي تبحث في الوظائف البيولوجية للبلاعم في التهاب المفاصل الالتهابي ، تم استخدام خطوط الخلايا ، والبلاعم المشتقة من نخاع العظم ، والبلاعم المشتقة من الدم الوحيد. ومع ذلك ، فمن غير الواضح ما إذا كانت هذه الضامة تعكس بالفعل وظائف الضامة المقيمة في الأنسجة. للحصول على الضامة المقيمة ، تم تعديل البروتوكولات السابقة لعزل وتوسيع كل من الضامة الأولية والخلايا الليفية من الأنسجة الزليلية في نموذج فأر التهاب المفاصل الالتهابي. قد تكون هذه الخلايا الزليلية الأولية مفيدة للتحليل في المختبر لالتهاب المفاصل.
Introduction
التهاب المفاصل الروماتويدي (RA) هو أحد أمراض المناعة الذاتية التي تتميز بتضخم الغشاء الزليلي ، مما يؤدي إلى تدمير المفاصل 1,2. توجد البلاعم والخلايا الليفية المقيمة في الأنسجة في الغشاء الزليلي الصحي للحفاظ على توازن المفاصل. في مرضى التهاب المفاصل الروماتويدي ، تتكاثر الخلايا الليفية الزليلية (SFs) ، وتتسلل الخلايا المناعية ، بما في ذلك الخلايا الوحيدة ، إلى الغشاء الزليلي وسائل المفاصل ، وهي عمليات مرتبطة بالالتهاب1،3،4. يتم تنشيط الضامة الزليلية (SMs) ، والتي تشمل الضامة المقيمة والبلاعم المشتقة من الخلايا الوحيدة في الدم المحيطي ، و SFs بشكل شاذ ولها أدوار مهمة في التسبب في التهاب المفاصل الروماتويدي. اقترحت الدراسات الحديثة أن تفاعلات الخلايا الخلوية بين SMs و SFs تساهم في كل من تفاقم ومغفرة RA 5,6.
لفهم التسبب في التهاب المفاصل الروماتويدي ، تم استخدام العديد من نماذج القوارض من التهاب المفاصل الالتهابي ، بما في ذلك التهاب المفاصل في مصل K / BxN ، والتهاب المفاصل الناجم عن الكولاجين ، والتهاب المفاصل الناجم عن الأجسام المضادة للكولاجين. المقايسات القائمة على الخلايا مطلوبة بشكل عام لتوضيح الوظائف الجزيئية في التهاب المفاصل. لذلك ، تم عزل الخلايا الأولية من النماذج الحيوانية لالتهاب المفاصل. طريقة عزل SFs من أنسجة التهاب المفاصل الفئران راسخة ، وقد ساهمت هذه الخلايا في توضيح الآليات الجزيئية في التسبب في التهاب المفاصل 7,8. من ناحية أخرى ، غالبا ما تستخدم الضامة المشتقة من نخاع العظم ، والبلاعم المشتقة من الدم الأحادي ، وخطوط خلايا البلاعم كموارد للبلاعم لدراسات التهاب المفاصل9،10. نظرا لأن البلاعم يمكن أن تكتسب وظائف مرتبطة ببيئتها المكروية ، فقد تفتقر المصادر العامة للبلاعم إلى استجابات خاصة بأنسجة التهاب المفاصل. بالإضافة إلى ذلك ، من الصعب الحصول على ما يكفي من الخلايا الزليلية عن طريق الفرز ، لأن الغشاء الزليلي للفئران هو نسيج صغير جدا حتى في نماذج التهاب المفاصل. كان عدم استخدام البلاعم الزليلية للدراسات في المختبر قيدا في دراسات التهاب المفاصل. سيكون إنشاء بروتوكول لعزل وتوسيع الضامة الزليلية ميزة لتوضيح الآليات المرضية في التهاب المفاصل الروماتويدي.
في الطريقة السابقة لعزل SFs ، تم تجاهل SMs7. إلى جانب ذلك ، تم الإبلاغ عن طريقة لعزل وتوسيع الضامة المقيمة من بعض الأعضاء11. لذلك ، تم تعديل البروتوكولات الحالية مجتمعة. يهدف التعديل إلى تحقيق الثقافة الأولية لكل من SMs و SFs بنقاوة عالية. الهدف العام من هذه الطريقة هو عزل وتوسيع كل من SMs و SFs من أنسجة التهاب المفاصل الفئران.
Protocol
تمت الموافقة على التجارب التي شملت الحيوانات من قبل لجنة التجارب على الحيوانات بجامعة إهيمه وتم إجراؤها وفقا لإرشادات جامعة إهيمه للتجارب على الحيوانات (37A1-1 * 16).
1. إعداد الأدوات والكواشف ووسط الاستزراع
- تحضير وسط الاستزراع على النحو التالي: مكمل وسط النسر المعدل من Dulbecco (DMEM) مع 10٪ مصل بقري جنيني (FBS) و 1٪ محلول مضاد حيوي مضاد حيوي (مضاد للطهرو).
- تحضير وسط الهضم على النحو التالي: تكملة وسط الاستزراع مع 1 ملغ / مل كولاجيناز من النوع الرابع. اضبط تركيز كولاجيناز قبل الاستخدام مباشرة.
- خفف الكولاجين من النوع I-C إلى تركيز 0.15 مجم / مل بمحلول 1 مللي مول حمض الهيدروكلوريك. أطباق ثقافة الفيضانات (قطرها 40 أو 60 مم) بمحلول الكولاجين المخفف. بعد 6-12 ساعة في درجة حرارة الغرفة ، قم بإزالة محلول الكولاجين من الأطباق وجففه في درجة حرارة الغرفة. يمكن حفظ الأطباق المغلفة بالكولاجين في درجة حرارة الغرفة لمدة 1 أسبوع على الأقل. اغسل الأطباق المطلية مسبقا بمحلول ملحي مخزن بالفوسفات (PBS) أو متوسط قبل الاستخدام.
- قم بإعداد الأدوات الجراحية المعقمة ، مثل المقص والملاقط ذات الأطراف المسننة والملاقط الدقيقة. نقع في 70 ٪ من الإيثانول قبل الاستخدام.
2. إعداد أنسجة التهاب الغشاء المفصلي في الفئران ( الشكل 1 أ)
- إعداد الماوس مع التهاب المفاصل الالتهابي في الكفوف الخلفية.
ملاحظة: تم استخدام إناث الفئران C57BL / 6 (18-20 جم) ، بعد 7-8 أسابيع من الولادة ، مع التهاب المفاصل الناجم عن الأجسام المضادة للكولاجين (CAIA) أو التهاب المفاصل في مصل نقل K / BxN (STA) لهذا البروتوكول8. قد يكون من الصعب عزل SMs عن الأنسجة غير المنتفخة (أي السليمة) ، لأن عدد الخلايا غير كاف. - تخدير الفئران عن طريق الحقن داخل الصفاق من 80 ملغم / كغم من الكيتامين و 16 ملغ / كغ من الزيلازين. تنظيف الفئران مع 70 ٪ من الإيثانول.
- قطع فتح المنطقة الصدرية مع مقص لفضح القلب. اقطع الأذن اليمنى للقلب بالمقص ، ثم ضع إبرة فراشة 23 جراما في البطين الأيسر عبر قمة القلب ، متبوعا بارتجاع 15-20 مل من برنامج تلفزيوني معقم باستخدام حقنة لإزالة الدم المحيطي يدويا (حوالي 1 مل / 2 ثانية).
- تقشير الكفوف الخلفية عن طريق قطع الجلد باستخدام مقص وسحب الجلد باستخدام ملاقط مع نصائح مسننة.
ملاحظة: بعد هذه الخطوة ، يوصى باستخدام الملقط للتعامل مع العينات. لا تلمس الأنسجة المتقشرة بالأصابع ، لتجنب التصاق شعر الفئران. - خلع المفاصل المشطية السلامية عن طريق السحب ، تليها قطع أربطة المفاصل باستخدام مقص لإزالة أصابع القدم.
- قطع أوتار عضلات أسفل الساق بالقرب من الكاحل باستخدام المقص. أمسك الوتر بملاقط وقشر العضلات بالقرب من أسفل الساق لكشف الساق. إزالة الشظية.
- خلع مفصل الركبة عن طريق السحب ، متبوعا بقطع أربطة المفاصل باستخدام مقص لفصل الساق بمخلب الخلف المتورم. احتفظ بالعينات في وسط استزراع بارد (0.3 مل / سم2) حتى المعالجة إلى الخطوة 3.1.
3. هضم أنسجة التهاب الغشاء المفصلي ( الشكل 1 ب)
- قم بشفط وسط الاستزراع ، وتجنب العينة ، ثم أضف وسط استزراع جديد (0.3 مل / سم2). كرر عملية الغسيل ثلاث أو أربع مرات.
ملاحظة: من هذه الخطوة ، يجب إجراء معالجة العينات بشكل معقم في مقعد نظيف أو خزانة أمان. - خلع جميع مفاصل العينات عن طريق السحب باستخدام ملاقط دقيقة في وسط الاستزراع تحت المجهر المجسم (عند التكبير 10x-20x). ملاقط دقيقة نقطة مريحة في هذه الخطوة. قم بإزالة الساق وأكبر عدد ممكن من الأوعية والأوتار والأربطة. احرص على عدم كسر العظام عند الخلع.
- تحضير أنبوبين سعة 15 مل لكل عينة. نقل العظام المخلوعة مع الأنسجة الرخوة إلى أول أنبوب 15 مل باستخدام ملاقط. أضف 4 مل من وسط الهضم لكل عينة ، تم الحصول عليها من كل من الكفوف الخلفية ، في الأنبوب.
- لجمع الخلايا المتبقية وشظايا الأنسجة ، انقل الوسط الذي تم احتواء العينة فيه إلى الأنبوب الثاني سعة 15 مل. أجهزة الطرد المركزي المتوسطة عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة. بعد إزالة المادة الطافية ، أعد تعليق الحبيبات ب 1 مل من وسط الهضم وانقل محلول جزء الخلية والأنسجة إلى أول أنبوب سعة 15 مل يحتوي على جميع الأنسجة تقريبا (إجمالي 5 مل من مخالب الهضم المتوسطة / الخلفية).
- هضم العينة لمدة 60-120 دقيقة عند 37 درجة مئوية مع رجها في فرن التهجين.
ملاحظة: يجب تحديد الوقت الأمثل لهضم العينات. الوقت يعتمد على درجة التورم في الكاحلين والكولاجيناز. في معظم الحالات ، 60-120 دقيقة كافية. بعد 60 دقيقة من الحضانة ، اجمع جزءا من العينة المهضومة عن طريق السحب ، وراقبها تحت المجهر. إذا كان الهضم غير كاف ، يجب أن تستمر الحضانة ، ويتم فحص الهضم كل 30 دقيقة. - ماصة الحل جيدا. قم بتصفية محلول الخلية من خلال مصفاة خلوية (حجم مسام 40 ميكرومتر) إلى أنبوب سعة 50 مل.
- أضف 10 مل من وسط الاستزراع إلى أنبوب 50 مل من خلال مصفاة الخلية. أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- بعد إزالة المادة الطافية ، أعد التعليق باستخدام 10 مل من وسط الثقافة. كرر الطرد المركزي. بعد إزالة المادة الطافية ، أعد التعليق باستخدام 2 مل من وسط الاستزراع.
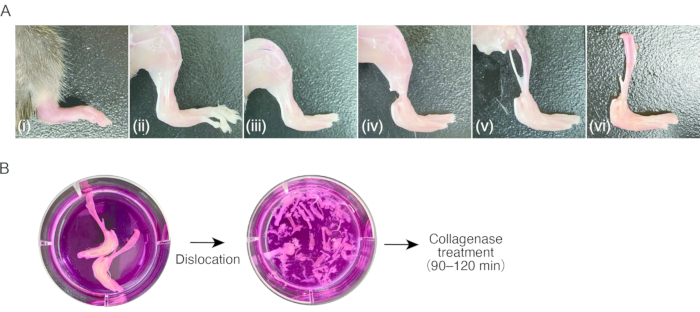
الشكل 1: إجراء أخذ عينات من أنسجة التهاب المفاصل في الفئران وهضم الكولاجيناز . (أ) (ط) مخلب الفئران الخلفي المصاب بالتهاب المفاصل. (ii) إزالة الجلد على مخلب الخلفي. (iii) خلع المفاصل المشطية السلامية وإزالة أصابع القدم. (iv) قطع الأوتار في الكاحل. (ت) إزالة العضلات في أسفل الساقين. (vi) خلع مفصل الركبة. (ب) اليسار؛ الساقين المستأصلة في وسط الثقافة. يمين; خلع طرسوس ومشط القدم في وسط الثقافة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. عزل الخلايا الليفية الزليلية ( الشكل 2 أ)
- بذر جميع معلقات الخلايا التي تم الحصول عليها من كلا الكاحلين على الطبق المطلي بالكولاجين.
ملاحظة: في حالة استخدام الكاحلين مع تورم ضعيف أو معتدل للحصول على الخلايا ، يتم تطبيق طبق قطره 40 مم. يمكن تغيير حجم الطبق المطلي بالكولاجين إلى طبق قطره 60 مم إذا كان كلا الكاحلين يعاني من تورم شديد. - أضف وسط استزراع (حوالي 222 ميكرولتر/سم2). احتضان لمدة 1 ساعة عند 37 درجة مئوية في جو مرطب مع 5٪ CO2.
- اجمع الخلايا غير الملتصقة باستخدام ماصة (استخدم في الخطوة 5.1). اغسل الطبق المطلي بالكولاجين بوسط الثقافة واجمع الوسط. استزراع الخلايا الملتصقة في وسط جديد (الشكل 2B ، i). تظهر معظم الخلايا التي تلتصق بسرعة بالطبق المطلي بالكولاجين مورفولوجيا ليفية (على شكل مغزل).
- مرور الخلايا شبه المتقاربة عن طريق العلاج بنسبة 0.05٪ من التربسين في محلول الملح المتوازن هانكس (HBSS). في هذه الطريقة ، يكون تلوث الخلايا الأخرى محدودا ، حتى لو كان في التوسع الأولي. إذا كانت هناك حاجة إلى المزيد من الخلايا الشبيهة بالخلايا الليفية النقية ، فقم بإجراء تمرير متكرر للسماح بتعزيز النقاء ؛ ومع ذلك ، لوحظ أيضا توسع السيتوبلازم في الخلايا في الالتصاق (الشكل 2B ، ii). نظرا لأن الممرات المفرطة تؤثر على فقدان الخصائص الساذجة في الخلايا ، استخدم الخلايا التي تحتوي على أقل من 5 ممرات.
5. عزل الضامة الزليلية ( الشكل 2 أ)
- قم بزرع جميع الخلايا غير الملتصقة من الخطوة 4.4 على الأطباق (قطرها 40 أو 60 مم) التي لم يتم تغليفها بالكولاجين.
ملاحظة: تشمل الخلايا غير الملتصقة الضامة والخلايا الليمفاوية الأخرى والخلايا الليفية المتبقية من أنسجة التهاب الغشاء المفصلي. - استزرع الخلايا السائبة لمدة يوم واحد عند 37 درجة مئوية في جو مرطب مع 5٪ CO2.
- لإزالة الخلايا الليمفاوية غير الملتصقة ، قم بنضح الوسط المستزرع ، ثم أضف وسط استزراع جديد. كرر هذه العملية مرتين أو ثلاث مرات (الشكل 2B ، iii).
- استزرع الخلايا السائبة الملتصقة لمدة 1-2 أسابيع في وسط الاستزراع ، مع تغييرات متوسطة كل يومين مع الحفاظ على الالتقاء (الشكل 2B ، iv).
ملاحظة: يزداد عدد الرسائل القصيرة ببطء في ظل ظروف الاستزراع المشترك مع SFs. وبالتالي ، يجب تعديل فترة الثقافة المشتركة حسب الحاجة. - يغسل مع PBS أو HBSS مرتين. يعالج ب 0.05٪ تربسين في HBSS (حوالي 55 ميكرولتر / سم 2) لمدة 3 دقائق عند 37 درجة مئوية في جو مرطب مع 5٪ CO2. تنفصل الخلايا الليفية بسهولة عن طبق الاستزراع عن طريق علاج التربسين ، وتظهر البلاعم مقاومة لعلاج التربسين. استخدم هذه الخاصية لاختيار الضامة الزليلية.
- أضف وسط الاستزراع (حوالي 222 ميكرولتر / سم2) برفق إلى 0.05٪ تربسين في HBSS. بعد هذه الخطوة ، لا تصب الوسط مباشرة على الخلايا.
- لإزالة الخلايا المنفصلة ، قم باستنشاق الوسط المزروع ، ثم أضف وسط ثقافة جديد برفق. كرر هذه العملية مرتين أو ثلاث مرات. احتفظ بالخلايا المتبقية على الطبق في وسط استزراع طازج حتى الاستخدام (الشكل 2B ، v).
ملاحظة: بعد علاج التربسين ، تظهر الخلايا الملتصقة خصائص مورفولوجية تشبه البلاعم.

الشكل 2: فصل الأجزاء الغنية بالبلاعم والأجزاء الغنية بالخلايا الليفية عن أنسجة التهاب المفاصل. أ: مخطط الإجراء لفصل الخلايا الغنية بالبلاعم والخلايا الغنية بالخلايا الليفية عن أنسجة التهاب المفاصل. (ب) صور تباين الطور التمثيلية لمراحل الإجراء ، (i) إلى (v) في الشكل 2A. يمثل شريط المقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
خضعت إناث الفئران C57BL / 6 في عمر 7-8 أسابيع لالتهاب المفاصل الناجم عن الأجسام المضادة للكولاجين. تم عزل الخلايا الشبيهة بالبلاعم والخلايا الشبيهة بالخلايا الليفية بشكل مستقل عن أنسجة التهاب المفاصل الالتهابي وفقا للإجراء الموصوف أعلاه (الشكل 2 أ ، ب). تم استخدام الخل...
Discussion
تعمل هذه الطريقة التي تم تطويرها هنا على تحسين التقنيات السابقة لعزل كل من SFs من التهاب المفاصل في الفئران والبلاعم المقيمة من عدد من الأعضاء7،11. يمكن للطريقة المعدلة عزل كل من الضامة والخلايا الليفية من الغشاء الزليلي الالتهابي بنقاوة عالية ، وهي بسيطة وقا...
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
يشكر المؤلفون الموظفين في قسم دعم البحوث الطبية ، ومركز دعم البحوث المتقدمة (ADRES) ، وأعضاء قسم الفيزيولوجيا المرضية التكاملية ، مركز علوم البروتينات (PROS) ، جامعة إهيمه ، على مساعدتهم الفنية ودعمهم المفيد. تم دعم هذه الدراسة جزئيا من قبل الجمعية اليابانية لتعزيز العلوم (JSPS) KAKENHI منح JP17K17929 ، JP19K16015 ، JP21K05974 (إلى NS) و JP23689066 ، JP15H04961 ، JP15K15552 ، JP17K19728 ، JP19H03786 (إلى YI) ؛ منح من مؤسسة أوساكا للبحوث الطبية للأمراض المستعصية ، ومؤسسة ناكاتومي ، والجمعية اليابانية لأبحاث العظام والمعادن (JSBMR) منحة النجوم الصاعدة ، ومؤسسة سوميتومو ، ومؤسسة سينشين للبحوث الطبية ، ومؤسسة موتشيدا التذكارية (إلى NS) ؛ ومنحة مؤسسة تاكيدا للعلوم للبحوث الطبية، ومنحة مشروع UCB Japan (UCBJ)، ومنحة JSBMR Frontier Scientist لعام 2019 (إلى YI).
Materials
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
References
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved