JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 관절염 조직에서 Primary Synovial Macrophages and Fibroblasts의 분리 및 배양
요약
본 연구는 쥐의 염증성 관절염 조직으로부터 활막 대식세포 및 섬유아세포를 분리하기 위한 수정된 프로토콜을 제공한다.
초록
류마티스 관절염은 관절의 만성 염증을 유발하는자가 면역 질환입니다. 활막 대식세포와 활막 섬유아세포는 류마티스 관절염의 발병기전에서 중심적인 역할을 합니다. 염증성 관절염의 병리학적 진행과 완화의 기본 메커니즘을 밝히기 위해 두 세포 집단의 기능을 이해하는 것이 중요합니다. 일반적으로, 시험관 내 실험 조건은 가능한 한 생체내 환경을 모방해야 한다. 일차 조직 유래 세포는 관절염에서 활막 섬유아세포를 특성화하는 실험에 사용되었습니다. 이에 반해 염증성 관절염에서 대식세포의 생물학적 기능을 조사하는 실험에서는 세포주, 골수 유래 대식세포, 혈액 단핵구 유래 대식세포를 사용하였다. 그러나, 이러한 대식세포가 실제로 조직에 상주하는 대식세포의 기능을 반영하는지 여부는 불분명하다. 상주하는 대식세포를 얻기 위해, 이전 프로토콜은 염증성 관절염 마우스 모델에서 활막 조직에서 일차 대식세포와 섬유아세포를 모두 분리하고 확장하도록 수정되었습니다. 이러한 일차 활막 세포는 염증성 관절염의 시험관내 분석에 유용할 수 있습니다.
서문
류마티스 관절염 (RA)은 활액막의 증식을 특징으로하는자가 면역 질환으로 관절 파괴를 유발합니다 1,2. 조직에 상주하는 대식세포와 섬유아세포는 관절 항상성을 유지하기 위해 건강한 활막에 존재합니다. RA 환자에서, 활막 섬유아세포(SFs)가 증식하고, 단핵구를 포함한 면역 세포가 활막 및 관절액으로 침윤하며, 염증과 관련된 과정이다 1,3,4. 상주 대식세포 및 말초 혈액 단핵구 유래 대식세포를 포함하는 활막 대식세포(SM) 및 SF는 비정상적으로 활성화되며 RA 발병기전에서 중요한 역할을 합니다. 최근 연구에 따르면 SM과 SF 사이의 세포-세포 상호작용은 RA 5,6의 악화 및 완화 모두에 기여합니다.
RA 발병기전을 이해하기 위해 K/BxN 혈청 전달 관절염, 콜라겐 유도 관절염 및 콜라겐 항체 유도 관절염을 포함하여 염증성 관절염의 여러 설치류 모델이 사용되었습니다. 세포 기반 분석은 일반적으로 관절염의 분자 기능을 명확히 하는 데 필요합니다. 따라서 관절염 동물 모델로부터의 일차 세포가 분리되었다. 쥐의 관절염 조직으로부터 SF를 분리하는 방법은 잘 확립되어 있으며, 이들 세포는 관절염 발병기전에서 분자 기전의 해명에 기여하였다 7,8. 한편, 골수 유래 대식세포, 혈액 단핵구 유래 대식세포 및 대식세포 세포주는 관절염 연구를 위한 대식세포 자원으로 자주 사용되어 왔다 9,10. 대식세포는 미세 환경과 관련된 기능을 획득할 수 있기 때문에 대식세포의 일반적인 공급원은 관절염 조직에 특이적인 반응이 부족할 수 있습니다. 또한, 쥐의 활막은 관절염 모델에서도 매우 작은 조직이기 때문에 분류하여 충분한 활막 세포를 얻는 것이 어렵습니다. 시험관 내 연구를 위한 활막 대식세포의 사용 부족은 관절염 연구의 한계였습니다. 활막 대식세포를 분리하고 확장하기 위한 프로토콜의 확립은 RA에서 병리학적 기전을 밝히는 데 이점이 될 것입니다.
SF를 분리하는 이전 방법에서는 SM을 폐기했습니다7. 그 외에도 일부 장기에서 상주하는 대식세포를 분리하고 확장하는 방법이 보고되었다11. 따라서 기존 프로토콜이 조합되어 수정되었습니다. 수정은 고순도로 SM과 SF 모두의 1차 배양을 달성하는 것을 목표로 합니다. 이 방법의 전반적인 목표는 쥐 관절염 조직에서 SM과 SF를 모두 분리하고 확장하는 것입니다.
프로토콜
동물을 대상으로 한 실험은 에히메대학 동물실험위원회의 승인을 받아 에히메대학 동물실험 지침(37A1-1*16)에 따라 실시했습니다.
1. 기구, 시약 및 배양액의 준비
- 다음과 같이 배양 배지를 준비합니다: Dulbecco's Modified Eagle Medium(DMEM)에 10% 소 태아 혈청(FBS)과 1% 항생제-항진균 용액(항-항균제)을 보충합니다.
- 다음과 같이 소화 배지를 준비합니다: 배양 배지에 1mg/mL 콜라게나제 유형 IV를 보충합니다. 사용 직전에 콜라게나제 농도를 조절하십시오.
- 유형 I-C 콜라겐을 0.15mM HCl 용액으로 1mg/mL 농도로 희석합니다. 홍수 배양 접시 (직경 40 또는 60 mm)에 희석 된 콜라겐 용액을 넣습니다. 실온에서 6-12 시간 후, 접시에서 콜라겐 용액을 제거하고 실온에서 건조시킵니다. 콜라겐으로 코팅된 접시는 실온에서 최소 1주일 동안 보관할 수 있습니다. 사용하기 전에 미리 코팅된 접시를 인산염 완충 식염수(PBS) 또는 배지로 세척하십시오.
- 가위, 끝이 톱니 모양의 핀셋, 가는 핀셋과 같은 멸균 수술 기구를 준비합니다. 사용하기 전에 70% 에탄올에 담그십시오.
2. 생쥐의 활막염 조직의 제조 ( 도 1A)
- 뒷발에 염증성 관절염이있는 마우스를 준비하십시오.
참고: 콜라겐 항체 유발 관절염(CAIA) 또는 K/BxN 혈청 이식 관절염(STA)이 있는 출생 후 7-8주 암컷 C57BL/6 마우스(18-20g)가 이 프로토콜에 사용되었습니다8. 부풀어 오르지 않은(즉, 건강한) 조직에서 SM을 분리하는 것은 세포 수가 부족하기 때문에 어려울 수 있습니다. - 80mg/kg 케타민과 16mg/kg 자일라진을 복강내 주사하여 마우스를 마취합니다. 70 % 에탄올로 마우스를 청소하십시오.
- 가슴 부위를 가위로 잘라 심장을 노출시킵니다. 가위로 심장의 오른쪽 귓바퀴를 자른 다음 23G 나비 바늘을 심장 정점을 통해 좌심실에 꽂은 다음 주사기를 사용하여 멸균 PBS 15-20mL를 환류시켜 말초 혈액을 수동으로 제거합니다(약 1mL/2초).
- 가위를 사용하여 피부를 자르고 톱니 모양의 팁이 있는 핀셋을 사용하여 피부를 당겨 뒷발을 장식합니다.
알림: 이 단계 후에는 s를 취급할 때 핀셋을 사용하는 것이 좋습니다.amp르. 쥐 털이 붙는 것을 피하기 위해 손가락으로 절피 된 조직을 만지지 마십시오. - 잡아당겨 중족지절관절을 탈구시킨 후 가위로 관절의 인대를 절단하여 발가락을 제거합니다.
- 가위를 사용하여 발목 근처의 다리 근육의 힘줄을 자릅니다. 핀셋으로 힘줄을 잡고 다리 아래쪽의 근위부 근육을 벗겨 경골을 노출시킵니다. 비골을 제거하십시오.
- 당겨서 무릎 관절을 탈구시킨 다음 가위로 관절의 인대를 절단하여 부은 뒷발로 경골을 분리합니다. 3.1단계로 처리할 때까지 샘플을 얼음처럼 차가운 배양 배지(0.3mL/cm2)에 보관합니다.
3. 활액막염 조직의 소화 ( 그림 1B)
- 샘플을 피하고 배양 배지를 흡인한 다음 신선한 배양 배지(0.3mL/cm2)를 추가합니다. 세척 과정을 서너 번 반복하십시오.
알림: 이 단계부터 s의 취급amp깨끗한 벤치 또는 안전 캐비닛에서 무균 상태로 수행해야 합니다. - 실체 현미경(10x-20x 배율)에서 배양 배지의 미세 핀셋을 사용하여 당겨 샘플의 모든 관절을 탈구시킵니다. 이 단계에서는 미세한 핀셋이 편리합니다. 경골과 가능한 한 많은 혈관, 힘줄 및 인대를 제거하십시오. 탈구 할 때 뼈가 부러지지 않도록주의하십시오.
- 시료당 2개의 15mL 튜브를 준비합니다. 핀셋을 사용하여 연조직이 있는 탈구된 뼈를 처음 15mL 튜브로 옮깁니다. 양쪽 뒷발에서 얻은 샘플당 4mL의 소화 배지를 튜브에 추가합니다.
- 잔류 세포 및 조직 단편을 수집하기 위해, 샘플이 함유된 배지를 제2 15 mL 튜브로 옮긴다. 배지를 실온에서 5분 동안 500 x g 로 원심분리합니다. 상층액을 제거한 후 펠릿을 1mL의 소화 배지로 재현탁하고 세포 및 조직 단편 용액을 거의 모든 조직(총 5mL의 소화 배지/뒷발)을 포함하는 처음 15mL 튜브로 옮깁니다.
- 샘플을 하이브리드화 오븐에서 진탕하면서 37°C에서 60-120분 동안 분해한다.
알림: 샘플을 소화하는 최적의 시간을 결정해야 합니다. 시간은 발목과 콜라겐 분해 효소의 붓기 정도에 따라 다릅니다. 대부분의 경우 60-120분이면 충분합니다. 배양 60분 후, 소화된 샘플의 일부를 피펫팅으로 수집하고, 현미경으로 관찰한다. 소화가 불충분하면 배양을 계속하고 30 분마다 소화를 점검해야합니다. - 용액을 잘 피펫하십시오. 세포 여과기(40μm 공극 크기)를 통해 세포 용액을 50mL 튜브로 여과합니다.
- 세포 여과기를 통해 50mL 튜브에 배양액 10mL를 추가합니다. 실온에서 5분 동안 300 x g 로 원심분리합니다.
- 상층액을 제거한 후 배양액 10mL로 재현탁합니다. 원심 분리를 반복하십시오. 상층액을 제거한 후 2mL의 배양액으로 재현탁합니다.
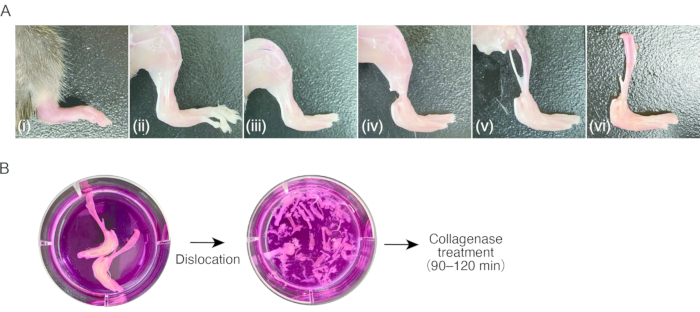
그림 1: 쥐 관절염 조직 샘플링 및 콜라게나제 소화 절차. (ᅡ) (i) 염증성 관절염이 있는 쥐 뒷발. (ii) 뒷발의 피부 제거. (iii) 중족지절관절의 탈구 및 발가락 제거. (iv) 발목의 힘줄 절단. (v) 다리 아래 근육의 제거. (vi) 무릎 관절의 탈구. (b) 왼쪽; 배양 배지에서 절제된 다리. 오른쪽; 탈구된 tarsus 및 metatarsus 배양 배지에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 활막 섬유아세포의 분리( 그림 2A)
- 양쪽 발목으로부터 얻은 모든 세포 현탁액을 콜라겐 코팅된 접시에 시드한다.
참고: 부종이 약하거나 중간 정도인 발목을 사용하여 세포를 얻는 경우 직경 40mm의 접시를 적용합니다. 양쪽 발목이 심하게 부어오르면 콜라겐 코팅 접시 크기를 직경 60mm 접시로 변경할 수 있습니다. - 배양 배지(약 222μL/cm2)를 추가합니다. 5%CO2로 가습된 분위기에서 37°C에서 1시간 동안 인큐베이션한다.
- 피펫을 사용하여 부착되지 않은 세포를 수집합니다(5.1단계에서 사용). 콜라겐이 코팅된 접시를 배양액으로 세척하고 배지를 수거한다. 부착 세포를 신선한 배지에서 배양합니다(그림 2B, i). 콜라겐 코팅 접시에 빠르게 부착되는 대부분의 세포는 섬유아세포질(방추형) 형태를 나타냅니다.
- 계대-합류성 세포는 행크스 평형염 용액(HBSS)에서 0.05% 트립신으로 처리하였다. 이 방법에서, 다른 세포의 오염은 초기 팽창 시에도 제한된다. 더 정제된 섬유아세포 유사 세포가 필요한 경우 순도를 높일 수 있도록 반복적인 계대배양을 수행합니다. 그러나 접착력에서 세포의 세포질 확장도 관찰됩니다(그림 2B, ii). 과도한 계대는 세포의 순진한 특성의 손실에 영향을 미치기 때문에 계대가 5 개 미만인 세포를 사용하십시오.
5. 활막 대식세포의 분리( 그림 2A)
- 콜라겐으로 코팅되지 않은 접시(직경 40 또는 60mm)에 4.4단계의 모든 비부착 세포를 시딩합니다.
참고: 비부착성 세포에는 대식세포, 기타 림프구 및 활막염 조직의 잔류 섬유아세포가 포함됩니다. - 벌크 세포를 5%CO2로 가습된 분위기에서 37°C에서 1일 동안 배양하였다.
- 비부착성 림프구를 제거하려면 배양된 배지를 흡인한 다음 새로운 배양 배지를 추가합니다. 이 과정을 두세 번 반복합니다(그림 2B, iii).
- 부착된 벌크 세포를 배양 배지에서 1-2주 동안 배양하고 합류를 유지하면서 2일마다 배지를 교체합니다(그림 2B, iv).
참고: SM의 수는 SF와의 공동 배양 조건에서 서서히 증가합니다. 따라서 공동 배양 기간은 필요에 따라 조정되어야 합니다. - PBS 또는 HBSS로 두 번 씻으십시오. HBSS (약 55 μL/ cm 2)에서 0.05 % 트립신으로 3 ° C에서 37 분 동안 5 % CO2로 가습 된 분위기에서 처리하십시오. 섬유아세포는 트립신 처리에 의해 배양 접시에서 쉽게 분리되며, 대식세포는 트립신 처리에 내성을 나타낸다. 활액 대 식세포의 선택에이 속성을 사용하십시오.
- 배양 배지(약 222μL/cm2)를 HBSS의 0.05% 트립신에 부드럽게 추가합니다. 이 단계 후에 배지를 세포에 직접 붓지 마십시오.
- 분리된 세포를 제거하려면 배양된 배지를 흡인한 다음 신선한 배양 배지를 부드럽게 추가합니다. 이 과정을 두세 번 반복하십시오. 사용할 때까지 접시에 남아있는 세포를 신선한 배양 배지에 보관하십시오 (그림 2B, v).
참고: 트립신 처리 후 부착 세포는 대식세포와 유사한 형태학적 특성을 나타냅니다.

그림 2: 염증성 관절염 조직에서 대식세포가 풍부한 분획과 섬유아세포가 풍부한 분획의 분리. (A) 관절염 조직에서 대식세포가 풍부한 세포와 섬유아세포가 풍부한 세포를 분리하는 절차의 도식. (B) 도 2A의 절차의 단계들, (i) 내지 (v)의 대표적인 위상차 이미지. 스케일 바는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
7-8주령의 암컷 C57BL/6 마우스는 콜라겐 항체 유발 관절염을 겪었습니다. 대식세포-유사 세포 및 섬유아세포-유사 세포는 상기 기술된 절차에 따라 염증성 관절염 조직으로부터 독립적으로 분리되었다(도 2A, B). 대식세포-유사 세포는 단계 5.7 직후에 사용하였다. 섬유아세포-유사 세포는 초기에 단계 4.4 후에 서브-컨플루언트(sub-confluent)가 되도록 배양한 다음, 새?...
토론
여기에서 개발된 이 방법은 쥐 관절염으로부터 SF와 다수의 장기로부터 상주하는 대식세포를 분리하기 위한 이전의 기술들을 개선한다 7,11. 변형된 방법은 염증성 활막에서 대식세포와 섬유아세포를 모두 고순도로 분리할 수 있으며 간단하고 재현성이 있습니다. 이 방법은 세포 분류기와 같은 복잡한 도구가 필요하지 않기 때문에 누구나 수행 할 수 있...
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
저자는 에히메 대학 의료 연구 지원부, 고급 연구 지원 센터 (ADRES) 및 통합 병태 생리학 부서 (PROS) 구성원의 기술 지원과 유용한 지원에 감사드립니다. 이 연구는 일본 과학 진흥 협회 (JSPS)의 KAKENHI 보조금 JP17K17929, JP19K16015, JP21K05974 (NS) 및 JP23689066, JP15H04961, JP15K15552, JP17K19728, JP19H03786 (YI)에 의해 부분적으로 지원되었습니다. 난치성 질환 의학 연구 재단, 나카토미 재단, 일본 뼈 및 미네랄 연구 협회 (JSBMR) 라이징 스타 그랜트, 스미토모 재단, 센신 의학 연구 재단, 모치다 기념 재단 (NS에); 다케다 과학 재단 의학 연구 보조금, UCB Japan (UCBJ) 프로젝트 보조금 및 JSBMR Frontier Scientist 보조금 2019 (YI).
자료
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
참고문헌
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유