需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠关节炎组织中原代滑膜巨噬细胞和成纤维细胞的分离和培养
摘要
本研究提供了一种改进的方案,用于从小鼠炎性关节炎组织中分离滑膜巨噬细胞和成纤维细胞。
摘要
类风湿性关节炎是一种自身免疫性疾病,会导致关节慢性炎症。滑膜巨噬细胞和滑膜成纤维细胞在类风湿性关节炎的发病机制中起核心作用。重要的是要了解两个细胞群的功能,以揭示炎症性关节炎病理进展和缓解的机制。一般来说, 体外 实验条件应尽可能模仿 体内 环境。原代组织来源细胞已被用于表征关节炎滑膜成纤维细胞的实验。相反,在研究巨噬细胞在炎症性关节炎中的生物学功能的实验中,已经使用了细胞系、骨髓来源的巨噬细胞和血单核细胞来源的巨噬细胞。然而,目前尚不清楚这些巨噬细胞是否真的反映了组织驻留巨噬细胞的功能。为了获得常驻巨噬细胞,修改了先前的方案以在炎性关节炎小鼠模型中从滑膜组织中分离和扩增原代巨噬细胞和成纤维细胞。这些原代滑膜细胞可用于炎症性关节炎的 体外 分析。
引言
类风湿性关节炎(RA)是一种自身免疫性疾病,其特征是滑膜增生,导致关节破坏1,2。组织驻留的巨噬细胞和成纤维细胞存在于健康的滑膜中,以维持关节稳态。在 RA 患者中,滑膜成纤维细胞 (SF) 增殖,免疫细胞(包括单核细胞)浸润到滑膜和关节液中,与炎症相关的过程 1,3,4。滑膜巨噬细胞 (SM),包括常驻巨噬细胞和外周血单核细胞来源的巨噬细胞,以及 SF 异常激活,在 RA 发病机制中起重要作用。最近的研究表明,SM和SF之间的细胞间相互作用有助于RA 5,6的恶化和缓解。
为了了解RA的发病机制,已经使用了几种啮齿动物的炎症性关节炎模型,包括K/BxN血清转移关节炎、胶原蛋白诱导的关节炎和胶原抗体诱导的关节炎。通常需要基于细胞的测定来阐明关节炎的分子功能。因此,已经分离出关节炎动物模型中的原代细胞。从小鼠关节炎组织中分离SFs的方法已经建立,这些细胞有助于阐明关节炎发病机制中的分子机制7,8。另一方面,骨髓来源的巨噬细胞、血单核细胞来源的巨噬细胞和巨噬细胞系经常被用作关节炎研究的巨噬细胞资源9,10。由于巨噬细胞可以获得与其微环境相关的功能,因此巨噬细胞的一般来源可能缺乏关节炎组织特有的反应。此外,很难通过分选获得足够的滑膜细胞,因为即使在关节炎模型中,鼠滑膜也是一个非常小的组织。缺乏滑膜巨噬细胞用于体外研究一直是关节炎研究的局限性。建立分离和扩增滑膜巨噬细胞的方案对于阐明RA的病理机制将是一个优势。
在以前的SF分离方法中,SM被丢弃7。除此之外,据报道了一种从某些器官分离和扩增常驻巨噬细胞的方法11。因此,对现有协议进行了组合修改。该改性旨在实现SM和SF的原代培养物具有高纯度。该方法的总体目标是从小鼠关节炎组织中分离和扩增SM和SF。
研究方案
涉及动物的实验经爱媛大学动物实验委员会批准,并按照爱媛大学动物实验指南(37A1-1*16)进行。
1. 仪器、试剂和培养基的制备
- 按如下方式制备培养基:用10%胎牛血清(FBS)和1%抗生素 - 抗真菌溶液(抗抗)补充Dulbecco的改良鹰培养基(DMEM)。
- 按如下方式制备消化培养基:用1mg / mLIV型胶原酶补充培养基。使用前调整胶原酶浓度。
- 用 1 mM HCl 溶液稀释 I-C 型胶原蛋白至 0.15 mg/mL 的浓度。用稀释的胶原蛋白溶液淹没培养皿(直径40或60毫米)。在室温下6-12小时后,从培养皿中取出胶原蛋白溶液并在室温下干燥。涂有胶原蛋白的培养皿可以在室温下保存至少 1 周。使用前用磷酸盐缓冲盐水(PBS)或培养基清洗预涂布的餐具。
- 准备无菌手术器械,如剪刀、带锯齿尖端的镊子和细尖镊子。使用前浸泡在70%乙醇中。
2.小鼠滑膜炎组织的制备( 图1A)
- 准备一只后爪有炎症性关节炎的小鼠。
注意:雌性C57BL / 6小鼠(18-20g),出生后7-8周,胶原蛋白抗体诱导的关节炎(CAIA)或K / BxN血清转移关节炎(STA)用于本协议8。从非肿胀(即健康)组织中分离SM可能很困难,因为细胞数量不足。 - 通过腹膜内注射80mg / kg氯胺酮和16mg / kg甲苯噻嗪麻醉小鼠。用70%乙醇清洁小鼠。
- 用剪刀切开胸肌区域,露出心脏。用剪刀切开心脏的右耳廓,然后通过心脏顶点 将 23 G蝶针插入左心室,然后使用注射器手动去除外周血(约1mL / 2 s)反流15-20 mL无菌PBS。
- 用剪刀剪开皮肤,用锯齿状尖端的镊子拉皮肤,使后爪去皮质。
注意:在此步骤之后,建议使用镊子来处理样品。不要用手指触摸去皮质组织,以免附着鼠毛。 - 通过拉扯使跖趾关节脱臼,然后用剪刀切割关节的韧带以去除脚趾。
- 用剪刀剪断脚踝附近的小腿肌肉肌腱。用镊子抓住肌腱,将小腿近端的肌肉剥离,露出胫骨。切除腓骨。
- 通过拉扯使膝关节脱臼,然后用剪刀用肿胀的后爪分离胫骨,切断关节的韧带。将样品保存在冰冷的培养基(0.3 mL/ cm 2)中,直到处理至步骤3.1。
3.滑膜炎组织的消化( 图1B)
- 吸出培养基,避开样品,然后加入新鲜培养基(0.3 mL/cm2)。重复洗涤过程三到四次。
注意:从此步骤开始,样品的处理应在洁净工作台或安全柜中无菌进行。 - 通过在体视显微镜(10x-20x放大倍率)下使用培养基中的细点镊子拉动样品的所有关节,使样品的所有关节脱臼。在此步骤中,细点镊子很方便。切除胫骨以及尽可能多的血管、肌腱和韧带。脱臼时注意不要骨折。
- 每个样品准备两个 15 mL 管。使用镊子将带有软组织的脱臼骨转移到第一个 15 mL 管中。将每个样品从双后爪获得的消化培养基加入管中。
- 为了收集残留的细胞和组织碎片,将包含样品的培养基转移到第二个15 mL管中。在室温下以500× g 离心培养基5分钟。除去上清液后,用 1 mL 消化培养基重悬沉淀,并将细胞和组织碎片溶液转移到包含几乎所有组织(总共 5 mL 消化培养基/后爪)的前 15 mL 管中。
- 将样品在37°C下在杂交炉中振荡消化60-120分钟。
注意:应确定消解样品的最佳时间。时间取决于脚踝和胶原酶的肿胀程度。在大多数情况下,60-120分钟就足够了。孵育60分钟后,通过移液收集一部分消化的样品,并在显微镜下观察。如果消化不足,应继续孵育,每30分钟检查一次消化。 - 充分移液。通过细胞过滤器(40 μm 孔径)将细胞溶液过滤到 50 mL 管中。
- 通过细胞过滤器向 50 mL 管中加入 10 mL 培养基。在室温下以300× g 离心5分钟。
- 除去上清液后,用10mL培养基重悬。重复离心。除去上清液后,用2mL培养基重悬。
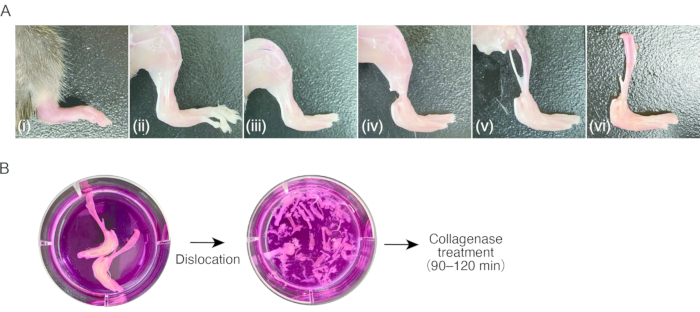
图1:小鼠关节炎组织和胶原酶消化取样程序 。 (A) (i) 鼠后爪伴炎性关节炎。(二) 去除后爪的皮肤。(iii)跖趾关节脱位和脚趾切除。(四) 切断脚踝肌腱。(五) 去除小腿肌肉。(六)膝关节脱位。(b) 左;在培养基中切除腿。右;培养基中的跗骨和跖骨脱位。 请点击此处查看此图的大图。
4.滑膜成纤维细胞的分离( 图2A)
- 将所有从双脚踝获得的细胞悬浮液接种在涂有胶原蛋白的培养皿上。
注意:如果使用弱或中度肿胀的脚踝来获得细胞,则使用直径为40毫米的培养皿。如果两个脚踝都有严重的肿胀,胶原蛋白涂层的培养皿尺寸可以更改为直径为 60 毫米的培养皿。 - 加入培养基(约 222 μL/cm2)。在37°C下在含有5%CO 2的潮湿气氛中孵育1小时。
- 使用移液管收集非贴壁细胞(在步骤5.1中使用)。用培养基清洗胶原蛋白涂层的培养皿并收集培养基。在新鲜培养基中培养贴壁细胞(图2B,i)。大多数快速粘附在胶原蛋白包被培养皿上的细胞表现出成纤维细胞样(纺锤形)形态。
- 通过在汉克斯平衡盐溶液(HBSS)中用0.05%胰蛋白酶处理来传代亚汇合细胞。在这种方法中,即使在初始扩增中,其他细胞的污染也是有限的。如果需要更多纯化的成纤维细胞样细胞,请进行重复传代以提高纯度;然而,也观察到细胞细胞质在粘附中的扩张(图2B,ii)。由于过多的传代会影响细胞中幼稚特征的丧失,因此请使用少于5代的细胞。
5.滑膜巨噬细胞的分离( 图2A)
- 将步骤4.4中的所有非贴壁细胞接种在未涂有胶原蛋白的培养皿(直径为40或60毫米)上。
注意:非贴壁细胞包括巨噬细胞,其他淋巴细胞和滑膜炎组织的残留成纤维细胞。 - 将块细胞在37°C下在含有5%CO2的潮湿气氛中培养1天。
- 为了去除非贴壁淋巴细胞,吸出培养基,然后加入新鲜培养基。重复此过程两到三次(图2B,iii)。
- 在培养基中培养贴壁大块细胞1-2周,培养基每2天更换一次,同时保持汇合(图2B,iv)。
注意:在与SF共培养的条件下,SM的数量缓慢增加。因此,应根据需要调整共培养期。 - 用PBS或HBSS清洗两次。在含有5%CO2的潮湿气氛中用HBSS(约55μL /cm 2)中的0.05%胰蛋白酶处理3分钟。成纤维细胞很容易通过胰蛋白酶处理从培养皿中分离出来,巨噬细胞对胰蛋白酶处理表现出耐药性。使用此属性选择滑膜巨噬细胞。
- 在HBSS中将培养基(约222μL/cm2)轻轻加入到0.05%胰蛋白酶中。完成此步骤后,请勿将培养基直接倒入细胞上。
- 要去除分离的细胞,吸出培养基,然后轻轻加入新鲜培养基。重复此过程两到三次。将培养皿上的剩余细胞保持在新鲜培养基中直至使用(图2B,v)。
注意:胰蛋白酶处理后,贴壁细胞表现出巨噬细胞样形态特征。

图2:从炎性关节炎组织中分离富含巨噬细胞和成纤维细胞 的部分。 (A)从关节炎组织中分离富含巨噬细胞和富含成纤维细胞的程序图式。(B) 图2A中(i)至(v)程序各阶段的代表性相衬图像。比例尺代表 100 μm。 请点击此处查看此图的大图。
结果
7-8周龄的雌性C57BL / 6小鼠经历胶原抗体诱导的关节炎。根据上述程序,从炎性关节炎组织中独立分离巨噬细胞样细胞和成纤维细胞样细胞(图2A,B)。步骤5.7后立即使用巨噬细胞样细胞。成纤维细胞样细胞最初在步骤4.4后培养为亚汇合,然后传代到新的培养皿中,然后使用。为了评估SM和SF是否被成功分离,进行了以下实验。
为了评估分离?...
讨论
这里开发的这种方法改进了以前从小鼠关节炎中分离SF和从许多器官中分离常驻巨噬细胞的技术7,11。改进的方法可以从炎性滑膜中分离出巨噬细胞和成纤维细胞,纯度高,简单易重复。由于该方法不需要细胞分选仪等复杂仪器,因此任何人都可以进行。此外,本技术避免了与其他方法相关的问题,例如荧光激活细胞分选(FACS)和磁激活细胞分选(MACS)...
披露声明
提交人声明他们没有竞争利益。
致谢
作者感谢医学研究支持部,高级研究支持中心(ADRES)的工作人员以及爱媛大学蛋白质科学中心(PROS)综合病理生理学部的成员,感谢他们的技术援助和有益的支持。这项研究得到了日本科学促进会(JSPS)KAKENHI赠款JP17K17929,JP19K16015,JP21K05974(NS)和JP23689066,JP15H04961,JP15K15552,JP17K19728,JP19H03786(YI)的部分支持;大阪疑难病医学研究财团、中富财团、日本骨与矿物研究学会(JSBMR)明日之星财团、住友财团、SENSHIN医学研究财团、望田纪念财团(致NS)的资助;以及武田科学基金会医学研究基金、UCB日本(UCBJ)项目资助和2019年JSBMR前沿科学家资助(致YI)。
材料
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
参考文献
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。