È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento e coltura di macrofagi sinoviali primari e fibroblasti da tessuto di artrite murina
In questo articolo
Riepilogo
Il presente studio fornisce un protocollo modificato per isolare i macrofagi sinoviali e i fibroblasti dal tessuto dell'artrite infiammatoria murina.
Abstract
L'artrite reumatoide è una malattia autoimmune che porta all'infiammazione cronica delle articolazioni. I macrofagi sinoviali e i fibroblasti sinoviali hanno ruoli centrali nella patogenesi dell'artrite reumatoide. È importante comprendere le funzioni di entrambe le popolazioni cellulari per rivelare i meccanismi alla base della progressione patologica e della remissione nell'artrite infiammatoria. In generale, le condizioni sperimentali in vitro dovrebbero imitare il più possibile l'ambiente in vivo . Le cellule primarie derivate dai tessuti sono state utilizzate in esperimenti che caratterizzano i fibroblasti sinoviali nell'artrite. Al contrario, negli esperimenti che studiano le funzioni biologiche dei macrofagi nell'artrite infiammatoria, sono state utilizzate linee cellulari, macrofagi derivati dal midollo osseo e macrofagi derivati dai monociti del sangue. Tuttavia, non è chiaro se tali macrofagi riflettano effettivamente le funzioni dei macrofagi residenti nei tessuti. Per ottenere macrofagi residenti, i protocolli precedenti sono stati modificati per isolare ed espandere sia i macrofagi primari che i fibroblasti dal tessuto sinoviale in un modello murino di artrite infiammatoria. Queste cellule sinoviali primarie possono essere utili per l'analisi in vitro dell'artrite infiammatoria.
Introduzione
L'artrite reumatoide (RA) è una malattia autoimmune caratterizzata da iperplasia della sinovia, che porta alla distruzione articolare 1,2. I macrofagi e i fibroblasti residenti nei tessuti sono presenti nella sinovia sana per mantenere l'omeostasi articolare. Nei pazienti con AR, i fibroblasti sinoviali (SF) proliferano e le cellule immunitarie, compresi i monociti, si infiltrano nella sinovia e nel liquido articolare, processi associati all'infiammazione 1,3,4. I macrofagi sinoviali (SM), che comprendono i macrofagi residenti e i macrofagi derivati dai monociti del sangue periferico, e i SF sono attivati in modo aberrante e hanno ruoli importanti nella patogenesi dell'AR. Studi recenti hanno suggerito che le interazioni cellula-cellula tra SM e SF contribuiscono sia all'esacerbazione che alla remissione di RA 5,6.
Per comprendere la patogenesi dell'AR, sono stati utilizzati diversi modelli di roditori di artrite infiammatoria, tra cui l'artrite da trasferimento del siero K / BxN, l'artrite indotta dal collagene e l'artrite indotta da anticorpi al collagene. I saggi basati sulle cellule sono generalmente necessari per chiarire le funzioni molecolari nell'artrite. Pertanto, sono state isolate cellule primarie da modelli animali di artrite. Il metodo per isolare le SF dal tessuto dell'artrite murina è ben consolidato, e queste cellule hanno contribuito alla delucidazione dei meccanismi molecolari nella patogenesi dell'artrite 7,8. D'altra parte, i macrofagi derivati dal midollo osseo, i macrofagi derivati dai monociti del sangue e le linee cellulari dei macrofagi sono stati spesso utilizzati come risorse macrofagiche per gli studi sull'artrite 9,10. Poiché i macrofagi possono acquisire funzioni associate al loro microambiente, le fonti generali di macrofagi possono mancare di risposte specifiche al tessuto artrite. Inoltre, è difficile ottenere abbastanza cellule sinoviali mediante selezione, poiché la sinovia murina è un tessuto molto piccolo anche nei modelli di artrite. La mancanza di utilizzo di macrofagi sinoviali per studi in vitro è stata una limitazione negli studi sull'artrite. L'istituzione di un protocollo per isolare ed espandere i macrofagi sinoviali sarebbe un vantaggio per la delucidazione dei meccanismi patologici nell'AR.
Nel metodo precedente per isolare le SF, gli SM sono stati scartati7. Oltre a ciò, è stato riportato un metodo per isolare ed espandere i macrofagi residenti da alcuni organi11. Pertanto, i protocolli esistenti sono stati modificati in combinazione. La modifica mira a raggiungere la cultura primaria sia di SM che di SF con elevata purezza. L'obiettivo generale di questo metodo è quello di isolare ed espandere sia SM che SF dal tessuto di artrite murina.
Protocollo
Gli esperimenti che coinvolgono animali sono stati approvati dall'Animal Experiment Committee dell'Università di Ehime e sono stati eseguiti in conformità con le linee guida dell'Università di Ehime per gli esperimenti sugli animali (37A1-1 * 16).
1. Preparazione di strumenti, reagenti e terreno di coltura
- Preparare il terreno di coltura come segue: integrare Dulbecco Modified Eagle Medium (DMEM) con siero bovino fetale al 10% (FBS) e soluzione antibiotico-antimicotica all'1% (anti-anti).
- Preparare il mezzo di digestione come segue: integrare il terreno di coltura con 1 mg/ml di collagenasi di tipo IV. Regolare la concentrazione di collagenasi appena prima dell'uso.
- Diluire il collagene di tipo I-C ad una concentrazione di 0,15 mg/ml con 1 mM di soluzione di HCl. Piatti di coltura alluvionale (diametro di 40 o 60 mm) con la soluzione di collagene diluito. Dopo 6-12 ore a temperatura ambiente, rimuovere la soluzione di collagene dai piatti e asciugare a temperatura ambiente. I piatti rivestiti di collagene possono essere conservati a temperatura ambiente per almeno 1 settimana. Lavare le stoviglie pre-rivestite con soluzione salina tamponata fosfato (PBS) o terreno prima dell'uso.
- Preparare strumenti chirurgici sterili, come forbici, pinzette con punte seghettate e pinzette a punta fine. Immergere in etanolo al 70% prima dell'uso.
2. Preparazione del tessuto sinovite nei topi ( Figura 1A)
- Preparare un topo con artrite infiammatoria nelle zampe posteriori.
NOTA: Per questo protocollo 8 sono stati utilizzati topi femmina C57BL / 6 (18-20 g),7-8 settimane postnatali, con artrite indotta da anticorpi collagene (CAIA) o artrite da trasferimento sierico K / BxN (STA). Isolare le SM da tessuto non gonfio (cioè sano) potrebbe essere difficile, poiché il numero di cellule è insufficiente. - Anestetizzare i topi mediante iniezione intraperitoneale di 80 mg/kg di ketamina e 16 mg/kg di xilazina. Pulire i topi con etanolo al 70%.
- Tagliare la regione pettorale con le forbici per esporre il cuore. Tagliare il padiglione auricolare destro del cuore con le forbici, quindi inserire un ago a farfalla da 23 G nel ventricolo sinistro attraverso l'apice del cuore, seguito da un reflusso di 15-20 ml di PBS sterile usando una siringa per rimuovere manualmente il sangue periferico (circa 1 ml / 2 s).
- Decorticare le zampe posteriori tagliando la pelle con le forbici e tirando la pelle usando una pinzetta con punte seghettate.
NOTA: dopo questo passaggio, si consiglia l'uso di pinzette per la manipolazione dei campioni. Non toccare il tessuto decorticato con le dita, per evitare l'attaccamento di peli murini. - Dislocare le articolazioni metatarso-falangee tirando, seguito tagliando i legamenti delle articolazioni usando le forbici per rimuovere le dita dei piedi.
- Tagliare i tendini dei muscoli della parte inferiore della gamba vicino alla caviglia usando le forbici. Afferrare il tendine con una pinzetta e sbucciare i muscoli prossimalmente nella parte inferiore della gamba per esporre la tibia. Rimuovere il perone.
- Dislocare l'articolazione del ginocchio tirando, seguita dal taglio dei legamenti delle articolazioni usando le forbici per staccare la tibia con la zampa posteriore gonfia. Conservare i campioni in terreno di coltura ghiacciato (0,3 ml/cm2) fino alla lavorazione fino alla fase 3.1.
3. Digestione del tessuto sinovite ( Figura 1B)
- Aspirare il terreno di coltura, evitando il campione, quindi aggiungere terreno di coltura fresco (0,3 mL/cm2). Ripetere il processo di lavaggio tre o quattro volte.
NOTA: da questa fase, la manipolazione dei campioni deve essere eseguita in modo asettico in un banco pulito o in un armadio di sicurezza. - Dislocare tutte le giunture dei campioni tirando usando una pinzetta a punta fine nel terreno di coltura sotto uno stereomicroscopio (con ingrandimento 10x-20x). Le pinzette a punta fine sono convenienti in questo passaggio. Rimuovere la tibia e il maggior numero possibile di vasi, tendini e legamenti. Fare attenzione a non rompere le ossa durante la dislocazione.
- Preparare due provette da 15 ml per campione. Trasferire le ossa lussate con tessuti molli al primo tubo da 15 ml usando una pinzetta. Aggiungere 4 ml di terreno di digestione per campione, ottenuto da entrambe le zampe posteriori, nel tubo.
- Per raccogliere cellule residue e frammenti di tessuto, trasferire il mezzo in cui il campione è stato contenuto nella seconda provetta da 15 ml. Centrifugare il terreno a 500 x g per 5 minuti a temperatura ambiente. Dopo aver rimosso il surnatante, risospendere il pellet con 1 mL di terreno di digestione e trasferire la soluzione di frammento cellulare e tissutale al primo tubo da 15 mL contenente quasi tutto il tessuto (totale di 5 mL di mezzo di digestione/zampe posteriori).
- Digerire il campione per 60-120 minuti a 37 °C agitando in forno di ibridazione.
NOTA: Il momento ottimale per digerire i campioni deve essere deciso. Il tempo dipende dal grado di gonfiore alle caviglie e alle collagenasi. Nella maggior parte dei casi, 60-120 minuti sono sufficienti. Dopo 60 minuti di incubazione, raccogliere una parte del campione digerito mediante pipettaggio e osservare al microscopio. Se la digestione è insufficiente, l'incubazione dovrebbe continuare e la digestione controllata ogni 30 minuti. - Pipet la soluzione bene. Filtrare la soluzione cellulare attraverso un filtro cellulare (dimensione dei pori di 40 μm) in un tubo da 50 ml.
- Aggiungere 10 ml di terreno di coltura al tubo da 50 ml attraverso il filtro cellulare. Centrifugare a 300 x g per 5 minuti a temperatura ambiente.
- Dopo aver rimosso il surnatante, risospendere con 10 ml di terreno di coltura. Ripetere la centrifugazione. Dopo aver rimosso il surnatante, risospendere con 2 ml di terreno di coltura.
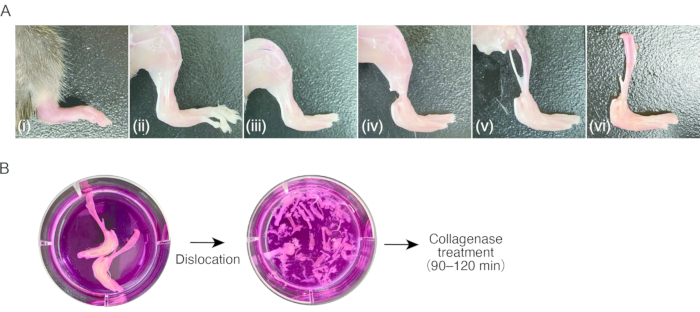
Figura 1: Procedura di campionamento del tessuto dell'artrite murina e della digestione della collagenasi . (A) (i) Zampa posteriore murina con artrite infiammatoria. ii) Rimozione della pelle della zampa posteriore. (iii) Dislocazione delle articolazioni metatarso-falangee e rimozione delle dita dei piedi. iv) Taglio dei tendini della caviglia. (v) Rimozione dei muscoli nella parte inferiore delle gambe. (vi) Dislocazione dell'articolazione del ginocchio. (b) sinistra; gambe asportate in terreno di coltura. A destra; Tarso e metatarso dislocati in terreno di coltura. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Isolamento dei fibroblasti sinoviali ( Figura 2A)
- Seminare tutte le sospensioni cellulari ottenute da entrambe le caviglie sul piatto rivestito di collagene.
NOTA: Se si utilizzano caviglie con gonfiore debole o moderato per ottenere le cellule, viene applicato un piatto di 40 mm di diametro. La dimensione del piatto rivestito di collagene può essere modificata in un piatto di 60 mm di diametro se entrambe le caviglie hanno un grave gonfiore. - Aggiungere terreno di coltura (circa 222 μL/cm2). Incubare per 1 h a 37 °C in atmosfera umidificata con 5% di CO2.
- Raccogliere le celle non aderenti usando un pipet (usare al punto 5.1). Lavare il piatto rivestito di collagene con terreno di coltura e raccogliere il terreno. Coltura delle cellule aderenti in terreno fresco (Figura 2B,i). La maggior parte delle cellule che aderiscono rapidamente al piatto rivestito di collagene mostrano una morfologia fibroblastoide (a forma di fuso).
- Passaggio di cellule subconfluenti mediante trattamento con tripsina allo 0,05% nella soluzione salina bilanciata di Hanks (HBSS). In questo metodo, la contaminazione di altre cellule è limitata, anche se nell'espansione iniziale. Se sono necessarie più cellule simili ai fibroblasti purificate, eseguire passaggi ripetuti per consentire il miglioramento della purezza; tuttavia, si osserva anche l'espansione del citoplasma delle cellule in adesione (Figura 2B,ii). Poiché passaggi eccessivi influenzano la perdita di caratteristiche ingenue nelle cellule, utilizzare cellule con meno di 5 passaggi.
5. Isolamento dei macrofagi sinoviali ( Figura 2A)
- Seminare tutte le cellule non aderenti dal punto 4.4 su piatti (diametro di 40 o 60 mm) che non sono stati rivestiti di collagene.
NOTA: Le cellule non aderenti includono macrofagi, altri linfociti e fibroblasti residui dal tessuto sinovite. - Coltivare le celle bulk per 1 giorno a 37 °C in atmosfera umidificata con il 5% di CO2.
- Per rimuovere i linfociti non aderenti, aspirare il terreno coltivato e quindi aggiungere terreno di coltura fresco. Ripetere questo processo due o tre volte (Figura 2B,iii).
- Coltura delle cellule di massa aderenti per 1-2 settimane in terreno di coltura, con variazioni del terreno ogni 2 giorni mantenendo la confluenza (Figura 2B,iv).
NOTA: Il numero di SM aumenta lentamente in condizioni di co-coltura con FS. Pertanto, il periodo di co-coltura dovrebbe essere adeguato secondo necessità. - Lavare con PBS o HBSS due volte. Trattare con tripsina allo 0,05% in HBSS (circa 55 μL/cm2) per 3 minuti a 37 °C in atmosfera umidificata con CO2 al 5%. I fibroblasti si staccano facilmente dal piatto di coltura con il trattamento con tripsina e i macrofagi mostrano resistenza al trattamento con tripsina. Utilizzare questa proprietà per la selezione dei macrofagi sinoviali.
- Aggiungere delicatamente terreno di coltura (circa 222 μL/cm2) allo 0,05% di tripsina in HBSS. Dopo questo passaggio, non versare il mezzo direttamente sulle cellule.
- Per rimuovere le cellule distaccate, aspirare il terreno di coltura e quindi aggiungere delicatamente terreno di coltura fresco. Ripeti questo processo due o tre volte. Mantenere le cellule rimanenti sul piatto in terreno di coltura fresco fino all'uso (Figura 2B,v).
NOTA: Dopo il trattamento con tripsina, le cellule aderenti presentano caratteristiche morfologiche simili ai macrofagi.

Figura 2: Separazione delle frazioni ricche di macrofagi e fibroblasti dal tessuto dell'artrite infiammatoria. (A) Schema della procedura per separare le cellule ricche di macrofagi e ricche di fibroblasti dal tessuto artrite. (B) Immagini rappresentative di contrasto di fase delle fasi della procedura, da (i) a (v) nella figura 2A. La barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
I topi femmina C57BL / 6 a 7-8 settimane di età sono stati sottoposti ad artrite indotta da anticorpi collagene. Le cellule simili ai macrofagi e le cellule simili ai fibroblasti sono state isolate indipendentemente dal tessuto dell'artrite infiammatoria secondo la procedura sopra descritta (Figura 2A, B). Le cellule simili ai macrofagi sono state immediatamente utilizzate dopo la fase 5.7. Le cellule simili ai fibroblasti sono state inizialmente coltivate per essere sub-co...
Discussione
Questo metodo sviluppato qui migliora le tecniche precedenti per isolare sia le SF dall'artrite murina che i macrofagi residenti da un certo numero di organi 7,11. Il metodo modificato può isolare sia i macrofagi che i fibroblasti dalla sinovia infiammatoria con elevata purezza ed è semplice e riproducibile. Poiché il metodo non richiede strumenti complessi come uno smistatore cellulare, chiunque può condurlo. Inoltre, la presente tecnica evita preoccupazioni...
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Gli autori ringraziano lo staff della Division of Medical Research Support, l'Advanced Research Support Center (ADRES) e i membri della Division of Integrative Pathophysiology, Proteo-Science Center (PROS), Ehime University, per la loro assistenza tecnica e il loro utile supporto. Questo studio è stato sostenuto in parte dalle sovvenzioni KAKENHI della Japan Society for the Promotion of Science (JSPS) JP17K17929, JP19K16015, JP21K05974 (a NS) e JP23689066, JP15H04961, JP15K15552, JP17K19728, JP19H03786 (a YI); sovvenzioni della Osaka Medical Research Foundation for Intractable Diseases, The Nakatomi Foundation, The Japanese Society for Bone and Mineral Research (JSBMR) Rising Stars Grant, The Sumitomo Foundation, SENSHIN Medical Research Foundation, The Mochida Memorial Foundation (to NS); e una sovvenzione per la ricerca medica della Takeda Science Foundation, una sovvenzione per progetti UCB Japan (UCBJ) e la sovvenzione JSBMR Frontier Scientist 2019 (a YI).
Materiali
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
Riferimenti
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon