É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento e Cultura de Macrófagos e Fibroblastos Sinoviais Primários de Tecido de Artrite Murina
Neste Artigo
Resumo
O presente estudo fornece um protocolo modificado para isolar macrófagos sinoviais e fibroblastos do tecido da artrite inflamatória murina.
Resumo
A artrite reumatoide é uma doença autoimune que leva à inflamação crônica das articulações. Macrófagos sinoviais e fibroblastos sinoviais têm papel central na patogênese da artrite reumatoide. É importante compreender as funções de ambas as populações celulares para revelar os mecanismos subjacentes à progressão patológica e remissão na artrite inflamatória. Em geral, as condições experimentais in vitro devem mimetizar ao máximo o ambiente in vivo . Células derivadas de tecidos primários têm sido utilizadas em experimentos caracterizando fibroblastos sinoviais em artrite. Em contraste, em experimentos investigando as funções biológicas de macrófagos em artrite inflamatória, linhagens celulares, macrófagos derivados da medula óssea e macrófagos derivados de monócitos sanguíneos têm sido usados. No entanto, não está claro se tais macrófagos realmente refletem as funções dos macrófagos residentes no tecido. Para a obtenção de macrófagos residentes, protocolos prévios foram modificados para isolar e expandir macrófagos primários e fibroblastos do tecido sinovial em um modelo de artrite inflamatória em camundongos. Essas células sinoviais primárias podem ser úteis para a análise in vitro da artrite inflamatória.
Introdução
A artrite reumatoide (AR) é uma doença autoimune caracterizada por hiperplasia da sinóvia, levando à destruiçãoarticular1,2. Macrófagos e fibroblastos residentes no tecido estão presentes na sinóvia saudável para manter a homeostase articular. Em pacientes com AR, fibroblastos sinoviais (FSs) proliferam e células imunes, incluindo monócitos, infiltram-se na sinóvia e no fluido articular, processos associados à inflamação 1,3,4. Macrófagos sinoviais (SMs), que incluem macrófagos residentes e macrófagos derivados de monócitos do sangue periférico, e SFs são aberrantemente ativados e têm papéis importantes na patogênese da AR. Estudos recentes têm sugerido que as interações célula-célula entre SMs e SFs contribuem tanto para a exacerbação quanto para a remissão da AR 5,6.
Para entender a patogênese da AR, vários modelos de artrite inflamatória em roedores têm sido usados, incluindo artrite de transferência sérica de K/BxN, artrite induzida por colágeno e artrite induzida por anticorpos de colágeno. Ensaios baseados em células são geralmente necessários para esclarecer as funções moleculares na artrite. Portanto, células primárias de modelos animais de artrite foram isoladas. O método para isolar as FS do tecido da artrite murina está bem estabelecido, e essas células têm contribuído para a elucidação de mecanismos moleculares na patogênese da artrite7,8. Por outro lado, macrófagos derivados da medula óssea, macrófagos derivados de monócitos sanguíneos e linhagens celulares de macrófagos têm sido frequentemente utilizados como recursos de macrófagos para estudos deartrite9,10. Uma vez que os macrófagos podem adquirir funções associadas ao seu microambiente, fontes gerais de macrófagos podem carecer de respostas específicas ao tecido da artrite. Além disso, é difícil obter células sinoviais suficientes por triagem, pois a sinóvia murina é um tecido muito pequeno, mesmo em modelos de artrite. A falta de uso de macrófagos sinoviais para estudos in vitro tem sido uma limitação em estudos de artrite. O estabelecimento de um protocolo para isolar e expandir macrófagos sinoviais seria uma vantagem para a elucidação dos mecanismos patológicos na AR.
No método anterior de isolamento das FS, os SMs eram descartados7. Além disso, foi relatado um método para isolar e expandir macrófagos residentes de alguns órgãos11. Portanto, os protocolos existentes foram modificados em combinação. A modificação visa atingir o cultivo primário de SMs e SFs com alta pureza. O objetivo geral deste método é isolar e expandir tanto SMs e SFs do tecido da artrite murina.
Protocolo
Experimentos envolvendo animais foram aprovados pelo Comitê de Experimentação Animal da Universidade de Ehime e foram realizados de acordo com as Diretrizes da Universidade de Ehime para Experimentos com Animais (37A1-1*16).
1. Preparação de instrumentos, reagentes e meio de cultura
- Preparar o meio de cultura da seguinte forma: suplementar o meio Dulbecco's Modified Eagle Medium (DMEM) com 10% de soro fetal bovino (FBS) e 1% de solução antibiótico-antimicótica (anti-anti).
- Preparar o meio de digestão da seguinte forma: complementar o meio de cultura com 1 mg/mL de colagenase tipo IV. Ajuste a concentração de colagenase imediatamente antes de usar.
- Diluir o colágeno tipo I-C até uma concentração de 0,15 mg/mL com solução de HCl 1 mM. Placas de cultura de inundação (diâmetro de 40 ou 60 mm) com a solução de colágeno diluída. Após 6-12 h à temperatura ambiente, retire a solução de colágeno das placas e seque à temperatura ambiente. Os pratos revestidos com colágeno podem ser mantidos em temperatura ambiente por pelo menos 1 semana. Lave as placas pré-revestidas com solução salina tamponada com fosfato (PBS) ou meio antes de usar.
- Prepare instrumentos cirúrgicos estéreis, como tesouras, pinças com pontas serrilhadas e pinças de ponta fina. Mergulhe em etanol 70% antes do uso.
2. Preparo do tecido de sinovite em camundongos ( Figura 1A)
- Prepare um rato com artrite inflamatória nas patas traseiras.
NOTA: Camundongos fêmeas C57BL/6 (18-20 g), 7-8 semanas pós-natal, com artrite induzida por anticorpos colágeno (CAIA) ou artrite de transferência sérica (STA) K/BxN foram utilizados para este protocolo8. Isolar SMs de tecido não inchado (ou seja, saudável) pode ser difícil, pois o número de células é insuficiente. - Anestesiar os camundongos por injeção intraperitoneal de 80 mg/kg de quetamina e 16 mg/kg de xilazina. Limpe os ratos com etanol 70%.
- Abra a região peitoral com uma tesoura para expor o coração. Cortar a aurícula direita do coração com uma tesoura e, em seguida, enfiar uma agulha borboleta de 23 G no ventrículo esquerdo através do ápice do coração, seguido por um refluxo de 15-20 mL de PBS estéril usando uma seringa para remover manualmente o sangue periférico (aproximadamente 1 mL/2 s).
- Decore as patas traseiras cortando a pele com tesoura e puxando a pele com pinça com pontas serrilhadas.
NOTA: Após esta etapa, recomenda-se o uso de pinças para o manuseio de amostras. Não toque no tecido decorticado com os dedos, para evitar a fixação de pelos murinos. - Deslocar as articulações metatarsofalangeanas puxando, seguido de cortar os ligamentos das articulações usando tesoura para remover os dedos.
- Corte os tendões dos músculos da perna perto do tornozelo usando uma tesoura. Segure o tendão com uma pinça e descasque os músculos proximalmente na perna para expor a tíbia. Remova a fíbula.
- Deslocar a articulação do joelho puxando, seguido de cortar os ligamentos das articulações usando tesoura para desprender a tíbia com a pata traseira inchada. Manter as amostras em meio de cultura gelado (0,3 mL/cm2) até o processamento até o passo 3.1.
3. Digestão do tecido da sinovite ( Figura 1B)
- Aspirar o meio de cultura, evitando a amostra, e adicionar meio de cultura fresco (0,3 mL/cm2). Repita o processo de lavagem três ou quatro vezes.
OBS: A partir desta etapa, o manuseio das amostras deve ser realizado de forma asséptica em bancada limpa ou armário de segurança. - Deslocar todas as juntas das amostras puxando-se com pinça de ponta fina no meio de cultura sob estereomicroscópio (aumento de 10x-20x). Pinças de ponto fino são convenientes nesta etapa. Remova a tíbia e o maior número possível de vasos, tendões e ligamentos. Tenha cuidado para não quebrar os ossos ao se deslocar.
- Preparar dois tubos de 15 mL por amostra. Transferir os ossos luxados com tecidos moles para o primeiro tubo de 15 mL com pinça. Adicionar 4 mL de meio de digestão por amostra, obtida de ambas as patas traseiras, no tubo.
- Para coletar células residuais e fragmentos de tecido, transferir o meio em que a amostra foi contida para o segundo tubo de 15 mL. Centrifugar o meio a 500 x g durante 5 min à temperatura ambiente. Após a remoção do sobrenadante, ressuspender o pellet com 1 mL de meio de digestão e transferir a solução de fragmento celular e tecido para o primeiro tubo de 15 mL contendo quase todo o tecido (total de 5 mL de meio de digestão/patas traseiras).
- Digerir a amostra durante 60-120 min a 37 °C com agitação num forno de hibridização.
NOTA: O momento ideal para digerir as amostras deve ser decidido. O tempo depende do grau de inchaço nos tornozelos e colagenases. Na maioria dos casos, 60-120 min é suficiente. Após 60 min de incubação, coletar uma parte da amostra digerida por pipetagem e observar ao microscópio. Se a digestão for insuficiente, a incubação deve continuar, e a digestão verificada a cada 30 min. - Pipetar bem a solução. Filtrar a solução celular através de um filtro celular (poro de 40 μm) para um tubo de 50 ml.
- Adicionar 10 mL de meio de cultura ao tubo de 50 mL através do filtro celular. Centrifugar a 300 x g durante 5 min à temperatura ambiente.
- Após a retirada do sobrenadante, ressuspender com 10 mL de meio de cultura. Repita a centrifugação. Após a retirada do sobrenadante, ressuspender com 2 mL de meio de cultura.
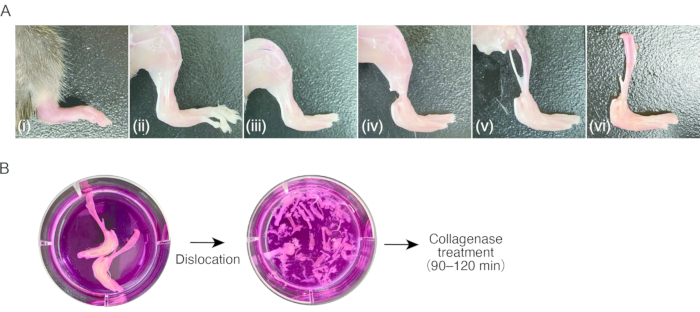
Figura 1: Procedimento de amostragem do tecido da artrite murina e digestão da colagenase . (A) (i) Pata traseira murina com artrite inflamatória. (ii) Remoção da pele da pata traseira. (iii) Luxação das articulações metatarsofalangeanas e remoção dos pododáctilos. (iv) Corte dos tendões do tornozelo. (v) Remoção dos músculos da parte inferior das pernas. (vi) Luxação da articulação do joelho. (B) esquerda; pernas excisadas em meio de cultura. Direita; luxação do tarso e metatarso em meio de cultura. Clique aqui para ver uma versão maior desta figura.
4. Isolamento dos fibroblastos sinoviais ( Figura 2A)
- Seme todas as suspensões celulares obtidas de ambos os tornozelos na placa revestida com colágeno.
NOTA: Se usar tornozelos com inchaço fraco ou moderado para obter as células, uma placa de 40 mm de diâmetro é aplicada. O tamanho da placa revestida de colágeno pode ser alterado para uma placa de 60 mm de diâmetro se ambos os tornozelos tiverem inchaço grave. - Adicionar meio de cultura (aproximadamente 222 μL/cm2). Incubar durante 1 h a 37 °C numa atmosfera humidificada com 5% de CO2.
- Recolher células não aderentes utilizando uma pipeta (utilizar no passo 5.1). Lave o prato revestido de colágeno com meio de cultura e colete o meio. Cultivar as células aderentes em meio fresco (Figura 2B,i). A maioria das células que aderem rapidamente à placa revestida de colágeno exibe uma morfologia fibroblastóide (fusiforme).
- Passagem de células subconfluentes por tratamento com tripsina 0,05% em solução salina balanceada de Hanks (HBSS). Nesse método, a contaminação de outras células é limitada, mesmo que na expansão inicial. Se forem necessárias células semelhantes a fibroblastos mais purificadas, realize a passagem repetida para permitir o aumento da pureza; entretanto, observa-se também a expansão do citoplasma das células em adesão (Figura 2B,ii). Como passagens excessivas afetam a perda de características ingênuas nas células, use células com menos de 5 passagens.
5. Isolamento de macrófagos sinoviais ( Figura 2A)
- Semeando todas as células não aderentes do passo 4.4 em placas (diâmetro de 40 ou 60 mm) que não tenham sido revestidas com colágeno.
NOTA: As células não aderentes incluem macrófagos, outros linfócitos e fibroblastos residuais do tecido da sinovite. - Cultivar as células a granel por 1 dia a 37 °C em atmosfera umidificada com 5% de CO2.
- Para remover linfócitos não aderentes, aspirar o meio de cultura e, em seguida, adicionar meio de cultura fresco. Repita esse processo duas ou três vezes (Figura 2B,iii).
- Cultivar as células a granel aderentes por 1-2 semanas em meio de cultura, com trocas de meio a cada 2 dias, mantendo a confluência (Figura 2B,iv).
NOTA: O número de SMs aumenta lentamente em condições de co-cultura com SFs. Assim, o período de co-cultura deve ser ajustado conforme necessário. - Lave com PBS ou HBSS duas vezes. Tratar com tripsina a 0,05% em HBSS (aproximadamente 55 μL/cm2) durante 3 minutos a 37 °C numa atmosfera humidificada com 5% de CO2. Os fibroblastos se desprendem facilmente da placa de cultura pelo tratamento com tripsina, e os macrófagos exibem resistência ao tratamento com tripsina. Use esta propriedade para a seleção de macrófagos sinoviais.
- Adicionar suavemente o meio de cultura (aproximadamente 222 μL/cm2) a 0,05% de tripsina em HBSS. Após esta etapa, não despeje o meio diretamente sobre as células.
- Para remover as células destacadas, aspirar o meio de cultura e, em seguida, adicionar o meio de cultura fresco suavemente. Repita esse processo duas ou três vezes. Manter as células remanescentes na placa em meio de cultura fresco até o uso (Figura 2B,v).
NOTA: Após o tratamento com tripsina, as células aderentes exibem características morfológicas semelhantes a macrófagos.

Figura 2: Separação das frações ricas em macrófagos e fibroblastos do tecido inflamatório da artrite. (A) Esquema do procedimento para separar células ricas em macrófagos e fibroblastos do tecido da artrite. (B) Imagens representativas de contraste de fase das etapas do procedimento, (i) a (v) na Figura 2A. A barra de escala representa 100 μm. Clique aqui para ver uma versão maior desta figura.
Resultados
Camundongos C57BL/6 fêmeas com 7-8 semanas de idade foram submetidos à artrite induzida por anticorpos de colágeno. Células semelhantes a macrófagos e fibroblastos foram isoladas independentemente do tecido inflamatório da artrite, de acordo com o procedimento descrito acima (Figura 2A,B). Células semelhantes a macrófagos foram utilizadas imediatamente após o passo 5.7. Células semelhantes a fibroblastos foram inicialmente cultivadas para serem subconfluentes após...
Discussão
Este método aqui desenvolvido aprimora técnicas anteriores para isolar tanto as FS de artrite murina quanto os macrófagos residentes de vários órgãos7,11. O método modificado pode isolar macrófagos e fibroblastos da sinóvia inflamatória com alta pureza, sendo simples e reprodutível. Como o método não requer instrumentos complexos, como um classificador de células, qualquer pessoa pode conduzi-lo. Além disso, a presente técnica evita preocupações...
Divulgações
Os autores declaram não ter interesses concorrentes.
Agradecimentos
Os autores agradecem à equipe da Divisão de Apoio à Pesquisa Médica, do Centro de Apoio à Pesquisa Avançada (ADRES) e aos membros da Divisão de Fisiopatologia Integrativa, Proteo-Science Center (PROS), Ehime University, por sua assistência técnica e apoio útil. Este estudo foi apoiado em parte pela Sociedade Japonesa para a Promoção da Ciência (JSPS) KAKENHI concede JP17K17929, JP19K16015, JP21K05974 (para NS) e JP23689066, JP15H04961, JP15K15552, JP17K19728, JP19H03786 (para YI); subsídios da Osaka Medical Research Foundation for Intractable Diseases, The Nakatomi Foundation, The Japanese Society for Bone and Mineral Research (JSBMR) Rising Stars Grant, The Sumitomo Foundation, SENSHIN Medical Research Foundation, The Mochida Memorial Foundation (para NS); e uma bolsa de pesquisa médica da Takeda Science Foundation, uma bolsa de projeto da UCB Japan (UCBJ) e a bolsa JSBMR Frontier Scientist 2019 (para YI).
Materiais
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
Referências
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados