Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и культивирование первичных синовиальных макрофагов и фибробластов из ткани мышиного артрита
В этой статье
Резюме
В настоящем исследовании представлен модифицированный протокол выделения синовиальных макрофагов и фибробластов из ткани воспалительного артрита мышей.
Аннотация
Ревматоидный артрит – это аутоиммунное заболевание, которое приводит к хроническому воспалению суставов. Синовиальные макрофаги и синовиальные фибробласты играют центральную роль в патогенезе ревматоидного артрита. Важно понимать функции обеих клеточных популяций, чтобы выявить механизмы, лежащие в основе патологического прогрессирования и ремиссии при воспалительном артрите. В целом, условия эксперимента in vitro должны максимально имитировать среду in vivo . Первичные клетки тканевого происхождения были использованы в экспериментах, характеризующих синовиальные фибробласты при артрите. Напротив, в экспериментах, изучающих биологические функции макрофагов при воспалительном артрите, использовались клеточные линии, макрофаги костного мозга и моноцитарные макрофаги крови. Однако неясно, действительно ли такие макрофаги отражают функции тканерезидентных макрофагов. Для получения резидентных макрофагов предыдущие протоколы были модифицированы для выделения и расширения как первичных макрофагов, так и фибробластов из синовиальной ткани в мышиной модели с воспалительным артритом. Эти первичные синовиальные клетки могут быть полезны для анализа воспалительного артрита in vitro .
Введение
Ревматоидный артрит (РА) – аутоиммунное заболевание, характеризующееся гиперплазией синовиальной оболочки, приводящей к разрушению сустава 1,2. Тканевые резидентные макрофаги и фибробласты присутствуют в здоровой синовиальной оболочке для поддержания гомеостаза суставов. У пациентов с РА синовиальные фибробласты (СФ) пролиферируют, а иммунные клетки, включая моноциты, проникают в синовиальную оболочку и суставную жидкость, процессы, связанные с воспалением 1,3,4. Синовиальные макрофаги (СМ), к которым относятся резидентные макрофаги и моноцитарные макрофаги периферической крови, а также СФ аберрантно активированы и играют важную роль в патогенезе РА. Недавние исследования показали, что межклеточное взаимодействие между СМ и СФ способствует как обострению, так и ремиссии РА 5,6.
Для понимания патогенеза РА было использовано несколько моделей воспалительного артрита грызунов, включая артрит с переносом сыворотки K/BxN, коллаген-индуцированный артрит и артрит, индуцированный антителами к коллагену. Клеточные анализы, как правило, необходимы для выяснения молекулярных функций при артрите. Поэтому первичные клетки животных моделей артрита были выделены. Метод выделения СФ из ткани мышиного артрита хорошо известен, и эти клетки внесли свой вклад в выяснение молекулярных механизмов патогенеза артрита 7,8. С другой стороны, макрофаги, полученные из костного мозга, макрофаги, полученные из моноцитов крови, и клеточные линии макрофагов часто использовались в качестве макрофагальных ресурсов для исследований артрита 9,10. Поскольку макрофаги могут приобретать функции, связанные с их микроокружением, общие источники макрофагов могут отсутствовать реакции, специфичные для тканей артрита. Кроме того, трудно получить достаточное количество синовиальных клеток путем сортировки, так как синовиальная оболочка мышей представляет собой очень маленькую ткань даже в моделях артрита. Отсутствие использования синовиальных макрофагов для исследований in vitro было ограничением в исследованиях артрита. Создание протокола для выделения и расширения синовиальных макрофагов было бы преимуществом для выяснения патологических механизмов при РА.
В предыдущем методе выделения СФ СМ отбрасывались7. Кроме того, сообщалось о способе выделения и распространения резидентных макрофагов из некоторых органов11. Поэтому существующие протоколы модифицировались в комплексе. Модификация направлена на получение первичной культуры как СМ, так и СФ высокой чистоты. Общая цель этого метода состоит в том, чтобы выделить и расширить как SM, так и SF из ткани мышиного артрита.
протокол
Эксперименты с участием животных были одобрены Комитетом по экспериментам на животных Университета Эхимэ и проводились в соответствии с Руководством Университета Эхимэ по проведению экспериментов на животных (37A1-1*16).
1. Подготовка инструментов, реагентов и питательных сред
- Приготовьте питательную среду следующим образом: дополните модифицированную орлиную среду (DMEM) Dulbecco 10% фетальной бычьей сывороткой (FBS) и 1% раствором антибиотика-антимикотика (анти-анти).
- Среду для переваривания готовят следующим образом: добавляют в питательную среду 1 мг/мл коллагеназы IV типа. Регулируйте концентрацию коллагеназы непосредственно перед использованием.
- Разбавить коллаген типа I-C до концентрации 0,15 мг/мл раствором HCl 1 мМ. Залейте чашки для культур (диаметром 40 или 60 мм) разбавленным раствором коллагена. Через 6-12 ч при комнатной температуре вынуть раствор коллагена из посуды и высушить при комнатной температуре. Блюда, покрытые коллагеновой оболочкой, можно хранить при комнатной температуре не менее 1 недели. Перед использованием вымойте предварительно покрытую посуду фосфатно-солевым буфером (PBS) или средством.
- Подготовьте стерильные хирургические инструменты, такие как ножницы, пинцет с зазубренными кончиками и пинцет с тонким концом. Перед употреблением замочить в 70% этаноле.
2. Подготовка синовитной ткани у мышей ( рис. 1А)
- Подготовьте мышку с воспалительным артритом задних лап.
ПРИМЕЧАНИЕ: Для этого протокола использовали самок мышей C57BL/6 (18-20 г) через 7-8 недель после рождения с артритом, индуцированным коллагеновыми антителами (CAIA) или артритом с переносом сыворотки K/BxN (STA)8. Выделение СМ из ненабухшей (т.е. здоровой) ткани может быть затруднено, так как количество клеток недостаточно. - Обезболивайте мышей внутрибрюшинной инъекцией 80 мг/кг кетамина и 16 мг/кг ксилазина. Очистите мышей 70% этанолом.
- Разрежьте ножницами грудную область, чтобы обнажить сердце. Разрежьте ножницами правое предсердие сердца, а затем воткните иглу-бабочку 23 G в левый желудочек через верхушку сердца, после чего последует рефлюкс 15-20 мл стерильного PBS с помощью шприца для ручного забора периферической крови (примерно 1 мл/2 с).
- Декортикируйте задние лапы, разрезая кожу ножницами и вытягивая кожу пинцетом с зазубренными кончиками.
ПРИМЕЧАНИЕ: После этого шага рекомендуется использовать пинцет для работы с образцами. Не прикасайтесь пальцами к декортикированной ткани, чтобы избежать прикрепления мышиной шерсти. - Вывихнуть плюснефаланговые суставы путем вытягивания с последующим разрезанием связок суставов с помощью ножниц для удаления пальцев ног.
- Обрежьте сухожилия мышц голени возле голеностопа с помощью ножниц. Возьмитесь за сухожилие пинцетом и отшлифуйте мышцы проксимально голени, чтобы обнажить большеберцовую кость. Удалите малоберцовую кость.
- Вывихнуть коленный сустав путем вытягивания с последующим перерезанием связок суставов с помощью ножниц отсоединить большеберцовую кость с опухшей задней лапой. Образцы хранят в ледяной питательной среде (0,3 мл/см2) до обработки до этапа 3.1.
3. Пищеварение синовитной ткани ( рис. 1Б)
- Аспирируйте питательную среду, избегая образца, а затем добавьте свежую питательную среду (0,3 мл/см2). Повторите процесс стирки три-четыре раза.
ПРИМЕЧАНИЕ: Начиная с этого этапа, работа с образцами должна выполняться асептически на чистом столе или в безопасном шкафу. - Вывихнуть все стыки образцов путем вытягивания тонким пинцетом в питательной среде под стереомикроскопом (при 10-20-кратном увеличении). На этом этапе удобен пинцет с тонким концом. Удалите большеберцовую кость и как можно больше сосудов, сухожилий и связок. Будьте осторожны, чтобы не сломать кости при вывихе.
- Подготовьте две пробирки по 15 мл на образец. Перенесите вывихнутые кости с мягкими тканями в первую пробирку объемом 15 мл с помощью пинцета. Добавьте в пробирку 4 мл питательной среды на образец, полученную из обеих задних лап.
- Для сбора остаточных клеток и фрагментов тканей переносят среду, в которой содержался образец, во вторую пробирку объемом 15 мл. Центрифугируйте среду при 500 x g в течение 5 минут при комнатной температуре. После удаления надосадочной жидкости повторно суспендируйте гранулу с 1 мл питательной среды и перенесите раствор из клеток и фрагментов тканей в первую пробирку объемом 15 мл, содержащую почти всю ткань (всего 5 мл среды пищеварения/задних лап).
- Вываривают образец в течение 60-120 мин при 37 °С с встряхиванием в гибридизационной печи.
ПРИМЕЧАНИЕ: Необходимо определить оптимальное время для разложения образцов. Время зависит от степени отека лодыжек и коллагеназ. В большинстве случаев достаточно 60-120 минут. Через 60 мин инкубации отбирают часть переваренного образца пипетированием и наблюдают под микроскопом. Если пищеварение недостаточное, инкубацию следует продолжать, а пищеварение проверять каждые 30 мин. - Хорошо пропитывайте раствор. Процедите клеточный раствор через сетчатый фильтр (размер пор 40 мкм) в пробирку объемом 50 мл.
- Добавьте 10 мл питательной среды в пробирку объемом 50 мл через клеточный фильтр. Центрифуга при 300 x g в течение 5 мин при комнатной температуре.
- После удаления надосадочной жидкости ресуспендировать с 10 мл питательной среды. Повторите центрифугирование. После удаления надосадочной жидкости ресуспендировать с 2 мл питательной среды.
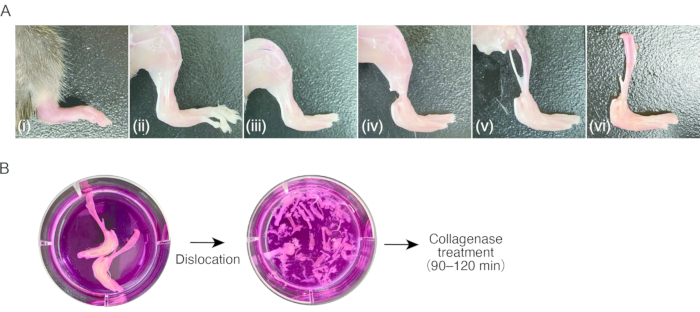
Рисунок 1: Процедура забора проб тканей мышиного артрита и расщепления коллагеназы . (A) (i) Задняя лапа мыши с воспалительным артритом. (ii) Удаление кожи на задней лапе. iii) Вывих плюснефаланговых суставов и удаление пальцев стопы. (iv) Разрезание сухожилий голеностопного сустава. (v) Удаление мышц голеней. (vi) Вывих коленного сустава. (Б) Левый; Иссеченные ножки в питательной среде. Правильно; вывих цевки и плюсны в питательной среде. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Выделение синовиальных фибробластов ( рис. 2А)
- Высейте все клеточные суспензии, полученные с обеих лодыжек, на чашку, покрытую коллагеном.
ПРИМЕЧАНИЕ: При использовании лодыжек со слабым или умеренным отеком для получения клеток применяется чашка диаметром 40 мм. Размер чашки, покрытой коллагеновой оболочкой, может быть изменен на 60 мм в диаметре, если обе лодыжки сильно опухли. - Добавьте питательную среду (примерно 222 мкл/см2). Инкубируют в течение 1 ч при 37 °C во влажной атмосфере с 5% CO2.
- Соберите неадгезивные клетки с помощью пипетки (используйте на шаге 5.1). Вымойте чашку, покрытую коллагеном, питательной средой и соберите среду. Культивирование адгезивных клеток в свежей среде (рис. 2B,i). Большинство клеток, которые быстро прикрепляются к покрытой коллагеном чашке, имеют фибробластоидную (веретенообразную) морфологию.
- Прохождение субсливающихся клеток путем обработки 0,05% трипсином в сбалансированном растворе соли Хэнкса (HBSS). В этом методе контаминация других клеток ограничена, даже если она находится в начальном расширении. Если требуется более очищенные фибробластоподобные клетки, выполните повторное пассирование, чтобы обеспечить повышение чистоты; однако также наблюдается расширение цитоплазмы клеток при адгезии (рис. 2B, ii). Поскольку чрезмерные пассажи влияют на потерю наивных характеристик в клетках, используйте клетки с менее чем 5 пассажами.
5. Выделение синовиальных макрофагов ( рис. 2А)
- Высейте все неадгезивные клетки, начиная с шага 4.4, на чашки (диаметр 40 или 60 мм), которые не были покрыты коллагеном.
ПРИМЕЧАНИЕ: К неадгезивным клеткам относятся макрофаги, другие лимфоциты и остаточные фибробласты из ткани синовита. - Культивирование объемных клеток в течение 1 суток при 37 °C в увлажненной атмосфере с 5%CO2.
- Для удаления неадгезивных лимфоцитов аспирируют культивируемую среду, а затем добавляют свежую питательную среду. Повторите этот процесс два или три раза (рисунок 2B, iii).
- Культивирование адгезивных объемных клеток в течение 1-2 недель в питательной среде, при этом среда меняется каждые 2 дня при сохранении слияния (рис. 2B, iv).
ПРИМЕЧАНИЕ: Количество СМ медленно увеличивается в условиях совместного культивирования с НФ. Таким образом, период совместного культивирования должен быть скорректирован по мере необходимости. - Вымойте PBS или HBSS два раза. Обработать 0,05% трипсином в HBSS (примерно 55 мкл/см2) в течение 3 мин при 37 °C во влажной атмосфере с 5% CO2. Фибробласты легко отделяются от культуральной чашки при обработке трипсином, а макрофаги проявляют устойчивость к обработке трипсином. Используют это свойство для отбора синовиальных макрофагов.
- Осторожно добавьте питательную среду (примерно 222 мкл/см2) к 0,05% трипсина в HBSS. После этого шага не выливайте средство непосредственно на клетки.
- Чтобы удалить отделившиеся клетки, аспирируйте питательную среду, а затем осторожно добавляйте свежую питательную среду. Повторите этот процесс два-три раза. Оставшиеся клетки на чашке выдерживают в свежей питательной среде до использования (рис. 2B, v).
ПРИМЕЧАНИЕ: После лечения трипсином адгезивные клетки проявляют макрофагоподобные морфологические характеристики.

Рисунок 2: Отделение фракций, богатых макрофагами и фибробластами, от ткани воспалительного артрита. (А) Схема процедуры отделения клеток, богатых макрофагами и фибробластами, от ткани артрита. (B) Репрезентативные фазово-контрастные изображения этапов процедуры, (i) - (v) на рисунке 2A. Масштабная линейка представляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Самки мышей C57BL/6 в возрасте 7-8 недель перенесли артрит, индуцированный коллагеновыми антителами. Макрофагоподобные клетки и фибробластоподобные клетки были независимо выделены из ткани воспалительного артрита в соответствии с процедурой, описанной выше (рис. 2А, Б<...
Обсуждение
Этот метод, разработанный здесь, является улучшением предыдущих методов выделения как СФ из мышиного артрита, так и резидентных макрофагов из ряда органов 7,11. Модифицированный метод позволяет выделять как макрофаги, так и фибробласты из воспалительной ?...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Авторы благодарят сотрудников Отдела поддержки медицинских исследований Центра поддержки перспективных исследований (ADRES) и членов Отдела интегративной патофизиологии Центра протео-науки (PROS) Университета Эхимэ за их техническую помощь и полезную поддержку. Это исследование было частично поддержано грантами KAKENHI Японского общества содействия науке (JSPS) JP17K17929, JP19K16015, JP21K05974 (для NS) и JP23689066, JP15H04961, JP15K15552, JP17K19728, JP19H03786 (для YI); гранты от Фонда медицинских исследований трудноизлечимых заболеваний Осаки, Фонда Накатоми, Гранта «Восходящие звезды» Японского общества исследований костей и минералов (JSBMR), Фонда «Сумитомо», Фонда медицинских исследований SENSHIN, Мемориального фонда Мочиды (для NS); а также грант Takeda Science Foundation на медицинские исследования, грант проекта UCB Japan (UCBJ) и грант JSBMR Frontier Scientist 2019 (YI).
Материалы
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
Ссылки
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены