Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement et culture de macrophages synoviaux primaires et de fibroblastes à partir de tissus arthritiques murins
Dans cet article
Résumé
La présente étude fournit un protocole modifié pour isoler les macrophages synoviaux et les fibroblastes du tissu arthritique inflammatoire murin.
Résumé
La polyarthrite rhumatoïde est une maladie auto-immune qui entraîne une inflammation chronique des articulations. Les macrophages synoviaux et les fibroblastes synoviaux jouent un rôle central dans la pathogenèse de la polyarthrite rhumatoïde. Il est important de comprendre les fonctions des deux populations cellulaires pour révéler les mécanismes sous-jacents à la progression pathologique et à la rémission de l’arthrite inflammatoire. En général, les conditions expérimentales in vitro devraient imiter autant que possible l’environnement in vivo . Des cellules dérivées de tissus primaires ont été utilisées dans des expériences caractérisant les fibroblastes synoviaux dans l’arthrite. En revanche, dans les expériences portant sur les fonctions biologiques des macrophages dans l’arthrite inflammatoire, des lignées cellulaires, des macrophages dérivés de la moelle osseuse et des macrophages dérivés de monocytes sanguins ont été utilisés. Cependant, il n’est pas clair si ces macrophages reflètent réellement les fonctions des macrophages résidant dans les tissus. Pour obtenir des macrophages résidents, les protocoles précédents ont été modifiés pour isoler et développer à la fois les macrophages primaires et les fibroblastes du tissu synovial dans un modèle murin d’arthrite inflammatoire. Ces cellules synoviales primaires peuvent être utiles pour l’analyse in vitro de l’arthrite inflammatoire.
Introduction
La polyarthrite rhumatoïde (PR) est une maladie auto-immune caractérisée par une hyperplasie de la synoviale, entraînant une destruction articulaire 1,2. Les macrophages et les fibroblastes résidant dans les tissus sont présents dans la synoviale saine pour maintenir l’homéostasie articulaire. Chez les patients atteints de PR, les fibroblastes synoviaux (SF) prolifèrent et les cellules immunitaires, y compris les monocytes, s’infiltrent dans la synoviale et le liquide articulaire, processus associés à l’inflammation 1,3,4. Les macrophages synoviaux (SM), qui comprennent les macrophages résidents et les macrophages dérivés de monocytes du sang périphérique, et les SF sont activés de manière aberrante et jouent un rôle important dans la pathogenèse de la PR. Des études récentes ont suggéré que les interactions cellule-cellule entre les SM et les SF contribuent à la fois à l’exacerbation et à la rémission de la PR 5,6.
Pour comprendre la pathogenèse de la PR, plusieurs modèles d’arthrite inflammatoire chez les rongeurs ont été utilisés, notamment l’arthrite par transfert sérique K/BxN, l’arthrite induite par le collagène et l’arthrite induite par les anticorps anticollagène. Les tests cellulaires sont généralement nécessaires pour clarifier les fonctions moléculaires dans l’arthrite. Par conséquent, des cellules primaires provenant de modèles animaux d’arthrite ont été isolées. La méthode pour isoler les SF du tissu arthritique murin est bien établie, et ces cellules ont contribué à l’élucidation des mécanismes moléculaires dans la pathogenèsede l’arthrite 7,8. D’autre part, les macrophages dérivés de la moelle osseuse, les macrophages dérivés de monocytes sanguins et les lignées cellulaires de macrophages ont souvent été utilisés comme ressources en macrophages pour les études sur l’arthrite 9,10. Étant donné que les macrophages peuvent acquérir des fonctions associées à leur microenvironnement, les sources générales de macrophages peuvent manquer de réponses spécifiques aux tissus arthritiques. De plus, il est difficile d’obtenir suffisamment de cellules synoviales par tri, car la synoviale murine est un très petit tissu, même dans les modèles d’arthrite. Le manque d’utilisation des macrophages synoviaux pour les études in vitro a été une limitation dans les études sur l’arthrite. L’établissement d’un protocole pour isoler et étendre les macrophages synoviaux serait un avantage pour l’élucidation des mécanismes pathologiques dans la PR.
Dans la méthode précédente d’isolement des FS, les SM étaient éliminés7. En outre, une méthode pour isoler et développer les macrophages résidents de certains organes a été signalée11. Par conséquent, les protocoles existants ont été modifiés en combinaison. La modification vise à atteindre la culture primaire des SM et des SF avec une grande pureté. L’objectif global de cette méthode est d’isoler et d’étendre les SM et les SF à partir du tissu arthritique murin.
Protocole
Les expériences impliquant des animaux ont été approuvées par le Comité de l’expérimentation animale de l’Université d’Ehime et ont été réalisées conformément aux directives de l’Université d’Ehime pour l’expérimentation animale (37A1-1 * 16).
1. Préparation des instruments, des réactifs et du milieu de culture
- Préparer le milieu de culture comme suit: compléter le milieu aigle modifié (DMEM) de Dulbecco avec 10% de sérum bovin fœtal (FBS) et 1% de solution antibiotique-antimycotique (anti-anti-anti).
- Préparer le milieu de digestion comme suit : compléter le milieu de culture avec 1 mg/mL de collagénase de type IV. Ajustez la concentration de collagénase juste avant utilisation.
- Diluer le collagène de type I-C à une concentration de 0,15 mg/mL avec une solution de HCl de 1 mM. Cuves de culture d’inondation (diamètre de 40 ou 60 mm) avec la solution de collagène diluée. Après 6-12 h à température ambiante, retirer la solution de collagène de la vaisselle et sécher à température ambiante. La vaisselle enrobée de collagène peut être conservée à température ambiante pendant au moins 1 semaine. Laver la vaisselle pré-enduite avec une solution saline tamponnée au phosphate (PBS) ou un moyen avant utilisation.
- Préparez des instruments chirurgicaux stériles, tels que des ciseaux, des pinces à épiler à extrémités dentelées et des pinces à pointe fine. Faire tremper dans de l’éthanol à 70% avant utilisation.
2. Préparation du tissu de synovite chez la souris ( Figure 1A)
- Préparez une souris atteinte d’arthrite inflammatoire dans les pattes postérieures.
REMARQUE: Des souris femelles C57BL / 6 (18-20 g), 7-8 semaines postnatales, atteintes d’arthrite induite par les anticorps de collagène (CAIA) ou d’arthrite par transfert sérique K / BxN (STA) ont été utilisées pour ce protocole8. Il peut être difficile d’isoler les SM des tissus non enflés (c.-à-d. sains), car le nombre de cellules est insuffisant. - Anesthésier les souris par une injection intrapéritonéale de 80 mg/kg de kétamine et de 16 mg/kg de xylazine. Nettoyez les souris avec de l’éthanol à 70%.
- Coupez la région pectorale avec des ciseaux pour exposer le cœur. Couper l’oreillette droite du cœur avec des ciseaux, puis enfoncer une aiguille papillon de 23 G dans le ventricule gauche via l’apex du cœur, suivi d’un reflux de 15 à 20 mL de PBS stérile à l’aide d’une seringue pour retirer manuellement le sang périphérique (environ 1 mL/2 s).
- Décorticez les pattes postérieures en coupant la peau à l’aide de ciseaux et en tirant la peau à l’aide d’une pince à épiler à extrémités dentelées.
REMARQUE: Après cette étape, l’utilisation de pincettes est recommandée pour la manipulation des échantillons. Ne touchez pas les tissus décortiqués avec les doigts, pour éviter la fixation des cheveux murins. - Disloquer les articulations métatarsophalangiennes en tirant, puis en coupant les ligaments des articulations à l’aide de ciseaux pour enlever les orteils.
- Coupez les tendons des muscles de la jambe près de la cheville à l’aide de ciseaux. Saisissez le tendon avec une pince à épiler et pelez les muscles à proximité de la jambe inférieure pour exposer le tibia. Retirez le péroné.
- Disloquez l’articulation du genou en tirant, puis en coupant les ligaments des articulations à l’aide de ciseaux pour détacher le tibia avec la patte postérieure enflée. Conserver les échantillons dans un milieu de culture glacée (0,3 mL/cm2) jusqu’à ce qu’ils passent à l’étape 3.1.
3. Digestion du tissu synovite ( Figure 1B)
- Aspirer le milieu de culture en évitant l’échantillon, puis ajouter le milieu de culture frais (0,3 mL/cm2). Répétez le processus de lavage trois ou quatre fois.
REMARQUE: À partir de cette étape, la manipulation des échantillons doit être effectuée de manière aseptique dans un banc propre ou une armoire de sécurité. - Disloquer toutes les articulations des échantillons en tirant à l’aide d’une pince à épiler à pointe fine dans le milieu de culture sous un stéréomicroscope (grossissement de 10x-20x). Les pincettes à pointe fine sont pratiques dans cette étape. Enlevez le tibia et autant de vaisseaux, de tendons et de ligaments que possible. Veillez à ne pas casser les os lors de la délocalisation.
- Préparer deux tubes de 15 mL par échantillon. Transférer les os disloqués avec les tissus mous dans le premier tube de 15 ml à l’aide d’une pince à épiler. Ajouter 4 mL de milieu de digestion par échantillon, obtenu à partir des deux pattes postérieures, dans le tube.
- Pour prélever des cellules résiduelles et des fragments de tissus, transférer le milieu dans lequel l’échantillon a été contenu dans le deuxième tube de 15 mL. Centrifuger le milieu à 500 x g pendant 5 min à température ambiante. Après avoir retiré le surnageant, remettre en suspension la pastille avec 1 mL de milieu de digestion et transférer la solution de fragments de cellules et de tissus dans le premier tube de 15 mL contenant presque tout le tissu (total de 5 mL de milieu de digestion/pattes postérieures).
- Digérer l’échantillon pendant 60-120 min à 37 °C en agitant dans une étuve d’hybridation.
REMARQUE: Le moment optimal pour digérer les échantillons doit être décidé. Le temps dépend du degré de gonflement des chevilles et des collagénases. Dans la plupart des cas, 60-120 minutes suffisent. Après 60 min d’incubation, prélever une partie de l’échantillon digéré par pipetage, et observer au microscope. Si la digestion est insuffisante, l’incubation doit se poursuivre et la digestion doit être vérifiée toutes les 30 minutes. - Bien canaliser la solution. Filtrer la solution cellulaire à travers une crépine cellulaire (taille des pores de 40 μm) jusqu’à un tube de 50 mL.
- Ajouter 10 mL de milieu de culture dans le tube de 50 mL à travers la passoire cellulaire. Centrifuger à 300 x g pendant 5 min à température ambiante.
- Après avoir retiré le surnageant, remettre en suspension avec 10 ml de milieu de culture. Répétez la centrifugation. Après avoir retiré le surnageant, remettre en suspension avec 2 ml de milieu de culture.
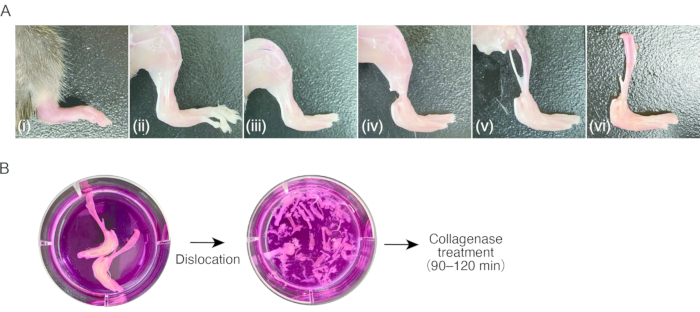
Figure 1 : Procédure d’échantillonnage des tissus arthritiques murins et digestion de la collagénase. (A) (i) Patte postérieure murine avec arthrite inflammatoire. ii) Enlèvement de la peau de la patte postérieure. iii) Luxation des articulations métatarsophalangiennes et ablation des orteils. iv) Incision des tendons de la cheville. v) Ablation des muscles de la partie inférieure des jambes. vi) Luxation de l’articulation du genou. b) à gauche; jambes excisées dans le milieu de culture. Droite; Tarse disloqué et métatarse dans le milieu de culture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Isolement des fibroblastes synoviaux ( Figure 2A)
- Ensemencer toutes les suspensions cellulaires obtenues des deux chevilles sur le plat enrobé de collagène.
REMARQUE: Si vous utilisez des chevilles avec un gonflement faible ou modéré pour obtenir les cellules, une antenne de 40 mm de diamètre est appliquée. La taille du plat enrobé de collagène peut être changée en une boîte de 60 mm de diamètre si les deux chevilles ont un gonflement sévère. - Ajouter le milieu de culture (environ 222 μL/cm2). Incuber pendant 1 h à 37 °C dans une atmosphère humidifiée avec 5% de CO2.
- Recueillir les cellules non adhérentes à l’aide d’une pipette (utiliser à l’étape 5.1). Lavez le plat enrobé de collagène avec un milieu de culture et recueillez le milieu. Culture des cellules adhérentes en milieu frais (Figure 2B,i). La plupart des cellules qui adhèrent rapidement à la boîte recouverte de collagène présentent une morphologie fibroblastoïde (fuseau).
- Passage des cellules sous-confluentes par traitement avec 0,05% de trypsine dans la solution saline équilibrée de Hanks (HBSS). Dans cette méthode, la contamination des autres cellules est limitée, même lors de l’expansion initiale. Si davantage de cellules purifiées ressemblant à des fibroblastes sont nécessaires, effectuer des passages répétés pour permettre l’amélioration de la pureté; cependant, l’expansion du cytoplasme des cellules en adhérence est également observée (Figure 2B,ii). Étant donné que les passages excessifs affectent la perte de caractéristiques naïves dans les cellules, utilisez des cellules avec moins de 5 passages.
5. Isolement des macrophages synoviaux ( Figure 2A)
- Ensemencer toutes les cellules non adhérentes de l’étape 4.4 sur des boîtes (diamètre de 40 ou 60 mm) qui n’ont pas été enrobées de collagène.
REMARQUE: Les cellules non adhérentes comprennent les macrophages, d’autres lymphocytes et les fibroblastes résiduels du tissu de la synovite. - Culture des cellules en vrac pendant 1 jour à 37 °C dans une atmosphère humidifiée avec 5% de CO2.
- Pour éliminer les lymphocytes non adhérents, aspirez le milieu cultivé, puis ajoutez un milieu de culture frais. Répétez ce processus deux ou trois fois (Figure 2B,iii).
- Culture des cellules adhérentes en vrac pendant 1-2 semaines dans un milieu de culture, avec des changements de milieu tous les 2 jours tout en maintenant la confluence (Figure 2B,iv).
NOTE: Le nombre de SM augmente lentement dans des conditions de co-culture avec les SF. Ainsi, la période de co-culture devrait être ajustée au besoin. - Lavez avec PBS ou HBSS deux fois. Traiter avec 0,05% de trypsine dans HBSS (environ 55 μL/cm 2) pendant 3 min à 37 °C dans une atmosphère humidifiée avec 5% de CO2. Les fibroblastes se détachent facilement de la boîte de culture par traitement à la trypsine, et les macrophages présentent une résistance au traitement à la trypsine. Utilisez cette propriété pour la sélection des macrophages synoviaux.
- Ajouter doucement le milieu de culture (environ 222 μL/cm2) à 0,05 % de trypsine dans l’HBSS. Après cette étape, ne versez pas le milieu directement sur les cellules.
- Pour enlever les cellules détachées, aspirez le milieu cultivé, puis ajoutez doucement le milieu de culture frais. Répétez ce processus deux ou trois fois. Maintenir les cellules restantes sur la boîte dans un milieu de culture frais jusqu’à utilisation (Figure 2B,v).
REMARQUE: Après le traitement par trypsine, les cellules adhérentes présentent des caractéristiques morphologiques de type macrophage.

Figure 2 : Séparation des fractions riches en macrophages et en fibroblastes du tissu arthritique inflammatoire. (A) Schéma de la procédure visant à séparer les cellules riches en macrophages et en fibroblastes des tissus arthritiques. (B) Images représentatives du contraste de phase des étapes de la procédure, (i) à (v) de la figure 2A. La barre d’échelle représente 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les souris C57BL/6 femelles âgées de 7 à 8 semaines ont souffert d’arthrite induite par les anticorps anticollagène. Les cellules de type macrophage et les cellules de type fibroblaste ont été isolées indépendamment du tissu arthritique inflammatoire selon la procédure décrite ci-dessus (figure 2A,B). Des cellules de type macrophage ont été utilisées immédiatement après l’étape 5.7. Les cellules de type fibroblaste ont d’abord été cultivées pour êtr...
Discussion
Cette méthode développée ici améliore les techniques précédentes pour isoler à la fois les SF de l’arthrite murine et les macrophages résidents d’un certain nombre d’organes 7,11. La méthode modifiée peut isoler à la fois les macrophages et les fibroblastes de la synoviale inflammatoire avec une grande pureté, et elle est simple et reproductible. Étant donné que la méthode ne nécessite pas d’instruments complexes tels qu’un trieur de cel...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Les auteurs remercient le personnel de la Division of Medical Research Support, du Advanced Research Support Center (ADRES) et les membres de la Division of Integrative Pathophysiology, Proteo-Science Center (PROS), Ehime University, pour leur assistance technique et leur soutien utile. Cette étude a été financée en partie par les subventions KAKENHI de la Société japonaise pour la promotion de la science (JSPS) JP17K17929, JP19K16015, JP21K05974 (à NS) et JP23689066, JP15H04961, JP15K15552, JP17K19728, JP19H03786 (à YI); des subventions de la Fondation de recherche médicale d’Osaka pour les maladies intraitables, de la Fondation Nakatomi, de la Bourse des étoiles montantes de la Société japonaise de recherche sur les os et les minéraux (JSBMR), de la Fondation Sumitomo, de la Fondation de recherche médicale SENSHIN, de la Fondation Mochida Memorial (à la Nouvelle-Écosse); et une subvention de recherche médicale de la Takeda Science Foundation, une subvention de projet UCB Japan (UCBJ) et la subvention JSBMR Frontier Scientist 2019 (à YI).
matériels
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
Références
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon