このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス関節炎組織からの初代滑膜マクロファージおよび線維芽細胞の単離と培養
要約
本研究は、マウス炎症性関節炎組織から滑膜マクロファージおよび線維芽細胞を単離するための修正されたプロトコルを提供する。
要約
関節リウマチは、関節の慢性炎症を引き起こす自己免疫疾患です。滑膜マクロファージと滑膜線維芽細胞は、関節リウマチの病因において中心的な役割を果たしています。炎症性関節炎の病理学的進行と寛解の根底にあるメカニズムを明らかにするために、両方の細胞集団の機能を理解することが重要です。一般に、インビ トロ 実験条件は、 可能な限りインビボ 環境を模倣すべきである。初代組織由来細胞は、関節炎における滑膜線維芽細胞を特徴付ける実験に使用されています。これに対し、炎症性関節炎におけるマクロファージの生物学的機能を調べる実験では、細胞株、骨髄由来マクロファージ、血中単球由来マクロファージが用いられてきた。しかし、このようなマクロファージが実際に組織常在性マクロファージの機能を反映しているかどうかは不明である。常在性マクロファージを得るために、以前のプロトコルは、炎症性関節炎マウスモデルにおいて滑膜組織から一次マクロファージおよび線維芽細胞の両方を単離および増殖するように改変された。これらの初代滑膜細胞は、炎症性関節炎の インビトロ 分析に有用であり得る。
概要
関節リウマチ(RA)は、滑膜の過形成を特徴とする自己免疫疾患であり、関節破壊につながります1,2。組織に常在するマクロファージと線維芽細胞は、関節の恒常性を維持するために健康な滑膜に存在します。RA患者では、滑膜線維芽細胞(SF)が増殖し、単球を含む免疫細胞が滑膜および関節液に浸潤し、炎症に関連するプロセスである1,3,4。常在マクロファージや末梢血単球由来マクロファージを含む滑膜マクロファージ(SM)やSFは異常に活性化され、RAの病態形成に重要な役割を果たしています。最近の研究では、SMとSFの間の細胞間相互作用がRAの増悪と寛解の両方に寄与することが示唆されています5,6。
RAの病因を理解するために、K / BxN血清転移関節炎、コラーゲン誘発性関節炎、コラーゲン抗体誘発性関節炎など、炎症性関節炎のいくつかのげっ歯類モデルが使用されています。細胞ベースのアッセイは、関節炎の分子機能を明らかにするために一般的に必要とされています。したがって、関節炎の動物モデルから初代細胞が単離されている。マウス関節炎組織からSFを単離する方法は十分に確立されており、これらの細胞は関節炎の発症機序の分子メカニズムの解明に貢献しています7,8。一方、骨髄由来マクロファージ、血中単球由来マクロファージ、およびマクロファージ細胞株は、関節炎研究のためのマクロファージリソースとしてしばしば使用されている9,10。マクロファージは微小環境に関連する機能を獲得できるため、マクロファージの一般的な供給源は関節炎組織に特異的な応答を欠いている可能性があります。また、マウス滑膜は関節炎モデルにおいても非常に小さな組織であるため、ソーティングによって十分な滑膜細胞を得ることは困難である。インビトロ研究のための滑膜マクロファージの使用の欠如は、関節炎研究における制限であった。滑膜マクロファージを分離・増殖させるプロトコールの確立は、関節リウマチの病態メカニズム解明に有利である。
SFを分離する以前の方法では、SMは破棄されました7。それに加えて、いくつかの臓器から常在マクロファージを分離および増殖させる方法が報告されました11。したがって、既存のプロトコルは組み合わせて変更されました。この改変は、SMとSFの両方の一次培養を高純度で達成することを目的としています。この方法の全体的な目標は、マウス関節炎組織からSMとSFの両方を分離および拡張することです。
プロトコル
動物を用いた実験は、愛媛大学動物実験委員会の承認を受け、愛媛大学動物実験ガイドライン(37A1-1※16)に従って実施しました。
1. 機器、試薬、培地の調製
- 以下のように培地を調製します:ダルベッコ改変イーグル培地(DMEM)に10%ウシ胎児血清(FBS)と1%抗生物質抗真菌溶液(抗抗)を補給します。
- 消化培地を次のように調製します:培地に1 mg/mLのコラゲナーゼIV型を補充します。使用直前にコラゲナーゼ濃度を調整してください。
- I-C型コラーゲンを1 mM HCl溶液で0.15 mg/mLの濃度に希釈します。培養皿(直径40または60 mm)を希釈コラーゲン溶液で浸水させる。室温で6〜12時間後、皿からコラーゲン溶液を取り除き、室温で乾燥させます。コラーゲンコーティングされた皿は、少なくとも1週間室温に保つことができます。使用前に、プレコートされた皿をリン酸緩衝生理食塩水(PBS)または培地で洗ってください。
- はさみ、鋸歯状の先端を持つピンセット、細いピンセットなどの滅菌手術器具を準備します。使用前に70%エタノールに浸してください。
2.マウスにおける滑膜炎組織の調製( 図1A)
- 後足に炎症性関節炎のマウスを準備します。
注:コラーゲン抗体誘発性関節炎(CAIA)またはK / BxN血清転移関節炎(STA)を有する生後7〜8週間の雌C57BL / 6マウス(18〜20 g)をこのプロトコル8に使用しました。細胞数が不十分なため、腫れていない(つまり健康な)組織からSMを分離することは困難な場合があります。 - 80 mg / kgのケタミンと16 mg / kgのキシラジンの腹腔内注射によってマウスに麻酔をかけます。70%エタノールでマウスを洗浄します。
- ハサミで胸部を切り開いて心臓を露出させます。心臓の右耳介をハサミで切断し、心臓の頂点 を介して 23 Gの蝶の針を左心室に刺し、続いて注射器を使用して15〜20 mLの滅菌PBSを還流し、末梢血を手動で除去します(約1 mL / 2 s)。
- はさみを使って皮膚を切ったり、鋸歯状の先端を持つピンセットを使って皮膚を引っ張ったりして、後足を装飾します。
注意: この手順の後、サンプルの取り扱いにはピンセットの使用をお勧めします。マウスの毛の付着を避けるために、指で装飾された組織に触れないでください。 - 引っ張って中足指節関節を脱臼させ、続いてハサミを使って関節の靭帯を切断してつま先を取り除きます。
- ハサミを使用して足首近くの下肢の筋肉の腱を切ります。ピンセットで腱をつかみ、下腿の近位の筋肉をはがして脛骨を露出させます。腓骨を取り除きます。
- 引っ張って膝関節を脱臼させ、続いてハサミを使用して関節の靭帯を切断し、腫れた後足で脛骨を切り離します。ステップ3.1に処理されるまで、サンプルを氷冷培地(0.3 mL/cm2)に保管してください。
3.滑膜炎組織の消化( 図1B)
- サンプルを避けて培地を吸引し、新しい培地(0.3 mL/cm2)を加えます。洗浄プロセスを3〜4回繰り返します。
注意: このステップから、サンプルの取り扱いはクリーンベンチまたは安全キャビネットで無菌的に実行する必要があります。 - 実体顕微鏡下で培地中の微細なピンセットを使用して引っ張ることにより、サンプルのすべての関節を脱臼させます(10x-20x倍の倍率で)。このステップでは、ファインポイントピンセットが便利です。脛骨とできるだけ多くの血管、腱、靭帯を取り除きます。脱臼時に骨を折らないように注意してください。
- サンプルごとに2本の15 mLチューブを準備します。脱臼した骨を軟部組織でピンセットを使用して最初の15 mLチューブに移します。両後足から得られたサンプルあたり4 mLの消化培地をチューブに加えます。
- 残留細胞および組織断片を収集するには、サンプルが含まれていた培地を2番目の15 mLチューブに移します。培地を500 x g で室温で5分間遠心分離します。上清を除去した後、ペレットを1 mLの消化培地で再懸濁し、細胞および組織断片溶液を、ほぼすべての組織(合計5 mLの消化培地/後足)を含む最初の15 mLチューブに移します。
- ハイブリダイゼーションオーブンで振とうしながら、サンプルを37°Cで60〜120分間消化します。
注:サンプルを消化するのに最適な時間を決定する必要があります。時間は足首とコラゲナーゼの腫れの程度に依存します。ほとんどの場合、60〜120分で十分です。60分間のインキュベーション後、ピペッティングにより消化サンプルの一部を採取し、顕微鏡で観察する。消化が不十分な場合は、インキュベーションを継続し、消化を30分ごとにチェックします。 - 解決策をうまくピペットします。細胞溶液をセルストレーナー(孔径40 μm)で50 mLチューブにろ過します。
- 10 mLの培養液をセルストレーナーを通して50 mLチューブに加えます。室温で5分間、300 x g で遠心分離します。
- 上清を除去した後、10 mLの培養液で再懸濁する。遠心分離を繰り返します。上清を除去した後、2 mLの培養液で再懸濁する。
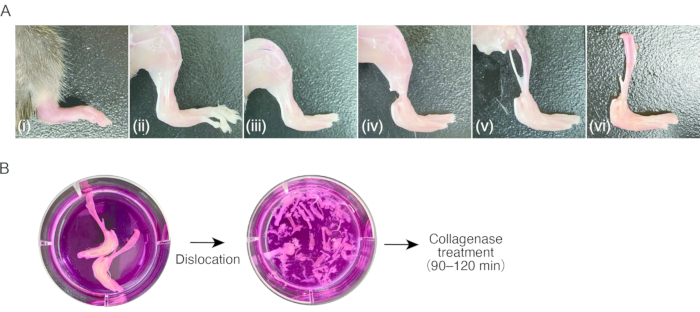
図1:マウス関節炎組織のサンプリングとコラゲナーゼ消化の手順 。 (a)(i)炎症性関節炎を伴うマウス後足。(ii)後足の皮膚の除去。(iii)中足指節関節の脱臼と足指の除去。(iv)足首の腱の切断。(v)下肢の筋肉の除去。(vi)膝関節の脱臼。(b)左;培地中の脚を切除した。右;培養液中の脱臼した足根骨および中足骨。 この図の拡大版を表示するには、ここをクリックしてください。
4.滑膜線維芽細胞の分離( 図2A)
- 両足首から得られたすべての細胞懸濁液をコラーゲンコートディッシュに播種する。
注:細胞を得るために弱いまたは中程度の腫れのある足首を使用する場合は、直径40mmの皿が適用されます。コラーゲンコーティングされたディッシュのサイズは、両足首の腫れがひどい場合は直径60mmのディッシュに変更することができます。 - 培地(約222 μL/cm2)を加えます。5%CO2を含む加湿雰囲気中で37°Cで1時間インキュベートします。
- ピペットを使用して非接着細胞を収集します(手順5.1で使用)。コラーゲンコーティングされたディッシュを培養液で洗浄し、培地を回収します。接着細胞を新鮮な培地で培養する(図2B、i)。コラーゲンコートディッシュに素早く接着する細胞のほとんどは、線維芽細胞様(紡錘形)の形態を示します。
- ハンクス平衡塩溶液(HBSS)中の0.05%トリプシンで処理することにより、サブコンフルエント細胞を継代します。この方法では、初期膨張であっても他の細胞の汚染は限定的である。より精製された線維芽細胞様細胞が必要な場合は、純度を高めるために繰り返し継代を行います。しかし、接着における細胞の細胞質の拡大も観察されています(図2B、ii)。過剰な継代は細胞内のナイーブ特性の喪失に影響を与えるので、5継代未満の細胞を使用してください。
5. 滑膜マクロファージの単離( 図2A)
- ステップ4.4のすべての非接着細胞を、コラーゲンでコーティングされていないディッシュ(直径40または60 mm)に播種します。
注:非接着細胞には、マクロファージ、他のリンパ球、および滑膜炎組織からの残留線維芽細胞が含まれます。 - バルク細胞を5%CO2の加湿雰囲気中で37°Cで1日間培養する。
- 非付着性リンパ球を除去するには、培養培地を吸引してから、新しい培地を追加します。このプロセスを2〜3回繰り返します(図2B、iii)。
- 接着バルク細胞を培養液中で1〜2週間培養し、コンフルエントを維持しながら2日毎に培地交換を行う(図2B、iv)。
注:SMの数は、SFとの共培養条件下でゆっくりと増加します。したがって、共存期間は必要に応じて調整する必要があります。 - PBSまたはHBSSで2回洗浄します。HBSS中の0.05%トリプシン(約55 μL/cm2)で、5%CO2の加湿雰囲気下で37°Cで3分間処理します。線維芽細胞はトリプシン処理によって培養皿から容易に剥離し、マクロファージはトリプシン処理に対して抵抗性を示す。このプロパティは、滑膜マクロファージの選択に使用します。
- 培養液(約222 μL/cm2)をHBSS中の0.05%トリプシンに穏やかに加えます。このステップの後、培地を細胞に直接注がないでください。
- 剥離した細胞を除去するには、培養培地を吸引し、新鮮な培地を穏やかに加えます。このプロセスを2、3回繰り返します。使用時まで新鮮な培養培地でディッシュ上の残りの細胞を維持します(図2B、v)。
注:トリプシン処理後、接着細胞はマクロファージ様の形態学的特徴を示します。

図2:炎症性関節炎組織からのマクロファージリッチおよび線維芽細胞リッチ画分の分離 。 (A)関節炎組織からマクロファージリッチおよび線維芽細胞リッチ細胞を分離する手順のスキーマ。(b)手順の段階の代表的な位相差画像、図 2Aの(i)〜(v)。スケールバーは100μmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
結果
7〜8週齢の雌C57BL/6マウスは、コラーゲン抗体誘発性関節炎を受けた。マクロファージ様細胞および線維芽細胞様細胞を、上述の手順に従って炎症性関節炎組織から独立して単離した(図2A、B)。マクロファージ様細胞は、ステップ5.7の直後に使用した。線維芽細胞様細胞は、ステップ4.4の後に最初にサブコンフルエントになるように培養し、次に新しい培養皿...
ディスカッション
ここで開発されたこの方法は、マウス関節炎からのSFと多数の臓器からの常在マクロファージの両方を単離するための以前の技術を改良したものです7,11。改変法は、炎症性滑膜からマクロファージと線維芽細胞の両方を高純度で単離することができ、簡便で再現性があります。セルソーターなどの複雑な器具を必要としないため、誰でも実施でき?...
開示事項
著者は、競合する利益がないことを宣言します。
謝辞
著者らは、愛媛大学先端研究支援センター(ADRES)医学研究支援部門と、愛媛大学プロテオサイエンスセンター統合病態学部門の方々の技術支援と有益なサポートに感謝しています。本研究の一部は、日本学術振興会(JSPS)科研費JP17K17929、JP19K16015、JP21K05974(NSへ)およびJP23689066、JP15H04961、JP15K15552、JP17K19728、JP19H03786(YIへ)の助成を受けて行われました。大阪難病医学研究財団、中富財団、日本骨ミネラル学会ライジングスター助成、住友財団、千信医学研究財団、持田記念財団(NSへ)武田科学振興財団医学研究助成、UCBジャパン(UCBJ)プロジェクト助成、JSBMRフロンティアサイエンティスト助成2019(YIへ)。
資料
| Name | Company | Catalog Number | Comments |
| 5.0 g/L Trypsin/5.3 mmol/L EDTA solution | nacalai tesque | 35556-44 | Diluted with HBSS |
| Antibiotic–antimycotic (anti/anti) | Gibco | 15240-062 | |
| Butterfly needle | TERUMO | SV-23DLK | 23G |
| Cell strainer | Falcon | 352340 | 40 µm pore, Nylon |
| Cellmatrix Type I-C | Nitta gelatin | 637-00773 | Type I-C collagen |
| Centriguge tube 15 | TPP | 91014 | 15 mL tube |
| Centriguge tube 50 | TPP | 91050 | 50 mL tube |
| Collagenase from C. Histolyticum | Sigma | C5138 | Type IV collagenase |
| Dulbecco’s Modified Eagle Medium GlutaMax (DMEM) | Gibco | 10569-010 | |
| Fetal bovine serum (FBS) | SIGAM | 173012 | Heat inactivation was performed |
| Hanks' balanced salt solution (HBSS) | Wako | 085-09355 | |
| Scissors | Bio Research Center | PRI28-1525A | |
| Tissue culture dish 40 | TPP | 93040 | For cell culture |
| Tissue culture dish 60 | TPP | 92006 | For cell culture |
| Tweezers | KFI | 1-9749-31 | Fine-point |
| Tweezers | Bio Research Center | PRI28-1522 | Serrated tip |
| ZEISS Stemi 305 | ZEISS | STEMI305-EDU | Stereomicroscope |
参考文献
- Smolen, J. S., Aletaha, D., McInnes, I. B. Rheumatoid arthritis. Lancet. 388 (10055), 2023-2038 (2016).
- McInnes, I. B., Schett, G. The pathogenesis of rheumatoid arthritis. The New England Journal of Medicine. 365 (23), 2205-2219 (2011).
- Kurowska-Stolarska, M., Alivernini, S. Synovial tissue macrophages: friend or foe. RMD Open. 3 (2), (2017).
- Hannemann, N., Apparailly, F., Courties, G. Synovial macrophages: from ordinary eaters to extraordinary multitaskers. Trends in Immunology. 42 (5), 368-371 (2021).
- Alivernini, S., et al. Distinct synovial tissue macrophage subsets regulate inflammation and remission in rheumatoid arthritis. Nature Medicine. 26 (8), 1295-1306 (2020).
- Saeki, N., Imai, Y. Reprogramming of synovial macrophage metabolism by synovial fibroblasts under inflammatory conditions. Cell Communication and Signaling. 18 (1), 188 (2020).
- Armaka, M., Gkretsi, V., Kontoyiannis, D., Kollias, G. A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts. Protocol Exchange. , (2009).
- Saeki, N., et al. Epigenetic regulator UHRF1 orchestrates proinflammatory gene expression in rheumatoid arthritis in a suppressive manner. The Journal of Clinical Investigation. 132 (11), (2022).
- Midwood, K., et al. Tenascin-C is an endogenous activator of Toll-like receptor 4 that is essential for maintaining inflammation in arthritic joint disease. Nature Medicine. 15 (7), 774-780 (2009).
- You, D. G., et al. Metabolically engineered stem cell-derived exosomes to regulate macrophage heterogeneity in rheumatoid arthritis. Science Advances. 7 (23), 0083 (2021).
- Ogawa, K., Tsurutani, M., Hashimoto, A., Soeda, M. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunology. 20 (1), 34 (2019).
- Andrä, I., et al. An evaluation of T-cell functionality after flow cytometry sorting revealed p38 MAPK activation. Cytometry Part A. 97 (2), 171-183 (2020).
- Ryan, K., Rose, R. E., Jones, D. R., Lopez, P. A. Sheath fluid impacts the depletion of cellular metabolites in cells afflicted by sorting induced cellular stress (SICS). Cytometry Part A. 99 (9), 921-929 (2021).
- Llorente, I., García-Castañeda, N., Valero, C., González-Álvaro, I., Castañeda, S. Osteoporosis in rheumatoid arthritis: dangerous liaisons. Frontiers in Medicine. 7, 601618 (2020).
- Croft, A. P., et al. Distinct fibroblast subsets drive inflammation and damage in arthritis. Nature. 570 (7760), 246-251 (2019).
- Wei, K., et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature. 582 (7811), 259-264 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved