A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير طويل المدى للمجموعات العصبية المحددة باستخدام المنشورات الدقيقة في التي تتحرك بحرية وثابتة الرأس
In This Article
Summary
عند دمجها مع لوحة رأس وتصميم بصري متوافق مع كل من المجاهر أحادية الفوتون وثنائية الفوتون ، تقدم عدسة المنشور الدقيق ميزة كبيرة في قياس الاستجابات العصبية في عمود عمودي في ظل ظروف متنوعة ، بما في ذلك التجارب التي يتم التحكم فيها جيدا في حالات ثابتة الرأس أو المهام السلوكية الطبيعية في التي تتحرك بحرية.
Abstract
مع تقدم المجهر متعدد الفوتونات والتقنيات الجزيئية ، ينمو التصوير الفلوري بسرعة ليصبح نهجا قويا لدراسة بنية أنسجة المخ الحية ووظيفتها ومرونتها. بالمقارنة مع الفيزيولوجيا الكهربية التقليدية ، يمكن للفحص المجهري الفلوري التقاط النشاط العصبي بالإضافة إلى مورفولوجيا الخلايا ، مما يتيح تسجيلات طويلة الأجل لمجموعات الخلايا العصبية المحددة بدقة خلية واحدة أو تحت خلوية. ومع ذلك ، يتطلب التصوير عالي الدقة عادة إعدادا مستقرا وثابتا للرأس يقيد حركة ، ويسمح إعداد سطح مستو من الزجاج الشفاف بتصور الخلايا العصبية في مستوى أفقي واحد أو أكثر ولكنه محدود في دراسة العمليات الرأسية التي تعمل عبر أعماق مختلفة. هنا ، نصف إجراء للجمع بين تثبيت لوحة الرأس والمنشور الدقيق الذي يعطي تصويرا متعدد الطبقات ومتعدد الوسائط. لا يتيح هذا المستحضر الجراحي الوصول إلى العمود الكامل للقشرة البصرية للفأر فحسب ، بل يسمح بالتصوير ثنائي الفوتون في وضع ثابت للرأس وتصوير فوتون واحد في نموذج يتحرك بحرية. باستخدام هذا النهج ، يمكن للمرء أخذ عينات من مجموعات الخلايا المحددة عبر طبقات قشرية مختلفة ، وتسجيل استجاباتها تحت حالات ثابتة الرأس وتتحرك بحرية ، وتتبع التغييرات طويلة المدى على مدى أشهر. وبالتالي ، توفر هذه الطريقة فحصا شاملا للدوائر الدقيقة ، مما يتيح المقارنة المباشرة للأنشطة العصبية التي تثيرها المحفزات التي يتم التحكم فيها جيدا وفي إطار نموذج سلوكي طبيعي.
Introduction
ظهر ظهور التصوير الفلوري ثنائي الفوتون في الجسم الحي 1,2 ، الذي يجمع بين التقنيات الجديدة في الأنظمة البصرية ومؤشرات التألق المعدلة وراثيا ، كتقنية قوية في علم الأعصاب للتحقيق في البنية المعقدة والوظيفة واللدونة في الدماغ الحي 3,4. على وجه الخصوص ، توفر طريقة التصوير هذه ميزة لا مثيل لها على الفيزيولوجيا الكهربية التقليدية من خلال التقاط كل من التشكل والأنشطة الديناميكية للخلايا العصبية ، وبالتالي تسهيل التتبع طويل المدى للخلايا العصبية المحددة5،6،7،8.
على الرغم من نقاط قوته الجديرة بالملاحظة ، فإن تطبيق التصوير الفلوري عالي الدقة غالبا ما يتطلب إعدادا ثابتا ثابتا للرأس يقيد حركة9،10،11. بالإضافة إلى ذلك ، فإن استخدام سطح زجاجي شفاف لتصور الخلايا العصبية يقيد الملاحظات على مستوى أفقي واحد أو أكثر ، مما يحد من استكشاف ديناميكيات العمليات الرأسية التي تمتد عبر أعماق قشرية مختلفة12.
لمعالجة هذه القيود ، تحدد الدراسة الحالية إجراء جراحيا مبتكرا يدمج تثبيت لوحة الرأس ، والمنشور الدقيق ، والمجهر الصغير لإنشاء طريقة تصوير ذات قدرات متعددة الطبقات ومتعددة الوسائط. يسمح المنشور الدقيق بمراقبة المعالجة الرأسية على طول العمود القشري13،14،15،16 ، وهو أمر بالغ الأهمية في فهم كيفية معالجة المعلومات وتحويلها أثناء تحركها عبر طبقات مختلفة من القشرة وكيف يتم تغيير المعالجة الرأسية أثناء التغيرات البلاستيكية. علاوة على ذلك ، فإنه يسمح بتصوير نفس المجموعات العصبية في نموذج ثابت للرأس وفي بيئة تتحرك بحرية ، بما في ذلك الإعدادات التجريبية متعددة الاستخدامات17،18،19: على سبيل المثال ، غالبا ما يكون تثبيت الرأس مطلوبا للنماذج التي يتم التحكم فيها جيدا مثل تقييم الإدراك الحسي والتسجيلات المستقرة تحت نموذج 2 فوتون ، بينما يوفر التحرك الحر بيئة أكثر طبيعية ومرونة للدراسات السلوكية. لذلك ، فإن القدرة على إجراء مقارنة مباشرة في كلا الوضعين أمر بالغ الأهمية لتعزيز فهمنا للدوائر الدقيقة التي تتيح استجابات مرنة ووظيفية.
في جوهرها ، يوفر دمج تثبيت لوحة الرأس ، والمنشور الدقيق ، والمجهر في التصوير الفلوري منصة واعدة لاستكشاف تعقيدات بنية الدماغ ووظائفه. يمكن للباحثين أخذ عينات من مجموعات الخلايا المحددة عبر أعماق مختلفة تغطي جميع الطبقات القشرية ، ومقارنة استجاباتهم مباشرة في كل من النماذج الطبيعية التي يتم التحكم فيها جيدا ، ومراقبة تغيراتها طويلة المدى على مدار20 شهرا. يقدم هذا النهج نظرة ثاقبة قيمة حول كيفية تفاعل هذه المجموعات العصبية وتغيرها بمرور الوقت في ظل ظروف تجريبية مختلفة ، مما يوفر نافذة على الطبيعة الديناميكية للدوائر العصبية.
Protocol
أجريت جميع التجارب وفقا لقانون في المملكة المتحدة (الإجراءات العلمية) لعام 1986 بموجب التراخيص الشخصية وتراخيص المشاريع المعتمدة والصادرة عن وزارة الداخلية البريطانية بعد مراجعة الأخلاقيات المناسبة. خطوط معدلة وراثيا للبالغين CaMKII-TTA ؛ تم تربية GCaMP6S-TRE21 واستخدام نسلها في التجربة. من أجل سلامة المجربين والحفاظ على الظروف المعقمة ، تم تنفيذ جميع الإجراءات في ظل ظروف معقمة ومع معدات الحماية الشخصية الكاملة.
1. التحضير قبل الجراحة
- لتقليل الوذمة، يتم تطبيق ديكساميثازون (0.2 ملغ/كغ) تحت الجلد، قبل 12-24 ساعة من الجراحة.
- تعقيم جميع الأدوات الجراحية في الأوتوكلاف وتعقيم المنطقة الجراحية بحمض هيبوكلوروس المستقر بالماء المقطر و 70٪ من الإيثانول قبل الجراحة. تأكد من تشغيل جميع المعدات الجراحية.
- تخدير (24 أسبوعا من العمر ، ذكر يزن 31 جم) باستخدام إيزوفلوران بجرعة تحريض 5٪ ، والتي تنخفض إلى 1٪ -2٪ بمجرد أن يكون الفأر على الإطار التجسيمي ، مع الاحتفاظ ب O2 بين 1-2 لتر / دقيقة. حقن مضادات الالتهاب غير الستيروئيدية (كاربروفين ، 2.5 ملغ / كغ) تحت الجلد.
- تحقق من عدم وجود منعكس قرصة إصبع القدم لتقييم عمق التخدير (زيادة تركيز الأيزوفلوران بزيادات 0.5٪ إذا شوهد المنعكس).
- حلق رأس ، باستخدام أداة تشذيب ، من خلف الأذنين إلى أعلى العينين قليلا. نظف هذه المنطقة بمسح الكحول ومحلول بوفيدون اليود ، مما يضمن تجنب ملامسة عيون.
- قم بتركيب على وسادة التدفئة المنزلية والإطار المجسم المزود بقضبان الأذن والأسنان وتأمين الرأس. تأكد من استقرار الرأس ، لأن هذا أمر بالغ الأهمية لنجاح الإجراء التالي (الشكل 1).
- ضع مرهما للعيون على عيون لمنعها من الجفاف أثناء الجراحة وتغطيتها بورق لحمايتها من الضوء. تغطية بغطاء جراحي معقم.

الشكل 1: التحضير قبل العملية. يتم وضع الماوس على الإطار التجسيمي ، ويتم تثبيته بواسطة قطعة أنف وقضبان أذن. يتم وضع الماوس على وسادة ساخنة منظمة لدرجة الحرارة. العيون لها مرهم عيني عليها ومغطاة بورق الألمنيوم. يتم حلق الرأس ، والجمجمة مكشوفة. يتم وضع غطاء معقم فوق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. حج القحف
- باستخدام المقص الجراحي ، قم بشق الجلد على طول خط الوسط للمنطقة المحلوقة من الرأس لكشف الجمجمة.
- نظف الجمجمة باستخدام قطعة قطن معقمة وبيروكسيد الهيدروجين المخفف (3٪ وزن / وزن 35٪H 2O2 في 97٪ dH2O) لمدة 1-3 ثوان لإزالة أي نسيج ضام (الشكل 2 أ). جفف الجمجمة باستخدام قطرة من الإيثانول بنسبة 70٪ ومسحة قطنية معقمة جديدة.
- قم بمحاذاة الجمجمة الأمامية / الخلفية (AP) والإنسي / الجانبي (ML) لضمان موقع زرع دقيق. للقيام بذلك ، قم بقياس العمق الظهري البطني (DV) للجمجمة في كل من bregma و lambda وتأكد من أن الفرق بين الاثنين هو <0.03 مم. بالنسبة للمحاذاة المتوسطة الجانبية ، قم بقياس النقاط المتساوية البعد على كل من العظام الجدارية من خط الوسط وتأكد مرة أخرى من أن فرق DV هو <0.03 مم.
- باستخدام bregma كأصل ، ابحث عن المنطقة القشرية المطلوبة وقم بتمييزها ؛ هنا ، هذه هي القشرة البصرية الأولية أحادية العين (V1) ، AP: -3.5 مم ، ML: -2.5 مم.
- استخدم مثقاب trephine (قطر 1.8 مم) ومثقاب أسنان (سرعة 10000 دورة في الدقيقة) لكشف القشرة ، مما يضمن وضع علامة المنطقة القشرية المرغوبة (أحادي العين V1) داخل الثلث السفلي من نافذة مثقاب الثقاب.
- تأكد من أن زاوية لقمة الحفر متعامدة مع انحناء الجمجمة. سيضمن ذلك حج القحف بشكل متساو وسيمنع تلف الجافية أو القشرة.
- حفر حتى يكون هناك انخفاض في المقاومة ثم توقف (الشكل 2 ب). قم بإزالة جزء العظم المنفصل بعناية باستخدام طرف إبرة 23G (الشكل 2C).
- نظف القشرة المكشوفة بالرغوة الجراحية المشبعة بالسائل الدماغي الشوكي الاصطناعي البارد (ACSF) لإزالة أي حطام ووقف أي نزيف قد يحدث.
- حافظ دائما على رطوبة القشرة المكشوفة ، باستخدام ACSF البارد ، طوال الجراحة.
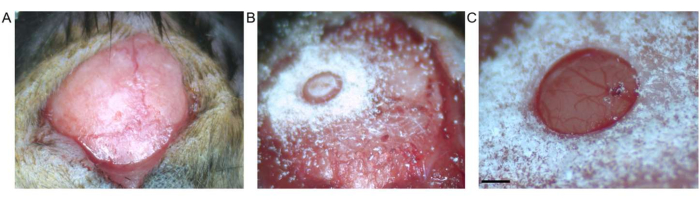
الشكل 2: حج القحف. (أ) يظهر شق الجلد بين البريغما واللامدا. تمت إزالة النسيج الضام من السطح المكشوف. ب: حج القحف بواسطة مثقاب التريفين قبل إزالة جزء العظم. (ج) حج القحف بعد إزالة شظية العظم ، مع إظهار الجافية والقشرة سليمة (يمثل شريط المقياس 0.5 مم). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. شق قبل قطع
ملاحظة: يجب أن يؤخذ في الاعتبار عند إجراء الشق المقطوع مسبقا ، يجب أن يكون الشق وزرع المنشور الدقيق أماميا لمنطقة التصوير ذات الأهمية (ROI). هذا للسماح بمجال رؤية كامل ودقيق. في سياق هذا البروتوكول ، سيتم إجراء الشق على طول المحور المتوسط الجانبي ، ويتم توجيه المنشور الدقيق في مواجهة الخلف (الشكل 3 ب).
- للمساعدة في الإدخال وتخفيف الضغط في القشرة أثناء إدخال المنشور الدقيق ، قم بعمل شق.
- قم بتوصيل السكين الجراحي بحامل الذراع التجسيمي وقم بتوجيه الشفرة أو الذراع المجسمة بحيث تقطع على طول محور ML.
- حرك السكين إلى إحداثيات AP المطلوبة (AP: -3.4 مم) ؛ يجب أن يكون المنشور أمام عائد الاستثمار ، لذا اجعل الشق 100 ميكرومتر أمام إحداثيات ROI AP للتصوير (-3.5 مم).
- الآن تحريك السكين إلى الحافة الإنسية لحج القحف ، حيث يلتقي بالجمجمة ، قم بخفض السكين ببطء حتى يصل إلى العظم ثم يتوقف. نظرا لأن سمك العظم يبلغ 200 ميكرومتر ، فقم بدمج هذه القيمة في إجمالي عمق الإدخال (انظر حساب الخطوة 5.1).
- التصوير الأمثل هو في مركز المنشور ، أي 500 ميكرومتر. لذلك ، تأكد من محاذاة هذا العمق مع عمق العمود القشري (ROI DV: - 0.35 مم).
- بدمج سمك الجمجمة في حساب العمق ، استخدم المعادلة أدناه ، والتي تحدد مدى عمق الشق المقطوع مسبقا من سطح الجمجمة. بالنسبة لهذا البروتوكول ، يتم حساب عمق الزرع على النحو التالي:
سمك العظام (200 ميكرومتر) + عائد استثمار التصوير (على سبيل المثال ، 350 ميكرومتر) + عمق المنشور الدقيق المتبقي (500 ميكرومتر) = 1050 ميكرومتر
- بدمج سمك الجمجمة في حساب العمق ، استخدم المعادلة أدناه ، والتي تحدد مدى عمق الشق المقطوع مسبقا من سطح الجمجمة. بالنسبة لهذا البروتوكول ، يتم حساب عمق الزرع على النحو التالي:
- تأكد من أن طول الشق أكثر من 1 مم ولكن ليس مفرطا ؛ لذلك ، تعتبر المسافة 1.2 مم مثالية ، حيث يكون إحداثي ML أحادي العين في منتصف هذه المسافة.
- عندما تكون مستعدا لإجراء الشق ، قم بإزالة ACSF الزائد حتى لا يتم حجب الرؤية (الشكل 3 أ).
- حرك السكين من الحافة الإنسية لحج القحف إلى الإحداثيات الإنسية الأولية للشق. ببطء (10 ميكرومتر / ثانية) أسفل السكين في القشرة.
- بمجرد ثقب الجافية ودخول السكين إلى القشرة ، ضع قطرة من ACSF البارد على القشرة للحفاظ على الأنسجة مشحمة ورطبة أثناء الشق.
- بمجرد الوصول إلى العمق النهائي ، ابدأ في تحريك السكين على طول محور ML (بمعدل 10 ميكرومتر / ثانية).
- استمر في مراقبة الأنسجة المحيطة أثناء إجراء الشق. إذا كان المنديل يسحب مع السكين ، حرك السكين لأعلى ولأسفل عدة مرات للتأكد من قطع الأنسجة ، ثم استمر بشكل جانبي ، وتذكر إعادة السكين إلى عمقه النهائي.
- عند الانتهاء ، ارفع السكين ببطء. إذا ظهر دم أثناء الشق ، فاستخدم هذا الوقت لتنظيف موقع الشق باستخدام رغوة جراحية مبللة ب ACSF لتخفيف الدم ودفع أي دم داخل الشق للخارج. تذكر أن تترك رغوة جراحية جديدة ومشبعة فوق القشرة المكشوفة حتى تصبح جاهزة لإدخال المنشور المجهري.

الشكل 3: زرع المنشور المجهري. أ: شق ما قبل القطع. (B) رسم تخطيطي لعدسة المنشور الدقيق المدمجة يوضح موقعها داخل القشرة (C) عدسة منشور دقيق مدمجة في الاتجاه الصحيح للشق المسبق قبل الإدخال في القشرة (يمثل شريط المقياس 0.5 مم). د: مثال على تراكم الأسمنت حول العدسة المدمجة لتأمين ارتباطها بالجمجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إدخال المنشور الدقيق وزرع لوحة الرأس
- تتكون عدسة المنشور الدقيق من عدسة مؤشر متدرجة متصلة بمنشور في الطرف البعيد للعدسة ، والتي يتم دمجها في صفيحة أساسية. قم بتوصيل المنشور الدقيق بمجموعة الزرع.
- تأكد من أن جانب التصوير من المنشور مقابل برغي الصفيحة. للمساعدة في إدخال ووضع المنشور الدقيق ، قم بإرفاقه بالإطار التجسيمي وقم بتوجيه المنشور بحيث يتماشى مع الشق (الشكل 3C).
- اخفض المنشور الدقيق ببطء في موقع الشق (10 ميكرومتر / ثانية). تذكر إزالة ACSF عند إدخال المنشور في البداية ، ولكن بمجرد دخوله إلى القشرة ، اغسله ب ACSF البارد لتليين الإدراج.
- يجب أن تظل القشرة مستقرة بينما يتم خفض المنشور في الشق. إذا لم يكن الأمر كذلك ، أضف ACSF إضافيا وقم بتحريك القشرة عن طريق تحريك المنشور لأعلى ولأسفل لتخفيف القشرة من المنشور.
- بمجرد الوصول إلى العمق النهائي ، جفف السطح القشري المكشوف باستخدام الأنسجة المعقمة ، مع الحرص على عدم لمس المنشور.
- قم بتغطية المنطقة القشرية المكشوفة المحيطة بالمنشور ، وكذلك العدسة ، بطبقة واقية من لاصق السيليكون ، مما يقلل من المادة اللاصقة الزائدة على الجمجمة المحيطة والنطاق الوهمي.
- بمجرد الشفاء (5-10 دقائق) ، قم بتوصيل صفيحة الرأس بالجمجمة لتثبيت الرأس أثناء التصوير المثبت على الرأس.
- تأكد من أن صفيحة الرأس خلفية بدرجة كافية حتى لا تتداخل مع وضع الغرسة وللسماح بالتطبيق المناسب للأسمنت لتأمين الغرسة بشكل صحيح.
- تأكد من أن خط الوسط لصفيحة الرأس يقع قليلا على يمين العدسة المزروعة لضمان إمكانية تثبيت جانبي صفيحة الرأس في مرحلة الرأس عند إجراء تجارب مثبتة على الرأس
- ضع الأسمنت اللاصق على لوح الرأس والجمجمة.
- تحضير الأسمنت الأسنان لاصق عن طريق خلط 1 مغرفة من مسحوق الأسمنت غير شفاف مع 4 قطرات من وسط الخلط وتطبيق قطرة واحدة من المحفز.
- ضع الأسمنت على كل من لوح الرأس والجمجمة وثبت صفيحة الرأس في مكانها حتى يتم علاجها ، وتأكد من أنها موازية لقضبان الأذن (من خلال الفحص البصري ، افحص من أعلى وخلف رأس).
- ضع الأسمنت اللاصق لتغطية بقية الجمجمة والأنسجة المكشوفة ، مع دمج المنشور الدقيق (حتى قاعدة الصفيحة) وصفيحة الرأس.
- لا تحصل على الأسمنت على الصفيحة الأساسية أو المجهر الوهمي أو أي من مكوناته. استمر في وضع الأسمنت اللاصق حتى يتم تغطية المنشور الدقيق وصفيحة الرأس وتكون مستقرة (الشكل 3 د).
- عندما يتم علاج الأسمنت ، افصل المجهر الوهمي عن طريق تحريك الذراع التجسيمي لأعلى ببطء أثناء تثبيت المنشور الدقيق بالملقط (يتم توصيلهما من خلال المغناطيس ، وبالتالي قد يتم الشعور ببعض المقاومة أثناء الفصل).
- أدخل الغطاء الواقي على العدسة وشد المسمار لتثبيته في مكانه.
- قم بإزالة من الإطار التجسيمي ، واتركه يتعافى في صندوق استرداد دافئ ، وقم بإدارة محلول ملحي معقم بنسبة 0.9٪ تحت الجلد (3٪ من وزن الجسم).
- بمجرد أن يستيقظ ويتحرك ، ضعه مرة أخرى في قفص نظيف من منزل واحد. مراقبة وإدارة تسكين إضافي بعد الجراحة وفقا لسياسة المؤسسة المحلية بشأن التسكين.
- انتظر لمدة 4 أسابيع بعد الجراحة ، يجب أن يكون جاهزا للتصوير.
5. تصوير الكالسيوم بفوتون واحد للطبقات القشرية في الفئران التي تتحرك بحرية
ملاحظة: من الضروري استخدام الصور الملتقطة من جلسة التصوير الأصلية في كل مرة لضمان الحصول بدقة على مستوى التصوير المقصود. تلعب هذه المعالم المحددة ، جنبا إلى جنب مع الخلايا العصبية ، دورا مهما في عملية المحاذاة الموضحة بالتفصيل في الخطوة 9 من البروتوكول. عند الحصول على بيانات الفوتون الواحد ، يكون المجهر هو نظام التصوير ومصدر الليزر. يستخدم الإثارة LED مع نطاق طاقة من 0-2 ميغاواط / مم2 على السطح الأمامي الموضوعي. يستخدم الليزر طولا موجيا للإثارة يبلغ 455 ± 8 نانومتر (الضوء الأزرق) لإشارات GCaMP. يمكن استخدام شريط تمرير تركيز العدسة لضبط التركيز (المحور Z) ، والذي يتم تمثيله على الواجهة ك 0-1000 ، حيث يمثل 0 مسافة عمل 0 ميكرومتر ، ويمثل 1000 أقصى مسافة عمل 300 ميكرومتر.
- قبل الحصول على البيانات ، دع يتأقلم مع الغرفة والساحة المفتوحة لمدة 1 ساعة قبل جلسة التسجيل.
- قبل التصوير ، قم بتطهير وتنظيف كل شيء بالمطهرات المناسبة (على سبيل المثال ، حمض هيبوكلوروس المستقر بالماء المقطر و 70٪ إيثانول).
- قم بإعداد مربع DAQ عن طريق توصيله بجهاز كمبيوتر وتشغيل برنامج الحصول على البيانات. إنشاء اتصال مباشر عبر كابل إيثرنت لتقليل الإطارات المتساقطة ؛ ومع ذلك ، قد يكون وضع الاتصال اللاسلكي كافيا اعتمادا على قوة الاتصال اللاسلكي.
- نعلق المنظار الصغير على صفيحة تحت لطيف.
- أولا ، قم بإزالة الغطاء الواقي من الصفيحة الأساسية عن طريق فك المسمار اللولبي. أمسك الغطاء من فتحته بالملقط. ثم ، قم بتوصيل المنظار الصغير بالصفيحة الأساسية ، حيث يجلس الغطاء.
- تحقق من اتجاه المنظار الصغير فيما يتعلق بالصفيحة الأساسية قبل تثبيته بحيث يواجه الجانب الذي يحمل علامة المسمار المسمار.
- بمجرد توصيل المنظار الصغير ، أحكم ربط المسمار اللولبي لتثبيته. قم فقط بدفع المسمار اللولبي حتى يمكن الشعور ببعض المقاومة. من المحتمل أن يؤدي الإفراط في شد المسمار اللولبي إلى إتلاف المنظار الصغير وبالتالي يجب تجنبه.
- قم بتوصيل المنظار الصغير بمربع DAQ وقم بإعداد البرنامج للتسجيل.
- في برنامج الحصول على البيانات ، قم بتشغيل الدفق للمنظار الصغير واضبط معلمات التسجيل (معدل إطارات التصوير ، والكسب ، وطاقة LED ، وقيمة eFocus) لتحقيق مجال رؤية واضح (الشكل 4A).
- قم بتشغيل نافذة الرسم البياني واضبط الكسب وطاقة LED بحيث تتراوح الكثافة المسجلة بين 35٪ إلى 70٪ .
- في حالة إجراء دراسة طولية ، ارجع إلى التسجيلات أو اللقطات التي تم التقاطها في جلسة سابقة واضبط قيمة eFocus بحيث يتم رؤية نفس مستوى التصوير بوضوح.
- ابدأ التجربة والحصول على البيانات.
- بعد الانتهاء من التجربة ، قم بإزالة من الجهاز السلوكي.
- تحت لطيف ، قم بفك المسمار اللولبي وإزالة المنظار الصغير من صفيحة.
- أعد الغطاء الواقي إلى الصفيحة الأساسية وقم بتثبيته باستخدام المسمار اللولبي.
- أعد إلى قفصه المنزلي (انتقل إلى الخطوة 7 إذا كنت ترغب في معالجة بيانات الفوتون الواحد).

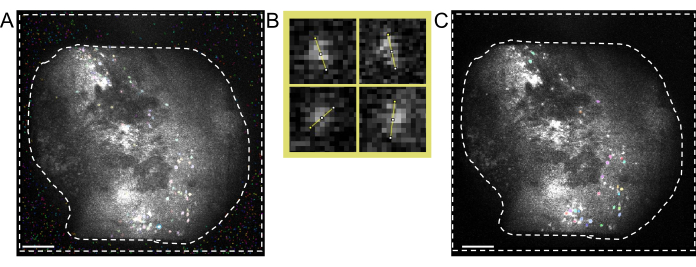
الشكل 4: الحصول على البيانات ومعالجتها باستخدام البرامج. (أ) صورة توضح التدفق في الوقت الفعلي من المنظار الصغير. يوصى بضبط قيمة تركيز العدسة ، بحيث يتم رؤية رؤية واضحة في نافذة البث ، جنبا إلى جنب مع الكسب وقوة الليزر التصويرية (B) رسم بياني تخطيطي يوضح سير عمل المحاذاة الموصى به للجلسات المسجلة في نقاط زمنية مختلفة. يوصى بإنشاء صورة متوسطة من الجلسة الأولى ، باتباع الإرشادات الخاصة ببرنامج معالجة البيانات. يجب استخدام هذه الصورة كصورة مرجعية أثناء تصحيح الحركة للجلسات التالية. (ج) أمثلة لأربع خلايا من نفس الصورة ΔF/F ذات الحد الأقصى المتوقع. يتم رسم خط برتقالي عبر كل خلية لقياس قطر الخلية بالبكسل ، ويتم أخذ متوسطها كوسيطة إدخال لخوارزمية تعريف الخلية (أعلى اليسار: 13 ، أعلى اليمين: 11 ، أسفل اليسار: 12 ، أسفل اليمين: 13). (د) إخراج خوارزمية تحديد الخلية بعد المعالجة اليدوية (تم اقتصاص الصورة). تمثل الخطوط العريضة البيضاء الخلايا المحددة (يمثل شريط المقياس 100 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
6. تصوير الكالسيوم ثنائي الفوتون للطبقات القشرية في الفئران الثابتة الرأس
ملاحظة: بالنسبة للمسح المجهري بالليزر ثنائي الفوتون ، فإن مصدر الضوء عبارة عن ليزر فائق السرعة قابل للضبط بطول موجة إثارة يبلغ 920 نانومتر. كانت قوة الإثارة ، التي تم قياسها عند الهدف ، تتراوح عادة بين 100-150 ميجاوات ويتم تعديلها في كل جلسة لتحقيق مستويات مماثلة من التألق. تم ترشيح ضوء الانبعاث بواسطة مرشح انبعاث (525/70 نانومتر) وقياسه بواسطة أنبوب مضاعف ضوئي مستقل (PMT) ، يشار إليه باسم القناة الخضراء. تم الحصول على الصور بهدف غمر الهواء 20x (NA = 0.45 ، مسافة عمل 6.9-8.2 مم).
- قبل الحصول على البيانات ، قم بتعويد على الجهاز في الأيام السابقة (لجعل يشعر بالراحة مع الإعداد السلوكي). اسمح للحيوان بقضاء 15-30 دقيقة في اليوم ، لمدة 2-3 أيام ، لاستكشاف الإعداد أو حتى يظهر سلوكا طبيعيا قبل البدء في الحصول على البيانات.
- قم بتشغيل نظام التصوير ثنائي الفوتون ، وقم بتشغيل برنامج الاستحواذ ، وقم بتشغيل الليزر. تأكد من إغلاق الليزر وإيقاف تشغيل PMTs قبل المتابعة.
- نظف جهاز التصوير ثنائي الفوتون بحمض هيبوكلوروس المستقر بالماء المقطر و 70٪ من الإيثانول.
- تأكد من ضبط الجهاز ليناسب حجم. قم بتوصيل الماوس وصفيحة الرأس برفق بإعداد مرحلة الرأس وقم بتثبيته في مكانه لتثبيت رأس الماوس.
- بمجرد تركيبه ، قم بإزالة غطاء العدسة (راجع الخطوة 5.4.1) ، وقم بمحاذاة الهدف بحيث يكون فوق الصفيحة الأساسية.
- استخدم عناصر التحكم في مرحلة التألق و XYZ لتركيز الأنسجة القشرية.
- بمجرد أن تصبح الطبقات القشرية مرئية ، قم بتبديل المجهر للسماح بالتصوير ثنائي الفوتون (استبدل المرآة بالمرآة ثنائية اللون ، وأغلق مصراع الفلورسنت ، وأوقف تشغيل ليزر وشاشة التألق). تأكد من إطفاء الأنوار الرئيسية لحماية PMTs عند التصوير.
- قم بإعداد المعلمات لتحسين ملفات الصور المكتسبة.
- استخدم وضع اكتساب الرنين لتصوير الكالسيوم حيث يمكنه التقاط الإطلاق السريع لإشارات GCaMP.
- اضبط طاقة الليزر وكسب PMT والتكبير / التصغير وجداول البحث (LUTs) للحصول على صورة مثالية والرجوع إلى صورة الفوتون الواحد لضمان تصوير المستوى البؤري الصحيح.
- ابدأ تصوير الطبقات القشرية بنظام الفوتون المزدوج مع المراقبة السلوكية المتزامنة ومدخلات التحفيز (إن وجدت).
- تأكد من حفظ معلمات الاستحواذ هذه ومسافات XYZ إذا كنت ترغب في إعادة إنتاج صور متطابقة بمرور الوقت.
- لالتقاط مكدس z من الطبقات القشرية ، اتبع الخطوات الموضحة أدناه.
- ابحث عن المستوى لبدء z-stack منه ، واضبط معلمات الاستحواذ لتحسين الصورة ، وحدد هذا كنقطة انطلاق في البرنامج.
- بعد ذلك ، باستخدام عنصر التحكم Z ، انتقل لأسفل المكدس ، واضبط طاقة الليزر فقط للحفاظ على إضاءة ثابتة للمكدس ، وحدد نهاية المكدس على البرنامج.
- الخطوة الحرجة: باستخدام خيار التدرج الأسي النسبي ضمن علامة التبويب تدرج طاقة الليزر ، اسمح للبرنامج بحساب الزيادة في طاقة الليزر أثناء تحركه عبر مكدس z. تأكد من وضع علامة على قيم طاقة الليزر لنقطة النهاية في الجدول الذي يوفره البرنامج للسماح له بحساب التدرج.
- بمجرد تعيين معلمات z-stack ، اضبط حجم الخطوة (μm).
ملاحظة: سيحدد حجم الخطوة الوقت المستغرق وعدد الشرائح وجودة تفاصيل المكدس. ستؤدي أحجام الخطوات الأصغر إلى وقت اكتساب أطول ، وزيادة في عدد الشرائح ، وتفاصيل أفضل مقارنة بحجم الخطوة الأكبر. تستخدم مكدسات Z للمساعدة في تسجيل صور الفوتون الواحد والفوتون ، لأنها ستسلط الضوء على أي معالم أو ميزات تشريحية.
- للحصول على سلسلة زمنية (T-series) لتغيرات الكالسيوم في الخلايا العصبية ، ابحث عن المستوى البؤري الأمثل باستخدام عناصر التحكم في المرحلة XYZ واضبط طاقة الليزر وكسب PMT والتكبير / التصغير وجداول البحث.
- ضمن علامة التبويب T-series في برنامج الاستحواذ ، حدد معلمات تردد الاستحواذ لمطابقة البيانات التي تم الحصول عليها باستخدام نظام التصوير أحادي الفوتون.
ملاحظة: ستؤدي مطابقة التردد إلى جعل بيانات 1P و 2P قابلة للمقارنة ، وهي مناسبة بشكل أفضل لخوارزمية تعريف الخلية المستخدمة في خطوات معالجة البيانات. يمكن دمج المشغلات المتعددة وأنماط الاستحواذ الأخرى في اكتساب T-series.
- ضمن علامة التبويب T-series في برنامج الاستحواذ ، حدد معلمات تردد الاستحواذ لمطابقة البيانات التي تم الحصول عليها باستخدام نظام التصوير أحادي الفوتون.
- ابدأ الاستحواذ على سلسلة T.
7. معالجة بيانات تصوير الكالسيوم بفوتون واحد
- بالنسبة لأفلام تسجيل الفوتون الواحد ، استخدم برنامج معالجة البيانات الذي يأتي مع نظام miniscope.
- أولا ، قم بمعالجة الفيلم مسبقا عن طريق أخذ العينات المكانية والزمانية. بشكل عام ، فإن أخذ العينات المكانية للفيلم بعامل اثنين من شأنه أن يقلل بشكل كبير من وقت المعالجة دون المساس بشدة بدقة تحديد الخلايا.
- اضبط عامل أخذ العينات الزمني لأسفل بحيث يتم خفض معدل الإطارات للفيلم إلى حوالي 10 هرتز ، وهو أكثر ملاءمة لخوارزمية تعريف الخلية المستخدمة في الخطوات التالية.
- في حالة الحصول على أفلام متعددة في نفس يوم التصوير ، ادمج الأفلام في سلسلة زمنية واحدة قبل خطوة المعالجة المسبقة لمعالجتها معا.
- اختياري: قم بتطبيق مرشح تمرير النطاق المكاني على الفيلم لإزالة الترددات المكانية المنخفضة والعالية، مما ينتج عنه فيلم أكثر سلاسة مع تباين أعلى.
- سجل الفيلم باستخدام وظيفة تصحيح الحركة الخاصة بالبرنامج. هذا يسجل الفيلم ويصحح القطع الأثرية للحركة الناتجة عن حركة المنظار المصغر بالنسبة لسطح التصوير.
- خطوة حرجة: في حالة إجراء دراسة طولية ، قم بتسجيل الأفلام في نفس مجال الرؤية ، على سبيل المثال ، متوسط صورة الفيلم التي تم التقاطها في يوم التصوير الأول (الشكل 4 ب).
- احسب ΔF / F للفيلم باستخدام علامة التبويب المقابلة وقم بعرض الفيلم لإنشاء صورة إسقاط قصوى لفيلم ΔF / F. ستعرض هذه الصورة المناطق التي تعرض تغيرات في مستويات التألق ، والخلايا العصبية الفردية المحتملة ، ويمكن استخدامها لقياس متوسط قطر الخلايا العصبية (الشكل 4C).
- بدلا من ذلك ، قم بقياس قطر الخلية على الفيلم المصحح للحركة ، حيث تظهر الخلايا العصبية مضانا واضحا.
- تحديد الخلايا باستخدام الخوارزميات في البرنامج.
- بينما يتوفر خياران (PCA-ICA و CNMF-E) في هذه الخطوة ، استخدم CNMF-E لهذه الدراسة. أدخل متوسط قطر الخلية بالبكسل وقم بتشغيل الخوارزمية لإنشاء مجموعة خلايا تحتوي على مناطق الاهتمام (ROIs) التي توضح الأنشطة الشبيهة بالخلية.
- حدد يدويا عائد الاستثمار الذي هو خلايا (لها مورفولوجيا تشبه الخلية ، ونشاط22,23 ، وتقع داخل مجال الرؤية) من تلك التي ليست كذلك ، وتحقق من صحة مجموعة الخلايا المنسقة (الشكل 4D).
- تصدير آثار الكالسيوم لكل عائد استثمار لمزيد من التحليل.
8. معالجة بيانات تصوير الكالسيوم ثنائي الفوتون
- بالنسبة لأفلام تسجيل الفوتونين ، استخدم حزمة python المصممة لمعالجة بيانات تحليل الكالسيوم ثنائي الفوتون.
- أولا ، ادمج الصور التي تم التقاطها في سلسلة T في مكدس .tiff كما هو موضح أدناه.
- ضمن واجهة خيارات التشغيل ، اضبط المعلمات ، بما في ذلك قيمة tau ومعدل الإطارات ، بحيث تتطابق مع GCaMP المستخدم ومعدل الإطارات للتسجيل.
- اختياري: اضبط المعلمة do_registration على 1 لتسجيل الفيلم. هذا يعادل خطوة تصحيح الحركة الموضحة أعلاه.
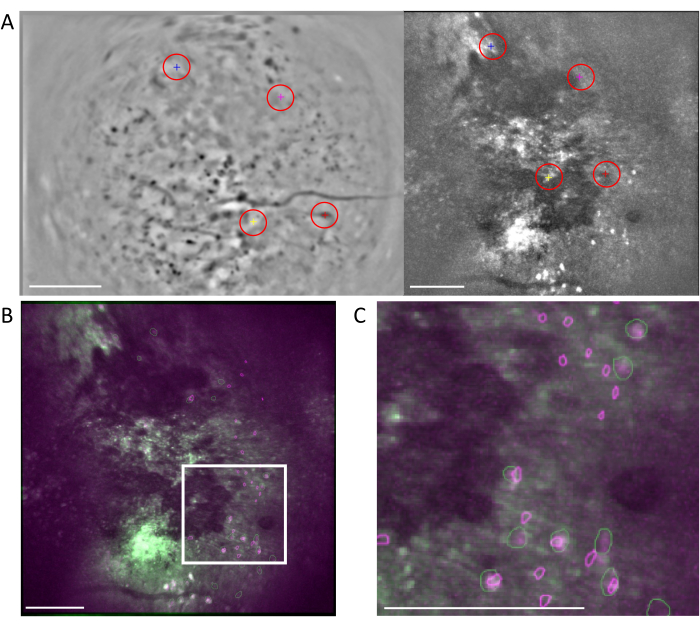
- اختياري: اضبط المعلمة anatomical_only على 1 لاكتشاف عائد الاستثمار باستخدام الميزات التشريحية بالإضافة إلى ديناميكيات التألق. يتطلب ذلك إدخال قطر الخلية ، لذا قم بإجراء القياسات باستخدام برنامج معالجة الصور. يوصى بهذا بشكل عام ، لأنه يولد عائد استثمار بأشكال طبيعية أكثر (الشكل 5A-C).
- بمجرد تعيين جميع المعلمات ، قم بتشغيل الخوارزمية بحيث تقوم بإجراء جميع العمليات الحسابية معا. ارجع إلى واجهة المستخدم الرسومية (GUI) للتحقق من التقدم.
- بمجرد الانتهاء من ذلك ، ارجع إلى واجهة اختيار الخلية للتنظيم اليدوي لنتائج تعريف الخلية.
- احفظ صورة للخلية المنسقة التي تم تعيينها أعلى الحد الأقصى لعرض الفيلم. سيتم استخدام هذا لاحقا كصورة مرجعية لتسجيل بيانات تسجيل الفوتون الواحد.
- ثم تقوم الخوارزمية بحفظ النتائج تلقائيا. تنسيق npy ، والذي يمكن الوصول إليه لاحقا باستخدام Python. بدلا من ذلك ، احفظ النتائج في ملفات منسقة أخرى لمزيد من التحليل في برامج أخرى.
الشكل 5: تحديد الخلية باستخدام برنامج معالجة الفوتونين. (أ) صورة تمثيلية لتعريف الخلية مأخوذة من برنامج المعالجة ثنائي الفوتون. تعيين Anatomical_only المعلمة إلى 0 مع الحفاظ على جميع المعلمات الأخرى كما هي ، توجد خلايا غير متعددة في المنطقة الواقعة بين الخطوط المتقطعة التي تتداخل مع المعالجة اليدوية للخلايا الفعلية. (ب) أمثلة على قياسات قطر الخلية مأخوذة من (أ)، باستخدام برنامج معالجة الصور (أعلى اليسار؛ 7.5 بكسل، أعلى اليمين؛ 9، أسفل اليسار؛ 6.5، أسفل اليمين؛ 7.5). ج: صورة تمثيلية لتعريف الخلية. عند ضبط Anatomical_only المعلمة على 1 وإدخال متوسط قطر الخلية المأخوذ من (B) في خوارزمية قطر الخلية ، لا توجد خلايا في المنطقة الواقعة بين الخطوط المتقطعة (تمثل أشرطة المقياس 200 ميكرومتر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
9. تسجيل مجموعات الخلايا المحددة عبر طرق التصوير
- قم بتسجيل الخلايا التي تم تحديدها من تسجيلات فوتون واحد وفوتونين باستخدام خوارزمية تسجيل وتحليل الصور متعددة الوسائط (MIRA) ، والتي تتوفر من خلال واجهة Python لبرنامج التصوير أحادي الفوتون.
- تقوم هذه الخوارزمية بمحاذاة بيانات الفوتون الواحد والفوتون عبر التسجيل غير الصلب. انظر مجموعة دفاتر الملاحظات التوضيحية عبر الإنترنت الموجودة على موقع الويب والمستخدمة في هذه الدراسة.
ملاحظة: تمت كتابة دفاتر الملاحظات بحيث تكتمل جميع عمليات المعالجة في برنامج 1P وبالتالي فهي غير متوافقة مع برنامج معالجة 2P. ومن ثم ، تابع فقط بعض الخطوات الواردة في دفاتر الملاحظات لهذه الدراسة.
- تقوم هذه الخوارزمية بمحاذاة بيانات الفوتون الواحد والفوتون عبر التسجيل غير الصلب. انظر مجموعة دفاتر الملاحظات التوضيحية عبر الإنترنت الموجودة على موقع الويب والمستخدمة في هذه الدراسة.
- اتبع الخطوات الموضحة في دفاتر الملاحظات التوضيحية ، والتي تتضمن إنشاء صورة هيكلية لكل طريقة تصوير. بشكل افتراضي ، يتضمن ذلك إنشاء أقصى إسقاط لمكدس z ثنائي الفوتون وصورة متوسطة لتسجيل الفوتون الواحد. بدلا من ذلك ، استخدم صورة متوسطة لتسجيل الفوتونين.
- عند المطالبة ، يقوم ممر النطاق الترددي المكاني بتصفية الصور لتصور المعالم بشكل أفضل وإعادة توجيهها بحيث تتطابق.
- حدد المعالم المطابقة على الصورتين (الشكل 6 أ).
- استخدمها لحساب الالتفاف اللازم لمحاذاة الصورتين. بشكل عام ، يجب أن تكون 3 إلى 5 معالم كافية.
- تحسب الخوارزمية الاعوجاج بناء على مجموعة من المعالم وتشابه الصورة. تحسين الوزن النسبي المعطى للعاملين حتى يتم تحقيق نتائج مرضية.
- قم بلف خريطة الخلية التي تم الحصول عليها في جلسة فوتون واحد لإنشاء خريطة خلية جديدة تتماشى مع بيانات الفوتونين.
- ثم قم باستيراد خريطة الخلية المشوهة هذه إلى برنامج معالجة 1P لإنشاء صورة بأقصى صورة إسقاط من فيلم ثنائي الفوتون في الخلفية.
- تصدير هذه الصورة لأغراض التسجيل.
- في برامج البرمجة ، قم بمحاذاة الصورتين اللتين تم إنشاؤهما حتى الآن (خريطة خلية ثنائية الفوتون أعلى صورة إسقاط قصوى ثنائية الفوتون) وقم بلف خريطة خلية فوتون واحد أعلى صورة إسقاط قصوى ثنائية الفوتون (الشكل 6B ، C).
- للقيام بذلك ، لهذه الدراسة ، استخدم تطبيق مقدر التسجيل الذي يسمح للمستخدم بمقارنة نتائج تقنيات التسجيل المختلفة. بالنظر إلى أن الصورتين لهما نفس الخلفية ، فإن تقنية ارتباط الطور ، مع التسجيل الجامد ، كانت كافية.
- بمجرد اكتمال التسجيل ، امسح الصورة المسجلة الآن بحثا عن عائد استثمار متداخل. هذه هي عائد الاستثمار النشط في كلتا جلستي التسجيل ، والتي يمكن استخدامها في مزيد من التحليل.
الشكل 6: تسجيل الخلايا عبر الوسائط باستخدام سير عمل MIRA. (أ) صورة تمثيلية من سير عمل محاذاة الخلية. تظهر الصورة المتوسطة من بيانات الفوتون الواحد على اليسار، والصورة من بيانات الفوتونين موضحة على اليمين. يتم تحديد المعالم المطابقة من كلتا الصورتين وتصنيفها في البرنامج بواسطة نظام ألوان عشوائي (دوائر حمراء). (ب) الصور المحاذية للأمثلة التي توضح مجموعتي الخلايا المحددتين، الفوتون الواحد (الأرجواني) والفوتونون (الأخضر)، متراكبة على الصورة المتوسطة لبيانات الفوتونين. (ج) صورة المنطقة المميزة بالمربع الأبيض في (B)، تمثل الخلايا المحاذية هنا في صورة حدود عريضة متداخلة باللونين الأخضر والأرجواني. في جميع اللوحات ، يمثل شريط المقياس 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
تم عرض طريقة إجراء تصوير الكالسيوم المزمن متعدد الطبقات في الجسم الحي لنفس المجموعة العصبية على مدى عدة أسابيع ، باستخدام كل من طرق التصوير بفوتون واحد وفوتون ، في ظل ظروف متحركة بحرية وثابتة الرأس. هنا ، تم إثبات القدرة على تحديد المجموعات العصبية المتطابقة تحت تصوير فوتون واحد أثنا...
Discussion
هنا ، أظهرنا القدرة على مراقبة الخلايا العصبية ومقارنتها مباشرة في ظروف ثابتة الرأس وتتحرك بحرية في نفس المجموعات العصبية. بينما أظهرنا التطبيق في القشرة البصرية ، يمكن تكييف هذا البروتوكول مع العديد من مناطق الدماغ الأخرى ، سواء المناطق القشرية أو النوى العميقة24،
Disclosures
يعلن المؤلفون عدم وجود مصلحة مالية متنافسة أو تضارب في المصالح.
Acknowledgements
نشكر السيدة شارو ريدي والبروفيسور ماتيو كارانديني (Cortex Lab) على نصائحهما بشأن البروتوكول الجراحي ومشاركة سلالة الفئران المعدلة وراثيا. نشكر الدكتور نوربرت هوجريف (Inscopix) على توجيهه ومساعدته من خلال تطوير الجراحة. نشكر السيدة أندريا ألديا (صن لاب) على مساعدتها في الإعداد الجراحي ومعالجة البيانات. وقد حظي هذا العمل بدعم من جمعية مورفيلدز الخيرية للعيون.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
References
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3 (2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472 (2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970 (2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579 (2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678 (2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728 (2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894 (2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved