JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자유롭게 움직이고 머리가 고정된 동물에서 마이크로프리즘을 사용하여 식별된 신경 집단의 장기 이미징
요약
헤드 플레이트 및 단일 광자 및 이광자 현미경과 호환되는 광학 설계와 통합될 경우, 마이크로프리즘 렌즈는 머리가 고정된 상태에서의 잘 제어된 실험이나 자유롭게 움직이는 동물의 자연스러운 행동 작업을 포함하여 다양한 조건에서 수직 컬럼의 신경 반응을 측정하는 데 상당한 이점을 제공합니다.
초록
다광자 현미경 및 분자 기술의 발전으로 형광 이미징은 빠르게 성장하여 살아있는 뇌 조직의 구조, 기능 및 가소성을 연구하기 위한 강력한 접근 방식이 되고 있습니다. 기존의 전기생리학과 비교했을 때, 형광 현미경은 세포의 형태뿐만 아니라 신경 활동도 포착할 수 있어 단세포 또는 세포 내 분해능으로 식별된 뉴런 집단을 장기간 기록할 수 있습니다. 그러나 고해상도 이미징은 일반적으로 동물의 움직임을 제한하는 안정적인 머리 고정 설정이 필요하며, 투명 유리의 평평한 표면을 준비하면 하나 이상의 수평면에서 뉴런을 시각화할 수 있지만 다양한 깊이에서 실행되는 수직 프로세스를 연구하는 데는 제한적입니다. 여기에서는 헤드 플레이트 고정과 다층 및 다중 모드 이미징을 제공하는 마이크로 프리즘을 결합하는 절차를 설명합니다. 이 수술 준비는 생쥐 시각 피질의 전체 기둥에 접근할 수 있을 뿐만 아니라 머리 고정 위치에서 2광자 이미징과 자유롭게 움직이는 패러다임에서 1광자 이미징을 가능하게 합니다. 이 접근법을 사용하면 다양한 피질 층에서 식별된 세포 집단을 샘플링하고, 머리가 고정되고 자유롭게 움직이는 상태에서 반응을 등록하고, 수개월에 걸친 장기적인 변화를 추적할 수 있습니다. 따라서 이 방법은 미세 회로에 대한 포괄적인 분석을 제공하여 잘 제어된 자극과 자연스러운 행동 패러다임에 의해 유발되는 신경 활동을 직접 비교할 수 있습니다.
서문
광학 시스템과 유전자 변형 형광 지표의 새로운 기술을 결합한 생체 내 이광자 형광 이미징(in vivo two-photon fluorescent imaging)1,2의 출현은 살아있는 뇌의 복잡한 구조, 기능 및 가소성을 조사하기 위한 신경 과학의 강력한 기술로 부상했습니다 3,4. 특히, 이 이미징 방식은 뉴런의 형태와 동적 활동을 모두 포착함으로써 기존 전기생리학에 비해 비교할 수 없는 이점을 제공하여 식별된 뉴런의 장기 추적을 용이하게 합니다 5,6,7,8.
주목할 만한 장점에도 불구하고, 고해상도 형광 이미징을 적용하려면 동물의 이동성을 제한하는 정적인 머리 고정 설정이 필요한 경우가 많습니다 9,10,11. 또한, 뉴런을 시각화하기 위해 투명한 유리 표면을 사용하면 관찰이 하나 이상의 수평면으로 제한되어, 상이한 피질 깊이(12)에 걸쳐 확장되는 수직 과정의 역학에 대한 탐색이 제한된다.
이러한 한계를 해결하기 위해 본 연구는 헤드 플레이트 고정, 마이크로 프리즘 및 미니스코프를 통합하여 다층 및 다중 모드 기능을 갖춘 이미징 양식을 만드는 혁신적인 수술 절차를 간략하게 설명합니다. 마이크로프리즘은 피질기둥(13,14,15,16)을 따라 수직처리를 관찰할 수 있게 해주는데, 이는 정보가 피질의 여러 층을 통과할 때 어떻게 처리되고 변형되는지, 그리고 소성 변화 동안 수직 처리가 어떻게 변경되는지를 이해하는 데 매우 중요하다. 더욱이, 다양한 실험 설정(17,18,19)을 포함하는 머리 고정 패러다임과 자유롭게 움직이는 환경에서 동일한 신경 집단의 이미징을 허용합니다: 예를 들어, 감각 지각 평가 및 2광자 패러다임 하에서 안정적인 기록과 같은 잘 제어된 패러다임에는 머리 고정이 종종 필요한 반면, 자유롭게 움직이는 것은 행동 연구를 위한 보다 자연스럽고 유연한 환경을 제공합니다. 따라서 두 모드에서 직접 비교를 수행할 수 있는 능력은 유연하고 기능적인 응답을 가능하게 하는 미세 회로에 대한 이해를 높이는 데 매우 중요합니다.
본질적으로, 형광 이미징에서 헤드 플레이트 고정, 마이크로 프리즘 및 미니스코프의 통합은 뇌 구조와 기능의 복잡성을 조사할 수 있는 유망한 플랫폼을 제공합니다. 연구원들은 모든 피질층에 걸쳐 다양한 깊이에서 식별된 세포 집단을 샘플링하고, 잘 통제된 패러다임과 자연 패러다임 모두에서 반응을 직접 비교하고,20개월 동안 장기적인 변화를 모니터링할 수 있습니다. 이 접근 방식은 이러한 신경 집단이 다양한 실험 조건에서 시간이 지남에 따라 어떻게 상호 작용하고 변화하는지에 대한 귀중한 통찰력을 제공하여 신경 회로의 동적 특성에 대한 창을 제공합니다.
프로토콜
모든 실험은 1986년 영국 동물(과학적 절차)법에 따라 영국 내무부에서 승인하고 발급한 개인 및 프로젝트 라이선스에 따라 적절한 윤리 검토를 거쳐 수행되었습니다. 성인 형질전환 라인 CaMKII-TTA; GCaMP6S-TRE21 을 사육하고 그 자손을 실험에 사용했습니다. 실험자의 안전과 멸균 조건의 유지를 위해 모든 절차는 무균 조건에서 완전한 개인 보호 장비로 수행되었습니다.
1. 수술 전 준비
- 부종을 최소화하려면 수술 12-24시간 전에 덱사메타손(0.2mg/kg)을 피하 투여하십시오.
- 오토클레이브에서 모든 수술 도구를 멸균하고 수술 전에 증류수와 70% 에탄올로 안정화된 차아염소산으로 수술 부위를 멸균합니다. 모든 수술 장비가 켜져 있는지 확인하십시오.
- 유도 용량 5%의 이소플루란을 사용하여 동물(생후 24주, 체중 31g의 수컷)을 마취하며, 마우스가 입체 프레임에 있으면 1%-2%로 감소하고 O2 는 1-2L/min 사이로 유지됩니다. 비스테로이드성 항염증제(Carprofen, 2.5 mg/kg)를 피하 주사합니다.
- 마취 깊이를 평가하기 위해 발가락 꼬집기 반사가 없는지 확인합니다(반사가 보이면 이소플루란 농도를 0.5% 단위로 증가).
- 트리머를 사용하여 동물의 머리를 귀 뒤에서 눈 약간 위로 면도합니다. 알코올 물티슈와 포비돈 요오드 용액으로 이 부위를 청소하고 동물의 눈에 닿지 않도록 합니다.
- 동물을 동종 가열 패드와 귀와 치아 막대가 장착된 입체 프레임에 장착하고 머리를 고정합니다. 헤드가 안정적인지 확인하는 것은 다음 절차를 성공적으로 수행하는 데 매우 중요합니다(그림 1).
- 수술 중 눈이 마르지 않도록 동물의 눈에 안과 연고를 바르고 호일로 덮어 빛으로부터 보호하십시오. 멸균 수술용 커버로 동물을 덮으십시오.

그림 1: 수술 전 준비. 마우스는 노즈 피스와 이어 바에 의해 고정되는 입체 프레임 위에 놓입니다. 마우스는 온도 조절이 가능한 가열 패드에 놓입니다. 눈에는 안과 연고가 바르고 알루미늄 호일로 덮여 있습니다. 머리를 깎고 두개골을 드러냅니다. 동물 위에 멸균 덮개가 씌워집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 개두술
- 수술용 가위를 사용하여 면도한 머리 부위의 정중선을 따라 피부를 절개하여 두개골을 노출시킵니다.
- 멸균 면봉과 희석된 과산화수소(3% w/v of 35% H2O2 in 97% dH2O)를 사용하여 1-3초 동안 두개골을 청소하여 결합 조직을 제거합니다(그림 2A). 70% 에탄올 한 방울과 새로운 멸균 면봉을 사용하여 두개골을 건조시킵니다.
- 정확한 이식 부위를 보장하기 위해 두개골을 전방/후방(AP) 및 내측/측면(ML)으로 정렬합니다. 이렇게 하려면 브레그마와 람다 모두에서 두개골의 등쪽(DV) 깊이를 측정하고 둘 사이의 차이가 <0.03mm인지 확인합니다. 내측 정렬의 경우 정중선에서 양쪽 두정골 뼈의 등거리 지점을 측정하고 DV 차이가 <0.03mm인지 다시 확인합니다.
- bregma를 원점으로 사용하여 원하는 피질 영역을 찾아 표시합니다. 여기서는 단안 1차 시각 피질(V1), AP: -3.5mm, ML: -2.5mm입니다.
- 트레핀 드릴 비트(직경 1.8mm)와 치과용 드릴(10,000rpm 속도)을 사용하여 피질을 노출시키고 원하는 피질 영역(단안 V1)에 대한 표시가 드릴 비트 창의 하단 1/3 내에 위치하도록 합니다.
- 드릴 비트의 각도가 두개골의 곡률에 수직인지 확인하십시오. 이렇게 하면 균일한 개두술을 보장하고 경막이나 피질의 손상을 방지할 수 있습니다.
- 저항이 감소할 때까지 드릴을 뚫은 다음 멈춥니다(그림 2B). 23G 바늘 끝을 사용하여 분리된 뼈 조각을 조심스럽게 제거합니다(그림 2C).
- 차가운 인공 뇌척수액(ACSF)에 적신 수술용 폼으로 노출된 피질을 청소하여 이물질을 제거하고 발생할 수 있는 출혈을 막습니다.
- 수술 내내 항상 차가운 ACSF를 사용하여 노출된 피질에 수분을 공급하십시오.
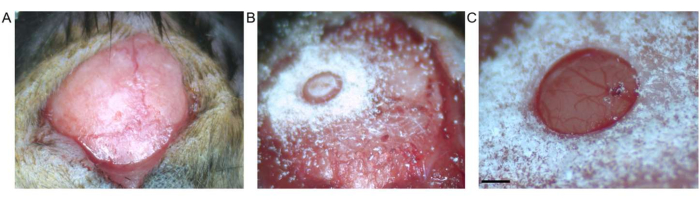
그림 2: 개두술. (A) 브레그마와 람다 사이의 피부 절개가 보입니다. 노출된 표면에서 결합 조직이 제거되었습니다. (B) 뼈 조각을 제거하기 전에 트레핀 드릴에 의한 개두술. (C) 온전한 경막과 피질을 보여주는 뼈 조각 제거 후 개두술(눈금 막대는 0.5mm를 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 프리컷 절개
참고: 사전 절개를 수행할 때 고려하려면 절개 및 마이크로 프리즘 이식이 관심 이미징 영역(ROI)의 앞쪽에 있어야 합니다. 이는 완전하고 정확한 시야를 허용하기 위한 것입니다. 이 프로토콜의 맥락에서 절개는 내측 축을 따라 수행되고 마이크로 프리즘은 후방을 향하도록 배향됩니다(그림 3B).
- 삽입을 돕고 마이크로 프리즘을 삽입하는 동안 피질의 압력을 완화하려면 절개를 하십시오.
- 수술용 칼을 입체 암 홀더에 부착하고 블레이드 또는 입체 암 방향을 지정하여 ML 축을 따라 절단합니다.
- 나이프를 원하는 AP 좌표(AP: -3.4mm)로 이동합니다. 프리즘은 ROI 앞에 있어야 하므로 절개 부위를 이미징 ROI AP 좌표(-3.5mm)의 전방 100μm로 만듭니다.
- 이제 칼을 두개골과 만나는 개두술의 내측 가장자리로 이동하여 칼이 뼈에 닿을 때까지 천천히 내린 다음 멈춥니다. 뼈 두께가 200μm이므로 이 값을 총 삽입 깊이에 통합합니다(5.1단계 계산 참조).
- 최적의 이미징은 프리즘의 중심, 즉 500μm에 있습니다. 따라서 이 깊이가 피질 컬럼 깊이(ROI DV: - 0.35mm)와 일치하는지 확인하십시오.
- 두개골의 두께를 깊이 계산에 통합하여 두개골 표면에서 사전 절단된 절개가 얼마나 깊어야 하는지 결정하는 아래 방정식을 사용합니다. 이 프로토콜의 경우 이식 깊이는 다음과 같이 계산됩니다.
뼈 두께(200μm) + 이미징 ROI(예: 350μm) + 남은 마이크로프리즘 깊이(500μm) = 1,050μm
- 두개골의 두께를 깊이 계산에 통합하여 두개골 표면에서 사전 절단된 절개가 얼마나 깊어야 하는지 결정하는 아래 방정식을 사용합니다. 이 프로토콜의 경우 이식 깊이는 다음과 같이 계산됩니다.
- 절개 길이가 1mm 이상이지만 과도하지 않은지 확인하십시오. 따라서 1.2mm의 거리가 이상적이며 단안 ML 좌표는 이 거리의 중간에 있습니다.
- 절개를 수행할 준비가 되면 시야가 가려지지 않도록 과도한 ACSF를 제거합니다(그림 3A).
- 개두술의 내측 가장자리에서 절개부의 시작 내측 좌표로 칼을 이동합니다. 천천히(10μm/s) 칼을 피질로 내립니다.
- 경막이 뚫리고 칼이 피질에 들어가면 차가운 ACSF 한 방울을 피질에 도포하여 절개 중에 조직을 윤활하고 수분을 공급합니다.
- 최종 깊이에 도달하면 ML 축을 따라 나이프를 움직이기 시작합니다(10μm/s의 속도로).
- 절개가 이루어지는 동안 주변 조직을 계속 관찰하십시오. 티슈가 칼과 함께 끌리는 경우 칼을 위아래로 몇 번 움직여 티슈가 잘리고 있는지 확인한 다음 칼을 마지막 깊이로 되돌려 놓는 것을 잊지 않고 옆으로 계속 진행하십시오.
- 완료되면 칼을 천천히 들어 올립니다. 절개 시 피가 나오면 ACSF를 적신 수술용 폼으로 절개 부위를 세척하여 혈액을 희석하고 절개 부위 내의 혈액을 밀어냅니다. 마이크로프리즘을 삽입할 준비가 될 때까지 노출된 피질 위에 신선하고 포화된 수술용 폼을 남겨두는 것을 잊지 마십시오.

그림 3: 마이크로프리즘 주입. (A) 사전 절개. (B) 피질 내 위치를 보여주는 통합 마이크로프리즘 렌즈의 개략도 (C) 피질에 삽입하기 전에 미리 절단된 절개를 위해 올바른 방향의 통합 마이크로프리즘 렌즈(눈금 막대는 0.5mm를 나타냄). (D) 두개골에 부착을 고정하기 위해 통합 렌즈 주위에 시멘트가 축적된 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 마이크로프리즘 삽입 및 헤드플레이트 이식
- microprism lens는 렌즈의 말단부에 있는 프리즘에 부착된 gradient index lens로 구성되며, 이 렌즈는 baseplate에 통합되어 있습니다. 마이크로프리즘을 임플란트 키트에 부착합니다.
- 프리즘의 이미징 면이 베이스 플레이트 나사의 반대쪽에 있는지 확인합니다. 마이크로 프리즘의 삽입 및 배치를 돕기 위해 마이크로 프리즘을 입체 프레임 프레임에 부착하고 절개 부위와 정렬되도록 프리즘의 방향을 지정합니다(그림 3C).
- 마이크로 프리즘을 절개 부위로 천천히 내립니다(10μm/s). 프리즘을 처음 삽입할 때는 ACSF를 제거하되, 피질에 삽입한 후에는 차가운 ACSF로 세척하여 삽입을 윤활합니다.
- 프리즘이 절개 부위로 내려가는 동안 피질은 안정적으로 유지되어야 합니다. 그렇지 않은 경우 ACSF를 추가하고 프리즘을 위아래로 움직여 프리즘에서 피질을 풀어 피질을 교반합니다.
- 최종 깊이에 도달하면 프리즘을 만지지 않도록 주의하면서 멸균 조직을 사용하여 노출된 피질 표면을 건조시킵니다.
- 프리즘과 렌즈를 둘러싼 노출된 피질 영역을 실리콘 접착제의 보호층으로 덮어 주변 두개골과 더미 스코프의 과도한 접착제를 최소화합니다.
- 경화되면(5-10분) 헤드플레이트를 두개골에 부착하여 헤드 고정 이미징 중에 헤드를 안정화합니다.
- 임플란트 배치를 방해하지 않고 임플란트를 적절하게 고정하기 위해 시멘트를 적절하게 도포할 수 있도록 헤드플레이트가 충분히 뒤쪽에 있는지 확인하십시오.
- 헤드플레이트의 정중선이 이식된 렌즈의 약간 오른쪽에 있는지 확인하여 헤드플레이트의 양쪽이 헤드에 고정될 수 있도록 합니다.tage 머리 고정 실험을 수행할 때
- 헤드플레이트와 두개골에 접착 시멘트를 바릅니다.
- 불투명 시멘트 분말 1스쿱과 혼합제 4방울을 혼합하고 촉매 1방울을 도포하여 접착성 치과용 시멘트를 준비합니다.
- 헤드플레이트와 두개골 모두에 시멘트를 바르고 경화될 때까지 헤드플레이트를 제자리에 고정하여 이어 바와 평행이 되도록 합니다(육안 검사를 통해 동물의 머리 위와 뒤에서 모두 검사).
- 접착 시멘트를 도포하여 노출된 두개골과 조직의 나머지 부분을 덮고 마이크로프리즘(베이스 플레이트 바닥까지)과 헤드플레이트를 통합합니다.
- 바닥판, 더미 현미경 또는 그 구성 요소에 시멘트가 묻지 않도록 하십시오. 마이크로 프리즘과 헤드플레이트가 덮이고 안정될 때까지 접착 시멘트를 계속 도포합니다(그림 3D).
- 시멘트가 경화되면 집게로 마이크로 프리즘을 안정화하면서 입체 암 암을 천천히 위쪽으로 움직여 더미 현미경을 분리합니다(자석을 통해 연결되므로 분리 중에 약간의 저항이 느껴질 수 있음).
- 보호 커버를 렌즈에 삽입하고 나사를 조여 제자리에 고정합니다.
- 동물을 입체 프레임에서 꺼내 따뜻한 회복 상자에서 회복하도록 하고 따뜻하게 데운 멸균 0.9% 식염수를 피하(체중의 3%)로 투여합니다.
- 동물이 깨어나 움직이면 깨끗한 1인용 케이지에 다시 넣으십시오. 동물을 모니터링하고 진통에 대한 지역 기관의 정책에 따라 수술 후 진통을 추가로 투여합니다.
- 수술 후 4주 동안 기다리면 동물이 이미징을 받을 준비가 됩니다.
5. 자유롭게 움직이는 생쥐의 피질층의 단광자 칼슘 이미징
알림: 의도한 이미징 평면의 정확한 획득을 보장하기 위해 매번 원본 이미징 세션에서 캡처한 이미지를 활용하는 것이 중요합니다. 이렇게 식별된 랜드마크는 뉴런과 함께 프로토콜의 9단계에서 자세히 설명된 정렬 과정에서 중요한 역할을 합니다. 단광자 데이터를 수집할 때 미니스코프는 이미징 시스템이자 레이저 소스입니다. 여기(Excitation)는 대물렌즈 전면에 0-2 mW/mm2 의 출력 범위를 가진 LED를 사용합니다. 레이저는 GCaMP 신호 처리를 위해 455 ± 8nm(청색광)의 여기 파장을 사용합니다. 렌즈 초점 슬라이더를 사용하여 초점(Z축)을 조정할 수 있으며, 이는 인터페이스에서 0-1000으로 표시되며, 여기서 0은 0μm 작동 거리를 나타내고 1000은 최대 300μm 작동 거리를 나타냅니다.
- 데이터를 수집하기 전에 녹음 세션 전에 동물이 방과 열린 경기장에 1시간 동안 적응하도록 하십시오.
- 이미징하기 전에 적절한 소독제(예: 증류수와 70% 에탄올이 포함된 안정화된 차아염소산)로 모든 것을 소독하고 청소하십시오.
- DAQ 박스를 컴퓨터에 연결하고 데이터 수집 소프트웨어를 실행하여 DAQ 박스를 설정합니다. 프레임 손실을 최소화하기 위해 이더넷 케이블을 통해 직접 연결을 설정합니다. 그러나 무선 연결 강도에 따라 무선 연결 모드로 충분할 수 있습니다.
- 미니스코프를 부드러운 목덜미 아래 동물의 바닥판에 부착합니다.
- 먼저 고정 나사를 풀어 베이스 플레이트에서 보호 커버를 제거합니다. 집게로 덮개의 구멍을 잡습니다. 그런 다음 덮개가 있는 베이스 플레이트에 미니스코프를 부착합니다.
- 미니스코프를 설치하기 전에 베이스 플레이트를 기준으로 미니스코프의 방향을 확인하여 나사 표시가 있는 면이 나사를 향하도록 하십시오.
- 미니스코프가 부착되면 고정 나사를 조여 고정합니다. 약간의 저항이 느껴질 때까지만 고정 나사를 전진시키십시오. 고정 나사를 과도하게 조이면 미니스코프가 손상될 수 있으므로 피해야 합니다.
- 미니스코프를 DAQ 상자에 연결하고 녹화를 위해 소프트웨어를 준비합니다.
- 데이터 취득 소프트웨어에서 미니스코프의 스트림을 켜고 기록 파라미터(이미징 프레임 속도, 게인, LED 전력, efocus 값)를 조정하여 선명한 시야를 확보합니다(그림 4A).
- 히스토그램 창을 켜고 기록된 강도가 35%에서 70% 사이가 되도록 게인과 LED 전원을 조정합니다.
- 종단 연구를 수행하는 경우 이전 세션에서 촬영한 기록 또는 스냅샷을 참조하고 동일한 이미징 평면이 명확하게 보이도록 efocus 값을 조정합니다.
- 실험 및 데이터 수집을 시작합니다.
- 실험이 끝나면 행동 장치에서 동물을 꺼냅니다.
- 부드러운 목덜미 아래에서 고정 나사를 풀고 동물의 바닥판에서 미니스코프를 제거합니다.
- 보호 커버를 베이스 플레이트로 되돌리고 고정 나사로 고정합니다.
- 동물을 홈 케이지로 되돌립니다(단광자 데이터를 처리하려면 7단계로 진행).

그림 4: 소프트웨어를 사용한 데이터 수집 및 처리. (A) 미니스코프의 실시간 스트림을 보여주는 이미지. 렌즈 초점 값을 조정하여 스트리밍 창에서 선명한 뷰를 볼 수 있도록 하는 것이 좋습니다., 게인 및 이미징 레이저 출력(B) 서로 다른 시점에서 기록된 세션에 대한 권장 정렬 워크플로를 보여주는 회로도 그래프. 데이터 처리 소프트웨어의 지침에 따라 첫 번째 세션에서 평균 이미지를 생성하는 것이 좋습니다. 이 이미지는 다음 세션에서 모션 보정 중에 참조 이미지로 사용해야 합니다. (C) 동일한 최대 투영 ΔF/F 이미지에서 4개 셀의 예. 각 셀에 주황색 선이 그려져 셀 지름을 픽셀 단위로 측정하며, 그 평균은 셀 식별 알고리즘의 입력 인수로 사용됩니다(왼쪽 위: 13, 오른쪽 위: 11, 왼쪽 아래: 12, 오른쪽 아래: 13). (D) 수동 큐레이션 후 세포 식별 알고리즘의 출력(이미지 잘림). 흰색 윤곽선은 식별된 세포를 나타냅니다(축척 막대는 100μm를 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 머리 고정 마우스의 피질 층의 2광자 칼슘 이미징
참고: 이광자 레이저 스캐닝 현미경의 경우 광원은 여기 파장이 920nm인 조정 가능한 극초단 레이저입니다. 대물렌즈에서 측정된 여기 전력은 일반적으로 100-150mW 사이였으며 유사한 수준의 형광을 달성하기 위해 각 세션에서 조정되었습니다. 방출광은 방출 필터(525/70nm)로 필터링되고 녹색 채널이라고 하는 독립 광전자 증배관(PMT)으로 측정되었습니다. 이미지는 20x 공기 침지 대물렌즈(NA = 0.45, 6.9-8.2mm 작동 거리)로 획득했습니다.
- 데이터를 수집하기 전에 동물을 장치에 익숙하게 하십시오(동물이 행동 설정에 익숙해지도록 하기 위해). 동물이 하루에 15-30분, 2-3일 동안 설정을 탐색하거나 데이터 수집을 시작하기 전에 자연스러운 행동을 보일 때까지 보내도록 합니다.
- 이광자 이미징 시스템을 켜고, 획득 소프트웨어를 실행하고, 레이저를 켭니다. 계속하기 전에 레이저가 닫혀 있고 PMT가 꺼져 있는지 확인하십시오.
- 증류수와 70% 에탄올로 안정화된 차아염소산으로 이광자 이미징 장치를 청소합니다.
- 동물의 크기에 맞게 장치를 조정하십시오. 마우스와 헤드플레이트를 헤드스테이지 설정에 부드럽게 부착하고 나사로 고정하여 마우스 헤드를 고정합니다.
- 부착이 완료되면 렌즈 커버를 제거하고(5.4.1단계 참조) 대물렌즈가 베이스 플레이트 위에 오도록 정렬합니다.
- epifluorescence 및 XYZ 스테이지 컨트롤을 사용하여 피질 조직에 초점을 맞춥니다.
- 피질층이 보이면 현미경을 전환하여 이광자 이미징을 허용합니다(거울을 이색성 거울로 교체하고 형광 셔터를 닫고 형광 레이저와 모니터를 끕니다). 이미징 시 PMT를 보호하기 위해 주 조명을 꺼야 합니다.
- 획득한 이미지 파일을 최적화하기 위해 파라미터를 설정합니다.
- GCaMP 신호의 빠른 발사를 캡처할 수 있는 칼슘 이미징에 공명 수집 모드를 사용합니다.
- 레이저 출력, PMT 게인, 줌 및 룩업 테이블(LUT)을 조정하여 최적의 이미지를 얻고 단광자 이미지를 참조하여 올바른 초점면이 이미지화되고 있는지 확인합니다.
- 동기화된 행동 모니터링 및 자극 입력(해당되는 경우)이 있는 이광자 시스템으로 피질층의 이미징을 시작합니다.
- 시간이 지남에 따라 동일한 이미지를 재현하려면 이러한 획득 매개변수와 XYZ 거리를 저장해야 합니다.
- 피질 층의 z-스택을 캡처하려면 아래에 설명된 단계를 따르십시오.
- Z 스택을 시작할 평면을 찾고, 획득 파라미터를 조정하여 이미지를 최적화하고, 이를 소프트웨어의 시작점으로 표시합니다.
- 그런 다음 Z 컨트롤을 사용하여 스택의 일정한 휘도를 유지하기 위해 레이저 출력만 조정하고 소프트웨어에서 스택의 끝을 표시하면서 스택 아래로 이동합니다.
- 중요 단계: Laser Power Gradient 탭의 Relative Exponential Gradient 옵션을 사용하여 소프트웨어가 z-stack을 통과할 때 레이저 출력의 증가를 계산할 수 있도록 합니다. 그래디언트를 계산할 수 있도록 소프트웨어에서 제공하는 표에 끝점 레이저 출력 값을 표시해야 합니다.
- z-스택 파라미터가 설정되면 스텝 크기(μm)를 조정합니다.
참고: 단계 크기는 소요 시간, 슬라이스 수 및 스택의 세부 품질을 결정합니다. 스텝 크기가 작을수록 획득 시간이 길어지고, 슬라이스 수가 증가하며, 스텝 크기가 클수록 디테일이 향상됩니다. Z-스택은 해부학적 랜드마크나 특징을 강조하기 때문에 1광자 및 2광자 이미지의 정합을 지원하는 데 사용됩니다.
- 뉴런의 칼슘 변화에 대한 시계열(T-시리즈)을 수집하려면 XYZ 스테이지 컨트롤을 사용하여 최적의 초점면을 찾고 레이저 출력, PMT 게인, 줌 및 LUT를 조정합니다.
- 수집 소프트웨어의 T-시리즈 탭에서 단광자 이미징 시스템을 사용하여 수집된 데이터와 일치하도록 수집 주파수 파라미터를 정의합니다.
알림: 주파수를 일치시키면 1P 및 2P 데이터를 비교할 수 있으며 데이터 처리 단계에 사용되는 셀 식별 알고리즘에 더 적합합니다. 여러 트리거 및 기타 수집 모드를 T-시리즈 수집에 통합할 수 있습니다.
- 수집 소프트웨어의 T-시리즈 탭에서 단광자 이미징 시스템을 사용하여 수집된 데이터와 일치하도록 수집 주파수 파라미터를 정의합니다.
- T-시리즈 인수 시작.
7. 단광자 칼슘 이미징 데이터 처리
- 단광자 녹화 동영상의 경우 미니스코프 시스템과 함께 제공되는 데이터 처리 소프트웨어를 사용하십시오.
- 먼저 공간적, 시간적 다운샘플링을 통해 동영상을 전처리합니다. 일반적으로, 무비의 공간적 다운샘플링을 2배로 하면 세포 식별 정확도를 심각하게 손상시키지 않으면서 처리 시간을 크게 줄일 수 있습니다.
- 동영상의 프레임 속도가 약 10Hz로 낮아지도록 시간적 다운 샘플링 계수를 설정하며, 이는 다음 단계에서 사용되는 셀 식별 알고리즘에 더 적합합니다.
- 같은 이미징 날짜에 여러 동영상을 촬영하는 경우 전처리 단계 전에 동영상을 하나의 시계열로 결합하여 함께 처리합니다.
- 선택 사항: 동영상에 공간 대역 통과 필터를 적용하여 더 낮은 공간 주파수와 더 높은 공간 주파수를 제거하여 더 높은 대비로 더 부드러운 동영상을 만듭니다.
- 소프트웨어의 모션 보정 기능을 사용하여 동영상을 등록합니다. 이렇게 하면 동영상이 등록되고 이미징 표면에 대한 미니스코프의 움직임으로 인해 발생하는 모션 아티팩트가 보정됩니다.
- 중요 단계: 종단 연구를 수행하는 경우 동영상을 동일한 시야(예: 첫 번째 이미징 날짜에 촬영한 동영상의 평균 이미지)에 등록합니다(그림 4B).
- 해당 탭을 사용하여 동영상의 ΔF/F를 계산하고 동영상을 투사하여 ΔF/F 동영상의 최대 투사 이미지를 생성합니다. 이 이미지는 형광 수준의 변화, 잠재적으로 개별 뉴런을 나타내는 영역을 보여주며 뉴런의 평균 직경을 측정하는 데 사용할 수 있습니다(그림 4C).
- 또는 뉴런이 명확한 형광을 나타내는 움직임 보정된 동영상에서 세포 직경을 측정합니다.
- 소프트웨어의 알고리즘을 사용하여 세포를 식별합니다.
- 이 단계에서 두 가지 옵션(PCA-ICA 및 CNMF-E)을 사용할 수 있지만 이 연구에서는 CNMF-E를 사용합니다. 평균 셀 직경을 픽셀 단위로 입력하고 알고리즘을 실행하여 셀과 유사한 활동을 보여주는 관심 영역(ROI)을 포함하는 셀 세트를 생성합니다.
- 그렇지 않은 세포(세포와 유사한 형태 및 활동22,23을 가지며 FOV 내에 있음)인 ROI를 수동으로 선택하고 선별된 세포 세트를 검증합니다(그림 4D).
- 추가 분석을 위해 각 ROI의 칼슘 흔적을 내보냅니다.
8. 이광자 칼슘 이미징 데이터 처리
- 2광자 기록 동영상의 경우 2광자 칼슘 분석 데이터를 처리하도록 설계된 python 패키지를 사용합니다.
- 먼저 아래 설명과 같이 T 시리즈로 촬영한 이미지를 .tiff 스택으로 결합합니다.
- 실행 옵션 인터페이스에서 tau 값 및 프레임 속도를 포함한 매개변수를 조정하여 사용된 GCaMP 및 녹화의 프레임 속도와 일치하도록 합니다.
- 선택 사항: do_registration 매개 변수를 1로 설정하여 동영상을 등록합니다. 이는 위에서 설명한 모션 보정 단계와 동일합니다.
- 선택 사항: anatomical_only 파라미터를 1로 설정하여 형광 동역학 외에도 해부학적 특징을 사용하여 ROI를 감지합니다. 이를 위해서는 셀 직경을 입력해야 하므로 이미지 처리 소프트웨어를 사용하여 측정하십시오. 이는 보다 자연스러운 형태의 ROI를 생성하므로 일반적으로 권장됩니다(그림 5A-C).
- 모든 매개 변수가 설정되면 모든 계산을 함께 수행하도록 알고리즘을 실행합니다. GUI(그래픽 사용자 인터페이스)를 참조하여 진행 상황을 확인합니다.
- 완료되면 세포 식별 결과를 수동으로 큐레이션하기 위해 세포 선택 인터페이스로 돌아갑니다.
- 동영상의 최대 프로젝션 위에 설정된 큐레이팅된 셀의 이미지를 저장합니다. 이것은 나중에 one-photon 기록 데이터를 등록하기 위한 참조 이미지로 사용될 것이다.
- 그런 다음 알고리즘은 결과를 자동으로 저장합니다. npy 형식으로, 나중에 Python으로 액세스할 수 있습니다. 또는 다른 소프트웨어에서 추가 분석을 위해 결과를 다른 형식의 파일로 저장합니다.
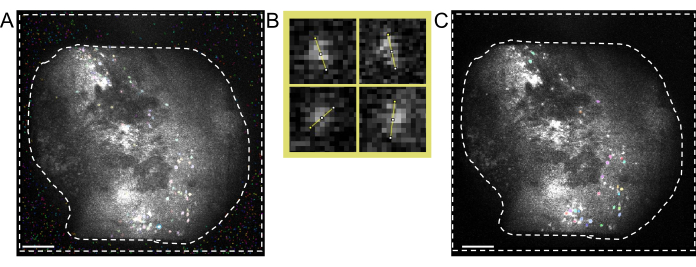
그림 5: 이광자 처리 소프트웨어를 사용한 세포 식별. (A) 이광자 처리 소프트웨어에서 가져온 세포 식별의 대표 이미지. Anatomical_only 매개 변수를 0으로 설정하지만 다른 모든 매개 변수를 동일하게 유지하면 실제 셀의 수동 큐레이션을 방해하는 점선 사이의 영역에 셀이 아닌 여러 개가 있습니다. (B) 이미지 처리 소프트웨어를 사용하여 (A)에서 가져온 셀 직경 측정의 예(왼쪽 상단, 7.5픽셀, 오른쪽 상단, 9, 왼쪽 하단, 6.5, 오른쪽 하단, 7.5). (C) 세포 식별의 대표 이미지. Anatomical_only 파라미터를 1로 설정하고 (B)에서 가져온 평균 셀 직경을 셀 직경 알고리즘에 입력하면 점선 사이의 영역에 셀이 없습니다(눈금 막대는 200μm를 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
9. 이미징 양식에 걸쳐 식별된 세포 세트 등록
- one-photon 이미징 소프트웨어의 Python 인터페이스를 통해 사용할 수 있는 MIRA(multimodal image registration and analysis algorithm)를 사용하여 1광자 및 2광자 기록에서 식별된 세포를 정합합니다.
- 이 알고리즘은 비강성 정합을 통해 1광자 및 2광자 데이터를 정렬합니다. 웹 사이트에서 찾을 수 있고 이 연구에 사용된 데모 온라인 노트북 세트를 참조하십시오.
참고: 노트북은 모든 처리가 1P 소프트웨어에서 완료되도록 작성되었으므로 2P 처리 소프트웨어와 호환되지 않습니다. 따라서 이 연구를 위해 노트북의 일부 단계만 수행합니다.
- 이 알고리즘은 비강성 정합을 통해 1광자 및 2광자 데이터를 정렬합니다. 웹 사이트에서 찾을 수 있고 이 연구에 사용된 데모 온라인 노트북 세트를 참조하십시오.
- 데모 노트북에 설명된 단계를 수행하며, 여기에는 각 이미징 양식에 대한 구조 이미지 생성이 포함됩니다. 기본적으로 여기에는 2광자 z 스택의 최대 투영과 1광자 기록의 평균 이미지 생성이 포함됩니다. 또는 2광자 기록의 평균 이미지를 사용합니다.
- 메시지가 표시되면 공간 대역통과 이미지를 필터링하여 랜드마크를 더 잘 시각화하고 일치하도록 방향을 변경합니다.
- 두 이미지에서 일치하는 랜드마크를 선택합니다(그림 6A).
- 이를 사용하여 두 이미지를 정렬하는 데 필요한 뒤틀림을 계산합니다. 일반적으로 3-5개의 랜드마크로 충분합니다.
- 이 알고리즘은 랜드마크와 이미지 유사성의 조합을 기반으로 워프를 계산합니다. 만족스러운 결과를 얻을 때까지 두 요인에 주어진 상대적 가중치에 대해 최적화합니다.
- 1광자 세션에서 획득한 셀 맵을 뒤틀어 2광자 데이터에 정렬된 새 셀 맵을 생성합니다.
- 그런 다음 이 뒤틀린 셀 맵을 1P 처리 소프트웨어로 가져와서 배경에 있는 2광자 동영상의 최대 투영 이미지를 가진 이미지를 생성합니다.
- 등록을 위해 이 이미지를 내보냅니다.
- 프로그래밍 소프트웨어에서 지금까지 생성된 두 이미지(2광자 최대 투영 이미지 위에 있는 2광자 셀 맵)를 정렬하고 2광자 최대 투영 이미지 위에 1광자 셀 맵을 뒤틀립니다(그림 6B,C).
- 이를 위해 이 연구에서는 사용자가 다양한 등록 기술의 결과를 비교할 수 있는 등록 추정기 응용 프로그램을 사용합니다. 두 이미지의 배경이 동일하다는 점을 감안할 때, 리지드 정합을 사용한 위상 상관 기법으로 충분했습니다.
- 등록이 완료되면 현재 등록된 이미지를 스캔하여 중복되는 ROI를 찾습니다. 이는 두 기록 세션 모두에서 활성화되는 ROI로, 추가 분석에 사용할 수 있습니다.
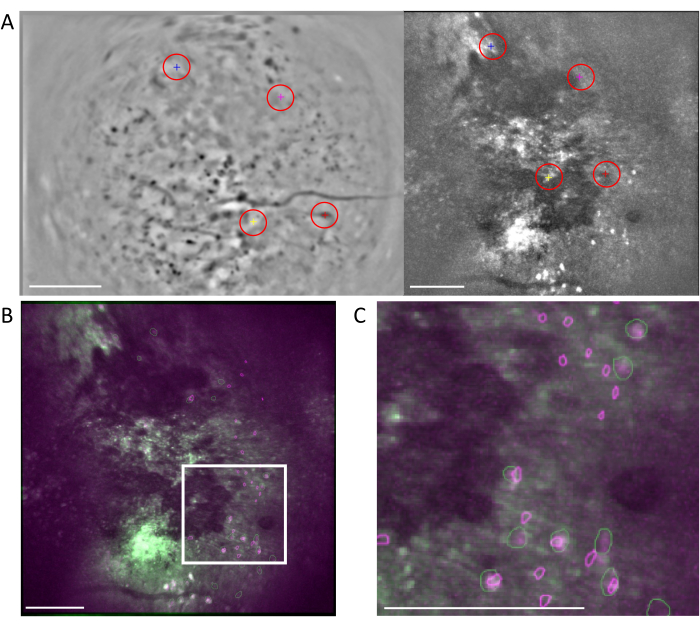
그림 6: MIRA 워크플로우를 사용한 교차 양식 세포 정합. (A) 셀 정렬 워크플로의 대표 이미지. 1광자 데이터의 평균 영상은 왼쪽에 표시되고, 2광자 데이터의 평균 영상은 오른쪽에 표시됩니다. 두 이미지에서 일치하는 랜드마크가 선택되고 소프트웨어에서 무작위 색 구성표(빨간색 원)로 레이블이 지정됩니다. (B) 식별된 두 개의 셀 세트인 1광자(보라색) 및 2광자(녹색)를 보여주는 예시 정렬 이미지는 2광자 데이터의 평균 이미지 위에 오버레이됩니다. (C) (B)에서 흰색 상자로 표시된 영역의 이미지, 정렬된 셀은 여기에서 겹쳐진 녹색과 보라색 윤곽선으로 표시됩니다. 모든 패널에서 축척 막대는 200μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
자유롭게 움직이고 머리가 고정된 조건에서 1광자 및 2광자 이미징 방식을 모두 사용하여 몇 주 동안 동일한 뉴런 집단의 만성 다층 생체 내 칼슘 이미징을 수행하는 방법이 나타났습니다. 여기에서 동물이 어둠 속에서 열린 경기장을 탐험하는 동안 단광자 이미징에서 일치하는 뉴런 집단을 식별하는 능력이 입증되었습니다(그림 7A). 식별된 뉴런에서 칼슘 흔적을 추?...
토론
여기에서 우리는 동일한 신경 집단에서 머리가 고정되고 자유롭게 움직이는 조건에서 뉴런을 관찰하고 직접 비교할 수 있는 능력을 보여주었습니다. 우리가 시각 피질에서 응용을 시연하는 동안, 이 프로토콜은 피질 영역과 심부 핵 24,25,26,27,28 뿐만 아니라 다른 데이터 수집 및 행동 설정
공개
저자는 경쟁하는 재정적 이익이나 이해 상충이 없음을 선언합니다.
감사의 말
수술 프로토콜과 형질전환 마우스 균주 공유에 대한 조언을 해주신 Ms. Charu Reddy와 Matteo Carandini 교수(Cortex Lab)에게 감사드립니다. 수술 개발 전반에 걸친 지도와 도움을 주신 Norbert Hogrefe 박사(Inscopix)에게 감사드립니다. 수술 설정 및 데이터 처리에 도움을 주신 Ms Andreea Aldea (Sun Lab)에게 감사드립니다. 이 작업은 Moorfields Eye Charity의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
참고문헌
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3 (2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472 (2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970 (2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579 (2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678 (2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728 (2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894 (2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유