A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה ארוכת טווח של אוכלוסיות עצביות מזוהות באמצעות מיקרופריזמות בבעלי חיים הנעים בחופשיות ומקובעים לראש
In This Article
Summary
בשילוב עם לוחית ראש ועיצוב אופטי התואם למיקרוסקופים של פוטון בודד ושני פוטונים, עדשת המיקרופריזמה מציגה יתרון משמעותי במדידת תגובות עצביות בטור אנכי בתנאים מגוונים, כולל ניסויים מבוקרים היטב במצבים קבועים בראש או משימות התנהגותיות טבעיות בבעלי חיים הנעים בחופשיות.
Abstract
עם התקדמות המיקרוסקופ הרב-פוטוני והטכנולוגיות המולקולריות, דימות פלואורסצנטי גדל במהירות והופך לגישה רבת עוצמה לחקר המבנה, התפקוד והפלסטיות של רקמות מוח חיות. בהשוואה לאלקטרופיזיולוגיה קונבנציונלית, מיקרוסקופ פלואורסצנטי יכול ללכוד את הפעילות העצבית כמו גם את המורפולוגיה של התאים, ומאפשר הקלטות ארוכות טווח של אוכלוסיות הנוירונים שזוהו ברזולוציה של תא בודד או תת-תאי. עם זאת, הדמיה ברזולוציה גבוהה דורשת בדרך כלל מערך יציב וקבוע ראש המגביל את תנועת החיה, והכנת משטח שטוח של זכוכית שקופה מאפשרת הדמיה של תאי עצב במישור אופקי אחד או יותר, אך מוגבלת בחקר התהליכים האנכיים הפועלים על פני עומקים שונים. כאן, אנו מתארים הליך לשילוב קיבוע לוחית ראש ומיקרופריזמה המעניקה הדמיה רב שכבתית ורב-מודאלית. הכנה כירורגית זו לא רק מעניקה גישה לכל העמודה של קליפת המוח הראייתית של העכבר, אלא מאפשרת הדמיה של שני פוטונים במיקום קבוע בראש והדמיה של פוטון אחד בפרדיגמה הנעה בחופשיות. באמצעות גישה זו, ניתן לדגום אוכלוסיות תאים מזוהות על פני שכבות קליפת המוח השונות, לרשום את תגובותיהן תחת מצבים קבועים ונעים בחופשיות, ולעקוב אחר השינויים ארוכי הטווח לאורך חודשים. לפיכך, שיטה זו מספקת בדיקה מקיפה של microcircuits, המאפשר השוואה ישירה של פעילויות עצביות המתעוררות על ידי גירויים מבוקרים היטב תחת פרדיגמה התנהגותית טבעית.
Introduction
הופעתו של הדמיה פלואורסצנטית של שני פוטונים in vivo 1,2, המשלבת את הטכנולוגיות החדשות במערכות אופטיות ואינדיקטורים פלואורסצנטיים מהונדסים גנטית, התפתחה כטכניקה רבת עוצמה במדעי המוח לחקור את המבנה, התפקוד והפלסטיות המורכבים במוח החי 3,4. בפרט, שיטת הדמיה זו מציעה יתרון שאין שני לו על פני אלקטרופיזיולוגיה מסורתית בכך שהיא לוכדת הן את המורפולוגיה והן את הפעילות הדינמית של נוירונים, ובכך מאפשרת מעקב ארוך טווח אחר נוירונים מזוהים 5,6,7,8.
למרות חוזקותיו הראויות לציון, היישום של הדמיה פלואורסצנטית ברזולוציה גבוהה דורש לעתים קרובות התקנה סטטית קבועה בראש המגבילה את ניידות החיה 9,10,11. בנוסף, השימוש במשטח זכוכית שקוף להדמיית תאי עצב מגביל את התצפיות למישור אופקי אחד או יותר, ומגביל את חקר הדינמיקה של תהליכים אנכיים המשתרעים על פני עומקים שונים של קליפת המוח12.
בהתייחס למגבלות אלה, המחקר הנוכחי מתווה הליך כירורגי חדשני המשלב קיבוע לוחית ראש, מיקרופריזמה ומיניסקופ ליצירת שיטת הדמיה עם יכולות רב-שכבתיות ורב-מודאליות. המיקרופריזמה מאפשרת תצפית על העיבוד האנכי לאורך עמוד קליפת המוח 13,14,15,16, שהוא קריטי להבנת האופן שבו מידע מעובד ומשתנה כשהוא נע דרך שכבות שונות של קליפת המוח וכיצד העיבוד האנכי משתנה במהלך שינויים פלסטיים. יתר על כן, הוא מאפשר הדמיה של אותן אוכלוסיות עצביות בפרדיגמה קבועה ראש ובסביבה הנעה בחופשיות, המקיפה את הגדרות הניסוי הרב-תכליתיות 17,18,19: לדוגמה, קיבוע ראש נדרש לעתים קרובות עבור פרדיגמות מבוקרות היטב כמו הערכת תפיסה חושית והקלטות יציבות תחת פרדיגמת 2 פוטונים, בעוד שתנועה חופשית מציעה סביבה טבעית וגמישה יותר למחקרים התנהגותיים. לכן, היכולת לבצע השוואה ישירה בשני המצבים חיונית לקידום הבנתנו את המיקרו-מעגלים המאפשרים תגובות גמישות ופונקציונליות.
בעיקרו של דבר, השילוב של קיבוע לוחית ראש, מיקרופריזמה ומיניסקופ בדימות פלואורסצנטי מציע פלטפורמה מבטיחה לחקירת המורכבות של מבנה המוח ותפקודו. חוקרים יכולים לדגום אוכלוסיות תאים מזוהות בעומקים שונים המשתרעים על פני כל שכבות קליפת המוח, להשוות ישירות את תגובותיהם בפרדיגמות טבעיות ומבוקרות היטב, ולנטר את השינויים ארוכי הטווח שלהם במשך חודשים20. גישה זו מציעה תובנה רבת ערך לגבי האופן שבו אוכלוסיות עצביות אלה מתקשרות ומשתנות לאורך זמן בתנאי ניסוי שונים, ומספקת חלון לטבע הדינמי של מעגלים עצביים.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הניסויים נערכו על פי חוק בעלי החיים הבריטי (נהלים מדעיים) 1986 תחת רישיונות אישיים ופרויקטים שאושרו והונפקו על ידי משרד הפנים הבריטי לאחר ביקורת אתית מתאימה. קווים טרנסגניים למבוגרים CaMKII-TTA; GCaMP6S-TRE21 גודלו וצאצאיהם שימשו בניסוי. למען בטיחות הנסיינים ושמירה על תנאים סטריליים, כל ההליכים בוצעו בתנאים אספטיים ועם ציוד מגן אישי מלא.
1. הכנה טרום ניתוחית
- כדי למזער בצקת, יש לתת דקסמתזון (0.2 מ"ג/ק"ג) תת עורית, 12-24 שעות לפני הניתוח.
- לעקר את כל כלי הניתוח באוטוקלאבה ולעקר את אזור הניתוח עם חומצה היפוכלורית מיוצבת עם מים מזוקקים ואתנול 70% לפני הניתוח. ודא שכל ציוד הניתוח מופעל.
- מרדימים את בעל החיים (בן 24 שבועות, זכר במשקל 31 גרם) באמצעות איזופלורן עם מינון אינדוקציה של 5%, אשר יורד ל 1%-2% ברגע שהעכבר נמצא על המסגרת הסטריאוטקסית, כאשר O2 נשמר בין 1-2 ליטר לדקה. יש להזריק NSAIDs (קרפרופן, 2.5 מ"ג/ק"ג) תת עורית.
- בדוק היעדר רפלקס צביטת בוהן כדי להעריך את עומק ההרדמה (להגדיל את ריכוז isoflurane במרווחים של 0.5% אם רפלקס נראה).
- לגלח את ראש החיה, באמצעות גוזם , מאחורי האוזניים עד מעט מעל העיניים. נקו את האזור עם מגבון אלכוהול ותמיסת פובידון-יוד, תוך הקפדה על הימנעות ממגע עם עיני החיה.
- הרכיבו את בעל החיים על כרית חימום הומאורמית ומסגרת סטריאוטקסית המצוידת במוטות אוזניים ושיניים ואבטחו את הראש. ודאו שהראש יציב, שכן זה חיוני כדי שההליך הבא יצליח (איור 1).
- יש למרוח משחה אופתלמית על עיני בעל החיים כדי למנוע מהן להתייבש במהלך הניתוח ולכסות אותן בנייר כסף כדי להגן עליהן מפני אור. כסו את בעל החיים בכיסוי כירורגי סטרילי.

איור 1: הכנה לפני ניתוח. העכבר מונח על המסגרת הסטריאוטקסית, מאובטחת על ידי חתיכת אף ומוטות אוזניים. העכבר מונח על כרית מחוממת מווסתת טמפרטורה. העיניים יש משחה אופתלמית עליהם והם מכוסים ברדיד אלומיניום. הראש מגולח, והגולגולת חשופה. כיסוי סטרילי מונח מעל החיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. קרניוטומיה
- בעזרת מספריים כירורגיים, חותכים את העור לאורך קו האמצע של האזור המגולח של הראש כדי לחשוף את הגולגולת.
- נקו את הגולגולת באמצעות צמר גפן סטרילי ומי חמצן מדוללים (3% w/v של 35% H2O2 ב-97% dH2O) במשך 1-3 שניות כדי להסיר רקמת חיבור כלשהי (איור 2A). יבשו את הגולגולת באמצעות טיפה של 70% אתנול וצמר גפן סטרילי חדש.
- יישר את הגולגולת קדמית/אחורית (AP) ומדיאלית/צידית (ML) כדי להבטיח אתר השתלה מדויק. כדי לעשות זאת, למדוד את עומק dorsoventral (DV) של הגולגולת הן bregma ו lambda ולוודא כי ההבדל בין שניהם הוא <0.03 מ"מ. עבור היישור הבינוני, מדוד נקודות שוות מרחק על שתי עצמות הקודקוד מקו האמצע ושוב ודא שהפרש DV הוא <0.03 מ"מ.
- באמצעות bregma כמקור, למצוא ולסמן את האזור קליפת המוח הרצוי; כאן, אלה הם קליפת המוח הראייתית הראשונית מונוקולרית (V1), AP: -3.5 מ"מ, ML: -2.5 מ"מ.
- השתמש במקדח טרפין (קוטר 1.8 מ"מ) ובמקדח דנטלי (מהירות 10,000 סל"ד) כדי לחשוף את קליפת המוח, ולהבטיח שהסימן לאזור קליפת המוח הרצוי (מונוקולרי V1) ממוקם בתוך השליש התחתון של חלון המקדח.
- ודא שזווית המקדח ניצבת לעקמומיות הגולגולת. זה יבטיח אפילו craniotomy וימנע נזק דורה או קליפת המוח.
- קדחו עד שתהיה ירידה בהתנגדות ואז עצרו (איור 2B). הסירו בזהירות את שבר העצם המנותק באמצעות קצה מחט 23G (איור 2C).
- נקו את קליפת המוח החשופה עם קצף כירורגי רווי בנוזל מוחי מלאכותי קר (ACSF) כדי להסיר פסולת ולעצור כל דימום שעלול להתרחש.
- הקפידו תמיד על קליפת המוח החשופה רוויה, באמצעות ACSF קר, לאורך כל הניתוח.
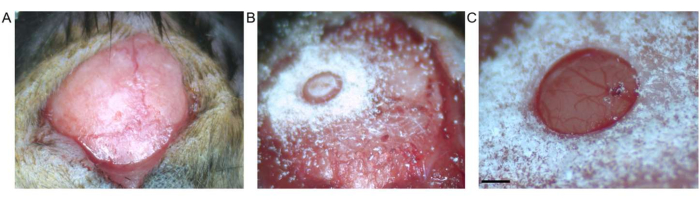
איור 2: קרניוטומיה. (A) מוצג חתך בעור בין ברגמה ללמדא. רקמת החיבור הוסרה מהמשטח החשוף. (B) קרניוטומיה על ידי מקדח טרפין לפני הסרת שבר העצם. (C) קרניוטומיה לאחר הסרת שבר עצם, המראה דורה וקליפת מוח שלמות (סרגל קנה המידה מייצג 0.5 מ"מ). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. חתך חתוך מראש
הערה: כדי להילקח בחשבון בעת ביצוע החתך החתוך מראש, החתך והשתלת המיקרופריזמה יצטרכו להיות קדמיים לאזור עניין ההדמיה (ROI). זאת כדי לאפשר שדה ראייה מלא ומדויק. בהקשר של פרוטוקול זה, החתך יבוצע לאורך הציר הבינוני-צדדי, והמיקרופריזמה מכוונת כלפי החלק האחורי (איור 3B).
- כדי לסייע בהחדרה ולהקל על הלחץ בקליפת המוח במהלך החדרת המיקרופריזמה, בצעו חתך.
- חברו את סכין הניתוח למחזיק הזרוע הסטריאוטקסי וכוונו את הלהב או הזרוע הסטריאוטקסית כך שהיא תחתוך לאורך ציר ML.
- העבר את הסכין לקואורדינטת AP הרצויה (AP: -3.4 מ"מ); המנסרה נדרשת להיות מול החזר ההשקעה, לכן יש לבצע את החתך 100 מיקרומטר קדמי של קואורדינטת AP של החזר ההדמיה (-3.5 מ"מ).
- כעת מזיזים את הסכין לקצה המדיאלי של הקרניוטומיה, שם היא פוגשת את הגולגולת, מורידים לאט את הסכין עד שהיא מגיעה לעצם ואז עוצרים. מכיוון שעובי העצם הוא 200 מיקרומטר, שלבו ערך זה בעומק ההחדרה הכולל (ראו חישוב שלב 5.1).
- הדמיה אופטימלית נמצאת במרכז המנסרה, כלומר 500 מיקרומטר; לכן, ודא שעומק זה מיושר עם עומק עמוד קליפת המוח (החזר השקעה DV: - 0.35 מ"מ).
- שילוב עובי הגולגולת בחישוב העומק, השתמש במשוואה שלהלן, הקובעת כמה עמוק צריך להיות החתך שנחתך מראש מפני השטח של הגולגולת. עבור פרוטוקול זה, עומק ההשתלה מחושב כ:
עובי עצם (200 מיקרומטר) + החזר השקעה בהדמיה (למשל, 350 מיקרומטר) + עומק מיקרופריזמה נותר (500 מיקרומטר) = 1,050 מיקרומטר
- שילוב עובי הגולגולת בחישוב העומק, השתמש במשוואה שלהלן, הקובעת כמה עמוק צריך להיות החתך שנחתך מראש מפני השטח של הגולגולת. עבור פרוטוקול זה, עומק ההשתלה מחושב כ:
- ודא שאורך החתך הוא יותר מ -1 מ"מ אך לא מוגזם; לכן, מרחק של 1.2 מ"מ הוא אידיאלי, כאשר קואורדינטת ML מונוקולרית נמצאת באמצע מרחק זה.
- כאשר אתם מוכנים לבצע את החתך, הסירו עודפי ACSF כדי שהראייה לא תיטשטש (איור 3A).
- הזיזו את הסכין מהקצה המדיאלי של הקרניוטומיה לקואורדינטה המדיאלית ההתחלתית של החתך. לאט (10 מיקרומטר לשנייה) מורידים את הסכין לתוך קליפת המוח.
- לאחר שהדורה מנוקבת והסכין נכנסה לקליפת המוח, יש למרוח טיפה של ACSF קר על קליפת המוח כדי לשמור על הרקמה משומנת ורוויה במהלך החתך.
- לאחר שמגיעים לעומק הסופי, מתחילים להזיז את הסכין לאורך ציר ML (בקצב של 10 מיקרומטר לשנייה).
- המשך להתבונן ברקמה שמסביב בזמן ביצוע החתך. אם הרקמה נגררת יחד עם הסכין, הזיזו את הסכין למעלה ולמטה כמה פעמים כדי לוודא שהרקמה נחתכת, ואז המשיכו לרוחב, זכרו להחזיר את הסכין לעומקה הסופי.
- בסיום, הרימו לאט את הסכין. אם דם יוצא במהלך החתך, השתמש בזמן זה כדי לנקות את אזור החתך עם קצף כירורגי ספוג ACSF כדי לדלל את הדם ולדחוף את כל הדם בתוך החתך החוצה. זכור להשאיר קצף כירורגי רענן ורווי על קליפת המוח החשופה עד שיהיה מוכן להחדיר את המיקרופריזמה.

איור 3: השתלת מיקרופריזמה. (A) חתך חתוך מראש. (B) סכמה של עדשת המיקרופריזמה המשולבת המדגימה את מיקומה בתוך קליפת המוח; (C) עדשת מיקרופריזמה משולבת בכיוון הנכון לחתך מראש לפני החדרתה לקליפת המוח (סרגל קנה המידה מייצג 0.5 מ"מ). (D) דוגמה להצטברות מלט סביב העדשה המשולבת כדי לאבטח את חיבורה לגולגולת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. החדרת מיקרופריזמה והשתלת לוחית ראש
- עדשת המיקרופריזמה מורכבת מעדשת אינדקס הדרגתי המחוברת למנסרה בקצה הדיסטלי של העדשה, המשולבת בלוח בסיס. חברו את המיקרופריזמה לערכת השתל.
- ודא שצד ההדמיה של המנסרה מנוגד לבורג לוח הבסיס. כדי לסייע בהחדרה ובמיקום של המיקרופריזמה, חברו אותה למסגרת הסטריאוטקסית וכוונו את המנסרה כך שתתיישר עם החתך (איור 3C).
- הורידו באיטיות את המיקרופריזמה לאתר החתך (10 מיקרומטר לשנייה). זכור להסיר ACSF בעת החדרת המנסרה בתחילה, אך פעם אחת בקליפת המוח, שטוף עם ACSF קר כדי לשמן את החדרת.
- קליפת המוח צריכה להישאר יציבה בזמן שהמנסרה יורדת לתוך החתך; אם לא, הוסיפו ACSF נוסף והרגזו את קליפת המוח על ידי הזזת המנסרה למעלה ולמטה כדי לשחרר את קליפת המוח מהמנסרה.
- לאחר ההגעה לעומק הסופי, יבש את משטח קליפת המוח החשופה באמצעות רקמה סטרילית, תוך זהירות שלא לגעת במנסרה.
- כסו את אזור קליפת המוח החשופה המקיפה את המנסרה, כמו גם את העדשה, בשכבת מגן של דבק סיליקון, תוך מזעור עודפי דבק על הגולגולת שמסביב והיקף הדמה.
- לאחר הריפוי (5-10 דקות), חבר את לוחית הראש לגולגולת כדי לייצב את הראש במהלך הדמיה קבועה בראש.
- ודא שלוחית הראש אחורית מספיק כדי לא להפריע למיקום השתל ולאפשר יישום הולם של מלט כדי לאבטח כראוי את השתל.
- ודא שקו האמצע של לוחית הראש נמצא מעט מימין לעדשה המושתלת כדי להבטיח שניתן יהיה לאבטח את שני צידי לוחית הראש לראש הבמה בעת ביצוע ניסויים קבועים בראש
- יש למרוח מלט דביק על לוחית הראש והגולגולת.
- הכינו צמנט דנטלי דביק על ידי ערבוב כף מדידה אחת של אבקת מלט אטום עם 4 טיפות של מדיום ערבוב ומריחת טיפה אחת של הזרז.
- הניחו מלט הן על לוחית הראש והן על הגולגולת והחזיקו את לוחית הראש במקומה עד לריפוי, כדי לוודא שהיא מקבילה למוטות האוזניים (באמצעות בדיקה חזותית, בדקו הן מלמעלה והן מאחורי ראשו של בעל החיים).
- יש למרוח מלט דביק כדי לכסות את שאר הגולגולת והרקמה החשופות, תוך שילוב המיקרופריזמה (עד בסיס לוחית הבסיס) ולוחית הראש.
- אין לקבל מלט על לוח הבסיס, מיקרוסקופ דמה, או כל אחד ממרכיביו. המשיכו למרוח את הצמנט המודבק עד שהמיקרופריזמה ולוחית הראש מכוסות ויציבות (איור 3D).
- כאשר המלט נרפא, נתקו את מיקרוסקופ הדמה על ידי הזזת הזרוע הסטריאוטקסית כלפי מעלה באיטיות תוך ייצוב המיקרופריזמה באמצעות מלקחיים (הם מחוברים באמצעות מגנטים, ולכן עשויה להיות מורגשת התנגדות מסוימת במהלך ההפרדה).
- הכנס את כיסוי המגן לעדשה והודק את הבורג כדי לאבטח אותו במקומו.
- הוציאו את בעל החיים מהמסגרת הסטריאוטקסית, אפשרו לו להתאושש בקופסת התאוששות חמה, ותנו לו 0.9% מלח סטרילי מחומם תת עורית (3% ממשקל הגוף).
- ברגע שבעל החיים ער וזז, הניחו אותו בחזרה בכלוב נקי ויחיד. לפקח על בעל החיים ולנהל משככי כאבים נוספים לאחר הניתוח בהתאם למדיניות המוסד המקומי על שיכוך כאבים.
- המתן 4 שבועות לאחר הניתוח, החיה צריכה להיות מוכנה להדמיה.
5. הדמיית סידן באמצעות פוטון אחד של שכבות קליפת המוח בעכברים הנעים בחופשיות
הערה: חיוני להשתמש בתמונות שצולמו מהפעלת ההדמיה המקורית בכל פעם כדי להבטיח רכישה מדויקת של מישור ההדמיה המיועד. ציוני דרך מזוהים אלה, יחד עם תאי העצב, ממלאים תפקיד קריטי בתהליך היישור המתואר בפירוט בשלב 9 של הפרוטוקול. כאשר רוכשים נתונים של פוטון אחד, המיניסקופ הוא גם מערכת ההדמיה וגם מקור הלייזר. עירור משתמש LED עם טווח הספק של 0-2 mW / mm2 על המשטח הקדמי האובייקטיבי. הלייזר משתמש באורך גל עירור של 455 ± 8nm (אור כחול) עבור איתות GCaMP. ניתן להשתמש במחוון מיקוד העדשה כדי להתאים את המיקוד (ציר Z), המיוצג בממשק כ- 0-1000, כאשר 0 מייצג מרחק עבודה של 0μm ו- 1000 מייצג את מרחק העבודה המרבי של 300μm.
- לפני קבלת הנתונים, תנו לבעל החיים להתאקלם בחדר ובזירה הפתוחה למשך שעה לפני ההקלטה.
- לפני ההדמיה, יש לחטא ולנקות הכל עם חומרי חיטוי מתאימים (למשל, חומצה היפוכלורית מיוצבת עם מים מזוקקים ו-70% אתנול).
- הגדר את תיבת DAQ על-ידי חיבורה למחשב והפעלת התוכנה לרכישת נתונים. צור חיבור ישיר באמצעות כבל Ethernet כדי למזער מסגרות שנפלו; עם זאת, מצב החיבור האלחוטי עשוי להספיק בהתאם לעוצמת החיבור האלחוטי.
- חברו את המיניסקופ לפלטת הבסיס של בעל החיים תחת קשקוש עדין.
- ראשית, הסר את כיסוי המגן מלוח הבסיס על ידי פתיחת בורג הסט. החזק את הכיסוי על ידי הצמצם שלו עם מלקחיים. לאחר מכן, חבר את המיניסקופ ללוחית הבסיס, שם יושב הכיסוי.
- בדוק את כיוון המיניסקופ ביחס ללוח הבסיס לפני התקנתו כך שהצד עם סימון הבורג, פונה לבורג.
- לאחר חיבור המיניסקוף, הדקו את בורג הסט כדי לייצב אותו. רק לקדם את בורג להגדיר עד שניתן להרגיש התנגדות מסוימת. הידוק יתר של בורג הסט עלול לפגוע במיניסקופ ולכן יש להימנע ממנו.
- חבר את המיניסקופ לתיבת DAQ והכן את התוכנה להקלטה.
- בתוכנת איסוף הנתונים, הפעל את הזרם עבור המיניסקופ והתאם את פרמטרי ההקלטה (קצב פריימים של הדמיה, רווח, כוח LED, ערך מיקוד אלקטרוני) כדי להשיג שדה ראייה ברור (איור 4A).
- הפעל את חלון ההיסטוגרמה והתאם את הרווח ואת עוצמת ה- LED כך שהעוצמה שנרשמה תהיה בין 35% ל -70% .
- אם אתה מבצע מחקר אורך, עיין בהקלטות או בתמונות שצולמו בפגישה קודמת והתאם את ערך המיקוד כך שאותו מישור הדמיה ייראה בבירור.
- התחל את הניסוי ואת איסוף הנתונים.
- לאחר השלמת הניסוי, להסיר את החיה מן המנגנון ההתנהגותי.
- תחת קשקוש עדין, שחררו את בורג הסט והוציאו את המיניסקופ מלוח הבסיס של החיה.
- החזירו את כיסוי המגן לפלטת הבסיס וייצבו אותו בעזרת בורג הסט.
- החזירו את בעל החיים לכלוב הביתי שלו (המשיכו לשלב 7 אם ברצונכם לעבד נתונים של פוטון אחד).

איור 4: איסוף נתונים ועיבודם באמצעות תוכנה. (A) תמונה המציגה את הזרם בזמן אמת מהמיניסקוף. מומלץ לכוונן את ערך מיקוד העדשה, כך שתיראה תצוגה ברורה בחלון הזרימה, יחד עם הרווח והגרף הסכמטי של עוצמת הלייזר (B) הממחיש את זרימת העבודה המומלצת ליישור עבור הפעלות שהוקלטו בנקודות זמן שונות. מומלץ ליצור תמונה ממוצעת מההפעלה הראשונה, בהתאם להוראות תוכנת עיבוד הנתונים. יש להשתמש בתמונה זו כתמונת הייחוס במהלך תיקון תנועה בהפעלות הבאות. (C) דוגמאות לארבעה תאים מאותה תמונת ΔF/F המוקרנת במקסימום. קו כתום משורטט לאורך כל תא כדי למדוד את קוטר התא שלו בפיקסלים, שהממוצע שלו נלקח כארגומנט קלט עבור אלגוריתם זיהוי התא (למעלה משמאל: 13, למעלה מימין: 11, למטה משמאל: 12, למטה מימין: 13). (D) פלט של אלגוריתם זיהוי התא לאחר אצירה ידנית (התמונה נחתכה). קווי מתאר לבנים מייצגים את התאים המזוהים (סרגל קנה המידה מייצג 100 מיקרומטר). לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. הדמיית סידן דו-פוטון של שכבות קליפת המוח בעכברים עם ראש קבוע
הערה: עבור מיקרוסקופ סריקת לייזר של שני פוטונים, מקור האור הוא לייזר מהיר במיוחד עם אורך גל עירור של 920 ננומטר. עוצמת העירור, שנמדדה במטרה, הייתה בדרך כלל בין 100-150 mW והותאמה בכל מפגש כדי להשיג רמות דומות של פלואורסצנטיות. אור הפליטה סונן על ידי מסנן פליטה (525/70 ננומטר) ונמדד על ידי צינור פוטו-מכפיל עצמאי (PMT), המכונה ערוץ ירוק. התמונות נרכשו עם יעד טבילה באוויר פי 20 (NA = 0.45, מרחק עבודה של 6.9-8.2 מ"מ).
- לפני רכישת הנתונים, הרגילו את בעל החיים למכשיר בימים שלפני (כדי לגרום לבעל החיים להרגיש בנוח עם המערך ההתנהגותי). אפשר לבעל החיים לבלות 15-30 דקות ביום, במשך 2-3 ימים, לחקור את ההתקנה או עד שהם מפגינים התנהגות נטורליסטית לפני תחילת איסוף הנתונים.
- הפעל את מערכת ההדמיה של שני פוטונים, הפעל את תוכנת הרכישה והפעל את הלייזר. ודא שהלייזרים סגורים ושה- PMT כבויים לפני שתמשיך.
- נקה מכשיר הדמיה של שני פוטונים עם חומצה היפוכלורית מיוצבת עם מים מזוקקים ואתנול 70%.
- הקפידו להתאים את המכשיר לגודל החיה. חבר בעדינות את העכבר ואת לוחית הראש שלו למערך שלב הראש והברג אותו למקומו כדי לייצב את ראש העכבר.
- לאחר החיבור, הסר את כיסוי העדשה (עיין בשלב 5.4.1) ויישר את המטרה כך שתהיה מעל לוח הבסיס.
- השתמש בפקדי שלב אפיפלואורסצנטיות ו- XYZ כדי להביא את רקמת קליפת המוח למיקוד.
- ברגע שהשכבות בקליפת המוח גלויות, החליפו את המיקרוסקופ כדי לאפשר הדמיה של שני פוטונים (החליפו את המראה במראה הדיכרואית, סגרו את התריס הפלואורסצנטי וכבו את הלייזר והצג האפיפלואורסצנטיים). הקפד לכבות את האורות הראשיים כדי להגן על PMT בעת ההדמיה.
- הגדר פרמטרים למיטוב קובצי תמונה שנרכשו.
- השתמש במצב רכישת תהודה להדמיית סידן מכיוון שהוא יכול ללכוד את הירי המהיר של אותות GCaMP.
- התאם את עוצמת הלייזר, רווח PMT, זום וטבלאות חיפוש (LUTs) כדי לקבל תמונה מיטבית והפנה לתמונה של פוטון אחד כדי לוודא שמישור המוקד הנכון מצולם.
- התחל הדמיה של שכבות קליפת המוח עם מערכת שני פוטונים עם ניטור התנהגותי מסונכרן וקלט גירוי (אם רלוונטי).
- הקפידו לשמור את פרמטרי הרכישה ואת מרחקי XYZ אם ברצונכם להפיק תמונות זהות לאורך זמן.
- כדי ללכוד ערימת z של שכבות קליפת המוח, בצע את השלבים המתוארים להלן.
- מצא את המישור שממנו תתחיל את ערימת z, התאם את פרמטרי הרכישה כדי לייעל את התמונה וסמן זאת כנקודת ההתחלה בתוכנה.
- לאחר מכן, באמצעות פקד Z, עבור במורד הערימה, רק להתאים את עוצמת הלייזר כדי לשמור על בהיקות קבועה של הערימה, ולסמן את סוף הערימה על התוכנה.
- שלב קריטי: באמצעות האפשרות הדרגתי מעריכי יחסי תחת הכרטיסייה מעבר צבע עוצמת לייזר , אפשר לתוכנה לחשב את הגידול בעוצמת הלייזר כשהיא נעה דרך מחסנית z. הקפד לסמן למטה את ערכי עוצמת הלייזר של נקודת הקצה בטבלה שסופקה על-ידי התוכנה כדי לאפשר לה לחשב את מעבר הצבע.
- לאחר הגדרת פרמטרים של z-stack, התאם את גודל הצעד (μm).
הערה: גודל השלב יקבע את הזמן שנלקח, מספר הפרוסות ואיכות הפירוט של הערימה. גדלי צעדים קטנים יותר יגרמו לזמן רכישה ארוך יותר, לעלייה במספר הפרוסות ולפירוט טוב יותר בהשוואה לגודל צעד גדול יותר. ערימות Z משמשות לסיוע ברישום של תמונות של פוטון אחד ושני פוטונים, מכיוון שהן ידגישו כל ציוני דרך אנטומיים או תכונות.
- כדי לרכוש סדרת זמן (T-series) של שינויים בסידן בנוירונים, מצא מישור מוקד אופטימלי באמצעות פקדי שלב XYZ וכוונן את עוצמת הלייזר, רווח PMT, זום ו- LUTs.
- תחת הכרטיסייה T-series בתוכנת הרכישה, הגדר פרמטרים של תדירות רכישה כך שיתאימו לנתונים המתקבלים באמצעות מערכת הדמיה של פוטון אחד.
הערה: התאמת התדירות תהפוך את נתוני 1P ו- 2P לדומים, והיא מתאימה יותר לאלגוריתם זיהוי התא המשמש בשלבי עיבוד הנתונים. ניתן לשלב טריגרים מרובים ומצבי רכישה אחרים ברכישה מסדרת T.
- תחת הכרטיסייה T-series בתוכנת הרכישה, הגדר פרמטרים של תדירות רכישה כך שיתאימו לנתונים המתקבלים באמצעות מערכת הדמיה של פוטון אחד.
- התחל לרכוש את סדרת T.
7. עיבוד נתוני דימות סידן של פוטון אחד
- להקלטת סרטים עם פוטון אחד, השתמש בתוכנת עיבוד הנתונים שמגיעה עם מערכת המיניסקופ.
- ראשית, לעבד מראש את הסרט על ידי דגימת מטה מרחבית וזמנית. באופן כללי, דגימה מרחבית מטה של הסרט פי שניים תקצר משמעותית את זמן העיבוד מבלי לפגוע קשות בדיוק זיהוי התא.
- הגדר מקדם דגימה מופחת זמני כך שקצב הפריימים של הסרט ירד לכ- 10 הרץ, המתאים יותר לאלגוריתם זיהוי התא המשמש בשלבים הבאים.
- אם אתם רוכשים מספר סרטים באותו יום הדמיה, שלבו את הסרטים לסדרה חד פעמית לפני שלב העיבוד המוקדם כדי לעבד אותם יחד.
- אופציונלי: החל מסנן פס מרחבי על סרט הצילום כדי להסיר את הצפיפויות המרחביות הנמוכות והגבוהות יותר, והתוצאה תהיה סרט צילום חלק יותר עם ניגודיות גבוהה יותר.
- רשום את הסרט באמצעות פונקציונליות תיקון התנועה של התוכנה. פעולה זו רושמת את הסרט ומתקנת את תוצרי התנועה הנגרמים על ידי תנועת המיניסקופ ביחס למשטח ההדמיה.
- שלב קריטי: אם אתם עורכים מחקר אורך, רשמו את הסרטים באותו שדה ראייה, לדוגמה, התמונה הממוצעת של הסרט שצולמה ביום ההדמיה הראשון (איור 4B).
- חשב את ה- ΔF/F של הסרט באמצעות הכרטיסייה המתאימה והקרן את הסרט ליצירת תמונת הקרנה מרבית של סרט ΔF/F. התמונה הזו תציג אזורים שמציגים שינויים ברמות הפלואורסצנטיות, אולי תאי עצב בודדים, ואפשר להשתמש בה כדי למדוד את הקוטר הממוצע של תאי העצב (איור 4C).
- לחלופין, מדדו את קוטר התא על הסרט המתוקן בתנועה, שבו תאי העצב מראים פלואורסצנטיות ברורה.
- זהה תאים באמצעות האלגוריתמים בתוכנה.
- בעוד שתי אפשרויות (PCA-ICA ו- CNMF-E) זמינות בשלב זה, השתמש CNMF-E עבור מחקר זה. הזן את קוטר התא הממוצע בפיקסלים והפעל את האלגוריתם כדי ליצור ערכת תאים המכילה אזורי עניין (ROI) המדגימים פעילויות דמויות תא.
- בחרו באופן ידני ROIs שהם תאים (בעלי מורפולוגיה דמוית תא, ופעילות22,23, ונמצאים בתוך ה-FOV) מאלה שאינם, ואמתו את ערכת התאים שנאצרו (איור 4D).
- ייצא את עקבות הסידן של כל החזר השקעה לניתוח נוסף.
8. עיבוד נתוני דימות סידן של שני פוטונים
- עבור סרטים להקלטת שני פוטונים, השתמש בחבילת Python שנועדה לעבד נתוני ניתוח סידן של שני פוטונים.
- ראשית, שלב את התמונות שצולמו בסדרת T לערימת .tiff כמתואר להלן.
- תחת ממשק אפשרויות הפעלה , התאם את הפרמטרים, כולל ערך tau וקצב פריימים, כך שיתאים ל- GCaMP המשמש ולקצב המסגרות של ההקלטה.
- אופציונלי: הגדר את הפרמטר do_registration ל- 1 כדי לרשום את הסרט. זה שווה ערך לשלב תיקון התנועה שתואר לעיל.
- אופציונלי: הגדר את הפרמטר anatomical_only ל- 1 כדי לזהות החזר השקעה באמצעות התכונות האנטומיות בנוסף לדינמיקה הפלואורסצנטית. זה דורש קלט של קוטר התא, לכן בצע מדידות באמצעות תוכנת עיבוד התמונה. זה מומלץ בדרך כלל, מכיוון שהוא מייצר ROI עם צורות טבעיות יותר (איור 5A-C).
- לאחר שכל הפרמטרים מוגדרים, הפעל את האלגוריתם כך שהוא יבצע את כל החישובים יחד. עיין בממשק המשתמש הגרפי (GUI) כדי לבדוק את ההתקדמות.
- לאחר שתסיים, חזור לממשק בחירת התא לאצירה ידנית של תוצאות זיהוי התא.
- שמור תמונה של התא שאצר מעל ההקרנה המרבית של הסרט. תמונה זו תשמש מאוחר יותר כתמונת הייחוס לרישום נתוני רישום פוטון אחד.
- לאחר מכן האלגוריתם שומר את התוצאות באופן אוטומטי. פורמט npy, אשר ניתן לגשת מאוחר יותר עם Python. לחלופין, שמור את התוצאות בקבצים מעוצבים אחרים לניתוח נוסף בתוכנות אחרות.
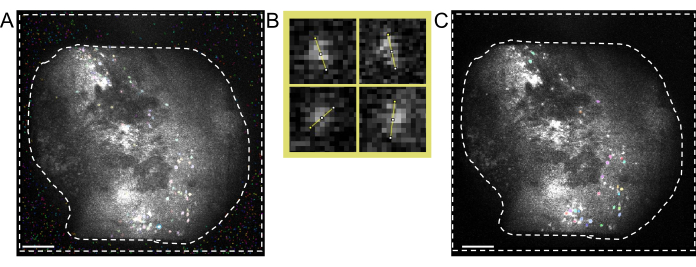
איור 5: זיהוי תאים באמצעות תוכנה לעיבוד שני פוטונים. (A) תמונה מייצגת של זיהוי תאים שנלקחה מתוכנת עיבוד שני פוטונים. הגדרת פרמטר Anatomical_only ל- 0 אך שמירה על כל שאר הפרמטרים זהים, קיימים מספר תאים שאינם תאים באזור שבין קווים מקווקווים המפריעים לאצור ידנית של תאים בפועל. (B) דוגמאות למדידות קוטר התא שנלקחו מ-(A), באמצעות תוכנה לעיבוד תמונה (למעלה משמאל; 7.5 פיקסלים, למעלה מימין; 9, למטה משמאל; 6.5, למטה מימין; 7.5). (C) תמונה מייצגת של זיהוי תאים. בעת הגדרת פרמטר Anatomical_only ל- 1 והזנת קוטר התא הממוצע שנלקח מ- (B) לאלגוריתם קוטר התא, אין תאים באזור שבין קווים מקווקווים (פסי קנה מידה מייצגים 200 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
9. רישום של קבוצות תאים מזוהות בשיטות הדמיה
- לבצע רישום של תאים שזוהו מהקלטות של פוטון אחד ושני פוטונים באמצעות אלגוריתם רישום וניתוח תמונה רב-מודאלית (MIRA), הזמין באמצעות ממשק Python של תוכנת ההדמיה של פוטון אחד.
- אלגוריתם זה מיישר את הנתונים של פוטון אחד ושני פוטונים באמצעות רישום לא קשיח. ראה את קבוצת המחברות המקוונות להדגמה שנמצאו באתר ושימשו למחקר זה.
הערה: המחברות נכתבו כך שכל העיבוד יושלם בתוכנת 1P ולכן אינן תואמות לתוכנת עיבוד 2P. לפיכך, בצע רק חלק מהשלבים במחברות עבור מחקר זה.
- אלגוריתם זה מיישר את הנתונים של פוטון אחד ושני פוטונים באמצעות רישום לא קשיח. ראה את קבוצת המחברות המקוונות להדגמה שנמצאו באתר ושימשו למחקר זה.
- בצע את השלבים המתוארים במחברות ההדגמה, הכוללים יצירת תמונה מבנית עבור כל שיטת הדמיה. כברירת מחדל, זה כרוך ביצירת הקרנה מקסימלית של מחסנית z של שני פוטונים ותמונה ממוצעת של הקלטת פוטון אחד. לחלופין, השתמש בתמונה ממוצעת של הקלטת שני פוטונים.
- כאשר תתבקש, פס פס מרחבי מסנן את התמונות כדי להציג בצורה טובה יותר את ציוני הדרך ולכוון אותם מחדש כך שיתאימו זה לזה.
- בחר ציוני דרך תואמים בשתי התמונות (איור 6A).
- השתמשו בהם כדי לחשב את העיקום הדרוש ליישור שתי התמונות. באופן כללי, 3 עד 5 ציוני דרך צריכים להספיק.
- האלגוריתם מחשב את העיקום בהתבסס על שילוב של ציוני דרך ודמיון תמונה. מטב את המשקל היחסי שניתן לשני הגורמים עד להשגת תוצאות משביעות רצון.
- עקם את מפת התא שנרכשה בסשן של פוטון אחד כדי ליצור מפת תאים חדשה המיושרת לנתונים של שני פוטונים.
- לאחר מכן ייבא מפת תאים מעוותת זו לתוכנת עיבוד 1P כדי ליצור תמונה עם תמונת ההקרנה המרבית מסרט שני פוטונים ברקע.
- ייצא תמונה זו למטרות רישום.
- בתוכנת תכנות, יישרו את שתי התמונות שנוצרו עד כה (מפת תא של שני פוטונים על גבי תמונת הקרנה מרבית של שני פוטונים) ועיוותו את מפת התא של פוטון אחד על גבי תמונת הקרנה מרבית של שני פוטונים (איור 6B,C).
- לשם כך, לצורך מחקר זה, השתמש ביישום מעריך רישום המאפשר למשתמש להשוות את התוצאות של טכניקות רישום שונות. בהתחשב בכך שלשתי התמונות יש אותו רקע, טכניקת מתאם הפאזה, עם רישום נוקשה, הספיקה.
- לאחר השלמת הרישום, סרוק את התמונה הרשומה כעת עבור החזר השקעה חופף. אלה הם ROI הפעילים בשני סשנים הקלטה, אשר יכול לשמש לניתוח נוסף.
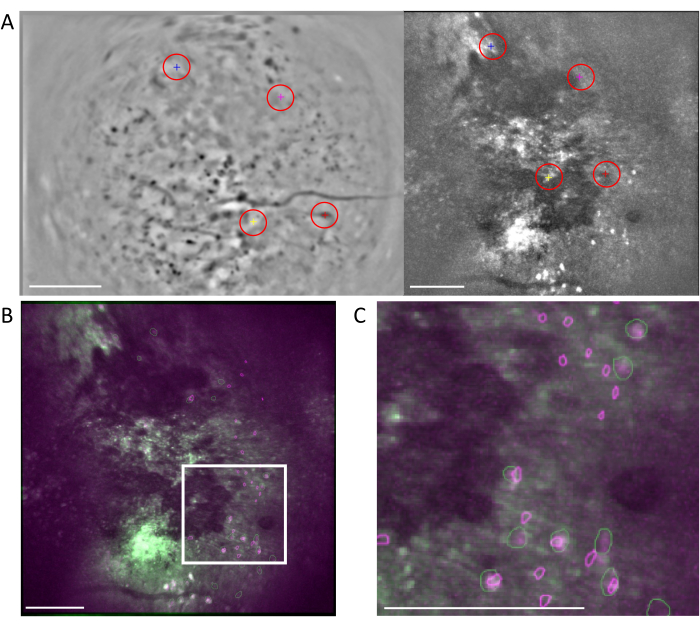
איור 6: רישום תאים חוצה מודאליות באמצעות זרימת העבודה של MIRA. (A) תמונה מייצגת מזרימת העבודה של יישור תאים. התמונה הממוצעת מנתוני הפוטון האחד מוצגת משמאל, והתמונה הממוצעת מנתוני שני הפוטונים מוצגת מימין. ציוני דרך תואמים משתי התמונות נבחרים ומתויגים בתוכנה על ידי ערכת צבעים אקראית (עיגולים אדומים). (B) תמונות מיושרות לדוגמה המציגות את שתי קבוצות התאים המזוהות, פוטון אחד (סגול) ושני פוטונים (ירוק), מונחות על התמונה הממוצעת של נתוני שני הפוטון. (C) תמונה של האזור המסומן בתיבה הלבנה ב- (B), תאים מיושרים מיוצגים כאן כקווי מתאר חופפים בירוק ובסגול. בכל החלוניות, סרגל קנה המידה מייצג 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
השיטה של ביצוע הדמיית סידן כרונית רב-שכבתית in vivo של אותה אוכלוסייה עצבית במשך תקופה של מספר שבועות, תוך שימוש בשיטות הדמיה של פוטון אחד ושני פוטונים, בתנאים הנעים בחופשיות וקבועים בראש. כאן הודגמה היכולת לזהות אוכלוסיות תאי עצב תואמות תחת הדמיה של פוטון אחד בזמן שהחיה חקרה זירה פתוחה ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן, הראינו את היכולת להתבונן ולהשוות ישירות תאי עצב בתנאים קבועים בראש ובתנועה חופשית באותן אוכלוסיות עצביות. בעוד הדגמנו את היישום בקליפת המוח הראייתית, פרוטוקול זה יכול להיות מותאם למספר רב של אזורים אחרים במוח, הן אזורים בקליפת המוח והן גרעינים עמוקים 24,25,26,27,28...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין אינטרס כלכלי מתחרה או ניגוד עניינים.
Acknowledgements
אנו מודים לגב' צ'ארו רדי ולפרופסור מתאו קרנדיני (מעבדת קורטקס) על עצתם בנוגע לפרוטוקול כירורגי ושיתוף זן עכברים מהונדס. אנו מודים לד"ר נורברט הוגרפה (Inscopix) על הדרכתו וסיועו בפיתוח הניתוח. אנו מודים לגב' אנדריאה אלדאה (Sun Lab) על עזרתה במערך הכירורגי ובעיבוד הנתונים. עבודה זו נתמכה על ידי Moorfields Eye Charity.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
References
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3(2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472(2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970(2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579(2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678(2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728(2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894(2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved