Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Serbest Hareket Eden ve Kafası Sabit Hayvanlarda Mikroprizmalar Kullanılarak Tanımlanmış Nöral Popülasyonların Uzun Süreli Görüntülenmesi
Bu Makalede
Özet
Bir kafa plakası ve hem tek hem de iki fotonlu mikroskoplarla uyumlu bir optik tasarımla entegre edildiğinde, mikroprizma mercek, kafa sabit durumlarda iyi kontrol edilen deneyler veya serbestçe hareket eden hayvanlarda doğal davranışsal görevler dahil olmak üzere çeşitli koşullar altında dikey bir sütundaki nöral tepkileri ölçmede önemli bir avantaj sunar.
Özet
Çoklu foton mikroskobu ve moleküler teknolojilerin ilerlemesiyle, floresan görüntüleme, canlı beyin dokularının yapısını, işlevini ve plastisitesini incelemek için güçlü bir yaklaşım haline gelmek için hızla büyüyor. Konvansiyonel elektrofizyoloji ile karşılaştırıldığında, floresan mikroskobu, hücrelerin morfolojisinin yanı sıra nöral aktiviteyi de yakalayabilir ve tanımlanan nöron popülasyonlarının tek hücreli veya hücre altı çözünürlükte uzun süreli kayıtlarını sağlar. Bununla birlikte, yüksek çözünürlüklü görüntüleme tipik olarak, hayvanın hareketini kısıtlayan kararlı, kafaya sabitlenmiş bir kurulum gerektirir ve şeffaf camın düz bir yüzeyinin hazırlanması, nöronların bir veya daha fazla yatay düzlemde görselleştirilmesine izin verir, ancak farklı derinliklerde çalışan dikey süreçlerin incelenmesinde sınırlıdır. Burada, bir kafa plakası fiksasyonu ile çok katmanlı ve çok modlu görüntüleme sağlayan bir mikroprizmayı birleştirmek için bir prosedür açıklıyoruz. Bu cerrahi preparat, yalnızca fare görsel korteksinin tüm kolonuna erişim sağlamakla kalmaz, aynı zamanda kafaya sabitlenmiş bir pozisyonda iki fotonlu görüntülemeye ve serbestçe hareket eden bir paradigmada bir fotonlu görüntülemeye izin verir. Bu yaklaşımı kullanarak, farklı kortikal katmanlar boyunca tanımlanmış hücre popülasyonlarını örnekleyebilir, yanıtlarını kafa sabit ve serbestçe hareket eden durumlar altında kaydedebilir ve aylar boyunca uzun vadeli değişiklikleri izleyebilir. Bu nedenle, bu yöntem, iyi kontrol edilen uyaranlar tarafından ve doğal bir davranış paradigması altında uyandırılan sinirsel aktivitelerin doğrudan karşılaştırılmasını sağlayan mikro devrelerin kapsamlı bir tahlilini sağlar.
Giriş
Optik sistemlerdeki yeni teknolojileri ve genetiği değiştirilmiş floresan göstergelerini birleştiren in vivo iki fotonlu floresan görüntülemenin 1,2 ortaya çıkışı, canlı beyindeki karmaşık yapıyı, işlevi ve plastisiteyi araştırmak için sinirbilimde güçlü bir teknik olarak ortaya çıkmıştır 3,4. Özellikle, bu görüntüleme yöntemi, nöronların hem morfolojisini hem de dinamik aktivitelerini yakalayarak geleneksel elektrofizyolojiye göre benzersiz bir avantaj sunar ve böylece tanımlanan nöronların uzun süreli izlenmesini kolaylaştırır 5,6,7,8.
Kayda değer güçlü yönlerine rağmen, yüksek çözünürlüklü floresan görüntüleme uygulaması genellikle hayvanın hareketliliğini kısıtlayan statik, başa sabitlenmiş bir kurulum gerektirir 9,10,11. Ek olarak, nöronları görselleştirmek için şeffaf bir cam yüzeyin kullanılması, gözlemleri bir veya daha fazla yatay düzlemle sınırlandırarak, farklı kortikal derinliklere uzanan dikey süreçlerin dinamiklerinin keşfini sınırlar12.
Bu sınırlamaları ele alan bu çalışma, çok katmanlı ve çok modlu yeteneklere sahip bir görüntüleme modalitesi oluşturmak için kafa plakası fiksasyonu, mikroprizma ve miniskopu entegre eden yenilikçi bir cerrahi prosedürün ana hatlarını çizmektedir. Mikroprizma, kortikal kolon 13,14,15,16 boyunca dikey işlemenin gözlemlenmesine izin verir, bu da bilginin korteksin farklı katmanlarından geçerken nasıl işlendiğini ve dönüştürüldüğünü ve plastik değişimler sırasında dikey işlemenin nasıl değiştiğini anlamada kritik öneme sahiptir. Ayrıca, aynı nöral popülasyonların kafaya sabitlenmiş bir paradigmada ve serbestçe hareket eden bir ortamda görüntülenmesine izin verir, çok yönlü deneysel ortamlarıkapsar 17,18,19: örneğin, duyusal algı değerlendirmesi ve 2-foton paradigması altında kararlı kayıtlar gibi iyi kontrol edilen paradigmalar için genellikle kafa fiksasyonu gerekirken, serbestçe hareket etmek davranışsal çalışmalar için daha doğal, esnek bir ortam sunar. Bu nedenle, her iki modda da doğrudan karşılaştırma yapabilme yeteneği, esnek, işlevsel yanıtları mümkün kılan mikro devreler hakkındaki anlayışımızı ilerletmek için çok önemlidir.
Özünde, kafa plakası fiksasyonu, mikroprizma ve miniskopun floresan görüntülemeye entegrasyonu, beynin yapısının ve işlevselliğinin inceliklerini araştırmak için umut verici bir platform sunar. Araştırmacılar, tüm kortikal katmanları kapsayan çeşitli derinliklerde tanımlanmış hücre popülasyonlarını örnekleyebilir, yanıtlarını hem iyi kontrol edilen hem de doğal paradigmalardaki yanıtlarını doğrudan karşılaştırabilir ve20 ay boyunca uzun vadeli değişikliklerini izleyebilir. Bu yaklaşım, bu nöral popülasyonların farklı deneysel koşullar altında zaman içinde nasıl etkileşime girdiğine ve değiştiğine dair değerli bilgiler sunarak, nöral devrelerin dinamik doğasına bir pencere sağlar.
Protokol
Tüm deneyler, 1986 tarihli Birleşik Krallık Hayvanlar (Bilimsel Prosedürler) Yasası'na göre, uygun etik incelemenin ardından Birleşik Krallık İçişleri Bakanlığı tarafından onaylanan ve verilen kişisel ve proje lisansları altında gerçekleştirilmiştir. Yetişkin transgenik hatlar CaMKII-TTA; GCaMP6S-TRE21 yetiştirildi ve yavruları deneyde kullanıldı. Deneycilerin güvenliği ve steril koşulların sürdürülmesi için tüm prosedürler aseptik koşullar altında ve tam kişisel koruyucu ekipmanlarla gerçekleştirilmiştir.
1. Ameliyat öncesi hazırlık
- Ödemi en aza indirmek için, ameliyattan 12-24 saat önce Deksametazon (0.2 mg / kg) deri altından uygulayın.
- Tüm cerrahi aletleri bir otoklavda sterilize edin ve ameliyattan önce cerrahi alanı damıtılmış su ve% 70 etanol ile stabilize hipokloröz asit ile sterilize edin. Tüm cerrahi ekipmanların AÇIK olduğundan emin olun.
- Hayvanı (24 haftalık, 31 g ağırlığında erkek) izofluran kullanarak %5'lik bir indüksiyon dozu ile anestezi altına alın, fare stereotaksik çerçeveye girdikten sonra %1-2'ye düşürülür ve O2 1-2 L / dak arasında tutulur. NSAID'leri (Carprofen, 2.5 mg / kg) deri altına enjekte edin.
- Anestezi derinliğini değerlendirmek için ayak parmağı sıkıştırma refleksinin olup olmadığını kontrol edin (refleks görülürse izofluran konsantrasyonunu %0,5'lik artışlarla artırın).
- Hayvanın kafasını bir düzeltici kullanarak kulakların arkasından gözlerin biraz üstüne kadar tıraş edin. Bu alanı alkollü mendil ve povidon-iyot solüsyonu ile temizleyin ve hayvanın gözleriyle temastan kaçının.
- Hayvanı homeotermik ısıtma yastığına ve kulak ve diş çubuklarıyla donatılmış stereotaksik çerçeveye monte edin ve kafayı sabitleyin. Aşağıdaki prosedürün başarılı olması için bu çok önemli olduğundan, kafanın sabit olduğundan emin olun (Şekil 1).
- Ameliyat sırasında kurumasını önlemek için hayvanın gözlerine oftalmik merhem sürün ve ışıktan korumak için folyo ile örtün. Hayvanı steril bir cerrahi örtü ile örtün.

Şekil 1: Ameliyat öncesi hazırlık. Fare, bir burun parçası ve kulak çubukları ile sabitlenmiş stereotaksik çerçeveye yerleştirilir. Fare, sıcaklık ayarlı ısıtmalı bir ped üzerine yerleştirilir. Gözlerin üzerinde oftalmik merhem bulunur ve alüminyum folyo ile kaplıdır. Kafa traş edilir ve kafatası açığa çıkar. Hayvanın üzerine steril bir örtü yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Kraniyotomi
- Cerrahi makas kullanarak, kafatasını ortaya çıkarmak için cildi başın traşlı bölgesinin orta hattı boyunca kesin.
- Herhangi bir bağ dokusunu çıkarmak için steril bir pamuklu çubuk ve seyreltilmiş hidrojen peroksit (%3 w/v %35H2O2in %97 dH2O) kullanarak kafatasını 1-3 saniye boyunca temizleyin (Şekil 2A). % 70 etanol damlası ve yeni bir steril pamuklu çubuk kullanarak kafatasını kurutun.
- Doğru bir implantasyon yeri sağlamak için kafatasını öne/arkaya (AP) ve medial/laterale (ML) hizalayın. Bunu yapmak için, kafatasının dorsoventral (DV) derinliğini hem bregma hem de lambda'da ölçün ve ikisi arasındaki farkın <0.03 mm olduğundan emin olun. Mediolateral hizalama için, orta hattan her iki parietal kemikte eşit uzaklıktaki noktaları ölçün ve DV farkının <0.03 mm olduğundan emin olun.
- Bregma'yı orijin olarak kullanarak, istenen kortikal alanı bulun ve işaretleyin; burada bunlar monoküler primer görsel korteks (V1), AP: -3.5 mm, ML: -2.5 mm'dir.
- Korteksi ortaya çıkarmak için bir trephine matkap ucu (1,8 mm çap) ve diş matkabı (10.000 rpm hız) kullanın ve istenen kortikal alan (monoküler V1) işaretinin matkap ucu penceresinin alt üçte birlik kısmında yer almasını sağlayın.
- Matkap ucunun açısının kafatasının eğriliğine dik olduğundan emin olun. Bu, eşit bir kraniotomi sağlayacak ve dura veya korteksin zarar görmesini önleyecektir.
- Dirençte bir azalma olana kadar delin ve ardından durun (Şekil 2B). 23G iğne ucu kullanarak ayrılan kemik parçasını dikkatlice çıkarın (Şekil 2C).
- Herhangi bir kalıntıyı temizlemek ve oluşabilecek kanamayı durdurmak için açıkta kalan korteksi soğuk yapay beyin omurilik sıvısına (ACSF) doyurulmuş cerrahi köpükle temizleyin.
- Ameliyat boyunca soğuk ACSF kullanarak açıkta kalan korteksi daima nemli tutun.
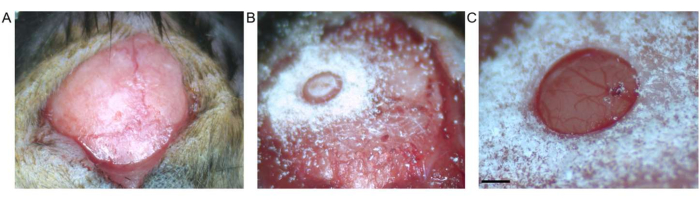
Şekil 2: Kraniyotomi. (A) Bregma ve lambda arasındaki deri kesisi gösterilmiştir. Açıkta kalan yüzeyden bağ dokusu çıkarıldı. (B) Kemik parçası çıkarılmadan önce trephine drill ile kraniyotomi. (C) Kemik parçasının çıkarılmasından sonra, sağlam dura ve korteks gösteren kraniyotomi (ölçek çubuğu 0,5 mm'yi temsil eder). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Önceden kesilmiş kesi
NOT: Önceden kesilmiş insizyon yapılırken göz önünde bulundurulması için, insizyon ve mikroprizma implantasyonunun ilgilenilen görüntüleme bölgesinin (ROI) önünde olması gerekecektir. Bu, tam ve doğru bir görüş alanı sağlamak içindir. Bu protokol bağlamında, insizyon mediolateral eksen boyunca gerçekleştirilecek ve mikroprizma posteriora bakacak şekilde yönlendirilecektir (Şekil 3B).
- Yerleştirmeye yardımcı olmak ve mikroprizmanın yerleştirilmesi sırasında korteksteki basıncı hafifletmek için bir kesi yapın.
- Cerrahi bıçağı stereotaksik kol tutucusuna takın ve bıçağı veya stereotaksik kolu ML ekseni boyunca kesecek şekilde yönlendirin.
- Bıçağı istediğiniz AP koordinatına getirin (AP: -3.4 mm); prizmanın ROI'nin önünde olması gerekir, bu nedenle insizyonu görüntüleme ROI AP koordinatının (-3,5 mm) 100 μm önünde yapın.
- Şimdi bıçağı kafatasıyla birleştiği kraniyotominin medial kenarına hareket ettirin, bıçağı kemiğe ulaşana kadar yavaşça indirin ve sonra durun. Kemik kalınlığı 200 μm olduğundan, bu değeri toplam yerleştirme derinliğine dahil edin (bkz. adım 5.1 hesaplaması).
- Optimal görüntüleme prizmanın merkezindedir, yani 500 μm; bu nedenle, bu derinliğin kortikal kolon derinliği ile hizalandığından emin olun (ROI DV: - 0,35 mm).
- Kafatasının kalınlığını derinlik hesaplamasına dahil ederek, önceden kesilmiş insizyonun kafatasının yüzeyinden ne kadar derin olması gerektiğini belirleyen aşağıdaki denklemi kullanın. Bu protokol için implantasyon derinliği şu şekilde hesaplanır:
Kemik kalınlığı (200 μm) + görüntüleme ROI'si (örneğin, 350 μm) + kalan mikroprizma derinliği (500 μm) = 1.050 μm
- Kafatasının kalınlığını derinlik hesaplamasına dahil ederek, önceden kesilmiş insizyonun kafatasının yüzeyinden ne kadar derin olması gerektiğini belirleyen aşağıdaki denklemi kullanın. Bu protokol için implantasyon derinliği şu şekilde hesaplanır:
- Kesi uzunluğunun 1 mm'den fazla olduğundan ancak aşırı olmadığından emin olun; bu nedenle, monoküler ML koordinatı bu mesafenin ortasında olacak şekilde 1,2 mm'lik bir mesafe idealdir.
- İnsizyonu gerçekleştirmeye hazır olduğunuzda, görüşün engellenmemesi için fazla ACSF'yi çıkarın (Şekil 3A).
- Bıçağı kraniotominin medial kenarından insizyonun başlangıç medial koordinatına hareket ettirin. Yavaşça (10 μm/s) bıçağı kortekse indirin.
- Dura delindikten ve bıçak kortekse girdikten sonra, insizyon sırasında dokuyu yağlanmış ve nemli tutmak için kortekse bir damla soğuk ACSF uygulayın.
- Son derinliğe ulaşıldığında, bıçağı ML ekseni boyunca (10 μm/s hızında) hareket ettirmeye başlayın.
- Kesi yapılırken çevredeki dokuyu gözlemlemeye devam edin. Mendil bıçakla birlikte sürükleniyorsa, mendilin kesildiğinden emin olmak için bıçağı birkaç kez yukarı ve aşağı hareket ettirin ve ardından bıçağı son derinliğine geri koymayı hatırlayarak yanal olarak devam edin.
- Tamamlandığında bıçağı yavaşça kaldırın. Kesi sırasında kan çıkarsa, kanı seyreltmek ve kesi içindeki kanı dışarı itmek için kesi bölgesini ACSF'ye batırılmış cerrahi köpükle temizlemek için bu süreyi kullanın. Mikroprizmayı yerleştirmeye hazır olana kadar açıkta kalan korteks üzerinde taze, doymuş bir cerrahi köpük bırakmayı unutmayın.

Şekil 3: Mikroprizma implantasyonu. (A) Önceden kesilmiş kesi. (B) Korteks içindeki konumunu gösteren entegre mikroprizma merceğinin şeması (C) Kortekse yerleştirmeden önce önceden kesilmiş kesi için doğru yönde entegre mikroprizma merceği (ölçek çubuğu 0,5 mm'yi temsil eder). (D) Kafatasına bağlanmasını sağlamak için entegre lensin etrafında çimento birikmesi örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Mikroprizma yerleştirme ve kafa plakası implantasyonu
- Mikroprizma mercek, merceğin distal ucundaki bir prizmaya tutturulmuş ve bir taban plakasına entegre edilmiş bir gradyan indeksli mercekten oluşur. Mikroprizmayı implant kitine takın.
- Prizmanın görüntüleme tarafının taban plakası vidasının karşısında olduğundan emin olun. Mikroprizmanın yerleştirilmesine ve yerleştirilmesine yardımcı olmak için, onu stereotaksik çerçeveye takın ve prizmayı insizyonla hizalanacak şekilde yönlendirin (Şekil 3C).
- Mikroprizmayı insizyon bölgesine yavaşça indirin (10 μm/s). Prizmayı ilk yerleştirirken ACSF'yi çıkarmayı unutmayın, ancak kortekse girdikten sonra, yerleştirmeyi yağlamak için soğuk ACSF ile yıkayın.
- Prizma insizyona indirilirken korteks sabit kalmalıdır; değilse, fazladan ACSF ekleyin ve korteksi prizmadan gevşetmek için prizmayı yukarı ve aşağı hareket ettirerek korteksi çalkalayın.
- Son derinliğe ulaşıldığında, prizmaya dokunmamaya dikkat ederek steril doku kullanarak açıkta kalan kortikal yüzeyi kurutun.
- Prizmayı ve lensi çevreleyen açıkta kalan kortikal alanı koruyucu bir silikon yapıştırıcı tabakasıyla kaplayın, çevredeki kafatası ve kukla dürbün üzerindeki fazla yapıştırıcıyı en aza indirin.
- Sertleştikten sonra (5-10 dakika), kafaya sabitlenmiş görüntüleme sırasında kafayı sabitlemek için kafa plakasını kafatasına takın.
- İmplantın yerleştirilmesine müdahale etmeyecek ve implantı düzgün bir şekilde sabitlemek için yeterli çimento uygulamasına izin verecek şekilde başlık plakasının yeterince arkada olduğundan emin olun.
- Kafaya sabitlenmiş deneyler yaparken kafa plakasının her iki tarafının da kafa aşamasına sabitlenebilmesini sağlamak için kafa plakasının orta hattının implante edilen lensin biraz sağında olduğundan emin olun
- Baş plakasına ve kafatasına yapışkan çimento uygulayın.
- 1 kaşık opak çimento tozunu 4 damla karıştırma ortamı ile karıştırarak ve bir damla katalizör uygulayarak yapışkan diş çimentosu hazırlayın.
- Hem kafa plakasına hem de kafatasına çimento yerleştirin ve kürlenene kadar baş plakasını yerinde tutun, kulak çubuklarına paralel olduğundan emin olun (görsel muayene yoluyla, hayvanın başının hem üstünden hem de arkasından inceleyin).
- Açıkta kalan kafatası ve dokunun geri kalanını kaplamak için mikroprizmayı (taban plakasının tabanına kadar) ve kafa plakasını içeren yapışkan çimento uygulayın.
- Taban plakasına, kukla mikroskoba veya herhangi bir bileşenine çimento bulaştırmayın. Mikroprizma ve başlık kaplanana ve stabil hale gelene kadar yapışkan çimentoyu uygulamaya devam edin (Şekil 3D).
- Çimento sertleştiğinde, mikroprizmayı forseps ile stabilize ederken stereotaksik kolu yavaşça yukarı doğru hareket ettirerek kukla mikroskobu ayırın (mıknatıslarla bağlanırlar, bu nedenle ayırma sırasında bir miktar direnç hissedilebilir).
- Koruyucu kapağı lensin üzerine yerleştirin ve yerine sabitlemek için vidayı sıkın.
- Hayvanı stereotaksik çerçeveden çıkarın, ılık bir geri kazanım kutusunda iyileşmesine izin verin ve ısıtılmış steril% 0.9 salin deri altına (vücut ağırlığının% 3'ü) uygulayın.
- Hayvan uyandığında ve hareket ettiğinde, onu temiz, tek yuvalı bir kafese geri koyun. Hayvanı izleyin ve yerel kurumun analjezi politikasına göre ameliyat sonrası ek analjezi uygulayın.
- Ameliyattan sonra 4 hafta bekleyin, hayvan görüntüleme için hazır olmalıdır.
5. Serbest hareket eden farelerde kortikal tabakaların tek fotonlu kalsiyum görüntülemesi
NOT: Amaçlanan görüntüleme düzleminin doğru bir şekilde elde edilmesini sağlamak için her seferinde orijinal görüntüleme oturumundan alınan görüntülerin kullanılması önemlidir. Tanımlanan bu yer işaretleri, nöronlarla birlikte, protokolün 9. adımında ayrıntılı olarak açıklanan hizalama sürecinde kritik bir rol oynar. Bir foton verisi elde ederken, miniskop hem görüntüleme sistemi hem de lazer kaynağıdır. Uyarma, objektif ön yüzeyinde 0-2 mW/mm2 güç aralığına sahip LED kullanır. Lazer, GCaMP sinyali için 455 ± 8nm'lik (mavi ışık) bir uyarma dalga boyu kullanır. Lens odak kaydırıcısı, arayüzde 0-1000 olarak temsil edilen odağı (Z ekseni) ayarlamak için kullanılabilir, burada 0, 0μm çalışma mesafesini ve 1000, maksimum 300μm çalışma mesafesini temsil eder.
- Veri toplamadan önce, kayıt seansından önce hayvanın odaya ve açık alana 1 saat alışmasına izin verin.
- Görüntülemeden önce, her şeyi uygun dezenfektanlarla dezenfekte edin ve temizleyin (örneğin, damıtılmış su ve% 70 etanol ile stabilize hipokloröz asit).
- DAQ kutusunu bir bilgisayara bağlayarak ve veri toplama yazılımını başlatarak kurun. Düşen çerçeveleri en aza indirmek için bir ethernet kablosuyla doğrudan bağlantı kurun; Ancak, kablosuz bağlantının gücüne bağlı olarak kablosuz bağlantı modu yeterli olabilir.
- Miniskopu hayvanın taban plakasına hafif bir tırmık altında takın.
- İlk olarak, ayar vidasını sökerek koruyucu kapağı taban plakasından çıkarın. Kapağı forseps ile açıklığından tutun. Ardından, miniskopu kapağın oturduğu taban plakasına takın.
- Vidanın işaretli tarafı vidaya bakacak şekilde takmadan önce miniskopun taban plakasına göre yönünü kontrol edin.
- Minoskop takıldıktan sonra, sabitlemek için ayar vidasını sıkın. Ayar vidasını yalnızca bir miktar direnç hissedilene kadar ilerletin. Ayar vidasının aşırı sıkılması potansiyel olarak miniskopa zarar verir ve bu nedenle bundan kaçınılmalıdır.
- Miniskopu DAQ kutusuna bağlayın ve yazılımı kayıt için hazırlayın.
- Veri toplama yazılımında, net bir görüş alanı elde etmek için miniskop için akışı açın ve kayıt parametrelerini (görüntüleme kare hızı, kazanç, LED gücü, odak değeri) ayarlayın (Şekil 4A).
- Histogram penceresini açın ve kazancı ve LED gücünü, kaydedilen yoğunluk %35 ila %70 arasında olacak şekilde ayarlayın.
- Uzunlamasına bir çalışma yürütüyorsanız, önceki bir oturumda alınan kayıtlara veya anlık görüntülere bakın ve aynı görüntüleme düzleminin net bir şekilde görülebilmesi için odak değerini ayarlayın.
- Denemeyi ve veri toplamayı başlatın.
- Deneyin tamamlanmasından sonra, hayvanı davranışsal aparattan çıkarın.
- Nazik bir tırmık altında, ayar vidasını gevşetin ve miniskopu hayvanın taban plakasından çıkarın.
- Koruyucu kapağı taban plakasına geri koyun ve ayar vidasıyla sabitleyin.
- Hayvanı ev kafesine geri koyun (bir foton verisini işlemek istiyorsanız 7. adıma geçin).

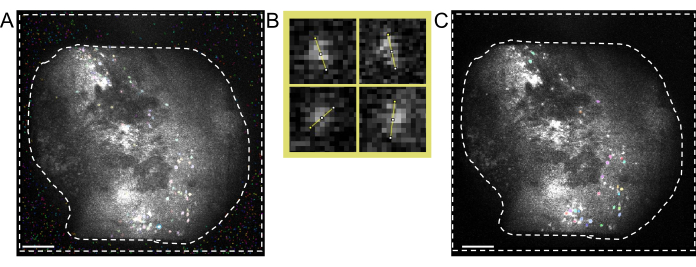
Şekil 4: Yazılımla veri toplama ve işleme. (A) Miniskoptan gerçek zamanlı akışı gösteren bir görüntü. Kazanç ve görüntüleme lazer gücü ile birlikte akış penceresinde net bir görünüm görülecek şekilde lens odak değerinin ayarlanması önerilir (B) Farklı zaman noktalarında kaydedilen oturumlar için önerilen hizalama iş akışını gösteren şematik grafik. Veri işleme yazılımı talimatlarını izleyerek ilk oturumdan ortalama bir görüntü oluşturmanız önerilir. Bu görüntü, sonraki oturumlar için hareket düzeltme sırasında referans görüntü olarak kullanılmalıdır. (C) Aynı maksimum yansıtılan ΔF/F görüntüsünden dört hücre örnekleri. Hücre çapını piksel cinsinden ölçmek için her hücreye turuncu bir çizgi çizilir ve bunun ortalaması hücre tanımlama algoritması için bir giriş bağımsız değişkeni olarak alınır (sol üst: 13, sağ üst: 11, sol alt: 12, sağ alt: 13). (D) Manuel küratörlükten sonra hücre tanımlama algoritmasının çıktısı (görüntü kırpılmış). Beyaz anahatlar tanımlanan hücreleri temsil eder (ölçek çubuğu 100 μm'yi temsil eder). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Kafaya sabitlenmiş farelerde kortikal tabakaların iki fotonlu kalsiyum görüntülemesi
NOT: İki fotonlu lazer tarama mikroskobu için ışık kaynağı, 920 nm uyarma dalga boyuna sahip ayarlanabilir ultra hızlı bir lazerdir. Objektifte ölçülen uyarma gücü tipik olarak 100-150 mW arasındaydı ve benzer floresan seviyeleri elde etmek için her seansta ayarlandı. Emisyon ışığı bir emisyon filtresi (525/70 nm) ile filtrelendi ve yeşil kanal olarak adlandırılan bağımsız bir fotoçoğaltıcı tüp (PMT) ile ölçüldü. Görüntüler 20x havaya daldırma objektifi ile elde edildi (NA = 0.45, 6.9-8.2 mm çalışma mesafesi).
- Veri elde etmeden önce, hayvanı önceki günlerde cihaza alıştırın (hayvanın davranış düzenine alışmasını sağlamak için). Hayvanın günde 15-30 dakika, 2-3 gün boyunca, kurulumu keşfederek veya veri toplamaya başlamadan önce doğal davranış sergileyene kadar geçirmesine izin verin.
- İki fotonlu görüntüleme sistemini açın, toplama yazılımını başlatın ve lazeri AÇIK konuma getirin. Devam etmeden önce lazerlerin kapatıldığından ve PMT'lerin kapatıldığından emin olun.
- Damıtılmış su ve% 70 etanol ile stabilize hipokloröz asit içeren iki fotonlu görüntüleme cihazını temizleyin.
- Aparatı hayvanın boyutuna uyacak şekilde ayarladığınızdan emin olun. Fareyi ve kafa plakasını yavaşça baş aşaması kurulumuna takın ve farenin kafasını sabitlemek için yerine vidalayın.
- Takıldıktan sonra lens kapağını çıkarın (bkz. adım 5.4.1) ve objektifi taban plakasının üzerinde olacak şekilde hizalayın.
- Kortikal dokuyu odağa getirmek için epifloresan ve XYZ aşama kontrollerini kullanın.
- Kortikal katmanlar göründüğünde, mikroskobu iki fotonlu görüntülemeye izin verecek şekilde değiştirin (aynayı dikroik ayna ile değiştirin, floresan deklanşörü kapatın ve epifloresan lazeri ve monitörü kapatın). Görüntüleme sırasında PMT'leri korumak için ana ışıkları kapattığınızdan emin olun.
- Alınan görüntü dosyalarını optimize etmek için parametreleri ayarlayın.
- GCaMP sinyallerinin hızlı ateşlenmesini yakalayabildiği için kalsiyum görüntüleme için rezonans toplama modunu kullanın.
- En iyi görüntüyü elde etmek için lazer gücünü, PMT kazancını, yakınlaştırmayı ve arama tablolarını (LUT'ler) ayarlayın ve doğru odak düzleminin görüntülendiğinden emin olmak için tek fotonlu görüntüye bakın.
- Senkronize davranışsal izleme ve uyaran girdileri (varsa) ile iki foton sistemi ile kortikal katmanların görüntülenmesine başlayın.
- Zaman içinde aynı görüntüleri yeniden üretmek istiyorsanız, bu çekim parametrelerini ve XYZ mesafelerini kaydettiğinizden emin olun.
- Kortikal katmanların z yığınını yakalamak için aşağıda açıklanan adımları izleyin.
- z-yığınının başlatılacağı düzlemi bulun, görüntüyü optimize etmek için alım parametrelerini ayarlayın ve bunu yazılımda başlangıç noktası olarak işaretleyin.
- Ardından, Z kontrolünü kullanarak yığını aşağı doğru hareket ettirin, yalnızca yığının sabit bir parlaklığını korumak için lazer gücünü ayarlayın ve yığının sonunu yazılımda işaretleyin.
- Kritik adım: Lazer Güç Gradyanı sekmesi altındaki Göreli Üstel Gradyan seçeneğini kullanarak, yazılımın z-yığını boyunca hareket ederken lazer gücündeki artışı hesaplamasına izin verin. Gradyanı hesaplamasına izin vermek için yazılım tarafından sağlanan tablodaki uç nokta lazer gücü değerlerini işaretlediğinizden emin olun.
- z-stack parametreleri ayarlandıktan sonra adım boyutunu (μm) ayarlayın.
NOT: Adım boyutu, yığının aldığı süreyi, dilim sayısını ve ayrıntı kalitesini belirler. Daha küçük adım boyutları, daha büyük adım boyutuna kıyasla daha uzun alım süresine, dilim sayısında artışa ve daha iyi ayrıntıya neden olur. Z-yığınları, herhangi bir anatomik yer işaretini veya özelliği vurgulayacağından, bir foton ve iki foton görüntülerinin kaydedilmesine yardımcı olmak için kullanılır.
- Nöronlardaki kalsiyum değişikliklerinin bir zaman serisini (T-serisi) elde etmek için, XYZ aşama kontrollerini kullanarak en uygun odak düzlemini bulun ve lazer gücünü, PMT kazancını, yakınlaştırmayı ve LUT'leri ayarlayın.
- Toplama yazılımındaki T serisi sekmesi altında, tek fotonlu görüntüleme sistemi kullanılarak elde edilen verilerle eşleşecek şekilde alım frekansı parametrelerini tanımlayın.
NOT: Frekansın eşleştirilmesi, 1P ve 2P verilerini karşılaştırılabilir hale getirecektir ve veri işleme adımlarında kullanılan hücre tanımlama algoritması için daha uygundur. Birden fazla tetikleyici ve diğer alım modları, T serisi alımına dahil edilebilir.
- Toplama yazılımındaki T serisi sekmesi altında, tek fotonlu görüntüleme sistemi kullanılarak elde edilen verilerle eşleşecek şekilde alım frekansı parametrelerini tanımlayın.
- T serisinin satın alınmasına başlandı.
7. Tek fotonlu kalsiyum görüntüleme verilerinin işlenmesi
- Tek fotonlu video kaydı için, miniskop sistemiyle birlikte gelen veri işleme yazılımını kullanın.
- İlk olarak, uzamsal ve zamansal aşağı örnekleme ile filmi önceden işleyin. Genel olarak, filmin iki kat uzamsal aşağı örneklemesi, hücre tanımlama doğruluğundan ciddi şekilde ödün vermeden işlem süresini önemli ölçüde azaltacaktır.
- Zamansal aşağı örnekleme faktörünü, filmin kare hızının yaklaşık 10 Hz'e düşürülmesi için ayarlayın, bu da aşağıdaki adımlarda kullanılan hücre tanımlama algoritması için daha uygundur.
- Aynı görüntüleme gününde birden fazla film alıyorsanız, filmleri birlikte işlemek için ön işleme adımından önce tek bir zaman serisinde birleştirin.
- İsteğe bağlı: Daha düşük ve daha yüksek uzamsal frekansları kaldırmak için filme uzamsal bant geçiren bir filtre uygulayın ve daha yüksek kontrastlı daha akıcı bir film elde edin.
- Yazılımın hareket düzeltme işlevini kullanarak filmi kaydedin. Bu, filmi kaydeder ve miniskopun görüntüleme yüzeyine göre hareketinden kaynaklanan hareket artefaktlarını düzeltir.
- Kritik adım: Boylamsal bir çalışma yürütüyorsanız, filmleri aynı görüş alanına, örneğin filmin ilk görüntüleme gününde çekilen ortalama görüntüsüne kaydedin (Şekil 4B).
- İlgili sekmeyi kullanarak filmin ΔF/F'sini hesaplayın ve ΔF/F filmin maksimum projeksiyon görüntüsünü oluşturmak için filmi yansıtın. Bu görüntü, floresan seviyelerinde değişiklikler gösteren bölgeleri, potansiyel olarak bireysel nöronları gösterecek ve nöronların ortalama çapını ölçmek için kullanılabilecektir (Şekil 4C).
- Alternatif olarak, nöronların berrak floresan gösterdiği hareket düzeltmeli filmde hücre çapını ölçün.
- Yazılımdaki algoritmaları kullanarak hücreleri tanımlayın.
- Bu adımda iki seçenek (PCA-ICA ve CNMF-E) mevcut olsa da, bu çalışma için CNMF-E kullanın. Ortalama hücre çapını piksel cinsinden girin ve hücre benzeri etkinlikleri gösteren ilgi alanlarını (ROI'ler) içeren bir hücre kümesi oluşturmak için algoritmayı çalıştırın.
- Hücre olan ROI'leri (hücre benzeri bir morfolojiye ve aktivite 22,23'e sahiptir ve FOV içinde yer alır) olmayanlardan manuel olarak seçin ve seçilmiş hücre kümesini doğrulayın (Şekil 4D).
- Daha fazla analiz için her bir ROI'nin kalsiyum izlerini dışa aktarın.
8. İki fotonlu kalsiyum görüntüleme verilerinin işlenmesi
- İki fotonlu kayıt filmleri için, iki fotonlu kalsiyum analizi verilerini işlemek üzere tasarlanmış bir python paketi kullanın.
- İlk olarak, bir T serisinde çekilen görüntüleri aşağıda açıklandığı gibi bir .tiff yığınında birleştirin.
- Çalıştırma seçenekleri arayüzü altında, tau değeri ve kare hızı dahil olmak üzere parametreleri, kullanılan GCaMP ve kaydın kare hızıyla eşleşecek şekilde ayarlayın.
- İsteğe bağlı: Filmi kaydetmek için do_registration parametresini 1 olarak ayarlayın. Bu, yukarıda açıklanan hareket düzeltme adımına eşdeğerdir.
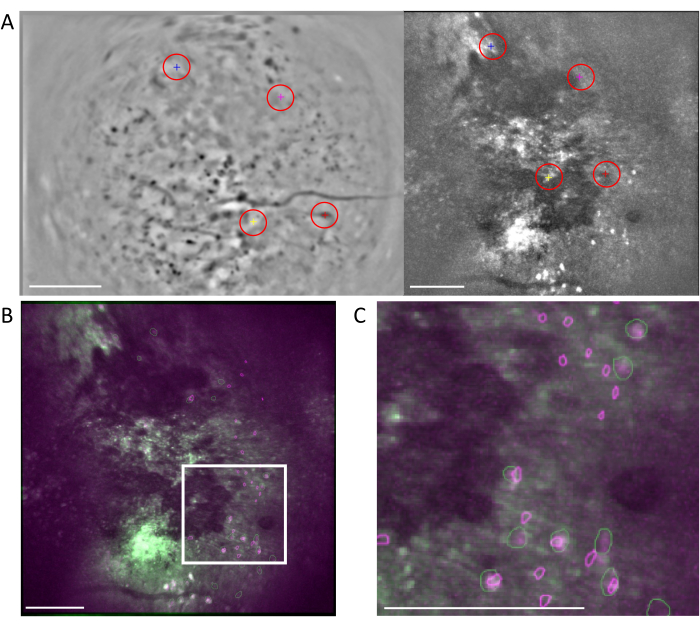
- İsteğe bağlı: Floresan dinamiklerine ek olarak anatomik özellikleri kullanarak ROI'leri algılamak için anatomical_only parametresini 1 olarak ayarlayın. Bu, hücre çapının girilmesini gerektirir, bu nedenle görüntü işleme yazılımını kullanarak ölçümler yapın. Bu, daha doğal şekillerle yatırım getirileri oluşturduğu için genellikle önerilir (Şekil 5A-C).
- Tüm parametreler ayarlandıktan sonra, tüm hesaplamaları birlikte gerçekleştirmesi için algoritmayı çalıştırın. İlerlemeyi kontrol etmek için grafik kullanıcı arayüzüne (GUI) bakın.
- Tamamlandığında, hücre tanımlama sonuçlarının manuel olarak küratörlüğü için hücre seçim arayüzüne dönün.
- Filmin maksimum projeksiyonunun üstüne seçilen hücre kümesinin bir görüntüsünü kaydedin. Bu, daha sonra tek fotonlu kayıt verilerini kaydetmek için referans görüntü olarak kullanılacaktır.
- Algoritma daha sonra sonuçları otomatik olarak kaydeder. npy formatı, daha sonra Python ile erişilebilir. Alternatif olarak, diğer yazılımlarda daha fazla analiz için sonuçları diğer biçimlendirilmiş dosyalara kaydedin.
Şekil 5: İki foton işleme yazılımı kullanılarak hücre tanımlama . (A) İki foton işleme yazılımından alınan hücre tanımlamasının temsili görüntüsü. Anatomical_only parametreyi 0 olarak ayarlamak, ancak diğer tüm parametreleri aynı tutmak, gerçek hücrelerin manuel olarak iyileştirilmesine müdahale eden kesikli çizgiler arasındaki alanda birden çok hücre olmayan hücre bulunur. (B) Bir görüntü işleme yazılımı kullanılarak (A) öğesinden alınan hücre çapı ölçümlerine örnekler (sol üst; 7,5 piksel, sağ üst; 9, sol alt; 6,5, sağ alt; 7,5). (C) Hücre kimliğinin temsili görüntüsü. Anatomical_only parametreyi 1 olarak ayarlarken ve (B)'den alınan ortalama hücre çapını hücre çapı algoritmasına girerken, kesikli çizgiler arasındaki alanda hücre bulunmaz (ölçek çubukları 200 μm'yi temsil eder). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
9. Görüntüleme modaliteleri arasında tanımlanan hücre setlerinin kaydı
- Tek fotonlu görüntüleme yazılımının Python arayüzü aracılığıyla kullanılabilen çok modlu görüntü kayıt ve analiz algoritması (MIRA) ile bir foton ve iki foton kayıtlarından tanımlanan hücrelerin kaydını gerçekleştirin.
- Bu algoritma, katı olmayan kayıt yoluyla bir foton ve iki foton verilerini hizalar. Web sitesinde bulunan ve bu çalışma için kullanılan çevrimiçi tanıtım defterleri setine bakın.
NOT: Dizüstü bilgisayarlar, tüm işlemler 1P yazılımında tamamlanacak şekilde yazılmıştır ve bu nedenle 2P işleme yazılımıyla uyumlu değildir. Bu nedenle, bu çalışma için not defterlerindeki bazı adımları izleyin.
- Bu algoritma, katı olmayan kayıt yoluyla bir foton ve iki foton verilerini hizalar. Web sitesinde bulunan ve bu çalışma için kullanılan çevrimiçi tanıtım defterleri setine bakın.
- Her görüntüleme modalitesi için yapısal bir görüntü oluşturmayı içeren tanıtım not defterlerinde açıklanan adımları izleyin. Varsayılan olarak, bu, iki fotonlu z yığınının maksimum projeksiyonunun ve tek fotonlu kaydın ortalama bir görüntüsünün oluşturulmasını içerir. Alternatif olarak, iki foton kaydının ortalama bir görüntüsünü kullanın.
- İstendiğinde, uzamsal bant geçişi, yer işaretlerini daha iyi görselleştirmek için görüntüleri filtreler ve eşleşecek şekilde yeniden yönlendirir.
- İki görüntüde eşleşen yer işaretlerini seçin (Şekil 6A).
- İki görüntüyü hizalamak için gereken çarpıtmayı hesaplamak için bunları kullanın. Genel olarak, 3 ila 5 yer işareti yeterli olmalıdır.
- Algoritma, çarpıtmayı yer işaretlerinin ve görüntü benzerliğinin bir kombinasyonuna göre hesaplar. Tatmin edici sonuçlar elde edilene kadar iki faktöre verilen bağıl ağırlık için optimize edin.
- İki foton verisine hizalanmış yeni bir hücre haritası oluşturmak için tek fotonlu bir oturumda elde edilen hücre haritasını çarpıtın.
- Ardından, arka plandaki iki fotonlu filmden maksimum projeksiyon görüntüsüne sahip bir görüntü oluşturmak için bu çarpık hücre haritasını 1P işleme yazılımına aktarın.
- Bu görüntüyü kayıt amacıyla dışa aktarın.
- Programlama yazılımında, o ana kadar oluşturulan iki görüntüyü hizalayın (iki fotonlu maksimum projeksiyon görüntüsünün üzerine iki fotonlu hücre haritası) ve iki fotonlu maksimum projeksiyon görüntüsünün üzerine bir fotonlu hücre haritasını çarpıtın (Şekil 6B,C).
- Bunu yapmak için, bu çalışma için, kullanıcının farklı kayıt tekniklerinin sonuçlarını karşılaştırmasına olanak tanıyan bir kayıt tahmincisi uygulaması kullanın. İki görüntünün aynı arka plana sahip olduğu göz önüne alındığında, katı kayıt ile faz korelasyon tekniği yeterliydi.
- Kayıt tamamlandıktan sonra, çakışan yatırım getirileri için şimdi kayıtlı görüntüyü tarayın. Bunlar, her iki kayıt oturumunda da aktif olan ve daha fazla analizde kullanılabilecek yatırım getirileridir.
Şekil 6: MIRA iş akışını kullanarak modaliteler arası hücre kaydı. (A) Hücre hizalama iş akışından temsili görüntü. Bir foton verisinden elde edilen ortalama görüntü solda, iki foton verisinden elde edilen görüntü ise sağda gösterilir. Her iki görüntüden eşleşen yer işaretleri seçilir ve yazılımda rastgele bir renk şeması (kırmızı daireler) ile etiketlenir. (B) Tanımlanan iki hücre kümesini, bir foton (mor) ve iki fotonu (yeşil) gösteren örnekle hizalanmış görüntüler, iki foton verisinin ortalama görüntüsünün üzerine bindirilir. (C) (B)'de beyaz kutu ile işaretlenmiş bölgenin görüntüsü, hizalanmış hücreler burada üst üste binen yeşil ve mor anahatlar olarak temsil edilir. Tüm panellerde ölçek çubuğu 200 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Aynı nöronal popülasyonun birkaç haftalık bir süre boyunca, hem bir hem de iki foton görüntüleme modaliteleri kullanılarak, serbestçe hareket eden ve başa sabitlenmiş koşullar altında kronik çok katmanlı in vivo kalsiyum görüntülemesi yapma yöntemi gösterilmiştir. Burada, hayvan karanlıkta açık bir arenayı keşfederken tek fotonlu görüntüleme altında eşleşen nöronal popülasyonları tanımlama yeteneği gösterilmiştir (Şekil 7A). Tanımlanan nör...
Tartışmalar
Burada, aynı nöral popülasyonlarda kafaya sabitlenmiş ve serbestçe hareket eden koşullarda nöronları gözlemleme ve doğrudan karşılaştırma yeteneğini gösterdik. Uygulamayı görsel kortekste göstermiş olsak da, bu protokol hem kortikal alanlar hem de derin çekirdekler 24,25,26,27,28 ve diğer veri toplama ve davranışsal kurulumlar
Açıklamalar
Yazarlar herhangi bir rakip finansal çıkar veya çıkar çatışması beyan etmezler.
Teşekkürler
Bayan Charu Reddy ve Profesör Matteo Carandini'ye (Cortex Lab) cerrahi protokol ve transgenik fare suşunun paylaşılması konusundaki tavsiyeleri için teşekkür ederiz. Dr Norbert Hogrefe'ye (Inscopix) ameliyatın geliştirilmesindeki rehberliği ve yardımı için teşekkür ederiz. Cerrahi kurulum ve veri işleme konusundaki yardımları için Bayan Andreea Aldea'ya (Sun Lab) teşekkür ederiz. Bu çalışma Moorfields Eye Charity tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
Referanslar
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3 (2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472 (2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970 (2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579 (2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678 (2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728 (2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894 (2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır