Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Долгосрочная визуализация идентифицированных нейронных популяций с использованием микропризм у свободно движущихся животных и животных с фиксированной головой
В этой статье
Резюме
При интеграции с головной пластиной и оптической конструкцией, совместимой как с однофотонными, так и с двухфотонными микроскопами, микропризменная линза представляет собой значительное преимущество при измерении нейронных реакций в вертикальной колонке в различных условиях, включая хорошо контролируемые эксперименты в состояниях, зафиксированных головой, или естественные поведенческие задачи у свободно движущихся животных.
Аннотация
С развитием многофотонной микроскопии и молекулярных технологий флуоресцентная визуализация быстро развивается и становится мощным подходом к изучению структуры, функций и пластичности живых тканей мозга. По сравнению с традиционной электрофизиологией, флуоресцентная микроскопия может фиксировать нейронную активность, а также морфологию клеток, что позволяет проводить долгосрочные записи идентифицированных популяций нейронов с одноклеточным или субклеточным разрешением. Тем не менее, визуализация с высоким разрешением, как правило, требует стабильной установки с фиксированной головой, которая ограничивает движения животного, а подготовка плоской поверхности из прозрачного стекла позволяет визуализировать нейроны в одной или нескольких горизонтальных плоскостях, но ограничена в изучении вертикальных процессов, протекающих на разных глубинах. Здесь мы опишем процедуру, сочетающую фиксацию головной пластины и микропризму, которая дает многослойную и мультимодальную визуализацию. Этот хирургический препарат не только дает доступ ко всему столбу зрительной коры головного мозга мыши, но и позволяет получать двухфотонную визуализацию в фиксированном положении головы и однофотонную визуализацию в свободно движущейся парадигме. Используя этот подход, можно отбирать идентифицированные популяции клеток в различных слоях коры, регистрировать их реакцию в свободно движущихся состояниях и отслеживать долгосрочные изменения в течение нескольких месяцев. Таким образом, этот метод обеспечивает всесторонний анализ микросхем, позволяя напрямую сравнивать нейронную активность, вызванную хорошо контролируемыми стимулами, и в рамках естественной поведенческой парадигмы.
Введение
Появление in vivo двухфотонной флуоресцентной визуализации 1,2, сочетающей в себе новые технологии оптических систем и генетически модифицированных индикаторов флуоресценции, стало мощным методом в нейробиологии для исследования сложной структуры, функций и пластичности живого мозга 3,4. В частности, этот метод визуализации дает беспрецедентное преимущество перед традиционной электрофизиологией, фиксируя как морфологию, так и динамическую активность нейронов, тем самым облегчая долгосрочное отслеживание идентифицированных нейронов 5,6,7,8.
Несмотря на свои замечательные сильные стороны, применение флуоресцентной визуализации с высоким разрешением часто требует статической установки с фиксированной головой, которая ограничивает подвижность животного 9,10,11. Кроме того, использование прозрачной стеклянной поверхности для визуализации нейронов ограничивает наблюдения одной или несколькими горизонтальными плоскостями, ограничивая изучение динамики вертикальных процессов, которые распространяются на различные глубины коры12.
Устраняя эти ограничения, в настоящем исследовании описывается инновационная хирургическая процедура, которая объединяет фиксацию головной пластины, микропризму и минископ для создания метода визуализации с многослойными и мультимодальными возможностями. Микропризма позволяет наблюдать вертикальную обработку вдоль кортикального столба 13,14,15,16, что имеет решающее значение для понимания того, как информация обрабатывается и трансформируется при прохождении через различные слои коры головного мозга и как вертикальная обработка изменяется при пластических изменениях. Более того, он позволяет визуализировать одни и те же нейронные популяции в парадигме с фиксированной головой и в свободно движущейся среде, охватывающей универсальные экспериментальные условия 17,18,19: например, фиксация головы часто требуется для хорошо контролируемых парадигм, таких как оценка сенсорного восприятия и стабильные записи в парадигме 2-фотонов, в то время как свободно движущаяся среда обеспечивает более естественную, гибкую среду для поведенческих исследований. Таким образом, возможность проведения прямого сравнения в обоих режимах имеет решающее значение для дальнейшего понимания микросхем, обеспечивающих гибкие, функциональные отклики.
По сути, интеграция фиксации головной пластины, микропризмы и минископа в флуоресцентную визуализацию предлагает многообещающую платформу для исследования тонкостей структуры и функциональности мозга. Исследователи могут отбирать образцы идентифицированных клеточных популяций на различной глубине, охватывающей все корковые слои, напрямую сравнивать их реакцию как в хорошо контролируемой, так и в естественной парадигме, и отслеживать их долгосрочные изменения в течение20 месяцев. Этот подход дает ценную информацию о том, как эти нейронные популяции взаимодействуют и изменяются с течением времени в различных экспериментальных условиях, открывая окно в динамическую природу нейронных цепей.
протокол
Все эксперименты проводились в соответствии с Законом Великобритании о животных (научные процедуры) 1986 года на основании персональных и проектных лицензий, одобренных и выданных Министерством внутренних дел Великобритании после соответствующей этической экспертизы. Взрослые трансгенные линии CaMKII-TTA; GCaMP6S-TRE21 были выведены, а их потомство использовано в эксперименте. Для безопасности экспериментаторов и поддержания стерильных условий все процедуры проводились в асептических условиях и с использованием полных средств индивидуальной защиты.
1. Предоперационная подготовка
- Для минимизации отека вводят дексаметазон (0,2 мг/кг) подкожно за 12-24 ч до операции.
- Перед операцией стерилизовать все хирургические инструменты в автоклаве и стерилизовать операционную область стабилизированной хлорноватистой кислотой с дистиллированной водой и 70% этанолом. Убедитесь, что все хирургическое оборудование включено.
- Обезболивайте животное (24 недели, самец весом 31 г) изофлураном с индукционной дозой 5%, которая снижается до 1%-2% после того, как мышь находится на стереотаксической рамке, при этомO2 удерживается в пределах 1-2 л/мин. Вводят НПВС (карпрофен, 2,5 мг/кг) подкожно.
- Проверьте отсутствие пальцевого рефлекса, чтобы оценить глубину анестезии (увеличьте концентрацию изофлурана с шагом 0,5%, если наблюдается рефлекс).
- Побрейте голову животного с помощью триммера от ушей до немного выше глаз. Очистите это место спиртовой салфеткой и раствором повидон-йода, избегая попадания в глаза животного.
- Установите животное на гомеотермическую грелку и стереотаксическую раму, оснащенную ушными и зубными стержнями, и закрепите голову. Убедитесь, что головка устойчива, так как это имеет решающее значение для успешной следующей процедуры (Рисунок 1).
- Нанесите офтальмологическую мазь на глаза животного, чтобы предотвратить их высыхание во время операции, и накройте их фольгой, чтобы защитить от света. Накройте животное стерильным хирургическим чехлом.

Рисунок 1: Предоперационная подготовка. Мышь помещается на стереотаксическую рамку, закрепленную носовой частью и ушными планками. Мышь помещается на грелку с регулируемой температурой. На глаза нанесена офтальмологическая мазь и покрыта алюминиевой фольгой. Голову бреют, череп обнажают. На животное надевают стерильный чехол. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Трепанация черепа
- Хирургическими ножницами надрежьте кожу вдоль средней линии выбритого участка головы, чтобы обнажить череп.
- Очистите череп с помощью стерильного ватного тампона и разбавленной перекиси водорода (3% массы 35%H2O2в 97% dH2O) в течение 1-3 с, чтобы удалить любую соединительную ткань (рисунок 2A). Высушите череп с помощью капли 70% этилового спирта и нового стерильного ватного тампона.
- Выровняйте череп спереди/сзади (AP) и медиально/латерально (ML), чтобы обеспечить точное место имплантации. Для этого измерьте дорсовентральную (DV) глубину черепа как на брегме, так и на лямбде и убедитесь, что разница между ними составляет <0,03 мм. Для медиолатерального выравнивания измерьте равноудаленные точки на обеих теменных костях от средней линии и снова убедитесь, что разница DV составляет <0,03 мм.
- Используя брегму в качестве источника, найдите и отметьте нужную область коры; здесь это монокулярная первичная зрительная кора (V1), AP: -3,5 мм, ML: -2,5 мм.
- Используйте трепанное сверло (диаметр 1,8 мм) и стоматологическую дрель (скорость вращения 10 000 об/мин), чтобы обнажить кортикальный слой, убедившись, что метка для нужной области коры (монокуляр V1) расположена в нижней трети окна сверла.
- Убедитесь, что угол сверла перпендикулярен кривизне черепа. Это обеспечит равномерную трепанацию черепа и предотвратит повреждение твердой мозговой оболочки или коры головного мозга.
- Сверлите до тех пор, пока сопротивление не уменьшится, а затем остановитесь (Рисунок 2B). Осторожно удалите отслоившийся фрагмент кости с помощью кончика иглы 23G (рис. 2C).
- Очистите открытую кору головного мозга хирургической пеной, пропитанной холодной искусственной спинномозговой жидкостью (ACSF), чтобы удалить любой мусор и остановить любое кровотечение, которое может возникнуть.
- Всегда поддерживайте гидратацию открытой коры головного мозга с помощью холодного ACSF на протяжении всей операции.
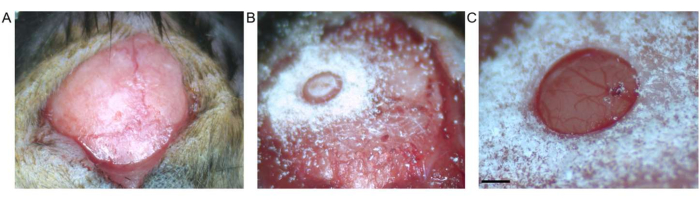
Рисунок 2: Трепанация черепа. (А) Показан разрез кожи между брегмой и лямбдой. С открытой поверхности удалена соединительная ткань. (B) Трепанация черепа трепаном перед удалением костного фрагмента. (C) Трепанация черепа после удаления костного фрагмента, демонстрирующего интактные твердую мозговую оболочку и кортикальный слой (масштабная линейка соответствует 0,5 мм). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Предварительно вырезанный разрез
ПРИМЕЧАНИЕ: Чтобы учитывать это при выполнении предварительного разреза, разрез и имплантация микропризмы должны быть расположены перед областью визуализации (ROI). Это необходимо для того, чтобы обеспечить полное и точное поле зрения. В рамках данного протокола разрез выполняется по медиолатеральной оси, а микропризма ориентирована лицом к задней (рис. 3Б).
- Чтобы облегчить введение и уменьшить давление в коре головного мозга во время введения микропризмы, сделайте разрез.
- Прикрепите хирургический нож к держателю стереотаксического рычага и сориентируйте лезвие или стереотаксический рычаг так, чтобы он резал вдоль оси ML.
- Переместите нож в нужную точку доступа (AP: -3,4 мм); призма должна находиться перед ROI, поэтому сделайте разрез на 100 мкм впереди координаты ROI AP визуализации (-3,5 мм).
- Теперь, перемещая нож к медиальному краю черепа, где он встречается с черепом, медленно опускайте нож, пока он не достигнет кости, а затем остановитесь. Поскольку толщина кости составляет 200 мкм, включите это значение в общую глубину введения (см. шаг 5.1 расчета).
- Оптимальная визуализация находится в центре призмы, т.е. 500 мкм; поэтому убедитесь, что эта глубина совпадает с глубиной кортикальной колонки (ROI DV: - 0,35 мм).
- Включив толщину черепа в расчет глубины, используйте приведенное ниже уравнение, которое определяет, насколько глубоким должен быть предварительно вырезанный разрез от поверхности черепа. Для данного протокола глубина имплантации рассчитывается как:
Толщина кости (200 мкм) + ROI визуализации (например, 350 мкм) + оставшаяся глубина микропризмы (500 мкм) = 1 050 мкм
- Включив толщину черепа в расчет глубины, используйте приведенное ниже уравнение, которое определяет, насколько глубоким должен быть предварительно вырезанный разрез от поверхности черепа. Для данного протокола глубина имплантации рассчитывается как:
- Убедитесь, что длина разреза более 1 мм, но не чрезмерная; поэтому идеальным является расстояние 1,2 мм, а монокулярная ML-координата находится в середине этого расстояния.
- Когда будете готовы к выполнению разреза, удалите излишки ACSF, чтобы не затуманивать зрение (рис. 3A).
- Переместите нож от медиального края трепанации черепа к начальной медиальной координате разреза. Медленно (10 мкм/с) опустите нож в кору.
- После того, как твердая мозговая оболочка проткнута и нож вошел в кортикальный слой, нанесите каплю холодного ACSF на кору, чтобы сохранить ткань смазанной и увлажненной во время разреза.
- Как только будет достигнута окончательная глубина, начните перемещать нож вдоль оси ML (со скоростью 10 мкм/с).
- Продолжайте наблюдать за окружающими тканями во время разреза. Если ткань волочится вместе с ножом, переместите нож вверх и вниз несколько раз, чтобы убедиться, что ткань разрезается, а затем продолжайте двигаться вбок, не забывая вернуть нож на окончательную глубину.
- Когда закончите, медленно поднимите нож. Если во время разреза появляется кровь, используйте это время, чтобы очистить место разреза хирургической пеной, пропитанной ACSF, чтобы разбавить кровь и вытолкнуть кровь из разреза. Не забудьте оставить свежую, насыщенную хирургическую пену на открытой коре головного мозга до тех пор, пока она не будет готова к введению микропризмы.

Рисунок 3: Имплантация микропризмы. (A) Предварительно вырезанный разрез. (B) Схема встроенной микропризменной линзы, демонстрирующая ее положение в коре головного мозга (C) Встроенная микропризменная линза в правильной ориентации для предварительного разреза перед введением в кору головного мозга (масштабная линейка соответствует 0,5 мм). (D) Пример скопления цемента вокруг встроенной линзы для ее крепления к черепу. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Введение микропризмы и имплантация головной пластины
- Микропризменная линза состоит из линзы градиентного индекса, прикрепленной к призме на дистальном конце линзы, которая интегрирована в опорную пластину. Прикрепите микропризму к набору имплантатов.
- Убедитесь, что сторона призмы противоположна винту опорной пластины. Чтобы облегчить введение и размещение микропризмы, прикрепите ее к стереотаксической рамке и сориентируйте призму так, чтобы она совпала с разрезом (рис. 3C).
- Медленно опустите микропризму в место разреза (10 мкм/с). Не забудьте удалить ACSF при первоначальном введении призмы, но как только вы попадете в кору, промойте холодной ACSF, чтобы смазать введение.
- Кора головного мозга должна оставаться стабильной, пока призма опущена в разрез; если нет, добавьте дополнительный ACSF и взбалтывайте кору, перемещая призму вверх и вниз, чтобы освободить кору от призмы.
- После того, как будет достигнута окончательная глубина, высушите открытую кортикальную поверхность стерильной салфеткой, стараясь не касаться призмы.
- Покройте открытую кортикальную область, окружающую призму, а также линзу, защитным слоем силиконового клея, сводя к минимуму избыток клея на окружающем черепе и манекенезе.
- После отверждения (5-10 минут) прикрепите головную пластину к черепу, чтобы стабилизировать голову во время визуализации с фиксацией головы.
- Убедитесь, что головка находится достаточно сзади, чтобы не мешать установке имплантата и обеспечить адекватное нанесение цемента для правильной фиксации имплантата.
- Убедитесь, что средняя линия головной пластины находится немного справа от имплантированной линзы, чтобы обеспечить закрепление обеих сторон головного стола на головном столике при выполнении экспериментов с фиксированной головкой
- Нанесите клейкий цемент на головную пластину и череп.
- Приготовьте адгезивный стоматологический цемент, смешав 1 мерную ложку непрозрачного цементного порошка с 4 каплями смесительной среды и нанеся одну каплю катализатора.
- Нанесите цемент на головную пластину и череп и удерживайте пластину на месте до отверждения, убедившись, что она параллельна ушным планкам (при визуальном осмотре осмотрите как сверху, так и сзади головы животного).
- Нанесите клейкий цемент, чтобы покрыть остальную часть обнаженного черепа и ткани, включая микропризму (до основания опорной пластины) и головную пластину.
- Не допускайте попадания цемента на опорную пластину, фиктивный микроскоп или какие-либо его компоненты. Продолжайте наносить клейкий цемент до тех пор, пока микропризма и оголовье не будут покрыты и не станут стабильными (Рисунок 3D).
- Когда цемент затвердеет, отсоедините фиктивный микроскоп, медленно перемещая стереотаксический рычаг вверх, стабилизируя микропризму щипцами (они соединены с помощью магнитов, поэтому во время разделения может ощущаться некоторое сопротивление).
- Вставьте защитную крышку на объектив и затяните винт, чтобы зафиксировать его на месте.
- Извлеките животное из стереотаксической рамы, дайте ему восстановиться в теплом боксе для восстановления и введите подкожно подогретый стерильный 0,9% физиологический раствор (3% от массы тела).
- Как только животное проснется и начнет двигаться, поместите его обратно в чистую клетку. Наблюдайте за животным и вводите дополнительное послеоперационное обезболивание в соответствии с политикой местного учреждения в отношении обезболивания.
- Подождите 4 недели после операции, животное должно быть готово к визуализации.
5. Однофотонная кальциевая визуализация корковых слоев у свободно движущихся мышей
ПРИМЕЧАНИЕ: Важно каждый раз использовать изображения, полученные во время первоначального сеанса визуализации, чтобы обеспечить точное получение предполагаемой плоскости изображения. Эти идентифицированные ориентиры, наряду с нейронами, играют решающую роль в процессе выравнивания, подробно описанном на шаге 9 протокола. При получении однофотонных данных минископ является одновременно и системой визуализации, и лазерным источником. Для возбуждения используется светодиод с диапазоном мощности 0-2 мВт/мм2 на передней поверхности объектива. Лазер использует длину волны возбуждения 455 ± 8 нм (синий свет) для передачи сигналов GCaMP. Ползунок фокусировки объектива можно использовать для регулировки фокусировки (ось Z), которая отображается на интерфейсе как 0-1000, где 0 представляет рабочее расстояние 0 мкм, а 1000 — максимальное рабочее расстояние 300 мкм.
- Перед получением данных дайте животному акклиматизироваться в помещении и на открытой арене в течение 1 ч до сеанса записи.
- Перед визуализацией продезинфицируйте и очистите все соответствующими дезинфицирующими средствами (например, стабилизированной хлорноватистой кислотой с дистиллированной водой и 70% этиловым спиртом).
- Настройте блок сбора данных, подключив его к компьютеру и запустив программное обеспечение для сбора данных. Установите прямое соединение через кабель Ethernet, чтобы свести к минимуму пропущенные кадры; Однако режима беспроводного подключения может быть достаточно в зависимости от надежности беспроводного соединения.
- Прикрепите минископ к опорной пластине животного под легким загривком.
- Сначала снимите защитную крышку с опорной плиты, открутив установочный винт. Удерживайте чехол за отверстие щипцами. Затем прикрепите минископ к опорной пластине, где находится крышка.
- Перед установкой проверьте ориентацию минископа по отношению к опорной плите так, чтобы сторона с маркировкой винта была обращена к винту.
- После того, как минископ будет прикреплен, затяните установочный винт, чтобы стабилизировать его. Продвигайте установочный винт только до тех пор, пока не почувствуете некоторое сопротивление. Чрезмерная затяжка установочного винта может привести к повреждению минископа, поэтому ее следует избегать.
- Подключите минископ к блоку сбора данных и подготовьте программное обеспечение к записи.
- В программном обеспечении для сбора данных включите поток для минископа и отрегулируйте параметры записи (частоту кадров изображения, усиление, мощность светодиода, значение фокусировки) для получения четкого поля зрения (рис. 4A).
- Включите окно гистограммы и отрегулируйте усиление и мощность светодиода так, чтобы записанная интенсивность находилась в диапазоне от 35% до 70% .
- При проведении лонгитюдного исследования обратитесь к записям или снимкам, сделанным во время предыдущего сеанса, и отрегулируйте значение фокусировки таким образом, чтобы была четко видна та же плоскость изображения.
- Запустите эксперимент и сбор данных.
- После завершения эксперимента извлеките животное из поведенческого аппарата.
- Под легким загривком ослабьте установочный винт и снимите минископ с опорной пластины животного.
- Верните защитную крышку на опорную плиту и стабилизируйте ее установочным винтом.
- Верните животное в его домашнюю клетку (перейдите к шагу 7, если хотите обработать однофотонные данные).

Рисунок 4: Сбор и обработка данных с помощью программного обеспечения. (A) Изображение, показывающее поток в реальном времени с минископа. Рекомендуется отрегулировать значение фокусировки объектива таким образом, чтобы в окне потоковой передачи было видно четкое изображение, а также коэффициент усиления и мощность лазерного излучения (B) Схематический график, иллюстрирующий рекомендуемый рабочий процесс выравнивания для сеансов, записанных в разные моменты времени. Рекомендуется генерировать среднее изображение с первого сеанса, следуя инструкциям к программному обеспечению для обработки данных. Это изображение следует использовать в качестве эталонного изображения при коррекции движения для следующих сеансов. (C) Примеры четырех ячеек из одного и того же изображения ΔF/F с максимальной проекцией. Через каждую ячейку рисуется оранжевая линия для измерения ее диаметра в пикселях, среднее значение которой принимается в качестве входного аргумента для алгоритма идентификации ячеек (вверху слева: 13, вверху справа: 11, внизу слева: 12, внизу справа: 13). (D) Вывод алгоритма идентификации клеток после ручного курирования (изображение обрезано). Белые контуры обозначают идентифицированные ячейки (масштабная линейка соответствует 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Двухфотонная кальциевая визуализация корковых слоев у мышей с фиксированной головой
ПРИМЕЧАНИЕ: Для двухфотонной лазерной сканирующей микроскопии источником света является перестраиваемый сверхбыстрый лазер с длиной волны возбуждения 920 нм. Мощность возбуждения, измеренная на объективе, обычно составляла 100-150 мВт и регулировалась в каждом сеансе для достижения одинаковых уровней флуоресценции. Излучение света фильтровалось эмиссионным фильтром (525/70 нм) и измерялось независимой фотоумножительной трубкой (ФЭУ), называемой зеленым каналом. Изображения были получены с помощью объектива с 20-кратным погружением в воздух (NA = 0,45, рабочее расстояние 6,9-8,2 мм).
- Прежде чем собирать данные, приучите животное к аппарату за несколько дней до этого (чтобы животное привыкло к поведенческим настройкам). Дайте животному проводить 15-30 минут в день в течение 2-3 дней, изучая обстановку или до тех пор, пока оно не проявит натуралистическое поведение, прежде чем начинать сбор данных.
- Включите двухфотонную систему визуализации, запустите программное обеспечение для сбора данных и включите лазер. Прежде чем продолжить, убедитесь, что лазеры закрыты, а ФЭУ выключены.
- Очистите двухфотонную аппаратуру для визуализации стабилизированной хлорноватистой кислотой с дистиллированной водой и 70% этанолом.
- Обязательно отрегулируйте устройство в соответствии с размером животного. Аккуратно прикрепите мышь и ее накладку к головке и прикрутите ее на место, чтобы стабилизировать головку мыши.
- После установки снимите крышку объектива (см. шаг 5.4.1) и выровняйте объектив так, чтобы он находился над платной платой.
- Используйте элементы управления эпифлуоресценцией и стадией XYZ, чтобы сфокусировать кортикальную ткань.
- Как только кортикальные слои будут видны, переключите микроскоп, чтобы обеспечить двухфотонную визуализацию (замените зеркало на дихроичное зеркало, закройте флуоресцентный затвор и выключите эпифлуоресцентный лазер и монитор). Обязательно выключите основное освещение, чтобы защитить ФЭУ при съемке.
- Настройте параметры для оптимизации получаемых файлов изображений.
- Используйте режим резонансного сбора для визуализации кальция, так как он может улавливать быстрое срабатывание сигналов GCaMP.
- Отрегулируйте мощность лазера, усиление ФЭУ, масштабирование и таблицы поиска (LUT) для получения оптимального изображения и обратитесь к однофотонному изображению, чтобы убедиться, что изображение получено в правильной фокальной плоскости.
- Начните визуализацию корковых слоев с помощью двухфотонной системы с синхронизированным поведенческим мониторингом и вводом стимулов (если применимо).
- Обязательно сохраните эти параметры съемки и расстояния XYZ, если хотите воспроизвести идентичные изображения с течением времени.
- Чтобы получить z-стек кортикальных слоев, выполните шаги, описанные ниже.
- Найдите плоскость, с которой начинается z-стек, отрегулируйте параметры съемки для оптимизации изображения и отметьте ее в качестве отправной точки в программном обеспечении.
- Затем, используя элемент управления Z, двигайтесь вниз по стеку, регулируя мощность лазера только для поддержания постоянной яркости стека, и отметьте конец стека в программном обеспечении.
- Критический шаг: используя параметр «Относительный экспоненциальный градиент » на вкладке «Градиент мощности лазера », позвольте программному обеспечению рассчитать увеличение мощности лазера по мере его прохождения через z-стек. Обязательно отметьте значения мощности лазера конечной точки в таблице, предоставленной программным обеспечением, чтобы оно могло рассчитать градиент.
- После того, как параметры z-стека установлены, отрегулируйте размер шага (мкм).
ПРИМЕЧАНИЕ: Размер шага определяет затраченное время, количество срезов и качество детализации стека. Меньший размер шага приведет к более длительному времени сбора, увеличению количества срезов и лучшей детализации по сравнению с большим размером шага. Z-стеки используются для помощи в регистрации однофотонных и двухфотонных изображений, так как они выделяют любые анатомические ориентиры или особенности.
- Чтобы получить временной ряд (T-ряд) изменений кальция в нейронах, найдите оптимальную фокальную плоскость с помощью элементов управления каскадом XYZ и отрегулируйте мощность лазера, усиление ФЭУ, масштабирование и LUT.
- На вкладке Серия T в программном обеспечении для сбора данных определите параметры частоты сбора данных в соответствии с данными, полученными с помощью однофотонной системы визуализации.
ПРИМЕЧАНИЕ: Сопоставление частоты сделает данные 1P и 2P сопоставимыми, и это лучше подходит для алгоритма идентификации ячеек, используемого на этапах обработки данных. Несколько триггеров и других режимов сбора данных могут быть включены в захват данных серии T.
- На вкладке Серия T в программном обеспечении для сбора данных определите параметры частоты сбора данных в соответствии с данными, полученными с помощью однофотонной системы визуализации.
- Начало приобретения Т-серии.
7. Обработка однофотонных данных кальциевой визуализации
- Для однофотонной видеосъемки используйте программное обеспечение для обработки данных, входящее в комплект поставки системы минископа.
- Во-первых, выполните предварительную обработку фильма с помощью пространственной и временной дискретизации. Как правило, пространственное понижение дискретизации фильма в два раза значительно сокращает время обработки без серьезного ущерба для точности идентификации клеток.
- Установите временной коэффициент понижения дискретизации таким образом, чтобы частота кадров фильма была снижена примерно до 10 Гц, что больше подходит для алгоритма идентификации ячеек, используемого на следующих шагах.
- Если вы получаете несколько видеороликов в один и тот же день съемки, объедините их в один временной ряд перед этапом предварительной обработки, чтобы обработать их вместе.
- Необязательно: Примените к фильму пространственный полосовой фильтр, чтобы удалить нижние и более высокие пространственные частоты, что приведет к более плавному фильму с более высокой контрастностью.
- Зарегистрируйте фильм, используя функцию коррекции движения программного обеспечения. При этом регистрируется видеоролик и корректируются артефакты движения, вызванные перемещением минископа относительно поверхности изображения.
- Критический шаг: Если вы проводите лонгитюдное исследование, зарегистрируйте фильмы в одном и том же поле зрения, например, среднее изображение видео, сделанное в первый день съемки (рис. 4B).
- Вычислите ΔF/F фильма, используя соответствующую вкладку, и спроецируйте фильм для создания максимального проекционного изображения ΔF/F фильма. На этом изображении будут показаны области, которые отображают изменения уровней флуоресценции, потенциально отдельные нейроны, и могут быть использованы для измерения среднего диаметра нейронов (рис. 4C).
- В качестве альтернативы можно измерить диаметр клеток на видеоролике с коррекцией движения, где нейроны демонстрируют четкую флуоресценцию.
- Идентификация клеток с помощью алгоритмов в программном обеспечении.
- Несмотря на то, что на данном этапе доступны два варианта (PCA-ICA и CNMF-E), для этого исследования используйте CNMF-E. Введите средний диаметр ячейки в пикселях и запустите алгоритм для создания набора ячеек, содержащего области интереса (ROI), демонстрирующие действия, подобные ячейкам.
- Вручную выберите ROI, которые являются клетками (имеют клеточную морфологию и активность22,23 и лежат в пределах поля зрения) из тех, которые таковыми не являются, и проверьте курируемый набор клеток (рис. 4D).
- Экспортируйте кальциевые следы каждого ROI для дальнейшего анализа.
8. Обработка данных двухфотонной кальциевой визуализации
- Для двухфотонной записи видеороликов используйте пакет python, предназначенный для обработки данных двухфотонного анализа кальция.
- Во-первых, объедините изображения, сделанные в T-серии, в стек .tiff, как описано ниже.
- В интерфейсе «Параметры выполнения » настройте параметры, включая значение tau и частоту кадров, чтобы они соответствовали используемому GCaMP и частоте кадров записи.
- (Необязательно) Задайте для параметра do_registration значение 1, чтобы зарегистрировать фильм. Это эквивалентно шагу коррекции движения, описанному выше.
- Необязательно: Установите параметр anatomical_only равным 1, чтобы определить ROI по анатомическим особенностям в дополнение к динамике флуоресценции. Для этого необходимо ввести диаметр ячейки, поэтому выполняйте измерения с помощью программного обеспечения для обработки изображений. Как правило, это рекомендуется, так как это создает ROI с более естественными формами (рис. 5A-C).
- После того, как все параметры заданы, запустите алгоритм так, чтобы он выполнял все вычисления вместе. Обратитесь к графическому интерфейсу пользователя (GUI), чтобы проверить ход выполнения.
- Как только это будет сделано, вернитесь в интерфейс выбора ячеек для ручной проверки результатов идентификации ячейки.
- Сохраните изображение курируемой ячейки, установленной поверх максимальной проекции фильма. В дальнейшем он будет использован в качестве эталонного изображения для регистрации однофотонных данных записи.
- Затем алгоритм автоматически сохраняет результаты. npy, к которому можно получить доступ позже с помощью Python. Кроме того, можно сохранить результаты в других форматированных файлах для дальнейшего анализа в другом программном обеспечении.
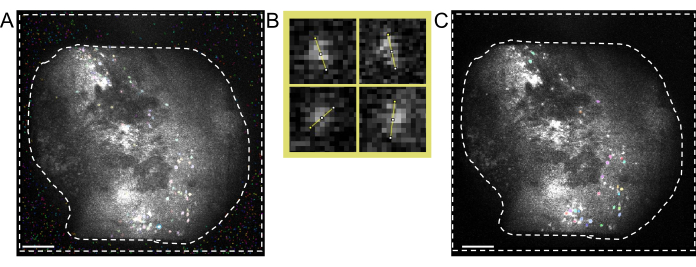
Рисунок 5: Идентификация клеток с помощью программного обеспечения для двухфотонной обработки. (A) Репрезентативное изображение идентификации клеток, полученное с помощью программного обеспечения для обработки двух фотонов. Если установить Anatomical_only параметр равным 0, но оставить все остальные параметры прежними, в области между пунктирными линиями будет присутствовать несколько не-ячеек, которые мешают ручному курированию фактических ячеек. (B) Примеры измерений диаметра ячеек, взятых из рисунка (A) с использованием программного обеспечения для обработки изображений (вверху слева; 7,5 пикселей, вверху справа; 9, внизу слева; 6,5, внизу справа; 7,5). (C) Репрезентативное изображение идентификации клеток. При установке Anatomical_only параметра в 1 и вводе среднего диаметра ячейки, взятого из (B), в алгоритм диаметра ячейки, в области между пунктирными линиями отсутствуют ячейки (масштабные линейки представляют 200 мкм). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
9. Регистрация идентифицированных наборов клеток по всем методам визуализации
- Выполняйте регистрацию клеток, идентифицированных по однофотонным и двухфотонным записям, с помощью алгоритма мультимодальной регистрации и анализа изображений (MIRA), который доступен через интерфейс Python программного обеспечения для однофотонной визуализации.
- Этот алгоритм выравнивает однофотонные и двухфотонные данные с помощью нежесткой регистрации. Ознакомьтесь с набором демонстрационных онлайн-блокнотов, найденных на веб-сайте и используемых для этого исследования.
ПРИМЕЧАНИЕ: Блокноты были написаны таким образом, чтобы вся обработка выполнялась в программном обеспечении 1P и, таким образом, несовместимы с программным обеспечением для обработки 2P. Следовательно, выполняйте только некоторые шаги, описанные в записных книжках для этого изучения.
- Этот алгоритм выравнивает однофотонные и двухфотонные данные с помощью нежесткой регистрации. Ознакомьтесь с набором демонстрационных онлайн-блокнотов, найденных на веб-сайте и используемых для этого исследования.
- Выполните шаги, описанные в демонстрационных записных книжках, которые включают в себя создание структурного изображения для каждой модальности визуализации. По умолчанию это включает в себя генерацию максимальной проекции двухфотонного z-стека и среднего изображения однофотонной записи. В качестве альтернативы можно использовать среднее изображение двухфотонной записи.
- При появлении запроса пространственная полоса пропускания фильтрует изображения, чтобы лучше визуализировать ориентиры и переориентировать их так, чтобы они совпадали.
- Выберите совпадающие ориентиры на двух изображениях (рис. 6A).
- Используйте их для вычисления деформации, необходимой для выравнивания двух изображений. Как правило, от 3 до 5 ориентиров должно быть достаточно.
- Алгоритм вычисляет деформацию на основе комбинации ориентиров и сходства изображений. Оптимизируйте относительный вес, придаваемый двум факторам, до тех пор, пока не будут достигнуты удовлетворительные результаты.
- Деформируйте карту ячеек, полученную в однофотонном сеансе, чтобы создать новую карту ячеек, выровненную по двухфотонным данным.
- Затем импортируйте эту деформированную карту ячеек в программное обеспечение для обработки 1P, чтобы сгенерировать изображение с максимальной проекцией изображения из двухфотонного фильма на заднем плане.
- Экспортируйте это изображение для регистрации.
- В программном обеспечении выровняйте два изображения, созданных на данный момент (двухфотонная карта ячейки поверх изображения с двухфотонной максимальной проекцией) и деформируйте карту однофотонной ячейки поверх изображения с двухфотонной максимальной проекцией (рис. 6B, C).
- Для этого в данном исследовании используется приложение для оценки регистрации, которое позволяет пользователю сравнивать результаты различных методов регистрации. Учитывая, что оба изображения имеют одинаковый фон, метода фазовой корреляции с жесткой регистрацией было достаточно.
- После завершения регистрации просканируйте зарегистрированное изображение на наличие перекрывающихся ROI. Это ROI, которые активны в обоих сеансах записи, которые могут быть использованы в дальнейшем анализе.
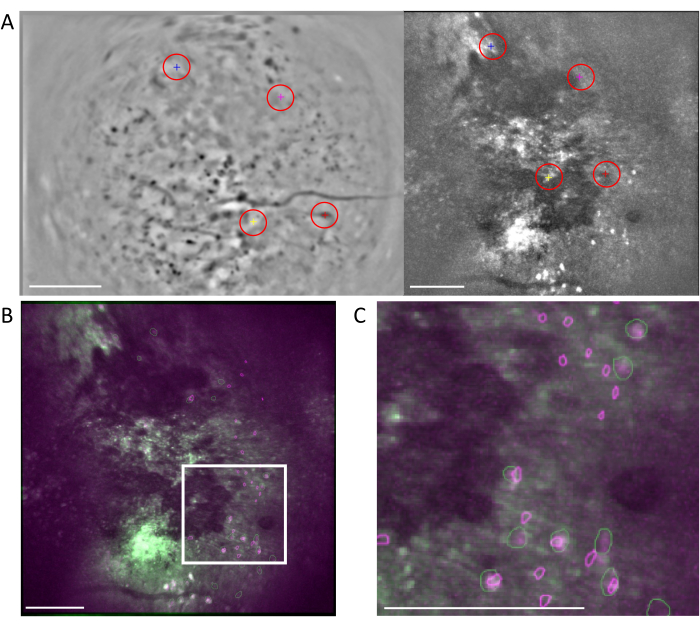
Рисунок 6: Кросс-модальная регистрация ячеек с использованием рабочего процесса MIRA. (A) Репрезентативное изображение рабочего процесса выравнивания ячеек. Слева показано среднее изображение из однофотонных данных, а справа — из двухфотонных данных. Совпадающие ориентиры с обоих изображений выбираются и помечаются в программном обеспечении случайной цветовой схемой (красные кружки). (B) Выровненные по примерам изображения, показывающие два идентифицированных набора ячеек, однофотонный (фиолетовый) и двухфотонный (зеленый), накладываются на среднее изображение двухфотонных данных. (C) Изображение области, отмеченной белым прямоугольником в (B), выровненные ячейки представлены здесь в виде перекрывающихся зеленых и фиолетовых контуров. На всех панелях масштабная линейка соответствует 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Показан метод проведения хронической многослойной in vivo кальциевой визуализации одной и той же популяции нейронов в течение нескольких недель с использованием как одно-, так и двухфотонной модальностей визуализации в свободно движущихся и фиксированных на голове условиях. Здесь ?...
Обсуждение
Здесь мы показали способность наблюдать и напрямую сравнивать нейроны в условиях фиксированной головы и свободно движущихся в одних и тех же нейронных популяциях. Несмотря на то, что мы продемонстрировали применение в зрительной коре, этот протокол может быть адаптирован к множеству ?...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов или конфликта интересов.
Благодарности
Мы благодарим г-жу Чару Редди и профессора Маттео Карандини (Cortex Lab) за их консультации по хирургическому протоколу и обмену трансгенной линией мышей. Мы благодарим д-ра Норберта Хогрефе (Inscopix) за его руководство и помощь в разработке операции. Мы благодарим г-жу Андреа Алдеа (Sun Lab) за помощь в организации хирургического вмешательства и обработке данных. Эта работа была поддержана благотворительной организацией Moorfields Eye Charity.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
Ссылки
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3 (2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472 (2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970 (2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579 (2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678 (2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728 (2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894 (2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены