A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد وتحليل السلف العضلي في الجسم الحي أثناء إصابة العضلات الهيكلية الحادة عن طريق قياس الكتلة الخلوية أحادية الخلية عالية الأبعاد
In This Article
Summary
يتيح البروتوكول المقدم هنا تحديد وتحليل الأبعاد العالية للخلايا الجذعية والسلفية العضلية عن طريق قياس الكتلة الخلوية أحادية الخلية وتنقيتها بواسطة FACS لإجراء دراسات متعمقة لوظيفتها. يمكن تطبيق هذا النهج لدراسة ديناميكيات التجديد في نماذج المرض واختبار فعالية التدخلات الدوائية.
Abstract
تجديد العضلات الهيكلية هو عملية ديناميكية تقودها الخلايا الجذعية العضلية البالغة وذريتها. غالبا ما تكون الخلايا الجذعية العضلية البالغة هادئة في حالة مستقرة ، ويتم تنشيطها عند إصابة العضلات. بعد التنشيط ، تتكاثر ، وتتمايز معظم ذريتها لتوليد خلايا عضلية ذات كفاءة اندماجية بينما يتجدد الباقي ذاتيا لتجديد تجمع الخلايا الجذعية. في حين تم تحديد هوية الخلايا الجذعية العضلية منذ أكثر من عقد من الزمان ، بناء على التعبير المشترك لعلامات سطح الخلية ، لم يتم تحديد السلف العضلي إلا مؤخرا باستخدام مناهج أحادية الخلية عالية الأبعاد. هنا ، نقدم طريقة قياس الكتلة الخلوية أحادية الخلية (قياس الخلايا حسب وقت الرحلة [CyTOF]) لتحليل الخلايا الجذعية والخلايا السلفية في إصابة العضلات الحادة لحل الديناميات الخلوية والجزيئية التي تتكشف أثناء تجديد العضلات. يعتمد هذا النهج على الكشف المتزامن عن علامات سطح الخلية الجديدة وعوامل النسخ العضلية الرئيسية التي يتيح تعبيرها الديناميكي تحديد الخلايا الجذعية المنشطة ومجموعات الخلايا السلفية التي تمثل معالم تكوين العضلات. الأهم من ذلك ، تم وصف استراتيجية فرز تعتمد على اكتشاف علامات سطح الخلية CD9 و CD104 ، مما يتيح العزل المحتمل للخلايا الجذعية العضلية والخلايا السلفية باستخدام فرز الخلايا المنشط بالفلورة (FACS) لإجراء دراسات متعمقة لوظيفتها. توفر الخلايا السلفية العضلية حلقة مفقودة مهمة لدراسة التحكم في مصير الخلايا الجذعية العضلية ، وتحديد الأهداف العلاجية الجديدة لأمراض العضلات ، وتطوير تطبيقات العلاج الخلوي للطب التجديدي. يمكن تطبيق النهج المقدم هنا لدراسة الخلايا الجذعية العضلية والخلايا السلفية في الجسم الحي استجابة للاضطرابات ، مثل التدخلات الدوائية التي تستهدف مسارات إشارات محددة. يمكن استخدامه أيضا للتحقيق في ديناميكيات الخلايا الجذعية العضلية والخلايا السلفية في النماذج الحيوانية لأمراض العضلات ، مما يعزز فهمنا لأمراض الخلايا الجذعية ويسرع تطوير العلاجات.
Introduction
تشكل العضلات الهيكلية أكبر نسيج من حيث الكتلة في الجسم وتنظم وظائف متعددة ، من البصر إلى التنفس ، ومن الموقف إلى الحركة ، وكذلك التمثيل الغذائي1. لذلك ، فإن الحفاظ على سلامة العضلات الهيكلية ووظيفتها أمر بالغ الأهمية للصحة. الأنسجة العضلية الهيكلية ، التي تتكون من حزم معبأة بإحكام من الألياف العضلية متعددة النوى محاطة بشبكة معقدة من الأعصاب والأوعية الدموية ، تظهر إمكانات تجديد ملحوظة 1,2.
الدوافع الرئيسية لتجديد العضلات الهيكلية هي الخلايا الجذعية للعضلات البالغة (MuSCs). تعرف أيضا باسم الخلايا الساتلية ، نظرا لموقعها التشريحي الفريد المجاور لغشاء البلازما للألياف العضلية وتحت الصفيحة القاعدية ، تم التعرف عليها لأول مرة في عام 19613. تعبر MuSCs عن علامة جزيئية فريدة ، عامل النسخ المقترن بالمربع 7 (Pax7) 4. غالبا ما تكون هادئة في البالغين الأصحاء ، ويتم تنشيطها عند إصابة العضلات وتتكاثر لتؤدي إلى ذرية من شأنها (i) التمايز إلى خلايا عضلية ذات كفاءة اندماجية ستشكل أليافا عضلية جديدة لإصلاح تلف العضلات أو (ii) التجديد الذاتي لتجديد تجمع الخلايا الجذعية5.
على المستوى الخلوي والجزيئي ، تكون عملية التجديد ديناميكية للغاية وتتضمن انتقالات حالة الخلية ، والتي تتميز بالتعبير المنسق لعوامل النسخ العضلية الرئيسية ، والمعروفة أيضا باسم العوامل التنظيمية العضلية (MRFs)6,7. أظهرت الدراسات التنموية السابقة في الجسم الحي ، وتجارب تتبع النسب ، وعمل زراعة الخلايا باستخدام الخلايا العضلية أن التعبير المتسلسل لعوامل النسخ هذه يدفع تكوين العضلات ، مع التعبير عن العامل العضلي 5 (Myf5) عند التنشيط ، والتمايز العضلي 1 (MyoD1) الذي يشير إلى الالتزام بالبرنامج العضلي ، وتعبير الميوجينين (MyoG) الذي يميز التمايز8،9،10،11 ،12،13،14. على الرغم من هذه المعرفة واكتشاف علامات سطح الخلية لتنقية MuSCs ، فإن الاستراتيجيات والأدوات لتحديد وعزل المجموعات المنفصلة على طول مسار التمايز العضلي وحل تطور العضلي في الجسم الحي كانت تفتقر إلى15،16،17،18.
هنا ، نقدم طريقة جديدة ، بناء على الأبحاث المنشورة مؤخرا ، والتي تمكن من تحديد الخلايا الجذعية والسلفية في العضلات الهيكلية وتحليل ديناميكياتها الخلوية والجزيئية والانتشار في سياق إصابة العضلات الحادة19. يعتمد هذا النهج على قياس الكتلة الخلوية أحادية الخلية (المعروف أيضا باسم قياس الخلايا حسب وقت الرحلة [CyTOF]) للكشف في وقت واحد عن علامات سطح الخلية الرئيسية (α7 integrin و CD9 و CD44 و CD98 و CD104) وعوامل النسخ العضلي داخل الخلايا (Pax7 و Myf5 و MyoD و MyoG) ونظير نيوكليوزيد (5-Iodo-2′-deoxyuridine ، IdU) ، لمراقبة الخلايا في المرحلة S19،20 ، 21,22,23. علاوة على ذلك ، يقدم البروتوكول استراتيجية تستند إلى الكشف عن علامتين لسطح الخلية ، CD9 و CD104 ، لتنقية مجموعات الخلايا هذه عن طريق فرز الخلايا المنشط بالفلور (FACS) ، وبالتالي تمكين الدراسات المتعمقة المستقبلية لوظيفتها في سياق الإصابات وأمراض العضلات. في حين تم استخدام الخلايا العضلية الأولية على نطاق واسع في الماضي لدراسة المراحل المتأخرة من التمايز العضلي في المختبر ، فمن غير المعروف ما إذا كانت تلخص الحالة الجزيئية للخلايا السلفية العضلية الموجودة في الجسم الحي24،25،26،27،28،29،30. إن إنتاج الخلايا العضلية شاق ويستغرق وقتا طويلا ، وتتغير الحالة الجزيئية لهذه الثقافة الأولية بسرعة عند اجتياز31. وبالتالي ، فإن السلف العضلي المعزول حديثا المنقى بهذه الطريقة سيوفر نظاما فسيولوجيا أكثر لدراسة تكوين العضلات وتأثير التلاعب الجيني أو الدوائي خارج الجسم الحي.
يمكن تطبيق البروتوكول المقدم هنا لمعالجة مجموعة متنوعة من الأسئلة البحثية ، على سبيل المثال ، لدراسة ديناميكيات المقصورة العضلية في الجسم الحي في النماذج الحيوانية لأمراض العضلات ، استجابة للتلاعبات الجينية الحادة أو عند التدخلات الدوائية ، وبالتالي تعميق فهمنا لخلل الخلايا الجذعية العضلية في سياقات بيولوجية مختلفة وتسهيل تطوير تدخلات علاجية جديدة.
Protocol
تمت الموافقة على الإجراءات الحيوانية من قبل مفتشية التجارب الحيوانية الدنماركية (البروتوكول # 2022-15-0201-01293) ، وتم إجراء التجارب وفقا للإرشادات المؤسسية لجامعة آرهوس. يتم توفير التسكين (البوبرينورفين) في مياه الشرب قبل 24 ساعة من الإصابة للفئران للتكيف مع الذوق. يستمر توفير البوبرينورفين في مياه الشرب لمدة 24 ساعة بعد الإصابة. جنبا إلى جنب مع حقن تحت الجلد (s.c.) من البوبرينورفين في وقت إصابة العضلات الحادة ، البوبرينورفين في مياه الشرب بعد حقن notexin سوف يخفف الألم المرتبط بالإصابة. في حين أنه يوصى بإعطاء حقن s.c. من البوبرينورفين في وقت إصابة العضلات الحادة ، تليها البوبرينورفين في مياه الشرب ، البوبرينورفين في مياه الشرب قبل الإصابة اختياري. ومع ذلك ، يجب على الباحثين اتباع معايير وإرشادات رعاية التي وضعتها الوكالة التنظيمية المناسبة.
ملاحظة: بالنسبة لتجارب قياس الكتلة الخلوية أحادية الخلية (CyTOF) لعضلات الأطراف الخلفية المصابة ، ابدأ في القسم 1: التسكين في الماء قبل 24 ساعة من إصابة العضلات حتى 24 ساعة بعد الإصابة. لفرز الخلايا الجذعية العضلية والخلايا السلفية من الفئران غير المصابة ، قم بإجراء القسمين 5 و 6: القتل الرحيم + تشريح العضلات الهيكلية وتفككها ، واستمر في القسم 11: تلطيخ الأجسام المضادة المترافقة بالفلوروفور ل FACS. يوضح الشكل 1 نظرة عامة على الإعداد التجريبي والبروتوكول.
1. تسكين في الماء قبل 24 ساعة من إصابة العضلات حتى 24 ساعة بعد الإصابة
- إلى زجاجة شرب داكنة أو مغلفة بورق الألمنيوم ، أضف 3 مل من البوبرينورفين (0.3 مجم / مل) واملأها إلى 100 مل بالماء المصفى للوصول إلى تركيز نهائي يبلغ 0.009 مجم / مل قبل 24 ساعة من الإصابة. نعلق على قفص الماوس.
- قم بإزالة زجاجة الشرب بعد 24 ساعة من الإصابة ، وأعد توصيل قفص الماوس بنظام صمام الشرب.
2. التحضير لإجراء الإصابة الحادة
ملاحظة: استخدم 70٪ إيثانول لتطهير طاولة العمل وإعداد مخروط الأنف وصندوق الحث.
- تحضير أنبوب 1.5 مل مع notexin المخفف في PBS (5 ميكروغرام / مل). تمييع البوبرينورفين (0.3 ملغ / مل) في محلول ملحي معقم 0.9٪ إلى 0.015 ملغ / مل في أنبوب 1.5 مل آمن للضوء. ابق على الجليد. تحضير محاقن الأنسولين للبوبرينورفين (28 جم ، 0.5 مل) وحقن notexin (29 جم ، 0.3 مل).
- تكوين وحدات التخدير القائمة على الأيزوفلوران:
- للتخدير في صندوق الحث ، استخدم 3٪ إيزوفلوران مع تدفق 1.5 لتر / دقيقة (50٪ O2 ، 50٪ هواء جوي).
- للصيانة باستخدام إعداد مخروط الأنف ، استخدم 1.5٪ إيزوفلوران بتدفق 0.6 لتر / دقيقة (50٪ O2 ، 50٪ هواء جوي).
3. إصابة حادة عن طريق حقن notexin
تنبيه: يحتوي Notexin على نشاط Phospholipase A2 وهو المكون الرئيسي للسم من ثعبان النمر الأسترالي (Notechis scutatus) ، مع LD50 في الوريد من 5-17 مجم notexin / kg في الفئران32،33. في البروتوكول الحالي ، يتم حقن عضلة الظنبوب الأمامية (TA) لكل طرف خلفي ب 10 ميكرولتر من 5 ملغ / مل نوتكسين ، ويتم حقن عضلة الساق (GA) لكل طرف خلفي مرتين (مرة واحدة في كل رأس من العضلات) مع 15 ميكرولتر من 5 ملغ / مل notexin. من المهم إجراء الحقن العضلي (i.m) بشكل صحيح للحد من الضرر وفحص المحقونة بشكل متكرر لضمان الحد الأدنى من الألم.
- تخدير الماوس في صندوق الحث (3 ٪ إيزوفلوران). عندما يكون الماوس فاقدا للوعي ، قم بخفض مستوى الأيزوفلوران إلى 1.5٪ في صندوق الحث.
- وزن الفئران ووضع علامة عليها بشكل فردي وفقا للإجراءات المؤسسية المعتمدة. تحت إعداد مخروط الأنف ، احلق الأطراف الخلفية باستخدام أداة تشذيب وانقلها مرة أخرى إلى صندوق الحث.
- حساب حجم البوبرينورفين لكل ماوس:
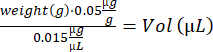
- امزج محلول notexin عن طريق السحب لأعلى ولأسفل. تحضير 2 حقنة أنسولين (29 جم ، 0.3 مل) محملة ب 10 ميكرولتر من محلول notexin (5 ميكروغرام / مل) لحقن TA ، و 4 محاقن أنسولين محملة ب 15 ميكرولتر من محلول notexin (5 ميكروغرام / مل) لحقن GA.
ملاحظة: تقع عضلة الظنبوب الأمامية (TA) على الجانب الأمامي من أسفل الساق من الفأر ، وتمتد من الركبة إلى الكاحل. عضلة الساق (GA) هي عضلة ذات رأسين تقع في الجزء الخلفي من أسفل الساق ، سطحية للنعل. يمتد من رأسيه (الإنسي والجانبي) فوق الركبة مباشرة إلى الكعب ، ويمتد عبر ما مجموعه ثلاثة مفاصل (الركبة والكاحل والمفاصل تحت الكاحل). - إجراء الحقن العضلي
- حقن TA (2 حقن في المجموع)
- ضع الماوس في وضع ضعيف أسفل إعداد مخروط الأنف وقم بتطهير موقع الحقن بمناديل كحولية معقمة (70٪ إيثانول أو إيزوبروبانول). أدخل الإبرة ، مائلة لأسفل ، في بطن TA (البعيد إلى منتصف البطن) بزاوية 30 درجة. تقدم الإبرة على طول العضلات ، والتحرك بالتوازي مع الساق ، للوصول إلى منتصف البطن من TA. حقن notexin ببطء وبشكل مستمر ، وترك الإبرة في مكانها لمدة 10 ثوان قبل سحبها. لا تقم بإدخال الإبرة عميقا جدا في البداية (لتجنب حقن notexin أسفل TA في العضلة الباسطة digitorum longus) ، وليس بعيدا جدا عند دفع الإبرة (لتجنب الحقن بالقرب من الركبة).
- حقن GA (4 حقن في المجموع)
- أدخل الإبرة ، مائلة لأسفل ، بزاوية ~ 45 درجة في منتصف بطن الرأس الجانبي ل GA. حقن notexin ببطء وبشكل مستمر ، وترك الإبرة في مكانها لمدة 10 ثوان قبل سحبها. قم بتدوير الطرف الخلفي وحقن notexin في الرأس الإنسي لعضلة GA على النحو الوارد أعلاه. يجب الحرص على عدم إدخال الإبرة بعمق.
- حقن TA (2 حقن في المجموع)
- اقلب الماوس وحقن البوبرينورفين باستخدام حقنة الأنسولين (28 جم ، 0.5 مل). انقل الماوس إلى قفص استرداد فارغ على لوحة تسخين. يجب وضع نصف قاع القفص فقط فوق لوحة التسخين للسماح للماوس بالتنظيم الحراري أثناء الاسترداد34. كرر الخطوات 3.3 إلى 3.6 للفئران المتبقية.
- عندما يكون الماوس في قفص الاسترداد مستيقظا تماما ، انقله مرة أخرى إلى القفص الأصلي. أعده إلى الإسطبل واستكمله بتشاو المبلل. قم بإزالة زجاجة شرب البوبرينورفين بعد 24 ساعة من الحقن.
- مراقبة الفئران لمدة 6 ساعات بعد حقن notexin ثم كل 12 ساعة لمدة يومين لعلامات الألم ، وضعف الحركة ، وانخفاض استهلاك الطعام35,36.
4. 5-Iodo-2'-حقن ديوكسي يوريدين
تنبيه: يشتبه في أن 5-Iodo-2'-deoxyuridine (IdU) يسبب عيوبا وراثية ويضر بالخصوبة أو الطفل الذي لم يولد بعد. اقرأ ورقة بيانات السلامة (SDS) قبل المناولة. يجب ارتداء معدات الحماية الشخصية أثناء المناولة. استخدم غطاء دخان عند وزن مسحوق IdU. يجب التخلص من المواد التي كانت على اتصال مع IdU وفقا للوائح السلامة المحلية.
ملاحظة: يتم استخدام وضع العلامات على IdU في الجسم الحي لمراقبة انقسام الخلايا أثناء دورة وقت الإصابة لأن IdU ، وهو نظير ثيميدين معالج باليود ، يتم دمجه في الحمض النووي للخلايا في المرحلة S. يتم حقن IdU داخل الصفاق (IP) عند 20 مجم / كجم من وزن الجسم قبل 8 ساعات من التضحية بالماوس.
- استخدم صوتينا عند 37 درجة مئوية لتحضير محلول مخزون 2 مجم / مل من IdU في برنامج تلفزيوني معقم. IdU حساس للضوء. يستخدم في نفس اليوم أو يجمد عند -20 درجة مئوية لمدة تصل إلى 3 أشهر. في حالة استخدام IdU المجمد: ذوبان الجليد ، الدوامة ، أجهزة الطرد المركزي عند 10000 × جم لمدة 30 ثانية ، واستخدام المادة الطافية للحقن أدناه.
- تخدير الماوس في صندوق الحث (3 ٪ إيزوفلوران). لاحظ التخصيص ، ووزن الفئران ، واحسب حجم محلول IdU:
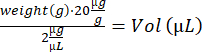
- إجراء حقن i.p. باستخدام حقنة الأنسولين (28 جم ، 0.5 مل) ونقل الماوس إلى قفص استرداد فارغ على لوحة تسخين. عند الاستيقاظ ، حرك الماوس مرة أخرى إلى قفصه الأصلي. كرر الخطوات 4.2-4.3 للفئران المتبقية وأعدها إلى الإسطبل.
5. القتل الرحيم
ملاحظة: انظر الجدول 1 للحصول على وصفات المخزن المؤقت. تحضير وسائط الغسيل (خليط المغذيات F-10 (Ham's) ، مصل الحصان 10٪ ، 1x Pen / Strep) والتصفية من خلال غشاء بولي إيثر سلفون (PES) في وعاء البوليسترين. قم بإعداد المخزن المؤقت للتفكك (وسائط الغسيل المكملة ب 650 وحدة / مل كولاجيناز ، النوع الثاني) واحتفظ بها على الثلج. قياسات قياس الكتلة الخلوية CyTOF حساسة للغاية للملوثات. لهذا السبب ، من الضروري استخدام الكواشف من أعلى درجة تحليلية لمعالجة العينات. لمنع التلوث المعدني ، يوصى بشدة باستخدام الأواني البلاستيكية المعقمة والأواني الزجاجية الجديدة التي لم يتم غسلها مطلقا بالمنظفات لأن العديد من الصابون المختبري يحتوي على مستويات عالية من الباريوم. يوصى باستخدام الماء المزدوج التصفية والمقطر ومنزوع الأيونات لإعداد الكاشف. يتم تحضير محلول ملحي مخزن بالفوسفات (PBS) في المنزل. قم بتخفيف مخزون 10x إلى 1x وقم بتصفية 1x PBS باستخدام مرشحات 0.2 ميكرومتر. قم بتصفية 1x PBS مرة أخرى في بداية كل تجربة. يجب عدم تنظيف أدوات التشريح بالمنظفات بسبب وجود الباريوم.
- قم بإعداد ميزان الوزن والحاوية ووحدة التخدير القائمة على الأيزوفلوران باستخدام صندوق الحث. تطهير أدوات التشريح المناسبة.
- قم بإعداد ووضع علامة على أنابيب 50 مل لكل ماوس مع 5 مل من المخزن المؤقت للتفكك وطبق بتري. الحفاظ على العازلة التفكك على الجليد.
- تخدير الماوس في صندوق الحث (3 ٪ إيزوفلوران ، وزيادة إلى 5 ٪ عندما فاقد الوعي) وإجراء خلع عنق الرحم.
6. تشريح العضلات الهيكلية وتفككها
- تشريح عضلات TA و GA من كلا الطرفين الخلفيين ونقلها إلى غطاء طبق بتري. استخدم المقص لقطع الأنسجة إلى ملاط مفروم (~ 1 مم3 قطع). نقل إلى أنبوب 50 مل يحتوي على 5 مل من مخزن تفكك الجليد البارد. ابق على الجليد.
- كرر إجراء القتل الرحيم (الخطوة 5.3) وتشريح العضلات الهيكلية وإجراء التفكك (الخطوة 6.1) حتى تتم معالجة جميع الفئران.
- قم بتسخين جميع أنابيب العينات مسبقا في حمام مائي بدرجة حرارة 37 درجة مئوية (2 دقيقة) ، واحتضانها لمدة 45 دقيقة عند الدوران في حاضنة (37 درجة مئوية).
- دوامة وغسل بإضافة 10 مل من وسائط الغسيل. أجهزة الطرد المركزي (380 × جم ، 10 دقائق ، درجة حرارة الغرفة [RT]) ، ونضح إلى 4 مل.
- أضف 0.5 مل من كولاجيناز (1000 وحدة / مل) و 0.5 مل من ديسباز (11 وحدة / مل). دوامة واحتضان لمدة 20 دقيقة على دوران عند 37 درجة مئوية (على سبيل المثال ، في حاضنة). أجهزة الطرد المركزي (380 × ز ، 1 دقيقة ، RT) وإعادة التعليق مع ماصة 5 مل.
- أضف مصافي خلايا 40 ميكرومتر إلى أنابيب سعة 50 مل ورطبها مسبقا ب 5 مل من وسائط الغسيل. نضح وإخراج تعليق الخلية 10 مرات باستخدام حقنة 5 مل بإبرة 20 جرام. سلالة من خلال مصفاة خلية 40 ميكرومتر مبللة مسبقا. اغسل الأنبوب سعة 50 مل بوسائط غسيل سعة 10 مل ، وانقله إلى مصفاة الخلايا 40 ميكرومتر ، وأجهزة الطرد المركزي (380 × جم ، 10 دقائق ، 4 درجات مئوية) تعليق الخلية.
7. تلطيخ حي / ميت مع تثبيت سيسبلاتين وبارافورمالدهايد
تنبيه: سيسبلاتين وبارافورمالدهيد (PFA) مسرطنة. اقرأ SDS قبل التعامل معها. بارافورمالدهيد (PFA ؛ 16٪) هو مهيج للجلد والعين والجهاز التنفسي. ارتداء معدات الحماية الشخصية والتعامل مع هذه المواد تحت غطاء الدخان. أثناء تثبيت الخلايا ، سيكون التركيز النهائي ل PFA 1.6٪. يجب اتخاذ تدابير الحماية الصحيحة ، ويجب التعامل مع النفايات وفقا للوائح المحلية.
ملاحظة: حضري DMEM البارد (4 درجات مئوية) والدافئ (37 درجة مئوية) الخالي من المصل. قم بإعداد DMEM المكمل ب 10٪ FBS ، وقم بالتصفية من خلال غشاء PES في وعاء البوليسترين ، واحتفظ به على الجليد. إعداد PBS ووسائط تلطيخ الخلايا (CSM; PBS ، 0.5٪ BSA ، 0.02٪ أزيد الصوديوم) في زجاجة زجاجية مخصصة ل CyTOF ومرشح من خلال غشاء PES. يمكن تخزين CSM في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- نضح المادة الطافية ، ونفض الحبيبات ، وأعد تعليقها في 1 مل من DMEM الخالي من المصل البارد. عد الخلايا واضبط كثافة الخلية على 1 × 106 خلايا / مل في DMEM الخالي من المصل.
- أضف مخزون سيسبلاتين (25 مللي مول) إلى تركيز نهائي قدره 25 ميكرومتر. دوامة 10 ثانية واحتضانها لمدة دقيقة واحدة بالضبط (التفاعل حساس للغاية للوقت). قم بإخماد التفاعل باستخدام DMEM + 10٪ FBS المثلج البارد (3 أضعاف حجم العينة) واحتفظ به على الجليد. أجهزة الطرد المركزي (380 × جم ، 10 دقائق ، 4 درجات مئوية) ، تستنشق المادة الطافية وتعيد تعليق الحبيبات جيدا (حتى 10 × 106 خلايا / مل في CSM). قم بتصفية التعليق من خلال مصفاة خلية 35 ميكرومتر.
- قم بإصلاح تعليق الخلية بمحلول مخزون PFA المصفى (16٪) والماصة لأعلى ولأسفل (أداء تحت غطاء الدخان) للوصول إلى تركيز PFA النهائي (1.6٪) (على سبيل المثال ، أضف 100 ميكرولتر من 16٪ PFA إلى 900 ميكرولتر من تعليق الخلية). دوامة لمدة 30 ثانية ، احتضان لمدة 10 دقائق على الجليد ، وغسل مرتين مع 2 مل من CSM عن طريق الطرد المركزي (800 × غرام ، 5 دقائق ، RT).
ملاحظة: في هذه المرحلة ، يمكن تجميد العينات على الثلج الجاف وتخزينها عند -80 درجة مئوية أو استخدامها مباشرة لتلطيخ الأجسام المضادة. إذا تم تجميد الخلايا ، فقم بنقل الخلايا إلى أنابيب البولي بروبلين سعة 5 مل ، حيث يمكن أن يتشقق البوليسترين في درجات حرارة منخفضة. إذا تم استخدام خلايا ثابتة حديثا للتلطيخ ، فانتقل إلى الخطوة 8.2.
8. تلطيخ مع الأجسام المضادة المترافقة المعدنية
تنبيه: الميثانول (MeOH) شديد الاشتعال وتآكل الجهاز التنفسي. اقرأ SDS قبل التعامل معها. ارتداء معدات الحماية الشخصية والتعامل مع هذه المادة تحت غطاء الدخان. التعامل مع النفايات وفقا للوائح المحلية.
ملاحظة: يمكن العثور على قائمة الأجسام المضادة (Ab) التي تستهدف علامات السطح والعلامات داخل الخلايا في الجدول 2.
اقتران الأجسام المضادة: تم اقتران معظم الأجسام المضادة المستخدمة في هذا البروتوكول داخليا لأنها لم تكن متوفرة تجاريا. تم نشر بروتوكولات اقتران المعادن للأجسام المضادة سابقا ، وأصبحت مجموعات الاقتران متاحة الآن تجاريا37,38. الغلوبولين المناعي من النوع G (IgG) متوافق مع بروتوكولات الاقتران المتاحة. من الأهمية بمكان أن تكون تركيبة الأجسام المضادة المستخدمة في اقتران المعادن خالية من البروتينات الحاملة المحتوية على السيستين (على سبيل المثال ، ألبومين مصل الأبقار (BSA)) ، والتي يمكن أن تؤثر على كفاءة الاقتران من خلال التنافس على مجموعات ماليميد الحرة من البوليمر ، ويمكن أن تتداخل مع القياس الكمي للجسم المضاد المترافق بالمعادن. محتوى السيستين من الجيلاتين أقل بكثير من محتوى BSA. ومع ذلك ، فمن المستحسن أنه إذا كانت تركيبة الأجسام المضادة تحتوي على بروتينات حاملة ، تتم إزالة هذه البروتينات قبل الاقتران. أصبح من الممكن الآن طلب الأجسام المضادة الخالية من BSA والجيلاتين من الشركة المصنعة. المواد الحافظة للجزيئات الصغيرة (مثل أزيد الصوديوم والجلسرين والتريتهالوز) متوافقة مع بروتوكولات اقتران المعادن37,38.
معايرة الأجسام المضادة: بعد كل اقتران معدني ، يجب معايرة الأجسام المضادة لتحديد تركيز الجسم المضاد الأمثل الذي يوفر أقصى نسبة إشارة إلى ضوضاء. لمعايرة الأجسام المضادة ، قم بإجراء تخفيف تسلسلي من 6 خطوات من شقين وصبغ كلتا العينتين المعروفتين بالتعبير (على سبيل المثال ، خلايا العضلات ، الضوابط الإيجابية) ونقص (الضوابط السلبية) البروتين محل الاهتمام19،21،37،38.
قم بإعداد حل عمل Cell-ID Intercalator-Ir جديد (المخزون = 500 ميكرومتر ؛ حل intercalator-ir) عن طريق تخفيف المخزون إلى 0.1 ميكرومتر في PBS / 1.6٪ PFA.
- إذابة العينات المجمدة لمدة 5 دقائق في RT وأجهزة الطرد المركزي (800 × جم ، 1 دقيقة ، RT). يغسل مع 2 مل من CSM عن طريق الطرد المركزي (800 × غرام ، 5 دقائق ، RT).
- قم بإعداد مزيج تلطيخ الأجسام المضادة السطحية (Ab) 2.5x في CSM. نضح المادة الطافية إلى ~ 60 ميكرولتر وأعد تعليق الحبيبات جيدا. تلطيخ الخلايا عن طريق إضافة 40 ميكرولتر من مزيج تلطيخ Ab السطحي واحتضانه لمدة 1 ساعة في RT.
- نفض الغبار العينات كل 20 دقيقة لخلطها. اغسل مرتين باستخدام 1 مل من CSM عن طريق الطرد المركزي (800 × جم ، 5 دقائق ، RT). نضح الطافع ونفض الغبار بيليه.
ملاحظة: إذا لم تكن هناك حاجة إلى تلطيخ داخل الخلايا ، فلن تكون هناك حاجة إلى نفاذية الميثانول. ومع ذلك ، إذا تم إجراء تلطيخ السطح فقط ، فيجب تخفيف محلول intercalator-ir في مخزن مؤقت يحتوي على عامل نفاذية (على سبيل المثال ، Maxpar fix و perm buffer) لاختراق الغشاء النووي. انتقل إلى الخطوة 8.5 وقم بتخفيف Cell-ID Intercalator-Ir في مخزن مؤقت يحتوي على عامل نفاذية و 1.6٪ PFA. خلاف ذلك ، استمر في تلطيخ الخلايا أدناه.
تنبيه: الإيريديوم خطير ، ويجب اتخاذ الاحتياطات اللازمة للتعامل الآمن. الإيريديوم قابل للاشتعال وهو مهيج للعينين / الجلد. تجنب تكوين الغبار أو الأبخرة واستنشاقها. تجنب ملامسة الجلد والعينين. ومع ذلك ، يتم توفير خليط محلول intercalator-ir بتركيز <1٪ في الماء ، والذي يعتبر غير خطير وفقا للنظام المنسق عالميا (GHS) لتصنيف المواد الكيميائية ووضع العلامات عليها. اقرأ SDS من الأدوات الحيوية القياسية قبل المناولة. يجب ارتداء معدات الحماية الشخصية أثناء المناولة. يجب التخلص من المواد التي كانت على اتصال بمحلول intercalator-ir وفقا للوائح السلامة المحلية. - لتخلل الخلايا ، أضف 0.5 مل من MeOH المثلج البارد بالتنقيط أثناء الدوامة. احتضان لمدة 15 دقيقة على الجليد تحت غطاء الدخان. أجهزة الطرد المركزي (800 × جم ، 5 دقائق ، RT) ثم تغسل مرتين باستخدام 1 مل من CSM عن طريق الطرد المركزي (800 × جم ، 5 دقائق ، RT). بعد الغسيل الأخير ، نضح المادة الطافية إلى ~ 60 ميكرولتر وأعد تعليق الحبيبات جيدا.
- تحضير 2.5x مزيج تلطيخ Ab داخل الخلايا في CSM. تلطيخ الخلايا عن طريق إضافة 40 ميكرولتر من مزيج تلطيخ Ab داخل الخلايا والحضانة لمدة 1 ساعة في RT. نفض الغبار العينات كل 20 دقيقة لخلط.
- اغسل مرتين باستخدام 1 مل من CSM عن طريق الطرد المركزي (800 × جم ، 5 دقائق ، RT). نضح الطافع ونفض الغبار بيليه. أعد تعليق العينات في 0.5 مل من محلول الإيريديوم المقحم (الجدول 1) والدوامة. احتضان العينات لمدة 1 ساعة في RT أو بين عشية وضحاها (O / N) عند 4 درجات مئوية (انظر الملاحظة أدناه).
ملاحظة: يمكن تخزين العينات في محلول الإيريديوم عند 4 درجات مئوية لمدة تصل إلى 48 ساعة. تم تطوير بروتوكول التلوين المستخدم في هذه الدراسة بناء على العمل الرائد الذي قام به مختبر نولان {C}23. وهو يختلف عن بروتوكولات Biotools القياسية ، حيث (i) يتم استخدام المخازن المؤقتة المعدة داخليا للغسيل والتلوين ، (ii) يتم تثبيت الخلايا قبل تلطيخ السطح ، و (iii) تتخلل الخلايا بالميثانول للتلطيخ داخل الخلايا بالأجسام المضادة لعوامل النسخ أو جزيئات الإشارة. يجب على الباحثين الذين يطورون بروتوكولا جديدا أن يختبروا بدقة توافق لوحة الأجسام المضادة الخاصة بهم مع الميثانول كعامل نفاذية. عند إضافة أجسام مضادة جديدة إلى لوحة ، يوصى باختبار خصوصية الأجسام المضادة عن طريق قياس التدفق الخلوي باستخدام عينات التحكم الإيجابية والسلبية قبل اقتران المعادن ومعايرتها.
9. إعداد عينة للتحميل في مقياس الخلايا الشامل
ملاحظة: الكريات الخلوية فضفاضة جدا عندما تكون في المخزن المؤقت CAS (جدول المواد). أثناء الغسيل باستخدام المخزن المؤقت CAS ، لا تنضح حتى الجفاف. بدلا من ذلك ، احتفظ بوحدة تخزين متبقية كما هو موضح أدناه.
- دوامة وأجهزة الطرد المركزي (800 × ز ، 10 دقائق ، RT) العينات. اسكب المادة الطافية (التعامل مع نفايات PFA) والدوامة.
- يغسل مع 1 مل من CSM عن طريق الطرد المركزي (800 × غرام ، 10 دقائق ، RT). نضح الطافع ونفض الغبار بيليه.
- يغسل مع 1 مل من العازلة CAS عن طريق الطرد المركزي (800 × غرام ، 10 دقائق ، RT). نضح إلى ~ 200 ميكرولتر. دوامة وإضافة 1 مل من المخزن المؤقت CAS. أخرج 5 ميكرولتر من القسمة لعدد الخلايا. أجهزة الطرد المركزي (800 × جم ، 10 دقائق ، RT) ونضح بعناية إلى ≤50 ميكرولتر. لا تزعج بيليه.
- أعد تعليق الحبيبات إلى 1-2 × 106 خلايا / مل في المخزن المؤقت CAS وأضف حبات المعايرة (1x ؛ جدول المواد) إلى تركيز نهائي قدره 0.1x (على سبيل المثال ، أضف 100 ميكرولتر من حبات معايرة 1x إلى 900 ميكرولتر من تعليق الخلية).
- قم بتحميل العينة في مقياس الكتلة الخلوي وجمع البيانات باستخدام معدل تدفق 400-500 خلية / ثانية.
- إجراء تطبيع البيانات من ملفات FCS باستخدام برنامج CyTOF أو أدوات التطبيع المطورة مسبقا39.
ملاحظة: تشغيل أجهزة قياس الكتلة الخلوية CyTOF خاص بالأداة40,41. يوصى بالرجوع إلى دليل مستخدم CyTOF قبل التشغيل. حبات المعايرة عبارة عن معايير حبة تطبيع البوليسترين المضمنة في المعدن والتي تحتوي على تركيزات معروفة من نظائر المعادن السيريوم (140/142Ce) واليوروبيوم (151/153Eu) والهولميوم (165Ho) واللوتيتيوم (175/176Lu). تسمح حبات المعايرة بالتحكم في حساسية الماكينة ، والتي يمكن أن تختلف بمرور الوقت ، ويرجع ذلك أساسا إلى تراكم المواد البيولوجية والاختلافات في تأين البلازما بمرور الوقت.
10. تحليل بيانات CyTOF
ملاحظة: لتحليل المصب، يمكن تحليل ملفات FCS التي تمت تسويتها محليا أو تحميلها إلى حلول البرامج المستندة إلى مجموعة النظراء مثل Cytobank أو Cell Engine أو OMIQ أو FCS Express42.
- قم بتسلسل ملفات FCS الفردية لكل عينة في ملف واحد، إذا لزم الأمر.
- حدد الخلايا المفردة عن طريق البوابات على الأحداث الإيجابية لإقحام إيريديوم ، مما يتيح التمييز بين الخلايا ذات النواة المفردة من الحطام أو الزوجي.
- بوابة للخلايا الحية عن طريق اختيار الأحداث السلبية سيسبلاتين. يرتبط سيسبلاتين تساهميا بالبروتينات الخلوية ويصف الخلايا الميتة والميتة بأغشية معرضة للخطر إلى حد أكبر من الخلايا الحية43.
- بوابة على السكان محل الاهتمام ، على سبيل المثال ، المقصورة العضلية (Live / CD45- / CD31- / SCA1- / α7integrin + / CD9 +) (الشكل 2A) وتحديد النسبة النسبية للخلايا الجذعية والسلفية. يتطلب هذا النهج معرفة مسبقة بسطح الخلية أو تعبير العلامة داخل الخلايا لتحديد المجموعات الفردية.
- لإجراء تحليل عالي الأبعاد من شأنه أن يمكن من تحديد مجموعات فرعية من الخلايا النادرة لم يتم التعرف عليها سابقا داخل مجموعة معقدة ، وتصدير السكان محل الاهتمام ، واستخدام خوارزميات التجميع التي تم تطويرها خصيصا لتحليل بيانات CyTOF44.
ملاحظة: استخدم العمل السابق خوارزمية X-shift ، والتي تستخدم تقدير كثافة الجار الأقرب k المرجح (kNN-DE) في الفضاء عالي الأبعاد لإجراء تجميع غير خاضع للإشراف بناء على المعلمات المحددة19. لقد ثبت أن X-shift فعال للغاية في تحديد مجموعات الخلاياالنادرة 45. - لتحليل X-shift ، قم بتنزيل حزمة برامج الدوامة (من صفحة GitHub لمختبر Nolan [https://github.com/nolanlab/vortex]) و Java 64 بت46. يمكن العثور على التعليمات هنا: https://github.com/nolanlab/vortex/wiki/Getting-Started.
- قم بتحميل مجموعات الخلايا المصدرة إلى قاعدة بيانات محلية وحدد معلمات التجميع. من بين المعلمات المعرفة من قبل المستخدم (i) العلامات المستخدمة للتجميع ، (ii) نطاق قيم k (على سبيل المثال ، من 5 إلى 150) ، و (iii) عدد خطوات التجميع.
ملاحظة: استخدم العمل السابق ، كعلامات عنقودية ، مزيجا من العلامات السطحية المعروفة بالتعبير عنها في الخلايا الجذعية العضلية ، وعلامات سطحية جديدة تم تحديدها في شاشة قياس التدفق الخلوي عالية الإنتاجية لخلايا العضلات والخلايا العضلية ، وعوامل النسخ العضلي (TFs) المعروفة بتحديد مراحل مختلفة من تكوين العضلات. مكن هذا النهج من تحديد علامتين لسطح الخلية ، CD9 و CD104 ، يميز نمط التعبير المشترك بينهما مجموعات الخلايا السلفية غير المعترف بها سابقا19. سيسمح الاختيار الدقيق لعلامات التجميع للباحث بالإجابة على أسئلة بحثية محددة. على سبيل المثال ، إذا كان تحديد وتحليل مجموعات الخلايا الفرعية المنقسمة بمرور الوقت مطلوبا ، يوصى بتضمين IdU كأحد علامات التجميع. يمكن ل X-shift إجراء التجميع عند قيم k متعددة وتحديد القيمة k تلقائيا ، من خلال حساب "نقطة الكوع" ، التي ينتج عنها رقم الكتلة الأمثل ، وبالتالي تجنب التجميع الناقص أو التجزئة الزائدة. يوصى بحساب نقطة الكوع واستخدام تحليل التجميع المحدد بواسطة قيمة k المثلى لتصور البيانات والتطبيقات النهائية. - لتصور العلاقات المكانية بين مجموعات الخلايا داخل مجموعات X-shift ، قم بإجراء تخطيط موجه بالقوة ، والذي سيولد خريطة 2D حيث تشير المسافة بين المجموعات إلى تشابهها في تعبير العلامة في الفضاء الظاهري عالي الأبعاد. من خلال تلوين الخريطة باستخدام علامة واحدة في كل مرة ، من الممكن اكتشاف مجموعات خلايا جديدة ومتابعة ديناميكياتها. يوصى بالقياس الكمي للمتابعة عن طريق البوابات اليدوية في البرامج ، مثل Cytobank و Cell Engine.
- إجراء تحليل خريطة الحرارة لتحديد التعبير الديناميكي للبروتينات السطحية وداخل الخلايا المتعددة طوال الدورة الزمنية والكشف عن اتجاهات جديدة.
ملاحظة: عند إجراء دورة وقت الإصابة ، من الممكن تجميع البيانات من جميع النقاط الزمنية معا لإنشاء خريطة للتجديد. بالإضافة إلى ذلك ، من الممكن تشريح هذه الخريطة إلى نقاط زمنية فردية لمتابعة الديناميات الخلوية والجزيئية للتجديد بمرور الوقت19.
11. تلطيخ بالأجسام المضادة المترافقة بالفلوروفور ل FACS
ملاحظة: يمكن أن تنشأ الخلايا المستخدمة لعناصر التحكم أحادية اللون غير الملوثة وعناصر التحكم الفلورية ناقص واحد (FMO) من مجموعة TA وGA من ماوس إضافي إذا كان متوفرا. بدلا من ذلك ، يمكن تشريح عضلات الفخذ الرباعية (عضلة الفخذ الأمامية العلوية) وهضمها في تعليق خلية واحدة ، باتباع نفس الإجراء المستخدم في مجموعة TA + GA أعلاه واستخدامها في الضوابط. قم بإعداد المخزن المؤقت FACS (PBS ، 2.5٪ مصل الماعز ، 2 mM EDTA) ، وقم بالتصفية من خلال غشاء PES في حاوية البوليسترين ، واحتفظ بها على الجليد. يمكن تخزين المخزن المؤقت FACS عند 4 °C لمدة تصل إلى 1 شهر. يمكن العثور على قائمة بالأجسام المضادة المستخدمة في FACS في الجدول 3.
- تحضير مزيج النسب. تلطيخ كل عنصر تحكم في 50 ميكرولتر (يحتوي على حوالي 3-5 × 105 خلايا). احسب مقدار مزيج النسب المطلوب. اجعل 20٪ -30٪ حجم زائد. تركيز مخزون الأجسام المضادة المستخدمة في مزيج النسب هو 0.2 مجم / مل.
- في أنبوب 0.5 مل ، أضف مضاد CD45 APC-Cy7 ، ومضاد CD31 APC-Cy7 ، ومضاد ل Sca1 APC-Cy7 ، ومضاد CD11b APC-Cy7 للوصول إلى تركيزات نهائية تبلغ 1 ميكروغرام / مل ، 2.5 ميكروغرام / مل ، 2.5 ميكروغرام / مل ، و 0.63 ميكروغرام / مل ، على التوالي.
- تحضير مزيج جميع البقع. قم بتلطيخ كل عينة ملطخة بالكامل في 500 ميكرولتر (تحتوي على حوالي 3-5 × 106 خلايا). اجعل حجم 10٪ زائدا عن مزيج البقع بالكامل.
- في أنبوب سعة 1.5 مل ، أضف أجساما مضادة لمزيج النسب على النحو الوارد أعلاه + مضادα 7 إنتغرين PE ومضاد CD9 APC ومضاد CD104 FITC للوصول إلى التركيزات النهائية 2 ميكروغرام / مل و 1.2 ميكروغرام / مل و 3 ميكروغرام / مل على التوالي.
- تحضير المخزن المؤقت FACS + DAPI: بالنسبة ل 10 مل من المخزن المؤقت FACS ، أضف 1 ميكرولتر من DAPI (المخزون = 1 مجم / مل) للوصول إلى تركيز DAPI النهائي 100 نانوغرام / مل.
تنبيه: يصنف DAPI (4',6-diamidino-2-phenylindole dihydrochloride) على أنه مهيج محتمل للجلد والجهاز التنفسي. ومع ذلك ، يعتبر محلول DAPI بتركيز <1٪ غير خطير ، وفقا ل GHS. اقرأ SDS قبل التعامل معها. يجب ارتداء معدات الحماية الشخصية أثناء المناولة. يجب التخلص من المواد التي كانت على اتصال ب DAPI وفقا للوائح السلامة المحلية. - إعادة تعليق الخلايا من القسم 6: تشريح العضلات الهيكلية وتفككها:
- بالنسبة لجميع العينات الملطخة ، أعد تعليق مجموعات TA و GA من ماوس واحد في 500 ميكرولتر من المخزن المؤقت FACS وانقله إلى أنابيب 15 مل للتلطيخ.
- لعناصر التحكم، استخدم إما مجموعات TA وGA أو مجموعات عضلات الفخذ. في حالة استخدام 1 ماوس لعناصر التحكم، أعد تعليق الخلايا في 750 ميكرولتر من المخزن المؤقت FACS. في حالة وجود عدة فئران ، أعد تعليق كل TA و GA أو مجموعة عضلات الفخذ في 500 ميكرولتر من المخزن المؤقت FACS وادمج المجموعات في عينة واحدة سعة 1 مل عن طريق أخذ جزء من كل عينة. أضف 50 ميكرولتر من خلايا التحكم (3-5 × 105 خلايا) إلى 5 مل من أنابيب البولي بروبلين للتلطيخ.
- بقعة كما هو موضح في الجدول 4 لمدة 45 دقيقة عند 4 درجات مئوية في الظلام.
- اغسل جميع العينات الملطخة بإضافة 5 مل من المخزن المؤقت FACS. اغسل أدوات التحكم بإضافة 1 مل من المخزن المؤقت وأجهزة الطرد المركزي FACS (380 × جم ، 10 دقائق ، 4 درجات مئوية).
- أعد تعليق جميع العينات الملطخة في 1 مل من المخزن المؤقت FACS + DAPI. أعد تعليق عناصر التحكم في 300 ميكرولتر من المخزن المؤقت FACS مع DAPI أو بدونه.
- احتفظ بالخلايا عند 4 درجات مئوية في الظلام حتى يتم فرزها على مقياس التدفق الخلوي باستخدام 4 ليزر (405 نانومتر ، 488 نانومتر ، 561 نانومتر ، 633 نانومتر).
- قم بتشغيل عناصر التحكم والعينات على جهاز الفرز وإنشاء بوابات فرز باستخدام البرنامج ذي الصلة. بالنسبة لعناصر التحكم غير الملطخة/أحادية اللون وعناصر التحكم في FMO، سجل أحداث 1 × 104 و0.3–1 × 105 ، على التوالي. بالنسبة للعينات الملطخة بالكامل ، سجل ما يصل إلى 1 × 106 أحداث. قم بفرز جميع العينات الملطخة بالكامل ، أو بقدر الحاجة ، اعتمادا على متطلبات الفحص النهائية. بالنسبة لمقياس التدفق الخلوي المستخدم هنا (FACSAria III) ، قم بالفرز في وضع النقاء باستخدام فوهة 70 مم.
- انظر الشكل 4 لاستراتيجية البوابات.
- استخدم عناصر التحكم غير الملوثة وأحادية اللون لضبط الجهد لجميع أجهزة الكشف.
- استخدم عناصر التحكم أحادية اللون لإعداد مصفوفة التعويض.
- استخدم عناصر تحكم FMO لإنشاء بوابات الفرز.
- يتم فرز مجموعات الخلايا الجذعية والسلفية المتميزة في مخزن FACS بارد الجليد.
- أجهزة الطرد المركزي (380 × جم ، 10 دقائق ، 4 درجات مئوية) مجموعات الخلايا. أعد التعليق في المخزن المؤقت المناسب ، وعد ، واستمر في التحليل النهائي.
النتائج
نقدم هنا نظرة عامة على الإعداد التجريبي لاستخدام هذا النهج المشترك الذي يتضمن (i) تحليل CyTOF عالي الأبعاد لدورة وقت الإصابة الحادة عن طريق حقن notexin لدراسة الديناميات الخلوية والجزيئية للخلايا الجذعية والسلفية في العضلات الهيكلية (الشكل 1 ، المخطط العلوي) ؛ ...
Discussion
تجديد العضلات الهيكلية هو عملية ديناميكية تعتمد على وظيفة الخلايا الجذعية البالغة. بينما ركزت الدراسات السابقة على دور الخلايا الجذعية العضلية أثناء التجدد ، لم تتم دراسة ذريتها في الجسم الحي ، ويرجع ذلك أساسا إلى نقص الأدوات لتحديد وعزل مجموعات الخلايا?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ونشكر أعضاء المرفق الأساسي لنظام مراقبة الأصول الميدانية في قسم الطب الحيوي في جامعة آرهوس على الدعم التقني. نشكر ألكسندر شميتز ، مدير وحدة قياس الكتلة الخلوية في قسم الطب الحيوي ، على المناقشة والدعم. تم إنشاء الرسوم التوضيحية العلمية باستخدام Biorender.com. تم تمويل هذا العمل من خلال منحة بدء جامعة آرهوس فورسكينغسفوند (AUFF) ومنحة حزمة البداية (0071113) من مؤسسة نوفو نورديسك إلى E.P.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
References
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved