JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
High-dimensional Single-Cell Mass Cytometry에 의한 급성 골격근 손상 중 In Vivo의 Myogenic Progenitors 식별 및 분석
요약
여기에 제시된 프로토콜은 단일 세포 질량 세포분석을 통한 근육 줄기 및 전구 세포의 식별 및 고차원 분석을 가능하게 하고 FACS에 의한 정제를 통해 기능에 대한 심층적인 연구를 가능하게 합니다. 이 접근법은 질병 모델의 재생 역학을 연구하고 약리학적 중재의 효능을 테스트하는 데 적용할 수 있습니다.
초록
골격근 재생은 성인 근육 줄기 세포와 그 자손에 의해 주도되는 역동적인 과정입니다. 대부분 안정된 상태에서 정지 상태에 있는 성인 근육 줄기 세포는 근육 손상 시 활성화됩니다. 활성화 후, 그들은 증식하고, 대부분의 자손은 융합 가능한 근육 세포를 생성하기 위해 분화하고, 나머지는 줄기 세포 풀을 보충하기 위해 자가 재생됩니다. 근육 줄기 세포의 정체성은 세포 표면 마커의 동시 발현을 기반으로 10여 년 전에 정의되었지만, 근인성 전구 세포는 최근에야 고차원 단일 세포 접근법을 사용하여 식별되었습니다. 여기에서는 급성 근육 손상에서 줄기 세포와 전구 세포를 분석하여 근육 재생 중에 펼쳐지는 세포 및 분자 역학을 해결하는 단세포 질량 세포분석(CyTOF[Cytometry]) 방법을 제시합니다. 이 접근법은 새로운 세포 표면 마커와 주요 근생성 전사 인자의 동시 검출을 기반으로 하며, 이들의 동적 발현을 통해 활성화된 줄기 세포와 근형성의 랜드마크를 나타내는 전구 세포 집단을 식별할 수 있습니다. 중요한 것은 세포 표면 마커 CD9 및 CD104 검출을 기반으로 하는 분류 전략이 설명되어 있으며, 이를 통해 근육 줄기 및 전구 세포의 기능에 대한 심층적인 연구를 위해 FACS(Fluorescence-Activated Cell Sorting)를 사용하여 근육 줄기 및 전구 세포를 전향적으로 분리할 수 있습니다. 근육 전구 세포는 근육 줄기 세포의 운명 조절을 연구하고, 근육 질환에 대한 새로운 치료 표적을 식별하고, 재생 의학을 위한 세포 치료 응용 프로그램을 개발하기 위한 중요한 누락 고리를 제공합니다. 여기에 제시된 접근법은 특정 신호 전달 경로를 표적으로 하는 약리학적 중재와 같은 섭동에 반응하여 생체 내에서 근육 줄기 및 전구 세포를 연구하는 데 적용할 수 있습니다. 또한 근육 질환의 동물 모델에서 근육 줄기 및 전구 세포의 역학을 조사하여 줄기 세포 질환에 대한 이해를 높이고 치료법 개발을 가속화하는 데 사용할 수 있습니다.
서문
골격근은 신체에서 가장 큰 조직을 구성하며 시력에서 호흡, 자세에서 움직임, 신진대사에 이르기까지 여러 기능을 조절합니다1. 따라서 골격근의 무결성과 기능을 유지하는 것은 건강에 매우 중요합니다. 신경과 혈관의 복잡한 네트워크로 둘러싸인 다핵 근섬유의 빽빽한 다발로 구성된 골격근 조직은 놀라운 재생 잠재력을 보여줍니다 1,2.
골격근 재생의 주요 동인은 성인 근육 줄기 세포(MuSC)입니다. 위성 세포라고도 하는 이 세포는 근섬유의 원형질막에 인접하고 기저층 아래에 있는 독특한 해부학적 위치로 인해 1961년에 처음 확인되었습니다3. MuSC는 독특한 분자 마커인 전사 인자 쌍을 이루는 상자 7(Pax7)4을 발현합니다. 건강한 성인에서 대부분 잠잠하다가 근육 손상 시 활성화되고 증식하여 (i) 근육 손상을 복구하기 위해 새로운 근섬유를 형성하거나 (ii) 줄기세포 풀을 보충하기 위해 자가 재생되는 융합 가능한 근육 세포로 분화되는 자손을 낳는다5.
세포 및 분자 수준에서 재생 과정은 매우 역동적이며 근육 형성 조절 인자(MRF)라고도 하는 주요 근생성 전사 인자의 조정된 발현을 특징으로 하는 세포 상태 전이를 포함합니다6,7. 이전의 in vivo 발달 연구, 계통 추적 실험 및 근아세포를 사용한 세포 배양 연구는 이러한 전사 인자의 순차적 발현이 근형성을 주도하는 것으로 나타났으며, 활성화 시 근형성 인자 5(Myf5)가 발현되고, 근형성 프로그램에 대한 헌신을 표시하는 Myogenic differentiation 1(MyoD1) 발현, 분화 8,9,10,11을 표시하는 myogenin(MyoG) 발현이 있습니다. 12,13,14. 이러한 지식과 MuSC를 정제하기 위한 세포 표면 마커의 발견에도 불구하고, 근육원성 분화 경로를 따라 이산적인 집단을 식별 및 분리하고 in vivo myogenic 진행을 해결하기 위한 전략 및 도구는 부족했습니다 15,16,17,18.
여기에서는 최근에 발표된 연구를 기반으로 한 새로운 방법을 제시하며, 이를 통해 골격근에서 줄기 세포와 전구 세포를 식별하고 급성 근육 손상의 맥락에서 세포, 분자 및 증식 역학을 분석할 수 있습니다19. 이 접근법은 단일 세포 질량 세포분석(CyTOF[Time-of Flight]에 의한 세포분석이라고도 함)을 사용하여 주요 세포 표면 마커(α7 integrin, CD9, CD44, CD98 및 CD104), 세포 내 근생성 전사 인자(Pax7, Myf5, MyoD 및 MyoG) 및 뉴클레오시드 유사체(5-Iodo-2′-deoxyuridine, IdU)를 동시에 검출하여 S기19,20의 세포를 모니터링합니다. 21,22,23. 또한, 이 프로토콜은 두 가지 세포 표면 마커인 CD9 및 CD104의 검출을 기반으로 하는 전략을 제시하여 형광 활성화 세포 분류(FACS)를 통해 이러한 세포 집단을 정제함으로써 부상 및 근육 질환의 맥락에서 해당 기능에 대한 향후 심층 연구를 가능하게 합니다. 일차 근아세포는 시험관 내에서 근형성 분화의 후기 단계를 연구하기 위해 과거에 광범위하게 사용되었지만, 생체 내에서 발견되는 근육 전구 세포의 분자 상태를 재현하는지 여부는 알려져 있지 않습니다 24,25,26,27,28,29,30 . 근아세포의 생산은 힘들고 시간이 많이 걸리며, 이 1차 배양물의 분자 상태는 노화가 끝나면 빠르게 변한다31. 따라서 이 방법으로 정제된 신선하게 분리된 근인성 전구세포는 근형성 및 생체 외 유전적 또는 약리학적 조작의 효과를 연구하기 위한 보다 생리학적 시스템을 제공할 것입니다.
여기에 제시된 프로토콜은 예를 들어 근육 질환의 동물 모델에서 생체 내 근육 구획의 역학을 연구하거나, 급성 유전자 조작에 대한 반응 또는 약리학적 개입에 따라 다양한 연구 질문을 해결하는 데 적용할 수 있으며, 따라서 다양한 생물학적 맥락에서 근육 줄기 세포 기능 장애에 대한 이해를 심화하고 새로운 치료 중재의 개발을 촉진합니다.
프로토콜
동물 실험은 덴마크 동물 실험 검사관(프로토콜 # 2022-15-0201-01293)의 승인을 받았으며 실험은 오르후스 대학의 기관 지침에 따라 수행되었습니다. 진통제(부프레노르핀)는 생쥐가 맛에 적응할 수 있도록 부상 24시간 전에 식수에 제공됩니다. 식수에 부프레노르핀을 공급하는 것은 부상 후 24시간 동안 계속됩니다. 급성 근육 손상시 부프레노르핀의 피하(s.c.) 주사와 함께, 노텍신 주사 후 음용수에 부프레노르핀을 넣으면 부상과 관련된 통증을 완화할 수 있습니다. 급성 근육 손상 시 부프레노르핀을 S.C.에 주입한 후 음용수에 부프레노르핀을 투여하는 것이 권장되지만, 부상 전에 음용수에 부프레노르핀을 투여하는 것은 선택 사항입니다. 그러나 연구자는 해당 규제 기관에서 정한 동물 복지 표준 및 지침을 따라야 합니다.
참고: 손상된 뒷다리 근육의 단세포 질량 세포분석(CyTOF) 실험의 경우 섹션 1: 근육 손상 24시간 전 물에서의 진통에서 시작하여 부상 후 24시간까지. 손상되지 않은 마우스에서 근육 줄기 및 전구 세포를 분류하기 위해 섹션 5 및 6: 안락사 + 골격근 박리 및 해리를 수행하고 섹션 11: FACS에 대한 형광단 접합 항체로 염색을 계속합니다. 실험 설정 및 프로토콜에 대한 개요는 그림 1에 나와 있습니다.
1. 부상 후 24시간까지 근육 부상 24시간 전에 물에 있는 진통제
- 어둡거나 알루미늄 호일로 감싼 음료수 병에 부프레노르핀 3mL(0.3mg/mL)를 넣고 여과수로 100mL까지 채워 부상 24시간 전에 최종 농도 0.009mg/mL에 도달합니다. 마우스 케이지에 부착합니다.
- 부상 후 24시간 후에 물병을 제거하고 마우스 케이지를 급수 밸브 시스템에 다시 연결합니다.
2. 급성 부상 시술 준비
알림: 70% 에탄올을 사용하여 작업대, 노즈콘 설정 및 인덕션 박스를 소독하십시오.
- PBS(5μg/mL)에 희석된 노텍신이 포함된 1.5mL 튜브를 준비합니다. 불에 안전한 1.5mL 튜브에 부프레노르핀(0.3mg/mL)을 멸균 0.9% 식염수에 희석하여 0.015mg/mL로 희석합니다. 얼음 위에 두십시오. 부프레노르핀(28G, 0.5mL) 및 노텍신 주사(29G, 0.3mL)용 인슐린 주사기를 준비합니다.
- 이소플루란 기반 마취 장치 구성:
- 인덕션 박스의 마취를 위해 3L/min(1.5% O50, 50% 대기 공기)의 흐름으로 50% 이소플루란을 사용하십시오.
- 노즈 콘 설정을 활용한 유지 관리를 위해 0.6L/min(50% O2, 50% 대기 공기)의 흐름으로 1.5% 이소플루란을 사용하십시오.
3. notexin 주입에 의하여 급성 상해
주의: Notexin은 Phospholipase A2 활성을 가지며 호주 호랑이 뱀(Notechis scutatus)의 독의 주성분으로, 생쥐에서 5–17mg notexin/kg의 LD50을 정맥 주사합니다32,33. 본 프로토콜에서는 각 뒷다리의 경골 전방(TA) 근육에 10μL의 5mg/mL 노텍신을 주입하고, 각 뒷다리의 비복근(GA)에 5mg/mL 노텍신 15μL를 2회(근육의 각 머리에 한 번) 주입합니다. 손상을 제한하기 위해 근육 주사(i.m) 주사를 올바르게 수행하고 주사한 동물을 자주 검사하여 통증을 최소화하는 것이 중요합니다.
- 인덕션 박스(3% 이소플루란)에 마우스를 마취합니다. 마우스가 의식을 잃었을 때 인덕션 박스에서 이소플루란 수치를 1.5%로 낮춥니다.
- 기관에서 승인한 절차에 따라 마우스의 무게를 측정하고 개별적으로 표시합니다. 노즈 콘 설정 아래에서 트리머로 뒷다리를 면도하고 인덕션 박스로 다시 옮깁니다.
- 각 마우스의 부프레노르핀 부피 계산:
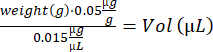
- 노텍신 용액을 위아래로 피펫팅하여 혼합합니다. TA 주입을 위해 10μL의 노텍신 용액(5μg/mL)을 주입한 인슐린 주사기 2개(2G, 0.3mL)와 GA 주입을 위해 15μL의 노텍신 용액(5μg/mL)을 주입한 인슐린 주사기 4개를 준비합니다.
참고: 경골 전방(TA) 근육은 무릎에서 발목까지 뻗어 있는 마우스 아래쪽 다리의 앞쪽에 있습니다. 비복근(GA)은 다리 아래쪽에 위치한 머리가 두 개인 근육으로 가자미암아 표면적입니다. 무릎 바로 위의 두 머리(내측 및 외측)에서 발뒤꿈치까지 이어지며 총 3개의 관절(무릎, 발목, 거골하 관절)을 가로질러 뻗어 있습니다. - 근육 주사 시행
- TA 주입 (총 2 회 주입)
- 마우스를 콧방울 아래 앙와위 위치에 놓고 멸균 알코올 물티슈(70% 에탄올 또는 이소프로판올)로 주사 부위를 소독합니다. 바늘을 비스듬히 아래로 내려 TA의 배(배 중앙에서 원위)에 30° 각도로 삽입합니다. 경골과 평행하게 움직여 근육을 따라 바늘을 전진시켜 TA의 중간 배에 도달합니다. 노텍신을 천천히 지속적으로 주입하고 바늘을 빼기 전에 10초 동안 제자리에 두십시오. 처음에는 바늘을 너무 깊숙이 삽입하지 마십시오(TA 아래의 notexin이 신전근 digitorum longus 근육에 주입되는 것을 방지하기 위해), 바늘을 전진시킬 때 너무 근접하지 마십시오(무릎에 너무 가깝게 주입하지 않기 위해).
- GA 주입 (총 4 회 주입)
- GA의 측면 머리의 중간 배에서 ~ 45 ° 각도로 바늘을 비스듬히 삽입합니다. 노텍신을 천천히 지속적으로 주입하고 바늘을 빼기 전에 10 초 동안 바늘을 제자리에 두십시오. 뒷다리를 회전시켜 위와 같이 GA 근육의 내측 머리에 노텍신을 주입합니다. 바늘을 너무 깊게 삽입하지 않도록 주의해야 합니다.
- TA 주입 (총 2 회 주입)
- 마우스를 돌려 인슐린 주사기(28G, 0.5mL)를 사용하여 부프레노르핀 s.c.를 주입합니다. 마우스를 가열판의 빈 회수 케이지로 옮깁니다. 케이지 바닥의 절반만 가열판 위에 놓아야 회복 중에 마우스가 온도를 조절할 수 있습니다34. 나머지 마우스에 대해 3.3–3.6단계를 반복합니다.
- 복구 케이지의 마우스가 완전히 깨어나면 원래 케이지로 다시 이동합니다. 그것을 마구간으로 되돌려 놓고 젖은 차우로 보충하십시오. 주입 후 24시간 후에 부프레노르핀 음료수 병을 제거하십시오.
- 노텍신 주사 후 6시간 동안 마우스를 모니터링한 다음 통증, 이동성 장애 및 음식 섭취 감소의 징후를 위해 2일 동안 12시간마다 모니터링하십시오35,36.
4. 5-요오도-2'-데옥시우리딘 주입
주의: 5-요오도-2'-데옥시우리딘(IdU)은 유전적 결함을 일으키고 생식력이나 태아에 해를 끼치는 것으로 의심됩니다. 취급하기 전에 안전보건자료(SDS)를 읽으십시오. 취급 중에는 개인 보호 장비를 착용해야 합니다. IdU 분말의 무게를 잴 때 흄 후드를 사용하십시오. IdU와 접촉한 물질은 현지 안전 규정에 따라 폐기해야 합니다.
참고: 생체 내 IdU 라벨링은 요오드화 티미딘 유사체인 IdU가 S 단계에서 세포의 DNA에 통합되기 때문에 부상 시간 과정 동안 세포 분열을 모니터링하는 데 사용됩니다. IdU는 마우스를 희생하기 8시간 전에 체중 20mg/kg으로 복강내(i.p.)로 주입됩니다.
- 37 ° C에서 초음파 발생기를 사용하여 멸균 PBS에서 IdU의 2mg / mL 원액을 준비합니다. IdU는 빛에 민감합니다. 당일 내에 사용하거나 최대 3개월 동안 -20 °C에서 얼립니다. 냉동 IdU를 사용하는 경우: 해동, 와류, 10,000 x g 에서 30초 동안 원심분리하고 아래 주사용 상층액을 사용합니다.
- 인덕션 박스(3% 이소플루란)에 마우스를 마취합니다. earmarking을 기록하고, 마우스의 무게를 측정하고, IdU 용액의 부피를 계산하십시오.
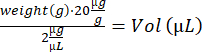
- 인슐린 주사기(28G, 0.5mL)를 사용하여 i.p. 주입을 수행하고 마우스를 가열판의 빈 회수 케이지로 옮깁니다. 깨어 있을 때 마우스를 원래 케이지로 다시 이동합니다. 나머지 쥐에 대해 4.2–4.3단계를 반복하고 마구간으로 되돌려 보냅니다.
5. 안락사
참고: 버퍼 레시피에 대해서는 표 1 을 참조하십시오. 세척 매체(영양 혼합물 F-10(Ham's), 10% 말 혈청, 1x 펜/스트렙)을 준비하고 폴리에테르설폰(PES) 멤브레인을 통해 폴리스티렌 용기에 넣습니다. 해리 완충액(650U/mL 콜라겐분해효소, Type II가 보충된 세척제)을 준비하고 얼음 위에 보관합니다. CyTOF 질량 유세포 분석 측정은 오염 물질에 매우 민감합니다. 이러한 이유로 시료 처리에는 최고 분석 등급의 시약을 사용하는 것이 필수적입니다. 금속 오염을 방지하려면 많은 실험실 비누에 높은 수준의 바륨이 포함되어 있기 때문에 멸균 플라스틱 용기와 세제로 세척한 적이 없는 새 유리 제품을 사용하는 것이 좋습니다. 시약 준비를 위해 이중 여과수, 증류수, 탈이온수를 사용하는 것이 좋습니다. 인산염 완충 식염수(PBS)는 사내에서 준비됩니다. 10x 스톡을 1x로 희석하고 1x PBS를 0.2μm 필터로 필터링합니다. 각 실험을 시작할 때 1x PBS를 다시 필터링합니다. 해부 도구는 바륨이 존재하기 때문에 세제로 청소해서는 안 됩니다.
- 인덕션 박스로 계량 저울, 용기 및 이소플루란 기반 마취 장치를 준비합니다. 적절한 해부 도구를 소독하십시오.
- 각 마우스에 대해 50mL 튜브를 준비하고 5mL의 해리 완충액과 페트리 접시를 표시합니다. 해리 버퍼를 얼음 위에 유지하십시오.
- 인덕션 박스에 마우스를 마취하고(3% 이소플루란, 의식이 없을 때 5%로 증가) 자궁경부 탈구를 수행합니다.
6. 골격근 박리 및 해리
- 양쪽 뒷다리에서 TA 및 GA 근육을 절개하고 페트리 접시의 뚜껑으로 옮깁니다. 가위를 사용하여 조직을 다진 슬러리 (~ 1mm3 개)로 자릅니다. 5mL의 얼음-냉간 해리 완충액이 들어 있는 50mL 튜브로 옮깁니다. 얼음 위에 두십시오.
- 모든 마우스가 처리될 때까지 안락사 절차(5.3단계)와 골격근 박리 및 해리 절차(6.1단계)를 반복합니다.
- 모든 시료 튜브를 37°C 수조(2분)에서 사전 가열하고 인큐베이터(37°C)에서 회전하면서 45분 동안 배양합니다.
- 와류 및 세척 매체 10mL를 추가하여 세척합니다. 원심분리기(380 x g, 10분, 실온[RT]) 및 4mL까지 흡인.
- 0.5mL의 콜라겐분해효소(1000U/mL)와 0.5mL의 디스파제(11U/mL)를 추가합니다. 37°C에서 회전하여 20분 동안 볼텍스하고 배양합니다(예: 인큐베이터에서). 원심분리기(380 x g, 1분, RT)하고 5mL 피펫으로 재현탁합니다.
- 40μm 세포 스트레이너를 50mL 튜브에 넣고 5mL의 세척 매체로 미리 적십니다. 20G 바늘이 있는 5mL 주사기를 사용하여 세포 현탁액을 10회 흡입 및 배출합니다. 미리 젖은 40μm 셀 스트레이너를 통해 걸러냅니다. 50mL 튜브를 10mL 세척 배지로 세척하고 40μm 세포 여과기로 옮긴 다음 세포 현탁액을 원심분리(380 x g, 10분, 4°C)합니다.
7. 시스플라틴과 파라포름알데히드 고정을 이용한 살아있는/죽은 염색
주의: 시스플라틴과 파라포름알데히드(PFA)는 발암성이 있습니다. 취급하기 전에 SDS를 읽으십시오. 파라포름알데히드(PFA, 16%)는 피부, 눈, 호흡기를 자극하는 물질입니다. 개인 보호 장비를 착용하고 흄 후드 아래에서 이러한 물질을 취급하십시오. 세포를 고정하는 동안 PFA의 최종 농도는 1.6%가 됩니다. 올바른 보호 조치를 취해야 하며 폐기물은 현지 규정에 따라 처리해야 합니다.
참고: 냉(4°C) 및 온난(37°C)의 무혈청 DMEM을 준비합니다. 10% FBS가 보충된 DMEM을 준비하고 PES 멤브레인을 통해 여과하여 폴리스티렌 용기에 넣고 얼음에 보관합니다. PBS 및 세포 염색 배지(CSM; PBS, 0.5% BSA, 0.02% 아지드화나트륨)을 CyTOF 전용 유리병에 넣고 PES 멤브레인을 통해 여과합니다. CSM은 4°C에서 최대 6개월 동안 보관할 수 있습니다.
- 상층액을 흡입하고 펠릿을 튕기고 1mL의 콜드 세럼이 없는 DMEM에 재현탁합니다. 세포를 세고 무혈청 DMEM에서 세포 밀도를 1 x 106 cells/mL로 조정합니다.
- 시스플라틴 스톡(25mM)을 최종 농도 25μM에 추가합니다. Vortex 10초 동안 정확히 1분 동안 배양합니다(반응은 시간에 매우 민감함). 얼음처럼 차가운 DMEM+10% FBS(시료 부피의 3배)로 반응을 담금질하고 얼음 위에 보관합니다. 원심분리기(380 x g, 10분, 4°C), 상층액을 흡입하고 펠릿을 완전히 재현탁시킵니다(CSM에서 최대 10 x 106 cells/mL). 35μm 셀 스트레이너를 통해 현탁액을 여과합니다.
- 여과된 PFA 스톡 용액(16%)으로 셀 현탁액을 고정하고 피펫을 위아래로(흄 후드 아래에서 수행) 최종 PFA 농도(1.6%)에 도달합니다(예: 16% PFA 100μL를 셀 현탁액 900μL에 추가). 30초 동안 소용돌이를 일으키고 얼음에서 10분 동안 배양한 다음 원심분리(800 x g, 5분, RT)를 통해 2mL의 CSM으로 두 번 세척합니다.
참고: 이 시점에서 샘플은 드라이아이스에 급속 냉동하여 -80°C에서 보관하거나 항체 염색에 직접 사용할 수 있습니다. 세포를 동결해야 하는 경우 폴리스티렌이 저온에서 깨질 수 있으므로 세포를 5mL 폴리프로필렌 튜브로 옮깁니다. 갓 고정된 셀을 염색에 사용하는 경우 8.2단계로 진행합니다.
8. 금속 복합 항체로 염색
주의: 메탄올(MeOH)은 가연성이 높으며 호흡기를 부식시킵니다. 취급하기 전에 SDS를 읽으십시오. 개인 보호 장비를 착용하고 흄 후드 아래에서 이 물질을 취급하십시오. 현지 규정에 따라 폐기물을 처리하십시오.
참고: 표면 마커 및 세포 내 마커를 표적으로 하는 항체(Ab) 목록은 표 2에서 확인할 수 있습니다.
항체 접합: 이 프로토콜에 사용된 대부분의 항체는 상업적으로 이용 가능하지 않았기 때문에 사내에서 접합되었습니다. 항체의 금속 접합에 대한 프로토콜은 이전에 발표되었으며, 접합 키트는 현재 상업적으로 이용 가능합니다37,38. 면역글로불린 G형(IgG)은 사용 가능한 접합 프로토콜과 호환됩니다. 금속 접합에 사용되는 항체 제형에는 시스테인 함유 캐리어 단백질(예: 소 혈청 알부민(BSA))이 없는 것이 매우 중요하며, 이는 고분자의 유리 말레이미드 그룹을 놓고 경쟁하여 접합 효율에 영향을 미칠 수 있고 금속 접합 항체의 정량화를 방해할 수 있습니다. 젤라틴의 시스테인 함량은 BSA의 시스테인 함량보다 훨씬 낮습니다. 그러나, 항체 제형이 캐리어 단백질을 포함하는 경우, 이러한 단백질은 접합 전에 제거하는 것이 권장된다. 이제 제조업체에 BSA 및 젤라틴이 없는 항체를 요청할 수 있습니다. 저분자 방부제(예: 아지드화나트륨, 글리세롤 및 트레할로스)는 금속 접합 프로토콜37,38과 호환됩니다.
항체 적정: 각 금속 접합 후에는 최대 신호 대 잡음비를 제공하는 최적의 항체 농도를 결정하기 위해 항체를 적정해야 합니다. 항체 적정을 위해 6단계 2중 연속 희석을 수행하고 관심 단백질 19,21,37,38을 발현하는 것으로 알려진 샘플(예: 근육 세포, 양성 대조군) 및 결핍(음성 대조군)을 모두 염색합니다.
PBS/1.6% PFA에서 스톡을 0.1μM로 희석하여 새로운 Cell-ID Intercalator-Ir(스톡 = 500μM, 인터컬레이터-ir 용액) 작업 용액을 준비합니다.
- 냉동 샘플을 RT 및 원심분리기(800 x g, 1분, RT)에서 5분 동안 해동합니다. 원심분리(800 x g, 5분, RT)로 CSM 2mL로 세척합니다.
- CSM에서 2.5x 표면 항체(Ab) 염색 혼합물을 준비합니다. 상층액을 ~60μL까지 흡인하고 펠릿을 완전히 재현탁시킵니다. 40 μL의 표면 Ab 염색 혼합물을 첨가하고 실온에서 1시간 동안 배양하여 세포를 염색합니다.
- 20분마다 샘플을 튕겨 섞습니다. 원심분리를 통해 1mL의 CSM으로 2회 세척합니다(800 x g, 5분, RT). 상층액을 흡인하고 펠릿을 튕깁니다.
참고: 세포 내 염색이 필요하지 않은 경우 메탄올 투과화가 필요하지 않습니다. 그러나 표면 염색만 수행하는 경우 intercalator-ir 용액을 투과제(예: Maxpar fix 및 perm buffer)가 포함된 완충액에 희석하여 핵막을 관통해야 합니다. 8.5단계로 진행하여 투과제와 1.6% PFA를 함유한 완충액에 Cell-ID Intercalator-Ir을 희석합니다. 그렇지 않으면 아래의 세포 내 염색을 계속하십시오.
주의: 이리듐은 위험하므로 안전한 취급을 위한 예방 조치를 취해야 합니다. 이리듐은 가연성이며 눈/피부에 자극을 줍니다. 먼지나 연기를 생성하거나 흡입하지 마십시오. 피부와 눈과의 접촉을 피하십시오. 그러나 intercalator-ir 용액 혼합물은 물에 <1%의 농도로 제공되며, 이는 화학 물질의 분류 및 라벨링에 대한 GHS(Globally Harmonized System)에 따라 무해한 것으로 간주됩니다. 취급하기 전에 표준 Biotools의 SDS를 읽으십시오. 취급 중에는 개인 보호 장비를 착용해야 합니다. intercalator-ir 용액과 접촉한 재료는 현지 안전 규정에 따라 폐기해야 합니다. - 세포를 투과시키려면 소용돌이치면서 0.5mL의 얼음처럼 차가운 MeOH를 적가합니다. 흄 후드 아래의 얼음 위에서 15분 동안 배양합니다. 원심분리기(800 x g, 5분, RT)한 다음 원심분리(800 x g, 5분, RT)를 통해 1mL의 CSM으로 2회 세척합니다. 마지막 세척 후 상층액을 ~60μL까지 흡인하고 펠릿을 완전히 재현탁합니다.
- CSM에서 2.5x 세포 내 Ab 염색 혼합물을 준비합니다. 40 μL의 세포 내 Ab 염색 혼합물을 추가하고 RT에서 1시간 동안 배양하여 세포를 염색합니다. 20분마다 샘플을 튕겨 혼합합니다.
- 원심분리를 통해 1mL의 CSM으로 2회 세척합니다(800 x g, 5분, RT). 상층액을 흡인하고 펠릿을 튕깁니다. 0.5mL의 인터컬레이터-이리듐 용액(표 1)과 와류에 샘플을 재현탁시킵니다. 상온에서 1시간 동안 또는 4°C에서 하룻밤(O/N) 동안 샘플을 배양합니다(아래 참고 참조).
참고: 샘플은 4°C의 인터컬레이터-이리듐 용액에서 최대 48시간 동안 보관할 수 있습니다. 이 연구에 사용된 염색 프로토콜은 Nolan lab{C}23의 선구적인 연구를 기반으로 개발되었습니다. (i) 자체 준비된 완충액을 세척 및 염색에 사용하고, (ii) 세포를 표면 염색 전에 고정하고, (iii) 세포는 전사 인자 또는 신호 분자에 대한 항체를 사용하여 세포 내 염색을 위해 메탄올로 투과된다는 점에서 표준 Biotools 프로토콜과 다릅니다. 새로운 프로토콜을 개발하는 연구자들은 항체 패널과 투과제로서의 메탄올의 호환성을 철저히 테스트해야 합니다. 패널에 새로운 항체를 추가할 때는 금속 접합 및 적정 전에 positive 및 negative control 샘플을 사용하여 유세포 분석으로 항체 특이성을 테스트하는 것이 좋습니다.
9. 질량 세포분석기에 로딩하기 위한 시료 준비
참고: 셀 펠릿은 CAS 버퍼(Table of Materials)에 있을 때 매우 느슨합니다. CAS 완충액으로 세척하는 동안 건조할 때까지 흡인하지 마십시오. 대신, 아래 설명된 대로 잔여 부피를 유지하십시오.
- 소용돌이 및 원심 분리기 (800 x g, 10 분, RT). 상층액(PFA 폐기물로 처리)과 와류를 붓습니다.
- 원심분리(800 x g, 10분, RT)로 1mL의 CSM으로 세척합니다. 상층액을 흡인하고 펠릿을 튕깁니다.
- 1mL의 CAS 완충액으로 원심분리(800 x g, 10분, RT)로 세척합니다. ~200 μL. Vortex로 흡인하고 1 mL의 CAS 완충액을 추가합니다. 세포 수를 위해 5μL 부분 표본을 제거합니다. 원심분리기(800 x g, 10분, RT)하고 ≤50μL까지 조심스럽게 흡입합니다. 펠릿을 방해하지 마십시오.
- CAS 완충액에서 펠릿을 1–2 x 106 cells/mL로 재현탁시키고 보정 비드(1x; 재료 목차) 최종 농도 0.1x(예: 100μL의 1x 보정 비드를 900μL의 세포 현탁액에 추가).
- 질량 유세포에 샘플을 로드하고 400–500 cells/s의 유속을 사용하여 데이터를 수집합니다.
- CyTOF 소프트웨어 또는 이전에 개발된 정규화 도구(39)를 사용하여 FCS 파일의 데이터 정규화를 수행한다.
참고: CyTOF 질량 유세포의 작동은 기기에 따라 다릅니다 40,41. 작동하기 전에 CyTOF 사용 설명서를 참조하는 것이 좋습니다. 보정 비드는 금속 동위원소 세륨(140/142Ce), 유로퓸(151/153Eu), 홀뮴(165Ho) 및 루테튬(175/176Lu)의 알려진 농도를 포함하는 금속 포매 폴리스티렌 정규화 비드 표준물질입니다. 캘리브레이션 비드를 사용하면 기계 감도를 제어할 수 있으며, 이는 주로 생물학적 물질의 축적과 시간 경과에 따른 플라즈마 이온화의 변화로 인해 시간이 지남에 따라 달라질 수 있습니다.
10. CyTOF 데이터 분석
참고: 다운스트림 분석을 위해 정규화된 FCS 파일을 로컬에서 분석하거나 Cytobank, Cell Engine, OMIQ 또는 FCS Express42와 같은 클라우드 기반 소프트웨어 솔루션에 업로드할 수 있습니다.
- 필요한 경우 각 샘플에 대한 개별 FCS 파일을 단일 파일로 연결합니다.
- 이리듐 인터컬레이터(Iridium-intercalator) 양성 이벤트에 대한 게이팅(gating)을 통해 단일 세포를 식별하며, 이를 통해 파편 또는 이중선에서 단일 핵 세포를 구별할 수 있습니다.
- 시스플라틴 음성 이벤트를 선택하여 살아있는 세포를 게이트합니다. 시스플라틴(Cisplatin)은 세포 단백질에 공유 결합하며, 살아있는 세포보다 더 많이 손상된 막을 가진 죽어가는 세포와 죽은 세포를 표지한다43.
- 예를 들어, 관심 집단, 예를 들어 근육 생성 구획(Live/CD45-/CD31-/Sca1-/α7integrin+/CD9+)을 게이트하고 줄기 세포와 전구 세포의 상대적 비율을 정량화합니다. 이 접근법은 개별 집단을 정의하기 위해 세포 표면 또는 세포 내 마커 발현에 대한 사전 지식이 필요합니다.
- 복잡한 집단 내에서 이전에 인식되지 않았던 희귀 세포 부분 집합을 식별할 수 있는 고차원 분석을 수행하려면, 관심 있는 집단을 내보내고, CyTOF 데이터 분석을 위해 특별히 개발된 클러스터링 알고리즘을 사용합니다(44).
참고: 이전 연구에서는 고차원 공간에서 가중 k-최근접 이웃 밀도 추정(kNN-DE)을 사용하여 정의된 매개변수19를 기반으로 비지도 클러스터링을 수행하는 X-shift 알고리즘을 사용했습니다. X-shift는 희귀 세포 집단을 식별하는 데 매우 효과적인 것으로 나타났습니다45. - X-shift 분석을 위해 vortex 소프트웨어 패키지(Nolan lab GitHub 페이지 [https://github.com/nolanlab/vortex]에서) 및 Java 64비트46을 다운로드합니다. 지침은 여기에서 찾을 수 있습니다: https://github.com/nolanlab/vortex/wiki/Getting-Started.
- 내보낸 cell population을 로컬 데이터베이스에 업로드하고 군집화 파라미터를 정의합니다. 사용자 정의 파라미터 중에는 (i) 클러스터링에 사용되는 마커, (ii) k 값의 범위(예: 5 - 150) 및 (iii) 클러스터링 단계 수가 있습니다.
참고: 이전 연구에서는 근육 줄기 세포에서 발현되는 것으로 알려진 표면 마커, 근육 세포 및 근아세포의 고처리량 유세포 스크리닝에서 식별된 새로운 표면 마커, 근육 형성의 다양한 단계를 정의하는 것으로 알려진 근육 생성 전사 인자(TF)의 조합을 클러스터링 마커로 사용했습니다. 이 접근법을 통해 두 개의 세포 표면 마커인 CD9 및 CD104를 식별할 수 있었으며, 이들의 동시 발현 패턴은 이전에 인식되지 않았던 전구 세포 집단을 구별합니다19. 클러스터링 마커의 신중한 선택을 통해 연구자는 특정 연구 질문에 답할 수 있습니다. 예를 들어, 분할하는 셀 하위 집합의 시간에 따른 식별 및 분석이 필요한 경우 IdU를 클러스터링 마커 중 하나로 포함하는 것이 권장됩니다. X-shift는 여러 k 값에서 클러스터링을 수행하고 "엘보우 포인트"를 계산하여 최적의 클러스터 수를 생성하는 k 값을 자동으로 식별하므로 과소 클러스터링 또는 과잉 단편화를 방지할 수 있습니다. 엘보우 점을 계산하고 데이터 시각화 및 다운스트림 응용 프로그램에 대해 최적의 k 값으로 정의된 클러스터링 분석을 사용하는 것이 좋습니다. - X-shift 클러스터 내에서 세포 집단 간의 공간적 관계를 시각화하려면 힘 지향 레이아웃을 수행하여 클러스터 간의 거리가 고차원 표현형 공간에서 마커 발현의 유사성을 나타내는 2D 맵을 생성합니다. 한 번에 하나의 마커를 사용하여 맵을 색칠하면 새로운 세포 집단을 발견하고 그들의 역학을 추적할 수 있습니다. Cytobank 및 Cell Engine과 같은 소프트웨어에서 수동 게이팅을 통한 후속 정량화가 권장됩니다.
- 히트맵 분석을 수행하여 시간 경과에 따른 여러 표면 및 세포 내 단백질의 동적 발현을 정량화하고 새로운 추세를 밝힐 수 있습니다.
참고: 인저리 타임 코스를 수행할 때 모든 시점의 데이터를 함께 클러스터링하여 재생 맵을 생성할 수 있습니다. 또한, 이러한 맵을 개별 시점으로 해부하여 시간에 따른 재생의 세포 및 분자 역학을 추적할 수 있다19.
11. FACS를 위한 형광단 접합 항체로 염색
참고: 염색되지 않은 단색 대조군 및 형광 마이너스 1(FMO) 대조군에 사용되는 셀은 사용 가능한 경우 추가 마우스의 TA 및 GA 세트에서 유래할 수 있습니다. 대안적으로, 대퇴사두근(상부 전방 허벅지 근육)을 절개하고 단일 세포 현탁액으로 소화할 수 있으며, 이는 위에 설정된 TA+GA와 동일한 절차에 따라 대조군에 사용할 수 있습니다. FACS 완충액(PBS, 2.5% 염소 혈청, 2mM EDTA)을 준비하고 PES 멤브레인을 통해 폴리스티렌 용기에 여과한 후 얼음에 보관합니다. FACS 버퍼는 4°C에서 최대 1개월 동안 보관할 수 있습니다. FACS에 사용되는 항체 목록은 표 3에서 확인할 수 있습니다.
- 리니지 믹스를 준비합니다. 각 컨트롤을 50 μL(약 3–5 x 105 셀 포함)로 염색합니다. 필요한 계보 혼합의 양을 계산합니다. 20%–30% 볼륨 초과를 만듭니다. 계통 혼합물에 사용되는 항체의 스톡 농도는 0.2mg/mL입니다.
- 0.5mL 튜브에 항-CD45 APC-Cy7, 항-CD31 APC-Cy7, 항-Sca1 APC-Cy7 및 항-CD11b APC-Cy7을 추가하여 각각 1μg/mL, 2.5μg/mL, 2.5μg/mL 및 0.63μg/mL의 최종 농도에 도달합니다.
- 모든 얼룩 혼합물을 준비합니다. 전체적으로 염색된 각 시료를 500μL(약 3–5 x 106 개 세포 포함)로 염색합니다. 모든 염색 혼합물의 10% 부피를 초과하십시오.
- 1.5mL 튜브에 위와 같은 계통 혼합 항체 + 항-α7 integrin PE, anti-CD9 APC 및 anti-CD104 FITC를 추가하여 각각 2μg/mL, 1.2μg/mL 및 3μg/mL의 최종 농도에 도달합니다.
- FACS 완충액 + DAPI 준비: FACS 완충액 10mL에 대해 1μL의 DAPI(스톡 = 1mg/mL)를 추가하여 최종 DAPI 농도 100ng/mL에 도달합니다.
주의: DAPI(4',6-디아미디노-2-페닐린돌 디하이드로클로라이드)는 피부 및 호흡기 자극 가능성이 있는 물질로 분류됩니다. 그러나 GHS에 따르면 <1% 농도의 DAPI 용액은 위험하지 않은 것으로 간주됩니다. 취급하기 전에 SDS를 읽으십시오. 취급 중에는 개인 보호 장비를 착용해야 합니다. DAPI와 접촉한 재료는 현지 안전 규정에 따라 폐기해야 합니다. - 섹션 6의 세포 재현탁: 골격근 박리 및 해리:
- 모든 염색이 완료된 시료의 경우 단일 마우스의 TA 및 GA 세트를 500μL의 FACS 버퍼에 재현탁하고 15mL 튜브로 옮겨 염색합니다.
- 컨트롤의 경우 TA 및 GA 세트 또는 quadricep 세트를 사용합니다. 컨트롤에 1개의 마우스를 사용하는 경우 750μL의 FACS 버퍼에 셀을 재현탁합니다. 마우스가 여러 개인 경우 각 TA 및 GA 또는 quadricep 세트를 500μL의 FACS 버퍼에 재현탁시키고 각 샘플에서 분획을 취하여 세트를 단일 1mL 샘플로 결합합니다. 염색을 위해 50mL 폴리프로필렌 튜브에 50μL의 대조 세포(3–5 x 105 개 세포)를 추가합니다.
- 표 4에 설명된 대로 어두운 곳에서 45°C에서 4분 동안 염색합니다.
- 5mL의 FACS 완충액을 추가하여 모든 염색된 시료를 세척합니다. 1mL의 FACS 완충액과 원심분리기(380 x g, 10분, 4°C)를 추가하여 대조군을 세척합니다.
- 모든 염색된 시료를 1mL의 FACS 완충액 + DAPI에 재현탁시킵니다. DAPI를 사용하거나 사용하지 않고 300μL의 FACS 버퍼에 컨트롤을 다시 일시 중단합니다.
- 4개의 레이저(405 nm, 488 nm, 561 nm, 633 nm)가 있는 유세포 분석기에서 분류할 때까지 세포를 어두운 곳에서 4°C로 유지하십시오.
- 분류기에서 제어 장치와 샘플을 실행하고 관련 소프트웨어를 사용하여 분류 게이트를 생성합니다. 염색되지 않은/단색 컨트롤 및 FMO 컨트롤의 경우 각각 1 x 104 및 0.3–1 x 105 이벤트를 기록합니다. 모든 염색 샘플의 경우 최대 1 x 106 이벤트를 기록합니다. 모든 염색된 샘플을 모두 분류하거나 다운스트림 분석 요구 사항에 따라 필요한 만큼 분류합니다. 여기에 사용된 유세포 분석기(FACSAria III)의 경우 70mm 노즐을 사용하여 순도 모드에서 분류합니다.
- gating 전략에 대해서는 그림 4 를 참조하십시오.
- unstained 및 single-color 컨트롤을 사용하여 볼륨을 설정합니다.tage 모든 감지기의.
- 단색 컨트롤을 사용하여 보정 매트릭스를 설정합니다.
- FMO 컨트롤을 사용하여 정렬 게이트를 설정합니다.
- 뚜렷한 근육 줄기 및 전구 세포 집단은 얼음처럼 차가운 FACS 완충액으로 분류됩니다.
- 세포 집단을 원심분리기(380 x g, 10분, 4°C)합니다. 적절한 버퍼에서 다시 중단하고, 개수를 세고, 다운스트림 분석을 계속합니다.
결과
여기에서는 (i) 골격근에서 줄기 세포 및 전구 세포의 세포 및 분자 역학을 연구하기 위해 notexin 주입에 의한 급성 부상 시간 경과의 고차원 CyTOF 분석을 포함하는이 결합 된 접근법을 사용하기위한 실험 설정의 개요를 제시합니다 (그림 1, 상단 계획). (ii) 두 개의 세포 표면 마커인 CD9 및 CD104를 사용하여 줄기 및 전구 세포의 FACS를 사용하여 이러한 집...
토론
골격근 재생은 성체 줄기 세포의 기능에 의존하는 역동적인 과정입니다. 이전 연구는 재생 중 근육 줄기 세포의 역할에 초점을 맞추었지만, 생체 내 자손은 주로 이러한 세포 집단을 식별하고 격리하는 도구가 부족하기 때문에 연구가 부족했습니다 15,16,17,18. 여기에서...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
기술 지원을 제공해 주신 오르후스 대학교 생물의학과의 FACS 핵심 시설 구성원에게 감사드립니다. 논의와 지원에 대해 Biomedicine의 질량 세포분석 부서 관리자인 Alexander Schmitz에게 감사드립니다. 과학 일러스트레이션은 Biorender.com 를 사용하여 제작되었습니다. 이 연구는 Novo Nordisk Foundation이 E.P.에게 제공하는 AUFF(Aarhus Universitets Forskningsfond) 시작 보조금과 0071113(Start Package) 보조금으로 운영되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
참고문헌
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유