Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüksek Boyutlu Tek Hücreli Kütle Sitometrisi ile Akut İskelet Kası Yaralanması Sırasında İn Vivo Miyojenik Progenitörlerin Tanımlanması ve Analizi
Bu Makalede
Özet
Burada sunulan protokol, kas sapı ve progenitör hücrelerin tek hücreli kütle sitometrisi ile tanımlanmasını ve yüksek boyutlu analizini ve işlevlerinin derinlemesine incelenmesi için FACS ile saflaştırılmasını sağlar. Bu yaklaşım, hastalık modellerinde rejenerasyon dinamiklerini incelemek ve farmakolojik müdahalelerin etkinliğini test etmek için uygulanabilir.
Özet
İskelet kası rejenerasyonu, yetişkin kas kök hücreleri ve onların soyları tarafından yönlendirilen dinamik bir süreçtir. Çoğunlukla sabit bir durumda hareketsiz olan yetişkin kas kök hücreleri, kas yaralanması üzerine aktive olur. Aktivasyonu takiben çoğalırlar ve döllerinin çoğu, füzyona yetkin kas hücreleri oluşturmak için farklılaşırken, geri kalanlar kök hücre havuzunu yenilemek için kendi kendini yeniler. Kas kök hücrelerinin kimliği, hücre yüzey belirteçlerinin birlikte ekspresyonuna dayalı olarak on yıldan daha uzun bir süre önce tanımlanırken, miyojenik progenitörler, yüksek boyutlu tek hücreli yaklaşımlar kullanılarak ancak son zamanlarda tanımlanmıştır. Burada, kas rejenerasyonu sırasında ortaya çıkan hücresel ve moleküler dinamikleri çözmek için akut kas hasarında kök hücreleri ve progenitör hücreleri analiz etmek için tek hücreli bir kütle sitometrisi (uçuş zamanına göre sitometri [CyTOF]) yöntemi sunuyoruz. Bu yaklaşım, dinamik ekspresyonu, miyogenezin dönüm noktalarını temsil eden aktive edilmiş kök hücrelerin ve progenitör hücre popülasyonlarının tanımlanmasını sağlayan yeni hücre yüzeyi belirteçlerinin ve anahtar miyojenik transkripsiyon faktörlerinin eşzamanlı olarak saptanmasına dayanmaktadır. Daha da önemlisi, hücre yüzeyi belirteçleri CD9 ve CD104'ü tespit etmeye dayanan bir sıralama stratejisi tanımlanmıştır ve bu da işlevlerinin derinlemesine incelenmesi için floresanla aktive edilen hücre sınıflandırması (FACS) kullanılarak kas sapı ve progenitör hücrelerin prospektif izolasyonunu sağlar. Kas progenitör hücreleri, kas kök hücre kaderinin kontrolünü incelemek, kas hastalıkları için yeni terapötik hedefleri belirlemek ve rejeneratif tıp için hücre tedavisi uygulamaları geliştirmek için kritik bir eksik bağlantı sağlar. Burada sunulan yaklaşım, spesifik sinyal yolaklarını hedef alan farmakolojik müdahaleler gibi bozulmalara yanıt olarak kas sapı ve progenitör hücreleri in vivo olarak incelemek için uygulanabilir. Ayrıca, kas hastalıklarının hayvan modellerinde kas kökü ve progenitör hücrelerin dinamiklerini araştırmak, kök hücre hastalıkları hakkındaki anlayışımızı ilerletmek ve tedavilerin geliştirilmesini hızlandırmak için de kullanılabilir.
Giriş
İskelet kası vücutta kütlece en büyük dokuyu oluşturur ve görmeden solunuma, duruştan harekete ve metabolizmaya kadar birçok işlevi düzenler1. Bu nedenle, iskelet kası bütünlüğünü ve işlevini korumak sağlık için kritik öneme sahiptir. Karmaşık bir sinir ve kan damarı ağı ile çevrili, sıkıca paketlenmiş çok çekirdekli miyofiber demetlerinden oluşan iskelet kası dokusu, dikkate değer rejeneratif potansiyel sergiler 1,2.
İskelet kası rejenerasyonunun ana itici güçleri yetişkin kas kök hücreleridir (MuSC'ler). Uydu hücreleri olarak da bilinen, miyofiberin plazma zarına bitişik ve bazal laminanın altındaki benzersiz anatomik konumları nedeniyle, ilk olarak 1961'de tanımlandılar3. MuSC'ler benzersiz bir moleküler markör, transkripsiyon faktörü eşleştirilmiş kutu 7 (Pax7)4'ü ifade eder. Çoğunlukla sağlıklı yetişkinlerde hareketsizdirler, kas yaralanması üzerine aktive olurlar ve çoğalırlar ve (i) kas hasarını onarmak için yeni miyolifler oluşturacak füzyona yetkin kas hücrelerine farklılaşacak veya (ii) kök hücre havuzunu yenilemek için kendini yenileyecek döllere yol açarlar5.
Hücresel ve moleküler düzeyde, rejenerasyon süreci oldukça dinamiktir ve miyojenik düzenleyici faktörler (MRF'ler) olarak da bilinen anahtar miyojenik transkripsiyon faktörlerinin koordineli ekspresyonu ile karakterize edilen hücre durumu geçişlerini içerir6,7. Önceki in vivo gelişimsel çalışmalar, soy izleme deneyleri ve miyoblastlar kullanılarak yapılan hücre kültürü çalışmaları, bu transkripsiyon faktörlerinin sıralı ekspresyonunun miyogenezi yönlendirdiğini, miyojenik faktör 5'in (Myf5) aktivasyon üzerine eksprese edildiğini, miyojenik farklılaşma 1 (MyoD1) ekspresyonunun miyojenik programa bağlılığı işaret ettiğini ve miyojenin (MyoG) ekspresyonunun farklılaşmayı işaretlediğinigöstermiştir 8,9,10,11, 12,13,14. Bu bilgiye ve MuSC'leri saflaştırmak için hücre yüzeyi belirteçlerinin keşfine rağmen, miyojenik farklılaşma yolu boyunca ayrı popülasyonları tanımlamak ve izole etmek ve in vivo miyojenik bir ilerlemeyi çözmek için stratejiler ve araçlar eksiktir 15,16,17,18.
Burada, iskelet kasındaki kök ve progenitör hücrelerin tanımlanmasını ve akut kas yaralanması bağlamında hücresel, moleküler ve proliferasyon dinamiklerinin analizini sağlayan, yakın zamanda yayınlanan araştırmalara dayanan yeni bir yöntem sunuyoruz19. Bu yaklaşım, anahtar hücre yüzeyi belirteçlerini (α7 integrin, CD9, CD44, CD98 ve CD104), hücre içi miyojenik transkripsiyon faktörlerini (Pax7, Myf5, MyoD ve MyoG) ve bir nükleosit analogunu (5-İyodo-2'-deoksiuridin, IdU) aynı anda tespit etmek için tek hücreli kütle sitometrisine (Uçuş Zamanına Göre Sitometri [CyTOF] olarak da bilinir] dayanır19,20, 21,22,23. Ayrıca, protokol, bu hücre popülasyonlarını floresanla aktive edilen hücre sınıflandırması (FACS) ile saflaştırmak için CD9 ve CD104 olmak üzere iki hücre yüzeyi markörünün tespitine dayanan bir strateji sunar, böylece yaralanma ve kas hastalıkları bağlamında işlevlerinin gelecekteki derinlemesine çalışmalarını mümkün kılar. Primer miyoblastlar geçmişte in vitro miyojenik farklılaşmanın geç aşamalarını incelemek için yaygın olarak kullanılmış olsa da, in vivo bulunan kas progenitör hücrelerinin moleküler durumunu özetleyip özetlemedikleri bilinmemektedir 24,25,26,27,28,29,30 . Miyoblastların üretimi zahmetli ve zaman alıcıdır ve bu birincil kültürün moleküler durumu31 geçtikten sonra hızla değişir. Bu nedenle, bu yöntemle saflaştırılan yeni izole edilmiş miyojenik progenitörler, miyogenezi ve ex-vivo genetik veya farmakolojik manipülasyonların etkisini incelemek için daha fizyolojik bir sistem sağlayacaktır.
Burada sunulan protokol, örneğin kas hastalıklarının hayvan modellerinde, akut genetik manipülasyonlara yanıt olarak veya farmakolojik müdahaleler üzerine miyojenik kompartmanın dinamiklerini in vivo olarak incelemek, böylece farklı biyolojik bağlamlarda kas kök hücre disfonksiyonu hakkındaki anlayışımızı derinleştirmek ve yeni terapötik müdahalelerin geliştirilmesini kolaylaştırmak gibi çeşitli araştırma sorularını ele almak için uygulanabilir.
Protokol
Hayvan prosedürleri Danimarka hayvan deneyleri müfettişliği tarafından onaylandı (protokol # 2022-15-0201-01293) ve deneyler Aarhus Üniversitesi'nin kurumsal yönergelerine uygun olarak gerçekleştirildi. Analjezi (buprenorfin), farelerin tada uyum sağlaması için yaralanmadan 24 saat önce içme suyunda sağlanır. İçme suyuna buprenorfin verilmesine yaralanma sonrası 24 saat boyunca devam edilir. Akut kas yaralanması sırasında deri altı (s.c.) buprenorfin enjeksiyonu ile birlikte, noteksin enjeksiyonundan sonra içme suyundaki buprenorfin, yaralanma ile ilişkili ağrıyı hafifletecektir. Akut kas yaralanması sırasında bir s.c. buprenorfin enjeksiyonu, ardından içme suyuna buprenorfin uygulanması tavsiye edilirken, yaralanmadan önce içme suyuna buprenorfin verilmesi isteğe bağlıdır. Bununla birlikte, araştırmacılar, uygun düzenleyici kurum tarafından belirlenen hayvan refahı standartlarına ve yönergelerine uymalıdır.
NOT: Yaralı arka bacak kaslarının tek hücreli kütle sitometrisi (CyTOF) deneyleri için, bölüm 1'den başlayın: Kas yaralanmasından 24 saat önce, yaralanmadan 24 saat sonrasına kadar suda analjezi. Yaralanmamış farelerden kas sapı ve progenitör hücrelerin sınıflandırılması için, bölüm 5 ve 6'yı gerçekleştirin: Ötenazi + İskelet kası diseksiyonu ve dissosiyasyonu ve bölüm 11: FACS için florofor konjuge antikorlarla boyamaya devam edin. Deney düzeneğine ve protokole genel bir bakış Şekil 1'de gösterilmektedir.
1. Kas yaralanmasından 24 saat öncesinden yaralanmadan 24 saat sonrasına kadar suda analjezi
- Koyu veya alüminyum folyo kaplı bir içme şişesine 3 mL buprenorfin (0.3 mg / mL) ekleyin ve yaralanma öncesi 24 saat 0.009 mg / mL'lik bir nihai konsantrasyona ulaşmak için filtrelenmiş su ile 100 mL'ye doldurun. Fare kafesine takın.
- Yaralanmadan 24 saat sonra içme şişesini çıkarın ve fare kafesini içme valfi sistemine yeniden bağlayın.
2. Akut yaralanma prosedürü için hazırlık
NOT: Çalışma tezgahını, burun konisi kurulumunu ve indüksiyon kutusunu dezenfekte etmek için %70 etanol kullanın.
- PBS'de (5 μg / mL) seyreltilmiş noteksin içeren 1.5 mL'lik bir tüp hazırlayın. Buprenorfini (0.3 mg / mL) steril% 0.9 salin içinde ışığa dayanıklı 1.5 mL'lik bir tüpte 0.015 mg / mL'ye seyreltin. Buz üzerinde tutun. Buprenorfin (28 G, 0.5 mL) ve notexin enjeksiyonları (29 G, 0.3 mL) için insülin şırıngaları hazırlayın.
- İzofluran bazlı anestezik üniteleri yapılandırın:
- Bir indüksiyon kutusunda anestezi için, 1.5 L / dak akışlı% 3 izofluran kullanın (% 50 O2,% 50 atmosferik hava).
- Burun konisi kurulumu kullanan bakım için, 0,6 L/dk akışla (%50 O2, %50 atmosferik hava) %1,5 izofluran kullanın.
3. Notexin enjeksiyonu ile akut yaralanma
DİKKAT: Notexin, FosfolipazA2 aktivitesine sahiptir ve Avustralya kaplan yılanından (Notechis scutatus) elde edilen zehirin ana bileşenidir ve farelerde 5-17 mg notexin / kg intravenöz LD50 ile32,33. Bu protokolde, her bir arka ayağın Tibialis Anterior (TA) kasına 10 μL 5 mg/mL notexin enjekte edilir ve her bir arka ayağın Gastrocnemius (GA) kasına 15 μL 5 mg/mL notexin ile iki kez (kasın her bir başına bir kez) enjekte edilir. Hasarı sınırlamak için kas içi (i.m.) enjeksiyonları doğru bir şekilde yapmak ve minimum ağrıyı sağlamak için enjekte edilen hayvanları sık sık incelemek önemlidir.
- Fareyi indüksiyon kutusunda uyuşturun (% 3 izofluran). Fare bilinçsiz olduğunda, indüksiyon kutusunda izofluran seviyesini %1,5'e düşürün.
- Fareleri kurumsal onaylı prosedürlere göre tartın ve ayrı ayrı işaretleyin. Burun konisi kurulumunun altında, arka ayakları bir düzeltici ile tıraş edin ve indüksiyon kutusuna geri aktarın.
- Her fare için buprenorfin hacmini hesaplayın:
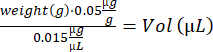
- Notexin çözeltisini yukarı ve aşağı pipetleyerek karıştırın. TA enjeksiyonları için 10 μL noteksin çözeltisi (5 μg / mL) ile yüklenmiş 2 insülin şırıngası (29 G, 0.3 mL) ve GA enjeksiyonu için 15 μL noteksin çözeltisi (5 μg / mL) ile yüklenmiş 4 insülin şırıngası hazırlayın.
NOT: Tibialis Anterior (TA) kası, farenin alt bacağının ön tarafında, dizden ayak bileğine kadar uzanan bir yerde bulunur. Gastroknemius (GA) kası, alt bacağın arkasında, soleusa yüzeysel olarak yerleştirilmiş iki başlı bir kastır. Dizin hemen üzerindeki iki başından (medial ve lateral) topuğa kadar uzanır ve toplam üç eklem (diz, ayak bileği ve subtalar eklemler) boyunca uzanır. - Kas içi enjeksiyonlar yapın
- TA enjeksiyonu (toplam 2 enjeksiyon)
- Fareyi burun konisi kurulumunun altına sırtüstü pozisyonda yerleştirin ve enjeksiyon bölgesini steril alkollü mendillerle (%70 etanol veya izopropanol) dezenfekte edin. İğneyi, eğim aşağı, TA'nın göbeğine (göbeğin ortasının distaline) 30° açıyla sokun. TA'nın orta karnına ulaşmak için iğneyi tibiaya paralel hareket ederek kas boyunca ilerletin. Noteksini yavaşça ve sürekli olarak enjekte edin, iğneyi geri çekmeden önce 10 saniye yerinde bırakın. İğneyi başlangıçta çok derine sokmayın (TA'nın altına ekstansör digitorum longus kasına noteksin enjekte etmekten kaçınmak için) ve iğneyi ilerletirken proksimal olarak çok uzağa sokmayın (dize çok yakın enjekte etmekten kaçınmak için).
- GA enjeksiyonu (toplam 4 enjeksiyon)
- İğneyi, eğim aşağı, GA'nın yan başının orta göbeğine ~ 45 ° açıyla yerleştirin. Noteksini yavaşça ve sürekli olarak enjekte edin, iğneyi geri çekmeden önce 10 saniye yerinde bırakın. Arka ayağı döndürün ve yukarıdaki gibi GA kasının medial kafasına notexin enjekte edin. İğneyi çok derine batırmamaya özen gösterilmelidir.
- TA enjeksiyonu (toplam 2 enjeksiyon)
- Fareyi ters çevirin ve bir insülin şırıngası (28 G, 0.5 mL) kullanarak buprenorfin sc enjekte edin. Fareyi bir ısıtma plakası üzerindeki boş bir kurtarma kafesine aktarın. Farenin geri kazanım sırasında termoregülasyon yapmasına izin vermek için kafes tabanının sadece yarısı ısıtma plakasının üzerine yerleştirilmelidir34. Kalan fareler için 3.3–3.6 adımlarını tekrarlayın.
- Kurtarma kafesindeki fare tamamen uyandığında, orijinal kafese geri taşıyın. Ahıra geri koyun ve ıslatılmış yemek ile destekleyin. Enjeksiyondan 24 saat sonra buprenorfin içme şişesini çıkarın.
- Fareleri notexin enjeksiyonundan sonra 6 saat boyunca ve daha sonra 2 gün boyunca her 12 saatte bir ağrı, hareket bozukluğu ve azalmış gıda tüketimi belirtileri açısından izleyin35,36.
4. 5-İyodo-2 '-deoksiüridin enjeksiyonu
DİKKAT: 5-İyodo-2'-deoksiüridin (IdU) genetik kusurlara neden olduğundan ve doğurganlığa veya doğmamış çocuğa zarar verdiğinden şüphelenilmektedir. Kullanmadan önce güvenlik bilgi formunu (SDS) okuyun. Kullanım sırasında kişisel koruyucu ekipman giyilmelidir. IdU tozunu tartarken çeker ocak kullanın. IdU ile temas etmiş malzemeler yerel güvenlik yönetmeliklerine göre atılmalıdır.
NOT: İn vivo IdU etiketlemesi, iyotlu bir timidin analoğu olan IdU, S fazındaki hücrelerin DNA'sına dahil edildiğinden, yaralanma süresi boyunca hücre bölünmesini izlemek için kullanılır. IdU, fareyi sakrifiye etmeden 8 saat önce 20 mg / kg vücut ağırlığında intraperitoneal (i.p.) enjekte edilir.
- Steril PBS'de 2 mg / mL stok IdU çözeltisi hazırlamak için 37 ° C'de bir sonikatör kullanın. IdU ışığa duyarlıdır; aynı gün içinde kullanın veya -20 °C'de 3 aya kadar dondurun. Dondurulmuş IdU kullanılıyorsa: çözdürün, girdap, 30 saniye boyunca 10.000 x g'da santrifüjleyin ve aşağıdaki enjeksiyonlar için süpernatanı kullanın.
- Fareyi indüksiyon kutusunda uyuşturun (% 3 izofluran). Ayırmaya dikkat edin, fareleri tartın ve IdU çözeltisinin hacmini hesaplayın:
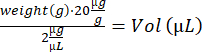
- Bir insülin şırıngası (28 G, 0.5 mL) kullanarak i.p. enjeksiyonu yapın ve fareyi bir ısıtma plakası üzerindeki boş bir kurtarma kafesine aktarın. Uyandığınızda, fareyi orijinal kafesine geri getirin. Kalan fareler için 4.2–4.3 adımlarını tekrarlayın ve onları ahıra geri koyun.
5. Ötenazi
NOT: Tampon tarifleri için Tablo 1'e bakın. Yıkama ortamı hazırlayın (Besin karışımı F-10 (Jambon), %10 at serumu, 1x Kalem/Strep) ve bir polietersülfon (PES) membranından polistiren bir kaba süzün. Ayrışma tamponu hazırlayın (650 U/mL Kollajenaz ile desteklenmiş yıkama ortamı, Tip II) ve buz üzerinde tutun. CyTOF kütle sitometrisi ölçümleri kontaminantlara karşı çok hassastır. Bu nedenle, numune işleme için en yüksek analitik dereceli reaktiflerin kullanılması esastır. Metal kontaminasyonunu önlemek için, steril plastik eşyaların ve hiç deterjanla yıkanmamış yeni cam eşyaların kullanılması şiddetle tavsiye edilir, çünkü birçok laboratuvar sabunu yüksek düzeyde baryum içerir. Reaktif hazırlama için çift filtreli, damıtılmış, deiyonize su kullanılması tavsiye edilir. Fosfat tamponlu salin (PBS) şirket içinde hazırlanır. 10x stoğu 1x'e seyreltin ve 1x PBS'yi 0,2 μm filtrelerle filtreleyin. Her deneyin başında 1x PBS'yi tekrar filtreleyin. Baryum varlığından dolayı diseksiyon aletleri deterjanla temizlenmemelidir.
- Tartıyı, kabı ve izofluran bazlı anestezik ünitesini indüksiyon kutusuyla hazırlayın. Uygun diseksiyon aletlerini dezenfekte edin.
- Her fare için 5 mL ayrışma tamponu ve bir Petri kabı ile 50 mL'lik tüpler hazırlayın ve işaretleyin. Ayrışma tamponunu buz üzerinde tutun.
- Fareyi indüksiyon kutusunda uyuşturun (% 3 izofluran,bilinçsiz olduğunda% 5'e yükseltin) ve servikal çıkık yapın.
6. İskelet kası diseksiyonu ve dissosiyasyonu
- TA ve GA kaslarını her iki arka ayaktan kesin ve bir Petri kabının kapağına aktarın. Dokuyu kıyılmış bir bulamaç halinde kesmek için makas kullanın (~ 1 mm3 parça). 5 mL buz gibi soğuk ayrışma tamponu içeren 50 mL'lik bir tüpe aktarın. Buz üzerinde tutun.
- Tüm fareler işlenene kadar ötenazi prosedürünü (adım 5.3) ve iskelet kası diseksiyonu ve ayrışma prosedürünü (adım 6.1) tekrarlayın.
- Tüm numune tüplerini 37 °C'lik bir su banyosunda (2 dakika) önceden ısıtın ve bir inkübatörde (37 °C) dönüşümlü olarak 45 dakika inkübe edin.
- Vorteksleyin ve 10 mL yıkama ortamı ekleyerek yıkayın. Santrifüjleyin (380 x g, 10 dk, oda sıcaklığı [RT]) ve 4 mL'ye aspire edin.
- 0.5 mL kollajenaz (1000 U / mL) ve 0.5 mL dispas (11 U / mL) ekleyin. Girdap yapın ve 37 ° C'de rotasyonda 20 dakika inkübe edin (örneğin, bir inkübatörde). Santrifüjleyin (380 x g, 1 dk, RT) ve 5 mL'lik bir pipetle tekrar süspanse edin.
- 50 mL'lik tüplere 40 μm hücre süzgeçleri ekleyin ve 5 mL yıkama ortamı ile önceden ıslatın. 20 G iğne ile 5 mL'lik bir şırınga kullanarak hücre süspansiyonunu 10 kez aspire edin ve çıkarın. Önceden ıslatılmış 40 μm hücre süzgecinden süzün. 50 mL'lik tüpü 10 mL'lik yıkama ortamı ile yıkayın, 40 μm'lik hücre süzgecine aktarın ve hücre süspansiyonunu santrifüjleyin (380 x g, 10 dk, 4 °C).
7. Sisplatin ve paraformaldehit fiksasyonu ile canlı / ölü boyama
DİKKAT: Sisplatin ve paraformaldehit (PFA) kanserojendir. Kullanmadan önce SDS'yi okuyun. Paraformaldehit (PFA; %16) cildi, gözü ve solunumu tahriş eder. Kişisel koruyucu ekipman giyin ve bu maddeleri çeker ocak altında tutun. Hücrelerin fiksasyonu sırasında, nihai PFA konsantrasyonu% 1.6 olacaktır. Doğru koruyucu önlemler alınmalı ve atıklar yerel yönetmeliklere göre ele alınmalıdır.
NOT: Soğuk (4 °C) ve ılık (37 °C) serumsuz DMEM hazırlayın. % 10 FBS ile takviye edilmiş DMEM hazırlayın, bir PES membranından polistiren bir kaba süzün ve buz üzerinde tutun. PBS ve hücre boyama ortamını hazırlayın (CSM; PBS, %0.5 BSA, %0.02 sodyum azid) CyTOF'a özel bir cam şişede ve bir PES membranından süzün. CSM 4 °C'de 6 aya kadar saklanabilir.
- Süpernatanı aspire edin, peleti hafifçe vurun ve 1 mL soğuk serumsuz DMEM'de yeniden süspanse edin. Hücreleri sayın ve serumsuz DMEM'de hücre yoğunluğunu 1 x 106 hücre / mL olarak ayarlayın.
- 25 μM'lik bir nihai konsantrasyona sisplatin stoğu (25 mM) ekleyin. 10 s vorteks yapın ve tam olarak 1 dakika inkübe edin (reaksiyon çok zamana duyarlıdır). Buz gibi soğuk DMEM +% 10 FBS (numune hacminin 3 katı) ile reaksiyonu söndürün ve buz üzerinde tutun. Santrifüj (380 x g, 10 dk, 4 °C), süpernatanı aspire edin ve peleti iyice yeniden süspanse edin (CSM'de 10 x 106 hücre / mL'ye kadar). Süspansiyonu 35 μm'lik bir hücre süzgecinden geçirin.
- Hücre süspansiyonunu filtrelenmiş PFA stok çözeltisi (%16) ile sabitleyin ve nihai PFA konsantrasyonuna (%1,6) ulaşmak için yukarı ve aşağı pipetleyin (%1,6) (örneğin, 900 μL hücre süspansiyonuna 100 μL %16 PFA ekleyin). 30 saniye vorteks yapın, buz üzerinde 10 dakika inkübe edin ve santrifüjleme ile 2 mL CSM ile iki kez yıkayın (800 x g, 5 dk, RT).
NOT: Bu noktada, numuneler kuru buz üzerinde dondurulabilir ve -80 °C'de saklanabilir veya doğrudan antikor boyaması için kullanılabilir. Hücreler dondurulacaksa, polistiren düşük sıcaklıklarda çatlayabileceğinden, hücreleri 5 mL polipropilen tüplere aktarın. Boyama için yeni sabitlenmiş hücreler kullanılıyorsa, adım 8.2'ye geçin.
8. Metal konjuge antikorlarla boyama
DİKKAT: Metanol (MeOH) son derece yanıcıdır ve solunum yolları için aşındırıcıdır. Kullanmadan önce SDS'yi okuyun. Kişisel koruyucu ekipman giyin ve bu maddeyi çeker ocak altında tutun. Atıkları yerel yönetmeliklere uygun olarak işleyin.
NOT: Yüzey belirteçlerini ve hücre içi belirteçleri hedefleyen antikorların (Ab) listesi Tablo 2'de bulunabilir.
Antikor konjugasyonu: Bu protokolde kullanılan antikorların çoğu, ticari olarak mevcut olmadıkları için kurum içinde konjuge edildi. Antikorların metal konjugasyonu için protokoller daha önce yayınlanmıştır ve konjugasyon kitleri artık ticari olarak temin edilebilir37,38. İmmünoglobulin tip G (IgG) mevcut konjugasyon protokolleri ile uyumludur. Metal konjugasyonu için kullanılan antikor formülasyonunun, polimerin serbest maleimid grupları için rekabet ederek konjugasyon verimliliğini etkileyebilecek sistein içeren taşıyıcı proteinlerden (örneğin, sığır serum albümini (BSA)) içermemesi ve metal konjuge antikorun miktar tayinine müdahale edebilmesi çok önemlidir. Jelatinin sistein içeriği BSA'nınkinden çok daha düşüktür. Bununla birlikte, antikor formülasyonu taşıyıcı proteinler içeriyorsa, bu tür proteinlerin konjugasyondan önce çıkarılması önerilir. Artık üreticiden BSA ve jelatin içermeyen antikorlar talep etmek mümkün. Küçük moleküllü koruyucular (örn., sodyum azid, gliserol ve trehaloz) metal konjugasyon protokolleri37,38 ile uyumludur.
Antikor titrasyonu: Her metal konjugasyonundan sonra, maksimum sinyal-gürültü oranını sağlayan optimal antikor konsantrasyonunu belirlemek için antikorlar titre edilmelidir. Antikor titrasyonu için, 6 aşamalı iki katlı bir seri seyreltme gerçekleştirin ve ifade ettiği bilinen her iki numuneyi (örneğin, kas hücreleri, pozitif kontroller) ve ilgilenilen proteini eksik (negatif kontroller) 19,21,37,38 boyayın.
Stoku PBS /% 1.6 PFA'da 0.1 μM'ye seyrelterek taze Cell-ID Intercalator-Ir (stok = 500 μM; interkalatör-ir çözeltisi) çalışma çözeltisini hazırlayın.
- Dondurulmuş numuneleri RT'de 5 dakika çözdürün ve santrifüjleyin (800 x g, 1 dk, RT). Santrifüjleme ile 2 mL CSM ile yıkayın (800 x g, 5 dk, RT).
- CSM'de 2,5x yüzey antikoru (Ab) boyama karışımı hazırlayın. Süpernatanı ~ 60 μL'ye aspire edin ve peleti iyice yeniden süspanse edin. 40 μL yüzey Ab boyama karışımı ekleyerek ve RT'de 1 saat inkübe ederek hücreleri boyayın.
- Karıştırmak için numuneleri her 20 dakikada bir hafifçe vurun. Santrifüjleme ile 1 mL CSM ile iki kez yıkayın (800 x g, 5 dk, RT). Süpernatanı aspire edin ve peleti hafifçe vurun.
NOT: Hücre içi boyamaya gerek yoksa, metanol geçirgenliği gerekli değildir. Bununla birlikte, sadece yüzey boyama yapılırsa, interkalatör-ir çözeltisinin, nükleer membrana nüfuz etmek için geçirgenleştirici bir ajan (örneğin, Maxpar fix ve perma tamponu) içeren bir tampon içinde seyreltilmesi gerekir. Adım 8.5'e geçin ve Cell-ID Intercalator-Ir'yi geçirgenleştirici bir ajan ve %1.6 PFA içeren bir tampon içinde seyreltin. Aksi takdirde, aşağıdaki hücre içi boyamaya devam edin.
DİKKAT: İridyum tehlikelidir ve güvenli kullanım için önlemler alınmalıdır. İridyum yanıcıdır ve gözleri/cildi tahriş eder. Toz veya duman oluşturmaktan ve solumaktan kaçının. Cilt ve gözlerle temasından kaçının. Bununla birlikte, interkalatör-ir çözeltisi karışımı, kimyasalların sınıflandırılması ve etiketlenmesine ilişkin küresel uyumlaştırılmış sisteme (GHS) göre tehlikesiz olarak kabul edilen suda %<1'lik bir konsantrasyonda sağlanır. Kullanmadan önce Standart Biotools'tan SDS'yi okuyun. Kullanım sırasında kişisel koruyucu ekipman giyilmelidir. İnterkalatör-ir çözeltisi ile temas halinde olan malzemeler, yerel güvenlik yönetmeliklerine göre atılmalıdır. - Hücrelere nüfuz etmek için, girdap yaparken damla damla 0.5 mL buz gibi MeOH ekleyin. Çeker ocak altında buz üzerinde 15 dakika inkübe edin. Santrifüjleyin (800 x g, 5 dk, RT) ve ardından santrifüjleme ile 1 mL CSM ile iki kez yıkayın (800 x g, 5 dk, RT). Son yıkamadan sonra, süpernatanı ~ 60 μL'ye aspire edin ve peleti iyice yeniden süspanse edin.
- CSM'de 2.5x hücre içi Ab boyama karışımı hazırlayın. 40 μL hücre içi Ab boyama karışımı ekleyerek ve RT'de 1 saat inkübe ederek hücreleri boyayın. Karıştırmak için numuneleri her 20 dakikada bir hafifçe vurun.
- Santrifüjleme ile 1 mL CSM ile iki kez yıkayın (800 x g, 5 dk, RT). Süpernatanı aspire edin ve peleti hafifçe vurun. Numuneleri 0.5 mL interkalatör-iridyum çözeltisi (Tablo 1) ve girdap içinde yeniden süspanse edin. Numuneleri RT'de 1 saat veya gece boyunca (O/N) 4 °C'de inkübe edin (aşağıdaki nota bakın).
NOT: Numuneler, interkalatör-iridyum çözeltisinde 4 ° C'de 48 saate kadar saklanabilir. Bu çalışmada kullanılan boyama protokolü, Nolan lab{C}23 tarafından yapılan öncü çalışmalara dayanarak geliştirilmiştir. (i) yıkama ve boyama için kurum içi hazırlanmış tamponlar kullanıldığından, (ii) hücreler yüzey boyamadan önce sabitlendiğinden ve (iii) hücreler, transkripsiyon faktörlerine veya sinyal moleküllerine karşı antikorlarla hücre içi boyama için metanol ile geçirgendiğinden, Standart Biotools protokollerinden farklıdır. Yeni bir protokol geliştiren araştırmacılar, antikor panellerinin geçirgenlik ajanı olarak metanol ile uyumluluğunu kapsamlı bir şekilde test etmelidir. Bir panele yeni antikorlar eklerken, metal konjugasyonu ve titrasyonundan önce pozitif ve negatif kontrol numuneleri kullanılarak akış sitometrisi ile antikor özgüllüğünün test edilmesi önerilir.
9. Kütle sitometresine yükleme için numune hazırlama
NOT: Hücre peletleri CAS tamponundayken çok gevşektir (Malzeme Tablosu). CAS tamponu ile yıkamalar sırasında kuruluğa kadar aspire etmeyiniz. Bunun yerine, aşağıda açıklandığı gibi artık bir hacim tutun.
- Vorteks ve santrifüj (800 x g, 10 dk, RT) numuneler. Süpernatanı dökün (PFA atığı olarak tutun) ve girdap.
- Santrifüjleme ile 1 mL CSM ile yıkayın (800 x g, 10 dk, RT). Süpernatanı aspire edin ve peleti hafifçe vurun.
- Santrifüjleme ile 1 mL CAS tamponu ile yıkayın (800 x g, 10 dk, RT). ~ 200 μL'ye aspire edin. Vorteks ve 1 mL CAS tamponu ekleyin. Hücre sayımı için 5 μL alikot çıkarın. Santrifüjleyin (800 x g, 10 dk, RT) ve dikkatlice ≤50 μL'ye aspire edin. Peletleri rahatsız etmeyin.
- Peleti CAS tamponunda 1–2 x 106 hücre/mL'ye yeniden süspanse edin ve kalibrasyon boncukları (1x; Malzeme Tablosu) 0.1x'lik bir nihai konsantrasyona kadar (örneğin, 900 μL hücre süspansiyonuna 100 μL 1x kalibrasyon boncuğu ekleyin).
- Numuneyi kütle sitometresine yükleyin ve 400-500 hücre/sn'lik bir akış hızı kullanarak veri toplayın.
- CyTOF yazılımını veya önceden geliştirilmiş normalleştirme araçlarını kullanarak FCS dosyalarının veri normalleştirmesini gerçekleştirin39.
NOT: CyTOF kütle sitometrelerinin çalışması cihaza özeldir40,41. Çalıştırmadan önce CyTOF kullanım kılavuzuna başvurmanız önerilir. Kalibrasyon boncukları, metal izotopları seryum (140 / 142Ce), öropyum (151 / 153Eu), holmiyum (165Ho) ve lutesyum (175 / 176Lu) bilinen konsantrasyonlarını içeren metale gömülü polistiren normalizasyon boncuk standartlarıdır. Kalibrasyon boncukları, öncelikle biyolojik materyalin birikmesi ve zaman içinde plazma iyonizasyonundaki değişiklikler nedeniyle zamanla değişebilen makine hassasiyetinin kontrolüne izin verir.
10. CyTOF veri analizi
NOT: Aşağı akış analizi için, normalleştirilmiş FCS dosyaları yerel olarak analiz edilebilir veya Cytobank, Cell Engine, OMIQ veya FCS Express42 gibi bulut tabanlı yazılım çözümlerine yüklenebilir.
- Gerekirse, her örnek için ayrı FCS dosyalarını tek bir dosyada birleştirin.
- Tek çekirdekli hücrelerin enkaz veya çiftlerden ayırt edilmesini sağlayan İridyum interkalatör pozitif olaylarını geçit yaparak tek hücreleri tanımlayın.
- Sisplatin negatif olaylarını seçerek canlı hücreler için kapı. Sisplatin, hücresel proteinlere kovalent olarak bağlanır ve ölmekte olan ve ölü hücreleri, canlı hücrelerden daha büyük ölçüde riskli zarlarla etiketler:43.
- İlgilenilen popülasyonu, örneğin miyojenik bölmeyi (Live/CD45-/CD31-/Sca1-/α7integrin+/CD9+) (Şekil 2A) açın ve kök ve progenitör hücrelerin nispi oranını ölçün. Bu yaklaşım, bireysel popülasyonları tanımlamak için hücre yüzeyi veya hücre içi belirteç ekspresyonu hakkında önceden bilgi sahibi olmayı gerektirir.
- Karmaşık bir popülasyon içinde daha önce tanınmamış nadir hücre alt kümelerinin tanımlanmasını sağlayacak yüksek boyutlu analiz yapmak, ilgilenilen popülasyonu dışa aktarmak ve CyTOF veri analizi için özel olarak geliştirilmiş kümeleme algoritmalarını kullanmak44.
NOT: Önceki çalışmalarda, tanımlanmış parametrelere19 dayalı olarak denetimsiz kümeleme gerçekleştirmek için yüksek boyutlu uzayda ağırlıklı k-en yakın komşu yoğunluk tahminini (kNN-DE) kullanan X-kaydırma algoritması kullanılmıştır. X-kaymasının nadir hücre popülasyonlarını tanımlamada oldukça etkili olduğu gösterilmiştir45. - X kayması analizi için vorteks yazılım paketini (Nolan lab GitHub sayfasından [https://github.com/nolanlab/vortex]) ve Java 64-bit46'yı indirin. Talimatlar burada bulunabilir: https://github.com/nolanlab/vortex/wiki/Getting-Started.
- Dışa aktarılan hücre popülasyonlarını yerel bir veritabanına yükleyin ve kümeleme parametrelerini tanımlayın. Kullanıcı tanımlı parametreler arasında (i) kümeleme için kullanılan işaretçiler, (ii) k değerlerinin aralığı (örneğin, 5 ila 150) ve (iii) kümeleme adımlarının sayısı bulunur.
NOT: Önceki çalışmalarda, kümeleme belirteçleri olarak, kas kök hücrelerinde eksprese edildiği bilinen yüzey belirteçlerinin, kas hücrelerinin ve miyoblastların yüksek verimli akış sitometrik ekranında tanımlanan yeni yüzey belirteçlerinin ve miyojenezin farklı aşamalarını tanımladığı bilinen miyojenik transkripsiyon faktörlerinin (TF'ler) bir kombinasyonu kullanılmıştır. Bu yaklaşım, daha önce tanınmayan progenitör hücre popülasyonlarını19 ayırt eden ortak ekspresyon paterni olan CD9 ve CD104 olmak üzere iki hücre yüzeyi markörünün tanımlanmasını sağlamıştır. Kümeleme işaretleyicilerinin dikkatli seçimi, araştırmacının belirli araştırma sorularını yanıtlamasına olanak tanır. Örneğin, bölünen hücre alt kümelerinin zaman içinde tanımlanması ve analizi isteniyorsa, kümeleme belirteçlerinden biri olarak IdU'nun dahil edilmesi önerilir. X-shift, birden fazla k değerinde kümeleme gerçekleştirebilir ve "dirsek noktasını" hesaplayarak, optimum küme sayısıyla sonuçlanan k değerini otomatik olarak tanımlayabilir, böylece yetersiz kümelemeyi veya aşırı parçalanmayı önleyebilir. Dirsek noktasının hesaplanması ve veri görselleştirme ve aşağı akış uygulamaları için en uygun k değeri ile tanımlanan kümeleme analizinin kullanılması önerilir. - X-kayması kümeleri içindeki hücre popülasyonları arasındaki uzamsal ilişkileri görselleştirmek için, kümeler arasındaki mesafenin yüksek boyutlu fenotipik uzayda işaretleyici ifadesindeki benzerliklerini gösterdiği bir 2B harita oluşturacak olan kuvvet yönelimli bir düzen gerçekleştirin. Her seferinde bir işaretleyici kullanarak haritayı renklendirerek, yeni hücre popülasyonlarını keşfetmek ve dinamiklerini takip etmek mümkündür. Cytobank ve Cell Engine gibi yazılımlarda manuel geçit ile takip ölçümü önerilir.
- Zaman boyunca çoklu yüzey ve hücre içi proteinlerin dinamik ekspresyonunu ölçmek ve yeni eğilimleri ortaya çıkarmak için ısı haritası analizi yapın.
NOT: Bir yaralanma zaman seyri gerçekleştirirken, bir rejenerasyon haritası oluşturmak için tüm zaman noktalarından gelen verileri bir araya getirmek mümkündür. Ek olarak, zaman içindeki rejenerasyonun hücresel ve moleküler dinamiklerini takip etmek için bu tür bir haritayı bireysel zaman noktalarına ayırmak mümkündür19.
11. FACS için florofor konjuge antikorlarla boyama
NOT: Lekesiz, tek renkli kontroller ve floresan eksi bir (FMO) kontroller için kullanılan hücreler, varsa ekstra bir fareden alınan TA ve GA setinden kaynaklanabilir. Alternatif olarak, kuadriseps (üst ön uyluk kası), yukarıda ayarlanan TA + GA ile aynı prosedürü izleyerek tek hücreli bir süspansiyona diseke edilebilir ve sindirilebilir ve kontroller için kullanılabilir. FACS tamponu hazırlayın (PBS, %2,5 Keçi serumu, 2 mM EDTA), bir PES zarından polistiren bir kaba süzün ve buz üzerinde tutun. FACS tamponu 4 °C'de 1 aya kadar saklanabilir. FACS için kullanılan antikorların bir listesi Tablo 3'te bulunabilir.
- Bir soy karışımı hazırlayın. Her kontrolü 50 μL'de boyayın (yaklaşık 3–5 x 105 hücre içerir). Gereken soy karışımı miktarını hesaplayın. %20-%30 hacim aşımı yapın. Soy karışımı için kullanılan antikorların stok konsantrasyonu 0.2 mg / mL'dir.
- 0,5 mL'lik bir tüpte, sırasıyla 1 μg/mL, 2,5 μg/mL, 2,5 μg/mL ve 0,63 μg/mL'lik nihai konsantrasyonlara ulaşmak için anti-CD45 APC-Cy7, anti-CD31 APC-Cy7, anti-Sca1 APC-Cy7 ve anti-CD11b APC-Cy7 ekleyin.
- Tüm leke karışımını hazırlayın. Tamamen lekelenmiş her numuneyi 500 μL'de boyayın (yaklaşık 3–5 x 106 hücre içerir). Tüm leke karışımından %10 fazla hacim yapın.
- 1.5 mL'lik bir tüpte, sırasıyla 2 μg / mL, 1.2 μg / mL ve 3 μg / mL'lik nihai konsantrasyonlara ulaşmak için yukarıdaki gibi soy karışımı antikorları + anti-α7 integrin PE, anti-CD9 APC ve anti-CD104 FITC ekleyin.
- FACS tamponu + DAPI'yi hazırlayın: 10 mL FACS tamponu için, 100 ng/mL nihai DAPI konsantrasyonuna ulaşmak için 1 μL DAPI (stok = 1 mg/mL) ekleyin.
DİKKAT: DAPI (4 ', 6-diamidino-2-fenilindol dihidroklorür) olası bir cilt ve solunum yolu tahriş edici olarak sınıflandırılır. Bununla birlikte, GHS'ye göre% <1'lik bir konsantrasyondaki DAPI çözeltisi tehlikesiz olarak kabul edilir. Kullanmadan önce SDS'yi okuyun. Kullanım sırasında kişisel koruyucu ekipman giyilmelidir. DAPI ile temas etmiş malzemeler yerel güvenlik yönetmeliklerine göre atılmalıdır. - Bölüm 6'daki hücreleri yeniden askıya alın: İskelet kası diseksiyonu ve dissosiyasyon:
- Tamamen lekeli numuneler için, TA ve GA setlerini tek bir fareden 500 μL FACS tamponunda yeniden süspanse edin ve boyama için 15 mL'lik tüplere aktarın.
- Denetimler için TA ve GA kümelerini veya kuadrisep kümelerini kullanın. Kontroller için 1 fare kullanıyorsanız, hücreleri 750 μL FACS tamponunda yeniden askıya alın. Birden fazla fare varsa, her bir TA ve GA veya kuadrisep setini 500 μL FACS tamponunda yeniden süspanse edin ve her numuneden bir fraksiyon alarak setleri tek bir 1 mL numunede birleştirin. Boyama için 5 mL polipropilen tüplere 50 μL kontrol hücresi (3–5 x 105 hücre) ekleyin.
- Tablo 4'te anlatıldığı gibi karanlıkta 4 °C'de 45 dakika boyayın.
- 5 mL FACS tamponu ekleyerek tüm lekeli numuneleri yıkayın. 1 mL FACS tamponu ve santrifüj (380 x g, 10 dk, 4 °C) ekleyerek kontrolleri yıkayın.
- Tüm lekeli numuneleri 1 mL FACS tamponu + DAPI içinde yeniden süspanse edin. DAPI ile veya DAPI olmadan 300 μL FACS tamponundaki kontrolleri yeniden askıya alın.
- 4 lazerli (405 nm, 488 nm, 561 nm, 633 nm) bir akış sitometresinde sıralanana kadar hücreleri karanlıkta 4 °C'de tutun.
- Kontrolleri ve numuneleri sorter üzerinde çalıştırın ve ilgili yazılımı kullanarak sıralama kapıları oluşturun. Lekesiz/tek renk kontrolleri ve FMO kontrolleri için sırasıyla 1 x 104 ve 0,3–1 x 105 olayları kaydedin. Tamamen lekeli örnekler için 1 x 106 olaya kadar kaydedin. Aşağı akış tahlil gereksinimlerine bağlı olarak, tamamı lekeli tüm numuneleri veya gerektiği kadar sıralayın. Burada kullanılan akış sitometresi (FACSAria III) için, 70 mm'lik bir nozul kullanarak Saflık Modunda sıralayın.
- Geçit stratejisi için Şekil 4'e bakın.
- Tüm dedektörlerin voltajını ayarlamak için lekesiz ve tek renkli kontrolleri kullanın.
- Telafi matrisini ayarlamak için tek renkli kontrolleri kullanın.
- Sıralama kapıları oluşturmak için FMO kontrollerini kullanın.
- Farklı kas sapı ve progenitör hücre popülasyonları buz gibi soğuk FACS tamponuna ayrılır.
- Santrifüj (380 x g, 10 dk, 4 °C) hücre popülasyonları. Uygun arabellekte yeniden askıya alın, sayın ve aşağı akış analizine devam edin.
Sonuçlar
Burada, (i) iskelet kasındaki kök ve progenitör hücrelerin hücresel ve moleküler dinamiklerini incelemek için noteksin enjeksiyonu ile akut yaralanma zaman seyrinin yüksek boyutlu CyTOF analizini içeren bu birleşik yaklaşımı kullanmak için deneysel kuruluma genel bir bakış sunuyoruz (Şekil 1, üst şema); ve (ii) bu popülasyonları izole etmek ve işlevleri hakkında derinlemesine çalışmalar yapmak için CD9 ve CD104 olmak üzere iki hü...
Tartışmalar
İskelet kası rejenerasyonu, yetişkin kök hücrelerin işlevine dayanan dinamik bir süreçtir. Önceki çalışmalar, rejenerasyon sırasında kas kök hücrelerinin rolüne odaklanmış olsa da, bunların soyları in vivo, öncelikle bu hücre popülasyonlarını tanımlamak ve izole etmek için gerekli araçların eksikliği nedeniyle yeterince çalışılmamıştır 15,16,17,18.<...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Aarhus Üniversitesi Biyotıp Bölümü'ndeki FACS Çekirdek Tesisi üyelerine teknik destek için teşekkür ederiz. Biyotıp Anabilim Dalı Kitle Sitometrisi Birimi yöneticisi Alexander Schmitz'e tartışma ve destek için teşekkür ederiz. Bilimsel İllüstrasyonlar Biorender.com kullanılarak oluşturulmuştur. Bu çalışma, Aarhus Universitets Forskningsfond (AUFF) Başlangıç Hibesi ve Novo Nordisk Vakfı'ndan EP'ye bir Başlangıç Paketi hibesi (0071113) ile finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
Referanslar
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır