A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי וניתוח של אבות מיוגניים in vivo במהלך פגיעה חריפה בשרירי השלד על ידי ציטומטריית מסה חד-תאית חד-ממדית גבוהה
In This Article
Summary
הפרוטוקול המוצג כאן מאפשר זיהוי וניתוח ממדי גבוה של תאי גזע שריר ותאי אב על ידי ציטומטריית מסה של תא בודד וטיהורם על ידי FACS לצורך מחקרים מעמיקים של תפקודם. גישה זו יכולה להיות מיושמת כדי לחקור דינמיקה התחדשות במודלים של מחלות ולבדוק את היעילות של התערבויות פרמקולוגיות.
Abstract
התחדשות שרירי השלד היא תהליך דינמי המונע על ידי תאי גזע שריריים בוגרים וצאצאיהם. לרוב רגועים במצב יציב, תאי גזע שריריים בוגרים מופעלים עם פציעת שריר. לאחר ההפעלה, הם מתרבים, ורוב צאצאיהם מתמיינים ליצירת תאי שריר בעלי יכולת היתוך בעוד ששאר הצאצאים מתחדשים בעצמם כדי לחדש את מאגר תאי הגזע. בעוד שזהותם של תאי גזע שריריים הוגדרה לפני יותר מעשור, בהתבסס על ביטוי משותף של סמנים על פני התא, אבות מיוגניים זוהו רק לאחרונה באמצעות גישות חד-תאיות חד-ממדיות גבוהות. כאן, אנו מציגים שיטת ציטומטריה של מסה חד-תאית (ציטומטריה לפי זמן טיסה [CyTOF]) לניתוח תאי גזע ותאי אב בפגיעה חריפה בשריר כדי לפתור את הדינמיקה התאית והמולקולרית המתפתחת במהלך התחדשות השריר. גישה זו מבוססת על זיהוי סימולטני של סמנים חדשים בפני השטח של התא וגורמי שעתוק מיוגניים מרכזיים שהביטוי הדינמי שלהם מאפשר זיהוי של תאי גזע פעילים ואוכלוסיות תאי אב המייצגים ציוני דרך של מיוגנזה. חשוב לציין כי מתוארת אסטרטגיית מיון המבוססת על זיהוי סמני פני התא CD9 ו- CD104, המאפשרת בידוד פרוספקטיבי של תאי גזע שריר ותאי אב באמצעות מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) למחקרים מעמיקים של תפקודם. תאי אב שריריים מספקים חוליה חסרה קריטית לחקר השליטה בגורל תאי גזע שריריים, זיהוי מטרות טיפוליות חדשות למחלות שריר ופיתוח יישומי תרפיה תאית לרפואה רגנרטיבית. הגישה המוצגת כאן יכולה להיות מיושמת לחקר תאי גזע שריר ותאי אב in vivo בתגובה להפרעות, כגון התערבויות פרמקולוגיות המכוונות למסלולי איתות ספציפיים. זה יכול לשמש גם כדי לחקור את הדינמיקה של גזע שריר ותאי אב במודלים של בעלי חיים של מחלות שריר, לקדם את ההבנה שלנו של מחלות תאי גזע ולהאיץ את הפיתוח של טיפולים.
Introduction
שרירי השלד מהווים את הרקמה הגדולה ביותר מבחינת מסה בגוף ומווסתים תפקודים רבים, מראייה לנשימה, מיציבה לתנועה, כמו גם חילוף חומרים1. לכן, שמירה על שלמות שרירי השלד ותפקודם היא קריטית לבריאות. רקמת שריר השלד, המורכבת מצרורות צפופים של שרירי מיופייבר מרובי גרעינים המוקפים ברשת מורכבת של עצבים וכלי דם, מציגה פוטנציאל התחדשות יוצא דופן 1,2.
הגורמים העיקריים להתחדשות שרירי השלד הם תאי גזע שריריים בוגרים (MuSCs). ידועים גם בשם תאי לוויין, בשל מיקומם האנטומי הייחודי בסמוך לקרום הפלזמה של המיופייבר ומתחת ללמינה הבסיסית, הם זוהו לראשונה בשנת 19613. MuSCs מבטאים סמן מולקולרי ייחודי, גורם השעתוק משויך לתיבה 7 (Pax7)4. הם שקטים בעיקר אצל מבוגרים בריאים, הם מופעלים עם פגיעה בשרירים ומתרבים כדי להצמיח צאצאים אשר (i) יתמינו לתאי שריר בעלי יכולת היתוך שייצרו מיוסיבים חדשים כדי לתקן נזק לשריר או (ii) לחדש את עצמם כדי לחדש את מאגר תאי הגזע5.
ברמה התאית והמולקולרית, תהליך ההתחדשות הוא דינמי למדי וכולל מעברים בין מצב התא, המאופיינים בביטוי מתואם של גורמי שעתוק מיוגניים מרכזיים, הידועים גם בשם גורמי בקרה מיוגניים (MRFs)6,7. מחקרים התפתחותיים קודמים in vivo, ניסויי מעקב אחר שושלות ועבודה בתרביות תאים באמצעות מיובלסטים הראו כי ביטוי רציף של גורמי שעתוק אלה מניע מיוגנזה, כאשר גורם מיוגני 5 (Myf5) מתבטא בעת ההפעלה, התמיינות מיוגנית 1 (MyoD1) מסמנת מחויבות לתוכנית המיוגנית, והתמיינות ביטוי מיוגנין (MyoG) המסמנת מחויבות לתוכנית המיוגנית, והתמיינות ביטוי מיוגנין (MyoG) 8,9,10,11, 12,13,14. למרות הידע הזה והגילוי של סמנים על פני השטח של התא לטיהור MuSCs, אסטרטגיות וכלים לזהות ולבודד אוכלוסיות בדידות לאורך נתיב ההתמיינות המיוגנית ולפתור התקדמות מיוגנית in vivo חסרו 15,16,17,18.
כאן אנו מציגים שיטה חדשנית, המבוססת על מחקר שפורסם לאחרונה, המאפשרת זיהוי תאי גזע ותאי אב בשרירי השלד וניתוח הדינמיקה התאית, המולקולרית והשגשוג שלהם בהקשר של פגיעה חריפה בשריר19. גישה זו מסתמכת על ציטומטריית מסה של תא יחיד (הידועה גם בשם Cytometry by Time of Flight [CyTOF]) כדי לזהות בו זמנית סמני פני שטח מרכזיים של התא (α7 אינטגרין, CD9, CD44, CD98 ו- CD104), גורמי שעתוק מיוגני תוך תאיים (Pax7, Myf5, MyoD ו- MyoG) ואנלוגי נוקלאוזיד (5-Iodo-2′-deoxyuridine, IdU), כדי לנטר תאים בשלב S19,20, 21,22,23. יתר על כן, הפרוטוקול מציג אסטרטגיה המבוססת על זיהוי שני סמנים על פני התא, CD9 ו- CD104, לטיהור אוכלוסיות תאים אלה על ידי מיון תאים המופעלים על ידי פלואורסצנטיות (FACS), ובכך מאפשר מחקרים מעמיקים עתידיים על תפקודם בהקשר של פציעות ומחלות שרירים. בעוד מיובלסטים ראשוניים היו בשימוש נרחב בעבר כדי לחקור את השלבים המאוחרים של התמיינות מיוגנית במבחנה, לא ידוע אם הם משחזרים את המצב המולקולרי של תאי אב שריר הנמצאים in vivo 24,25,26,27,28,29,30 . הייצור של מיובלסטים הוא מייגע וגוזל זמן, והמצב המולקולרי של תרבית ראשונית זו משתנה במהירות עם חלוף31. לפיכך, אבות מיוגנים מבודדים טריים מטוהרים בשיטה זו יספקו מערכת פיזיולוגית יותר לחקר מיוגנזה ואת ההשפעה של מניפולציות גנטיות או פרמקולוגיות ex-vivo.
הפרוטוקול המוצג כאן יכול להיות מיושם כדי לענות על מגוון שאלות מחקר, למשל, כדי לחקור את הדינמיקה של התא המיוגני in vivo במודלים של בעלי חיים של מחלות שרירים, בתגובה למניפולציות גנטיות חריפות או על התערבויות פרמקולוגיות, ובכך להעמיק את ההבנה שלנו של תפקוד לקוי של תאי גזע שריר בהקשרים ביולוגיים שונים ולהקל על הפיתוח של התערבויות טיפוליות חדשניות.
Protocol
נהלי בעלי חיים אושרו על ידי הפיקוח הדני על ניסויים בבעלי חיים (פרוטוקול # 2022-15-0201-01293), והניסויים בוצעו בהתאם להנחיות המוסדיות של אוניברסיטת ארהוס. שיכוך כאבים (buprenorphine) מסופק במי שתייה 24 שעות לפני הפציעה עבור העכברים להסתגל לטעם. אספקת buprenorphine במי שתייה נמשכת במשך 24 שעות לאחר הפציעה. יחד עם הזרקה תת עורית (s.c.) של buprenorphine בזמן פגיעה שריר חריפה, buprenorphine במי השתייה לאחר הזרקת notexin יקל על הכאב הקשור לפציעה. אמנם מומלץ לתת זריקה s.c. של buprenorphine בזמן פגיעה שריר חריפה, ואחריו buprenorphine במי השתייה, buprenorphine במי השתייה לפני הפציעה הוא אופציונלי. עם זאת, על החוקרים לפעול בהתאם לסטנדרטים ולהנחיות לרווחת בעלי חיים שנקבעו על ידי הרשות הרגולטורית המתאימה.
הערה: עבור ניסויי ציטומטריית מסה של תא יחיד (CyTOF) של שרירי גפיים אחוריות פגועים, התחל בסעיף 1: שיכוך כאבים במים 24 שעות לפני פגיעת שריר עד 24 שעות לאחר הפציעה. למיון תאי גזע שריר ותאי אב מעכברים שלא נפגעו, יש לבצע את סעיפים 5 ו-6: המתת חסד + דיסקציה ודיסוציאציה של שרירי השלד, ולהמשיך לסעיף 11: צביעה בנוגדנים מצומדים פלואורופורים ל-FACS. סקירה כללית של מערך הניסוי והפרוטוקול מוצגת באיור 1.
1. שיכוך כאבים במים 24 שעות לפני פגיעה בשריר עד 24 שעות לאחר הפציעה
- לבקבוק שתייה עטוף ברדיד אלומיניום כהה, יש להוסיף 3 מ"ל בופרנורפין (0.3 מ"ג/מ"ל) ולמלא עד 100 מ"ל במים מסוננים כדי להגיע לריכוז סופי של 0.009 מ"ג/מ"ל 24 שעות לפני הפציעה. חברו לכלוב העכבר.
- הסר את בקבוק השתייה 24 שעות לאחר הפציעה, וחבר מחדש את כלוב העכבר למערכת שסתום השתייה.
2. הכנה להליך פציעה חריפה
הערה: יש להשתמש באתנול 70% לחיטוי ספסל העבודה, מערך חרוט האף וקופסת האינדוקציה.
- הכינו צינור של 1.5 מ"ל עם נוטקסין מדולל ב-PBS (5 מיקרוגרם/מ"ל). לדלל buprenorphine (0.3 מ"ג / מ"ל) סטרילי 0.9% מלוחים ל 0.015 מ"ג / מ"ל בצינור 1.5 מ"ל בטוח אור. שמור על קרח. הכן מזרקי אינסולין עבור buprenorphine (28 G, 0.5 מ"ל) וזריקות notexin (29 G, 0.3 מ"ל).
- הגדרת יחידות הרדמה מבוססות איזופלורן:
- להרדמה בקופסת אינדוקציה, יש להשתמש באיזופלורן 3% עם זרימה של 1.5 ליטר/דקה (50% O2, 50% אוויר אטמוספרי).
- לתחזוקה באמצעות מערך חרוט אף, יש להשתמש באיזופלורן 1.5% עם זרימה של 0.6 ליטר/דקה (50% O2, 50% אוויר אטמוספרי).
3. פגיעה חריפה על ידי הזרקת נוטקסין
זהירות: לנוטקסין יש פעילות פוספוליפאז A2 והוא המרכיב העיקרי של ארס מנחש הנמר האוסטרלי (Notechis scutatus), עם LD50 תוך ורידי של 5-17 מ"ג נוטקסין לק"ג בעכברים32,33. בפרוטוקול הנוכחי, שריר טיביאליס קדמי (TA) של כל גפה אחורית מוזרק עם 10 μL של 5 מ"ג / מ"ל notexin, ואת שריר Gastrocnemius (GA) של כל גפה אחורית מוזרק פעמיים (פעם אחת לתוך כל ראש של השריר) עם 15 μL של 5 מ"ג / מ"ל notexin. חשוב לבצע את הזריקות תוך שריריות (i.m.) כראוי כדי להגביל את הנזק ולבדוק לעתים קרובות את בעלי החיים המוזרקים כדי להבטיח כאב מינימלי.
- מרדימים את העכבר בתיבת האינדוקציה (3% איזופלורן). כאשר העכבר מחוסר הכרה, הורידו את רמת האיזופלורן ל-1.5% בתיבת האינדוקציה.
- לשקול ולסמן בנפרד את העכברים על פי נהלים מוסדיים מאושרים. מתחת לקונוס האף, יש לגלח את הגפיים האחוריות בעזרת גוזם ולהעביר חזרה לקופסת האינדוקציה.
- חישוב נפח buprenorphine עבור כל עכבר :
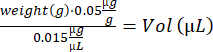
- מערבבים את תמיסת הנוטקסין על ידי פיפטינג למעלה ולמטה. הכינו 2 מזרקי אינסולין (29 גרם, 0.3 מ"ל) עמוסים ב-10 מיקרוליטר תמיסת נוטקסין (5 מיקרוגרם/מ"ל) לזריקות TA, ו-4 מזרקי אינסולין טעונים ב-15 מיקרוליטר תמיסת נוטקסין (5 מיקרוגרם/מ"ל) להזרקת GA.
הערה: שריר הטיביאליס הקדמי (TA) ממוקם בצד הקדמי של הרגל התחתונה של העכבר, המשתרע מהברך ועד הקרסול. שריר הגסטרוקנמיוס (GA) הוא שריר דו-ראשי הממוקם בחלק האחורי של הרגל התחתונה, שטחי לסוליאוס. הוא עובר משני ראשיו (מדיאלי ורוחבי) ממש מעל הברך ועד העקב, ומשתרע על פני שלושה מפרקים בסך הכל (ברך, קרסול ומפרקים תת-קרקעיים). - ביצוע זריקות תוך שריריות
- הזרקת ת"א (2 זריקות סה"כ)
- הניחו את העכבר במצב שכיבה מתחת לקונוס האף וחיטאו את אתר ההזרקה במגבוני אלכוהול סטריליים (70% אתנול או איזופרופנול). הכנס את המחט, משופעת כלפי מטה, לבטן ה- TA (דיסטלית עד אמצע הבטן) בזווית של 30 מעלות. מקדמים את המחט לאורך השריר, נעה במקביל לשוקה, כדי להגיע לאמצע הבטן של ה- TA. הזריקו את הנוטקסין לאט וברציפות, השאירו את המחט במקומה למשך 10 שניות לפני הוצאתה. אין להחדיר את המחט עמוק מדי בתחילה (כדי למנוע הזרקת נוטקסין מתחת לשריר ה-extensor digitorum longus), ולא רחוק מדי בעת קידום המחט (כדי להימנע מהזרקה קרובה מדי לברך).
- זריקת GA (4 זריקות בסך הכל)
- הכנס את המחט, משופע כלפי מטה, בזווית ~ 45° באמצע הבטן של הראש הצדדי של GA. הזריק את הנוטקסין לאט וברציפות, משאיר את המחט במקומה במשך 10 שניות לפני משיכתה. סובב את הגפה האחורית והזריק נוטקסין בראש המדיאלי של שריר GA כנ"ל. יש להקפיד לא להחדיר את המחט עמוק מדי.
- הזרקת ת"א (2 זריקות סה"כ)
- סובב את העכבר והזריק buprenorphine s.c. באמצעות מזרק אינסולין (28 גרם, 0.5 מ"ל). מעבירים את העכבר לכלוב התאוששות ריק על פלטת חימום. רק מחצית מתחתית הכלוב צריכה להיות ממוקמת מעל פלטת החימום כדי לאפשר לעכבר לווסת חום במהלך ההתאוששות34. חזור על שלבים 3.3-3.6 עבור העכברים הנותרים.
- כאשר העכבר בכלוב ההתאוששות ער לחלוטין, החזירו אותו לכלוב המקורי. מחזירים אותו לאורווה ומשלימים אותו בצ'או רטוב. הסר את בקבוק השתייה buprenorphine 24 שעות לאחר ההזרקה.
- עקוב אחר העכברים במשך 6 שעות לאחר הזרקת נוטקסין ולאחר מכן כל 12 שעות במשך יומיים עבור סימני כאב, ניידות לקויה וצריכת מזון מופחתת35,36.
4. הזרקת 5-יודו-2'-דאוקסיורידין
זהירות: 5-Iodo-2'-deoxyuridine (IdU) חשוד בגרימת פגמים גנטיים ופגיעה בפוריות או בתינוק שטרם נולד. קרא את גיליון נתוני הבטיחות (SDS) לפני הטיפול. יש ללבוש ציוד מגן אישי במהלך הטיפול. יש להשתמש במכסה אדים בעת שקילת אבקת IdU. יש להשליך חומרים שהיו במגע עם IdU בהתאם לתקנות הבטיחות המקומיות.
הערה: תיוג IdU in vivo משמש לניטור חלוקת תאים במהלך זמן הפציעה מכיוון ש- IdU, אנלוג תימידין עם יוד, משולב בדנ"א של תאים בשלב S. IdU מוזרק תוך צפקית (כלומר) במשקל גוף של 20 מ"ג/ק"ג 8 שעות לפני הקרבת העכבר.
- השתמש בסוניקטור ב 37 ° C כדי להכין תמיסת מלאי 2 מ"ג / מ"ל של IdU ב PBS סטרילי. IdU רגיש לאור; יש להשתמש באותו יום או להקפיא ב-20°C למשך עד 3 חודשים. אם משתמשים ב-IdU קפוא: הפשרה, מערבולת, צנטריפוגה ב-10,000 x גרם למשך 30 שניות, והשתמשו בסופרנאטנט להזרקות למטה.
- מרדימים את העכבר בתיבת האינדוקציה (3% איזופלורן). שימו לב לייעוד, שקלו את העכברים וחשבו את נפח תמיסת ה-IdU:
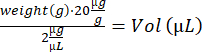
- בצע הזרקת i.p. באמצעות מזרק אינסולין (28 גרם, 0.5 מ"ל) והעבר את העכבר לכלוב התאוששות ריק על פלטת חימום. כאשר הוא ער, החזיר את העכבר לכלוב המקורי שלו. חזור על שלבים 4.2-4.3 עבור העכברים הנותרים והחזיר אותם לאורווה.
5. המתת חסד
הערה: ראה טבלה 1 למתכוני חיץ. הכינו את אמצעי השטיפה (תערובת חומרים מזינים F-10 (בשר חזיר), סרום 10% לסוסים, עט/סטרפ אחד) וסננו דרך קרום פוליאתרסולפון (PES) לתוך מיכל פוליסטירן. הכינו חיץ דיסוציאציה (מדיית שטיפה בתוספת 650 U/mL Collagenase, סוג II) ושמרו על קרח. מדידות ציטומטריית מסה CyTOF רגישות מאוד למזהמים. מסיבה זו, חיוני להשתמש ריאגנטים של הציון האנליטי הגבוה ביותר לעיבוד דגימה. כדי למנוע זיהום מתכות, מומלץ מאוד להשתמש בכלי פלסטיק סטריליים וכלי זכוכית חדשים שמעולם לא נשטפו בחומר ניקוי מכיוון שסבוני מעבדה רבים מכילים רמות גבוהות של בריום. מומלץ להשתמש במים מסוננים כפולים, מזוקקים ונטולי יונים, להכנת מגיב. מלוחים חוצצי פוספט (PBS) מוכנים בבית. דללו את מלאי 10x ל-1x וסננו את 1x PBS עם מסנני 0.2 מיקרומטר. סנן שוב את PBS 1x בתחילת כל ניסוי. אין לנקות כלי דיסקציה עם חומר ניקוי בשל נוכחות בריום.
- הכינו את סולם השקילה, המיכל ויחידת ההרדמה מבוססת איזופלורן עם קופסת האינדוקציה. יש לחטא את כלי הדיסקציה המתאימים.
- הכינו וסמנו צינורות 50 מ"ל לכל עכבר עם 5 מ"ל של חיץ דיסוציאציה וצלחת פטרי. שמור על חיץ דיסוציאציה על קרח.
- מרדימים את העכבר בתיבת האינדוקציה (3% איזופלורן, מגדילים ל-5% כשהוא מחוסר הכרה) ומבצעים נקע צוואר הרחם.
6. דיסקציה של שרירי השלד ודיסוציאציה
- מנתחים את שרירי TA ו-GA משתי הגפיים האחוריות ומעבירים למכסה של צלחת פטרי. השתמש מספריים לחתוך את הרקמה לתוך slurry טחון (~ 1 מ"מ3 חתיכות). מעבירים לצינור 50 מ"ל המכיל 5 מ"ל של חיץ דיסוציאציה קר כקרח. שמור על קרח.
- חזור על הליך המתת חסד (שלב 5.3) והליך דיסקציה ודיסוציאציה של שרירי השלד (שלב 6.1) עד שכל העכברים יעובדו.
- חממו מראש את כל צינורות הדגימה באמבט מים של 37 מעלות צלזיוס (2 דקות), ודגרו במשך 45 דקות בסיבוב באינקובטור (37 מעלות צלזיוס).
- מערבלים ושוטפים על ידי הוספת 10 מ"ל של אמצעי כביסה. צנטריפוגה (380 x גרם, 10 דקות, טמפרטורת החדר [RT]), ושואפת ל-4 מ"ל.
- הוסף 0.5 מ"ל של collagenase (1000 U / mL) ו 0.5 מ"ל של dispase (11 U / mL). מערבלים ודגרים במשך 20 דקות בסיבוב ב 37 מעלות צלזיוס (למשל, באינקובטור). צנטריפוגה (380 x גרם, 1 דקה, RT) והשעיה מחדש עם פיפטה 5 מ"ל.
- הוסף מסננות תאים 40 מיקרומטר לצינורות 50 מ"ל ורטוב מראש עם 5 מ"ל של מדיית שטיפה. שאפו והוציאו את תרחיף התאים 10 פעמים באמצעות מזרק 5 מ"ל עם מחט 20 גרם. מסננים דרך מסננת התאים 40 מיקרומטר שהורטבה מראש. שטפו את צינור 50 מ"ל עם מדיית שטיפה של 10 מ"ל, העבירו אותו למסננת התאים של 40 מיקרומטר, וצנטריפוגה (380 x גרם, 10 דקות, 4 מעלות צלזיוס) את תרחיף התא.
7. כתמים חיים/מתים עם קיבוע ציספלטין ופרפורמלדהיד
אזהרה: ציספלטין ופרפורמאלדהיד (PFA) הם חומרים מסרטנים. קרא את ה-SDS לפני הטיפול. פרפורמאלדהיד (PFA; 16%) הוא גורם לגירוי העור, העיניים והנשימה. יש ללבוש ציוד מגן אישי ולטפל בחומרים אלה מתחת למכסה מנוע. במהלך קיבוע של תאים, הריכוז הסופי של PFA יהיה 1.6%. יש לנקוט באמצעי הגנה נכונים ולטפל בפסולת בהתאם לתקנות המקומיות.
הערה: יש להכין DMEM קר (4°C) וחם (37°C) ללא סרום. הכינו DMEM בתוספת 10% FBS, סננו דרך קרום PES לתוך מיכל פוליסטירן, ושמרו על קרח. הכנת PBS ומדיה לכתמים בתאים (CSM; PBS, 0.5% BSA, 0.02% נתרן אזיד) בבקבוק זכוכית ייעודי CyTOF ולסנן דרך קרום PES. CSM ניתן לאחסן ב 4 ° C עד 6 חודשים.
- שאפו את הסופרנטנט, העבירו את הכדור, והשהו מחדש ב-1 מ"ל של DMEM ללא סרום קר. ספור את התאים והתאם את צפיפות התאים ל 1 x 106 תאים / מ"ל ב- DMEM ללא סרום.
- מוסיפים ציר ציספלטין (25 מ"מ) לריכוז סופי של 25 מיקרומטר. מערבולת 10 שניות ודגרים במשך דקה אחת בדיוק (התגובה מאוד רגישה לזמן). הרוו את התגובה עם DMEM קר כקרח + 10% FBS (פי 3 מנפח הדגימה) ושמרו אותו על קרח. צנטריפוגה (380 x גרם, 10 דקות, 4 ° C), לשאוף את supernatant ולהשהות את הגלולה ביסודיות (עד 10 x 106 תאים / מ"ל ב CSM). סנן את המתלה דרך מסננת תאים בגודל 35 מיקרומטר.
- תקן את תרחיף התא עם תמיסת מלאי PFA מסוננת (16%) ופיפטה למעלה ולמטה (בצע מתחת למכסה מנוע) כדי להגיע לריכוז PFA הסופי (1.6%) (למשל, הוסף 100 μL של 16% PFA ל- 900 μL של תרחיף תאים). מערבולת במשך 30 שניות, לדגור במשך 10 דקות על קרח, ולשטוף פעמיים עם 2 מ"ל של CSM על ידי צנטריפוגה (800 x גרם, 5 דקות, RT).
הערה: בשלב זה, ניתן להקפיא את הדגימות על קרח יבש ולאחסן בטמפרטורה של -80°C או להשתמש בהן ישירות להכתמת נוגדנים. אם רוצים להקפיא תאים, מעבירים תאים לצינורות פוליפרופילן 5 מ"ל, מכיוון שפוליסטירן יכול להיסדק בטמפרטורות נמוכות. אם תאים קבועים טריים משמשים לצביעה, המשך לשלב 8.2.
8. צביעה בנוגדנים מצומדים מתכתיים
אזהרה: מתנול (MeOH) דליק מאוד וקורוזיבי לדרכי הנשימה. קרא את ה-SDS לפני הטיפול. יש ללבוש ציוד מגן אישי ולטפל בחומר זה מתחת למכסה מנוע. טיפול בפסולת בהתאם לתקנות המקומיות.
הערה: רשימת נוגדנים (Ab) המכוונים לסמנים פני השטח ולסמנים תוך-תאיים ניתן למצוא בטבלה 2.
צימוד נוגדנים: רוב הנוגדנים המשמשים בפרוטוקול זה היו מצומדים בתוך החברה מכיוון שהם לא היו זמינים מסחרית. פרוטוקולים לצמידות מתכות של נוגדנים פורסמו בעבר, וערכות צימוד זמינות כעת באופן מסחרי37,38. אימונוגלובולין מסוג G (IgG) תואם לפרוטוקולי הצמידות הזמינים. יש חשיבות גבוהה לכך שנוסחת הנוגדנים המשמשת לצמידות מתכות תהיה נקייה מחלבונים נשאים המכילים ציסטאין (למשל, אלבומין בסרום בקר (BSA)), אשר יכולים להשפיע על יעילות הצמידות על ידי תחרות על קבוצות המלימיד החופשיות של הפולימר, ויכולים להפריע לכימות הנוגדן המצומד המתכתי. תוכן ציסטאין של ג'לטין הוא הרבה יותר נמוך מזה של BSA. עם זאת, מומלץ שאם נוסחת הנוגדנים מכילה חלבונים נשאים, חלבונים אלה יוסרו לפני הצמידה. כעת ניתן לבקש נוגדנים ללא BSA וג'לטין מהיצרן. חומרים משמרים של מולקולות קטנות (למשל, נתרן אזיד, גליצרול וטרהלוז) תואמים לפרוטוקולי צימוד מתכות37,38.
טיטרציה של נוגדנים: לאחר כל צימוד מתכת, יש לבצע טיטרציה של נוגדנים כדי לקבוע את ריכוז הנוגדנים האופטימלי המספק את יחס האות לרעש המקסימלי. לטיטרציה של נוגדנים, יש לבצע דילול סדרתי דו-שלבי בן 6 שלבים ולהכתים את שתי הדגימות הידועות כמבטאות (למשל, תאי שריר, בקרות חיוביות) וחסרות (בקרות שליליות) את החלבון המעניין 19,21,37,38.
הכן פתרון עבודה חדש מסוג Cell-ID Intercalator-Ir (מלאי = 500 מיקרומטר; תמיסת אינטרקלטור-IR) על ידי דילול המלאי ל-0.1 מיקרומטר ב-PBS/1.6% PFA.
- הפשירו דגימות קפואות למשך 5 דקות ב-RT ובצנטריפוגות (800 x גרם, דקה אחת, RT). לשטוף עם 2 מ"ל של CSM על ידי צנטריפוגה (800 x גרם, 5 דקות, RT).
- הכינו תערובת צביעת נוגדנים למשטח (Ab) פי 2.5 ב-CSM. שאפו את הסופרנאטנט ל~60 μL והשעו מחדש את הגלולה ביסודיות. הכתימו את התאים על ידי הוספת 40 μL של תערובת צביעת Ab פני השטח ודגירה במשך שעה אחת ב- RT.
- מעבירים את הדגימות כל 20 דקות כדי לערבב. יש לשטוף פעמיים עם 1 מ"ל CSM באמצעות צנטריפוגה (800 x גרם, 5 דקות, RT). שאפו את הסופרנאטנט והעיפו את הכדור.
הערה: אם אין צורך בכתמים תוך-תאיים, אין צורך בחדירת מתנול. עם זאת, אם רק צביעת פני השטח מבוצעת, הפתרון intercalator-ir צריך להיות מדולל בחיץ המכיל סוכן permebilizing (למשל, תיקון Maxpar ו חיץ perm) כדי לחדור את קרום הגרעין. המשך לשלב 8.5 ודלל את Cell-ID Intercalator-Ir במאגר המכיל חומר מחלחל ו- 1.6% PFA. אחרת, המשיכו עם הכתמים התוך-תאיים למטה.
אזהרה: אירידיום מסוכן, ויש לנקוט אמצעי זהירות לטיפול בטוח. אירידיום דליק ומהווה גירוי לעיניים/עור. יש להימנע מיצירה ונשימה של אבק או אדים. יש להימנע ממגע עם העור והעיניים. עם זאת, תערובת התמיסה intercalator-ir מסופק בריכוז של <1% במים, אשר נחשב לא מסוכן על פי המערכת ההרמונית הגלובלית (GHS) של סיווג ותיוג של כימיקלים. קרא את SDS של Standard Biotools לפני הטיפול. יש ללבוש ציוד מגן אישי במהלך הטיפול. חומרים שהיו במגע עם תמיסת intercalator-ir יש להשליך בהתאם לתקנות הבטיחות המקומיות. - כדי לחדור לתאים, הוסיפו 0.5 מ"ל של MeOH קר כקרח תוך כדי מערבולת. יש לדגור במשך 15 דקות על קרח מתחת למכסה אדים. צנטריפוגה (800 x גרם, 5 דקות, RT) ולאחר מכן לשטוף פעמיים עם 1 מ"ל של CSM על ידי צנטריפוגה (800 x גרם, 5 דקות, RT). לאחר השטיפה האחרונה, שאפו את הסופרנאטנט ל~60 מיקרוליטר והשעו מחדש את הגלולה ביסודיות.
- הכינו תערובת צביעת Ab תוך-תאית 2.5x ב-CSM. הכתימו את התאים על ידי הוספת 40 μL של תערובת צביעת Ab תוך תאית ודגירה במשך שעה אחת ב- RT. העבירו את הדגימות כל 20 דקות כדי לערבב.
- יש לשטוף פעמיים עם 1 מ"ל CSM באמצעות צנטריפוגה (800 x גרם, 5 דקות, RT). שאפו את הסופרנאטנט והעיפו את הכדור. השהה מחדש את הדגימות ב- 0.5 מ"ל של תמיסת אינטרקלטור-אירידיום (טבלה 1) ומערבולת. יש לדגור על הדגימות במשך שעה אחת ב-RT או למשך הלילה (O/N) ב-4°C (ראה הערה להלן).
הערה: ניתן לאחסן דגימות בתמיסת אינטרקלטור-אירידיום ב-4°C למשך עד 48 שעות. פרוטוקול הצביעה המשמש במחקר זה פותח על בסיס עבודה חלוצית של מעבדת נולאן {C}23. הוא שונה מהפרוטוקולים הסטנדרטיים של Biotools, שכן (i) מאגרים מוכנים פנימיים משמשים לשטיפה וצביעה, (ii) התאים קבועים לפני צביעת פני השטח, ו-(iii) תאים חדורים במתנול לצביעה תוך-תאית עם נוגדנים לגורמי שעתוק או מולקולות איתות. חוקרים המפתחים פרוטוקול חדש חייבים לבדוק ביסודיות את תאימות פאנל הנוגדנים שלהם עם מתנול כחומר חדירה. בעת הוספת נוגדנים חדשים לפאנל, מומלץ לבדוק את ספציפיות הנוגדנים על ידי ציטומטריית זרימה באמצעות דגימות בקרה חיוביות ושליליות לפני צימוד וטיטרציה של מתכת.
9. הכנת דגימה להעמסה לציטומטר מסה
הערה: כדורי התא רופפים מאוד כאשר הם נמצאים במאגר CAS (טבלת חומרים). במהלך שטיפות עם חיץ CAS, אין לשאוף ליובש. במקום זאת, שמור על אמצעי אחסון שיורי כמתואר להלן.
- מערבולת וצנטריפוגה (800 x גרם, 10 דקות, RT) הדגימות. יוצקים את supernatant (לטפל כמו פסולת PFA) ומערבולת.
- לשטוף עם 1 מ"ל של CSM על ידי צנטריפוגה (800 x גרם, 10 דקות, RT). שאפו את הסופרנאטנט והעיפו את הכדור.
- יש לשטוף עם 1 מ"ל של מאגר CAS באמצעות צנטריפוגה (800 x גרם, 10 דקות, RT). שאפו ל~200 μL. מערבולת והוסיפו 1 מ"ל של מאגר CAS. הוציאו 5 μL aliquot לספירת תאים. צנטריפוגה (800 x גרם, 10 דקות, RT) ובזהירות לשאוף ≤50 μL. אין להפריע לכדור.
- השהה מחדש את הגלולה ל- 1-2 x 106 תאים/מ"ל במאגר CAS והוסף חרוזי כיול (1x; טבלת חומרים) לריכוז סופי של 0.1x (למשל, הוסף 100 μL של חרוזי כיול 1x ל- 900 μL של תרחיף תאים).
- טען את הדגימה לתוך ציטומטר המסה ואסוף נתונים באמצעות קצב זרימה של 400-500 תאים לשנייה.
- בצע נורמליזציה של נתונים של קבצי FCS באמצעות תוכנת CyTOF או כלי נורמליזציה שפותחו בעבר39.
הערה: הפעולה של ציטומטרים מסה CyTOF היא ספציפיתלמכשיר 40,41. מומלץ לעיין במדריך למשתמש של CyTOF לפני הפעולה. חרוזי הכיול הם תקני חרוזי נורמליזציה מפוליסטירן משובצים מתכת המכילים ריכוזים ידועים של איזוטופים מתכתיים צריום (140/142Ce), יורופיום (151/153Eu), הולמיום (165Ho) ולוטטיום (175/176Lu). חרוזי הכיול מאפשרים בקרה על רגישות המכונה, שיכולה להשתנות עם הזמן, בעיקר בשל הצטברות החומר הביולוגי ושינויים ביינון הפלזמה לאורך זמן.
10. ניתוח נתוני CyTOF
הערה: לצורך ניתוח במורד הזרם, ניתן לנתח קבצי FCS מנורמלים באופן מקומי או להעלות אותם לפתרונות תוכנה מבוססי ענן כגון Cytobank, Cell Engine, OMIQ או FCS Express42.
- שרשר קבצי FCS נפרדים עבור כל מדגם לקובץ יחיד, במידת הצורך.
- זיהוי תאים בודדים על ידי גירוי על אירועים חיוביים של אירידיום-אינטרקלטור, המאפשר הבחנה של תאים בעלי גרעין בודד מפסולת או כפולים.
- שער עבור תאים חיים על ידי בחירת אירועים שליליים cisplatin. ציספלטין נקשר באופן קוולנטי לחלבונים תאיים ומתייג תאים גוססים ומתים עם קרומים פגומים במידה רבה יותר מאשר תאים חיים43.
- לדוגמה, בדקו את התא המיוגני (Live/CD45-/CD31-/Sca1-/α7integrin+/CD9+) (איור 2A) וכמתו את חלקם היחסי של תאי גזע ותאי אב. גישה זו דורשת ידע מוקדם על פני התא או ביטוי סמנים תוך תאיים כדי להגדיר אוכלוסיות בודדות.
- לבצע אנליזה בממדים גבוהים שתאפשר זיהוי של תת-קבוצות תאים נדירים שלא זוהו בעבר בתוך אוכלוסייה מורכבת, לייצא את האוכלוסייה המעניינת ולהשתמש באלגוריתמים של אשכולות שפותחו במיוחד עבור ניתוח נתוני CyTOF44.
הערה: בעבודה קודמת נעשה שימוש באלגוריתם X-shift, המשתמש בהערכת צפיפות השכן הקרוב ביותר (kNN-DE) משוקללת במרחב רב-ממדי כדי לבצע אשכולות ללא פיקוח בהתבסס על פרמטרים מוגדרים19. X-shift הוכח כיעיל ביותר בזיהוי אוכלוסיות תאים נדירות45. - לניתוח X-shift, הורד את חבילת התוכנה של מערבולת (מדף GitHub של מעבדת נולאן [https://github.com/nolanlab/vortex]) ואת Java 64-bit46. הוראות ניתן למצוא כאן: https://github.com/nolanlab/vortex/wiki/Getting-Started.
- העלה את אוכלוסיות התאים המיוצאות למסד נתונים מקומי והגדר את פרמטרי קיבוץ האשכולות. בין הפרמטרים המוגדרים על-ידי המשתמש ניתן למנות (i) את הסמנים המשמשים לקיבוץ באשכולות, (ii) את טווח ערכי k (לדוגמה, 5 עד 150), ו-(iii) את מספר שלבי האשכולות.
הערה: עבודות קודמות שימשו, כסמני אשכולות, שילוב של סמני פני שטח הידועים כבאים לידי ביטוי בתאי גזע שריריים, סמני שטח חדשים שזוהו במסך ציטומטרי של זרימת תפוקה גבוהה של תאי שריר ומיובלסטים, וגורמי שעתוק מיוגניים (TFs) הידועים כמגדירים שלבים שונים של מיוגנזה. גישה זו אפשרה זיהוי של שני סמני פני התא, CD9 ו-CD104, שדפוס הביטוי המשותף שלהם מבחין בין אוכלוסיות תאי אב שלא זוהו קודם לכן19. הבחירה הקפדנית של סמני אשכולות תאפשר לחוקר לענות על שאלות מחקר ספציפיות. לדוגמה, אם יש צורך בזיהוי וניתוח לאורך זמן של חלוקת תת-קבוצות תאים, מומלץ לכלול את IdU כאחד מסמני האשכולות. X-shift יכול לבצע קיבוץ באשכולות במספר ערכי k ולזהות באופן אוטומטי, על ידי חישוב "נקודת המרפק", את ערך k שמביא למספר אשכול אופטימלי, ובכך להימנע מתת-אשכולות או פיצול יתר. מומלץ לחשב את נקודת המרפק ולהשתמש בניתוח אשכולות המוגדר על ידי ערך k האופטימלי עבור תצוגה חזותית של נתונים ויישומים במורד הזרם. - כדי להמחיש את היחסים המרחביים בין אוכלוסיות תאים בתוך צבירי הסטת X, בצע פריסה מכוונת כוח, שתייצר מפה דו-ממדית שבה המרחק בין הצבירים מצביע על הדמיון ביניהם בביטוי סמן במרחב פנוטיפי ממדי גבוה. על ידי צביעת המפה באמצעות סמן אחד בכל פעם, ניתן לגלות אוכלוסיות תאים חדשות ולעקוב אחר הדינמיקה שלהן. מומלץ לבצע כימות מעקב על ידי כימות ידני בתוכנה, כגון Cytobank ו-Cell Engine.
- בצע ניתוח מפת חום כדי לכמת את הביטוי הדינמי של חלבונים מרובים על פני השטח ותוך התאיים לאורך מסלול הזמן ולחשוף מגמות חדשות.
הערה: בעת ביצוע מסלול זמן פציעה, ניתן לקבץ נתונים מכל נקודות הזמן יחד כדי ליצור מפה של התחדשות. בנוסף, ניתן לנתח מפה כזו לנקודות זמן בודדות כדי לעקוב אחר הדינמיקה התאית והמולקולרית של התחדשות לאורך זמן19.
11. צביעה בנוגדנים מצומדים פלואורופורים ל-FACS
הערה: תאים המשמשים עבור פקדים בצבע יחיד לא מוכתמים ופקדי פלואורסצנטיות פחות אחד (FMO) יכולים להגיע מקבוצת TA ו- GA מעכבר נוסף, אם זמין. לחלופין, ניתן לנתח ולעכל את שריר הארבע ראשי (שריר הירך הקדמי העליון) לתרחיף של תא בודד, באותו הליך כמו עבור TA+GA שנקבע לעיל ומשמש לבקרות. הכינו חיץ FACS (PBS, סרום עיזים 2.5%, 2 mM EDTA), סננו דרך קרום PES לתוך מיכל פוליסטירן ושמרו על קרח. ניתן לאחסן את מאגר FACS ב- 4 °C למשך עד חודש אחד. רשימה של נוגדנים המשמשים FACS ניתן למצוא בטבלה 3.
- הכינו תערובת שושלת. צבעו כל פקד ב-50 μL (מכיל כ-3-5 x 105 תאים). חשב את כמות תערובת השושלת הדרושה. הפוך 20%-30% עודף נפח. ריכוז הנוגדנים המשמשים לתמהיל השושלת הוא 0.2 מ"ג/מ"ל.
- בצינור של 0.5 מ"ל, הוסף APC-Cy7 נגד CD45, APC-Cy7 נגד CD31, APC-Cy7 נגד Sca1 ו-APC-Cy7 נגד CD11b כדי להגיע לריכוזים סופיים של 1 מיקרוגרם/מ"ל, 2.5 מיקרוגרם/מ"ל, 2.5 מיקרוגרם/מ"ל ו-0.63 מיקרוגרם/מ"ל, בהתאמה.
- הכינו תערובת שכולה כתמים. צבעו כל דגימה מוכתמת ב-500 μL (המכילה כ-3-5 x 106 תאים). יש להכין 10% נפח עודף של תערובת כתמים מלאה.
- בצינור של 1.5 מ"ל, הוסף נוגדנים לערבוב שושלות כנ"ל + Anti-α7 integrin PE, anti-CD9 APC ו- anti-CD104 FITC כדי להגיע לריכוזים סופיים של 2 מיקרוגרם/מ"ל, 1.2 מיקרוגרם/מ"ל ו-3 מיקרוגרם/מ"ל, בהתאמה.
- הכנת מאגר FACS + DAPI: עבור 10 מ"ל של מאגר FACS, הוסף 1 μL של DAPI (מלאי = 1 מ"ג/מ"ל) כדי להגיע לריכוז DAPI סופי של 100 ננוגרם/מ"ל.
אזהרה: DAPI (4',6-diamidino-2-phenylindole dihydrochloride) מסווג כמגרה אפשרי לעור ולדרכי הנשימה. עם זאת, תמיסת DAPI בריכוז של <1% נחשבת לא מסוכנת, על פי GHS. קרא את ה-SDS לפני הטיפול. יש ללבוש ציוד מגן אישי במהלך הטיפול. יש להשליך חומרים שהיו במגע עם DAPI בהתאם לתקנות הבטיחות המקומיות. - תאי השעיה מסעיף 6: דיסקציה ודיסוציאציה של שרירי השלד:
- עבור דגימות מוכתמות לחלוטין, השהה מחדש ערכות TA ו- GA מעכבר יחיד במאגר FACS של 500 μL והעבר אותו לצינורות 15 מ"ל לצורך צביעה.
- עבור פקדים, השתמש בערכות TA ו- GA או בערכות ארבע ראשיות. אם אתה משתמש בעכבר אחד עבור פקדים, השעה מחדש תאים במאגר FACS של 750 μL. אם יש מספר עכברים, יש להשהות מחדש כל TA ו-GA או ארבע ראשי במאגר FACS של 500 μL ולשלב את הקבוצות לדגימה אחת של 1 מ"ל על ידי לקיחת שבריר מכל דגימה. הוסף 50 μL של תאי בקרה (3-5 x 105 תאים) ל 5 מ"ל צינורות פוליפרופילן לצביעה.
- כתם כמתואר בטבלה 4 למשך 45 דקות ב-4°C בחושך.
- שטפו דגימות מוכתמות לחלוטין על ידי הוספת 5 מ"ל של מאגר FAC. שטוף את הפקדים על-ידי הוספת 1 מ"ל של מאגר FACS וצנטריפוגה (380 x גרם, 10 דקות, 4 ° C).
- השהה מחדש דגימות מוכתמות ב- 1 מ"ל של מאגר FACS + DAPI. השעה מחדש את הפקדים במאגר FACS של 300 μL עם או בלי DAPI.
- שמור על תאים בטמפרטורה של 4°C בחושך עד למיון על ציטומטר זרימה עם 4 לייזרים (405 ננומטר, 488 ננומטר, 561 ננומטר, 633 ננומטר).
- הפעל את הפקדים והדוגמאות על הממיין וצור שערי מיון באמצעות התוכנה הרלוונטית. עבור פקדי צבע לא מוכתמים/בודדים ופקדי FMO, הקלט 1 x 104 ו- 0.3-1 x 105 אירועים, בהתאמה. עבור דגימות מוכתמות, הקלט עד 1 x 106 אירועים. מיין את כל הדגימות המוכתמות, או לפי הצורך, בהתאם לדרישות הבדיקה במורד הזרם. עבור ציטומטר הזרימה המשמש כאן (FACSAria III), מיין במצב טוהר באמצעות זרבובית 70 מ"מ.
- ראו איור 4 של אסטרטגיית הגאטינג (gating).
- השתמש בפקדים ללא כתמים ובצבע יחיד כדי להגדיר את המתח עבור כל הגלאים.
- השתמש בפקדי הצבע היחיד כדי להגדיר את מטריצת הפיצוי.
- השתמש בפקדי FMO כדי ליצור שערי מיון.
- אוכלוסיות שונות של תאי גזע שריר ותאי אב ממוינות למאגר FACS קר כקרח.
- צנטריפוגה (380 x גרם, 10 דקות, 4 מעלות צלזיוס) אוכלוסיות התאים. השהה מחדש במאגר המתאים, ספור והמשך בניתוח במורד הזרם.
תוצאות
כאן אנו מציגים סקירה כללית של מערך הניסוי לשימוש בגישה משולבת זו, הכוללת (i) ניתוח CyTOF בממדים גבוהים של מסלול זמן פציעה חריפה באמצעות הזרקת נוטקסין לחקר הדינמיקה התאית והמולקולרית של תאי גזע ותאי אב בשרירי השלד (איור 1, סכימה עליונה); ו-(ii) FACS של תאי גזע ותאי א...
Discussion
התחדשות שרירי השלד היא תהליך דינמי המסתמך על תפקודם של תאי גזע בוגרים. בעוד שמחקרים קודמים התמקדו בתפקידם של תאי גזע שריריים במהלך התחדשות, צאצאיהם in vivo לא נחקרו מספיק, בעיקר בשל מחסור בכלים לזהות ולבודד אוכלוסיות תאים אלה 15,16,17,18.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
אנו מודים לחברי מתקן הליבה של FACS במחלקה לביו-רפואה באוניברסיטת Aarhus על התמיכה הטכנית. אנו מודים לאלכסנדר שמיץ, מנהל היחידה לציטומטריית מסה במחלקה לביו-רפואה, על הדיון והתמיכה. איורים מדעיים נוצרו באמצעות Biorender.com. עבודה זו מומנה על ידי מענק התחלה של Aarhus Universitets Forskningsfond (AUFF) ומענק חבילת התחלה (0071113) מקרן נובו נורדיסק ל- E.P.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
References
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved