このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
高次元シングルセルマスサイトメトリーによる急性骨格筋損傷時のin vivoにおける筋原性前駆細胞の同定と解析
要約
ここで紹介するプロトコールは、シングルセルマスサイトメトリーによる筋幹細胞および前駆細胞の同定と高次元解析、およびFACSによるそれらの精製を可能にし、それらの機能の詳細な研究を可能にします。このアプローチは、疾患モデルにおける再生動態の研究や、薬理学的介入の有効性の検証に適用することができます。
要約
骨格筋の再生は、成体筋幹細胞とその子孫によって駆動されるダイナミックなプロセスです。定常状態ではほとんどが静止している成体の筋幹細胞は、筋肉の損傷時に活性化されます。活性化後、それらは増殖し、その子孫の大部分は分化して融合能力のある筋肉細胞を生成し、残りの子孫は自己再生して幹細胞プールを補充します。筋幹細胞の同定は10年以上前に定義されましたが、細胞表面マーカーの共発現に基づいて、筋原性前駆細胞が同定されたのはごく最近のことで、高次元のシングルセルアプローチを使用して明らかになりました。ここでは、急性筋損傷における幹細胞および前駆細胞を解析し、筋肉再生中に展開する細胞および分子動態を解明するためのシングルセルマスサイトメトリー(Site by Time of Flight [CyTOF])法を紹介します。このアプローチは、新規の細胞表面マーカーと主要な筋原性転写因子の同時検出に基づいており、その動的発現により、筋形成のランドマークである活性化幹細胞と前駆細胞集団の同定が可能になります。重要なことに、細胞表面マーカーCD9およびCD104の検出に基づくソーティング戦略が説明されており、蛍光活性化セルソーティング(FACS)を使用して筋幹細胞および前駆細胞を前向きに分離し、それらの機能の詳細な研究を可能にします。筋前駆細胞は、筋幹細胞の運命制御を研究し、筋疾患の新規治療標的を特定し、再生医療のための細胞治療アプリケーションを開発するための重要なミッシングリンクを提供します。ここで紹介するアプローチは、特定のシグナル伝達経路を標的とする薬理学的介入など、摂動に応答するin vivo の筋幹細胞および前駆細胞の研究に適用することができます。また、筋疾患の動物モデルにおける筋幹細胞および前駆細胞の動態を調査するためにも使用でき、幹細胞疾患の理解を深め、治療法の開発を加速させます。
概要
骨格筋は、体内で質量で最大の組織を構成し、視力から呼吸、姿勢から動き、代謝まで、複数の機能を調節しています1。したがって、骨格筋の完全性と機能を維持することは、健康にとって非常に重要です。骨格筋組織は、神経と血管の複雑なネットワークに囲まれた多核筋線維の密集した束で構成されており、顕著な再生能力を示しています1,2。
骨格筋の再生の主な推進力は、成体筋幹細胞(MuSC)です。サテライト細胞とも呼ばれ、筋線維の原形質膜に隣接し、基底椎弓板の下にユニークな解剖学的位置にあるため、1961年に初めて同定されました3。MuSCは、転写因子対ボックス7(Pax7)4というユニークな分子マーカーを発現します。健康な成人ではほとんどが静止しますが、筋肉の損傷を受けると活性化して増殖し、子孫を生じさせます。これは、(i)融合能力のある筋肉細胞に分化して筋肉の損傷を修復するための新しい筋繊維を形成するか、(ii)幹細胞プールを補充するために自己再生します5。
細胞および分子レベルでは、再生のプロセスは非常に動的であり、筋原性調節因子(MRF)としても知られる主要な筋原性転写因子の協調的な発現を特徴とする細胞状態遷移を伴います6,7。これまでのin vivo発生研究、系統追跡実験、および筋芽細胞を用いた細胞培養研究により、これらの転写因子の逐次発現が筋形成を促進することが示されており、活性化時に筋原性因子5(Myf5)が発現し、筋原性分化1(MyoD1)の発現が筋原形成プログラムへのコミットメントを示し、ミオゲニン(MyoG)の発現が分化を阻害することが示されている8,9,10,11、12、13、14。この知識とMuSCを精製するための細胞表面マーカーの発見にもかかわらず、筋原性分化経路に沿った個別の集団を同定および単離し、in vivoで筋原性進行を解決するための戦略とツールが不足していました15,16,17,18。
ここでは、最近発表された研究に基づいて、骨格筋の幹細胞と前駆細胞の同定と、急性筋損傷の文脈におけるそれらの細胞、分子、および増殖ダイナミクスの分析を可能にする新しい方法を紹介します19。このアプローチは、シングルセルマスサイトメトリー(Cytometry by Time of Flight[CyTOF]とも呼ばれる)を使用して、主要な細胞表面マーカー(α7インテグリン、CD9、CD44、CD98、およびCD104)、細胞内筋原性転写因子(Pax7、Myf5、MyoD、およびMyoG)、およびヌクレオシドアナログ(5-ヨード-2′-デオキシウリジン、IdU)を同時に検出し、S期19,20の細胞をモニターします。21、22、23。さらに、このプロトコルは、2つの細胞表面マーカー、CD9およびCD104の検出に基づく戦略を提示し、蛍光活性化セルソーティング(FACS)によってこれらの細胞集団を精製するため、損傷や筋肉疾患の状況におけるそれらの機能の将来の詳細な研究が可能になります。初代筋芽細胞は、in vitroでの筋原性分化の後期段階を研究するために過去に広く使用されてきましたが、それらがin vivoで見つかった筋前駆細胞の分子状態を再現するかどうかは不明です24,25,26,27,28,29,30 .筋芽細胞の作製は手間と時間がかかり、この初代培養物の分子状態は継代時に急速に変化する31。したがって、この方法で精製された新たに単離された筋原性前駆細胞は、生体外で筋形成および遺伝的または薬理学的操作の影響を研究するためのより生理学的なシステムを提供するでしょう。
ここで提示されたプロトコルは、例えば、筋肉疾患の動物 モデルにおける筋 原性コンパートメントの動態を研究するために、急性の遺伝子操作に応答して、または薬理学的介入に基づいて、さまざまな研究課題に対処するために適用することができ、したがって、さまざまな生物学的状況での筋幹細胞の機能障害についての理解を深め、新しい治療介入の開発を促進します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物実験はデンマークの動物実験検査官によって承認され(プロトコル#2022-15-0201-01293)、実験はオーフス大学の機関ガイドラインに準拠して行われました。鎮痛剤(ブプレノルフィン)は、マウスが味に適応するために、傷害の24時間前に飲料水に提供されます。飲料水へのブプレノルフィンの供給は、損傷後24時間継続されます。.急性筋肉損傷時のブプレノルフィンの皮下注射(皮下注射)とともに、ノテキシン注射後の飲料水中のブプレノルフィンは、損傷に関連する痛みを軽減します。.急性筋肉損傷時にブプレノルフィンの皮下注射を投与し、続いて飲料水にブプレノルフィンを投与することをお勧めしますが、損傷前の飲料水中のブプレノルフィンはオプションです。.ただし、研究者は、適切な規制当局が定めた動物福祉の基準とガイドラインに従わなければなりません。
注:損傷した後肢筋のシングルセルマスサイトメトリー(CyTOF)実験の場合、セクション1:筋肉損傷の24時間前から損傷後24時間までの水中鎮痛から開始します。損傷していないマウスからの筋幹細胞および前駆細胞の選別については、セクション5および6:安楽死+骨格筋の解剖および解離を行い、セクション11:FACSの蛍光色素標識抗体による染色に進みます。 実験のセットアップとプロトコルの概要を 図1に示します。
1.筋肉損傷の24時間前から損傷後24時間までの水中での鎮痛
- 暗いまたはアルミホイルで包まれた飲料ボトルに、3 mLのブプレノルフィン(0.3 mg / mL)を加え、ろ過水で100 mLに充填して、損傷の24時間前に最終濃度0.009 mg / mLに到達します。.マウスケージに取り付けます。
- 怪我の24時間後に飲用ボトルを取り外し、マウスケージを飲用バルブシステムに再接続します。.
2. 急性傷害処置の準備
注意: 70%エタノールを使用して、作業台、ノーズコーンセットアップ、誘導ボックスを消毒します。
- PBS(5 μg/mL)で希釈したノテキシンを入れた1.5 mLチューブを調製します。ブプレノルフィン(0.3 mg / mL)を滅菌0.9%生理食塩水で0.015 mg / mLに希釈し、耐光性1.5 mLチューブで保存します。.氷の上を保ってください。ブプレノルフィン(28 G、0.5 mL)およびノテキシン注射(29 G、0.3 mL)用のインスリン注射器を調製します。
- イソフルランベースの麻酔ユニットを設定します。
- 誘導ボックス内の麻酔には、1.5 L / min(50%O2、50%大気)の流量で3%イソフルランを使用します。
- ノーズコーンセットアップを利用したメンテナンスには、0.6 L / min(50%O2、50%大気)の流量で1.5%イソフルランを使用します。
3. ノテキシン注射による急性障害
注意:ノテキシンはホスホリパーゼA2活性を持ち、オーストラリアのタイガースネーク(Notechis scutatus)の毒の主成分であり、マウス32,33の5〜17 mg notexin / kgの静脈内LD50があります。現在のプロトコルでは、各後肢の脛骨前部筋 (TA) に 10 μL の 5 mg/mL ノテキシンを注射し、各後肢の腓腹筋 (GA) に 15 μL の 5 mg/mL ノテキシンを 2 回 (各筋肉の頭に 1 回) 注射します。損傷を制限するために筋肉内(im)注射を正しく行い、注射された動物を頻繁に検査して痛みを最小限に抑えることが重要です。
- 誘導ボックス(3%イソフルラン)でマウスを麻酔します。マウスが意識を失ったら、誘導ボックス内のイソフルランレベルを1.5%に下げます。
- 施設が承認した手順に従ってマウスの重量を量り、個別にマーキングします。ノーズコーンのセットアップの下で、トリマーで後肢を剃り、誘導ボックスに戻します。
- 各マウスのブプレノルフィン量を計算します。
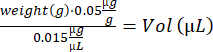
- notexin溶液をピペッティングで上下に混合します。TA注射用に10μLのノテキシン溶液(5μg/mL)を充填したインスリン注射器2本(29 G、0.3 mL)と、GA注射用に15 μLのノテキシン溶液(5 μg/mL)を充填したインスリン注射器4個を調製します。
注:前脛骨筋(TA)は、マウスの下肢の前面に位置し、膝から足首まで伸びています。腓腹筋(GA)は、ヒラメ筋の表面にある下腿の後ろにある双頭の筋肉です。膝のすぐ上の2つの頭(内側と外側)からかかとまで、合計3つの関節(膝、足首、距骨下関節)にまたがっています。 - 筋肉内注射を行う
- TAインジェクション(計2回)
- マウスをノーズコーンセットアップの下の仰臥位に置き、滅菌アルコールワイプ(70%エタノールまたはイソプロパノール)で注射部位を消毒します。.針をTAの腹(中腹の遠位)に30°の角度で挿入します。脛骨と平行に動きながら、筋肉に沿って針を進めて、TAの中腹に到達します。ノテキシンをゆっくりと連続的に注入し、針を所定の位置に10秒間置いてから引き抜きます。.最初は針を深く挿入しすぎないでください(TAの下のノテキシンを長指伸筋に注入するのを避けるため)、針を進めるときは近位に近すぎないようにします(膝に近すぎる注射を避けるため)。
- GAインジェクション(計4回)
- GAの外側頭の中央腹に~45°の角度で針を斜めに挿入し、notexinをゆっくりと連続的に注入し、針を所定の位置に10秒間置いてから引き抜きます。後肢を回転させ、上記のようにGA筋の内側頭にノテキシンを注入します。針を深く挿入しすぎないように注意する必要があります。
- TAインジェクション(計2回)
- マウスを裏返し、インスリン注射器(28 G、0.5 mL)を使用してブプレノルフィン皮下を注射します。.マウスを加熱プレート上の空のリカバリーケージに移します。ケージの底の半分だけを加熱プレートの上に置いて、マウスが回復中に体温調節できるようにすべきである34。残りのマウスについて、手順3.3〜3.6を繰り返します。
- リカバリーケージ内のマウスが完全に目覚めたら、元のケージに戻します。それを厩舎に戻し、濡れたチャウで補います。注射の24時間後にブプレノルフィン飲料ボトルを取り外します。.
- ノテキシン注射後6時間、その後12時間ごとに2日間マウスを監視し、痛みの兆候、運動障害、および食物消費の減少についてマウスを監視します35,36。
4. 5-ヨード-2'-デオキシウリジン注射
注意:5-ヨード-2'-デオキシウリジン(IdU)は、遺伝的欠陥を引き起こし、生殖能力または胎児に損害を与えると疑われています。お取り扱い前に安全データシート(SDS)をお読みください。取り扱いの際は、個人用保護具を着用する必要があります。IdU粉末の重量を量るときは、ドラフトを使用してください。IdUと接触した材料は、地域の安全規制に従って廃棄する必要があります。
注:ヨウ素化チミジン類似体であるIdUはS期の細胞のDNAに取り込まれるため、 in vivo でのIdU標識は、損傷時間経過中の細胞分裂を監視するために使用されます。IdUは、マウスを犠牲にする8時間前に、20 mg / kg体重で腹腔内(i.p.)に注射されます。
- 37°Cの超音波処理器を使用して、滅菌PBS中のIdUの2 mg/mL原液を調製します。IdUは光に敏感です。同日中に使用することも、-20°Cで最大3か月間凍結してください。凍結IdUを使用する場合:解凍、ボルテックス、10,000 x g で30秒間遠心分離し、以下の注射に上清を使用します。
- 誘導ボックス(3%イソフルラン)でマウスを麻酔します。イヤマーキングに注意し、マウスの体重を量り、IdU溶液の量を計算します。
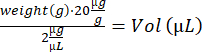
- インスリン注射器(28 G、0.5 mL)を使用して点滴注射を行い、マウスを加熱プレート上の空のリカバリーケージに移します。目が覚めたら、マウスを元のケージに戻します。残りのマウスに対して手順4.2〜4.3を繰り返し、厩舎に戻します。
5.安楽死
注:バッファレシピについては 、表1 を参照してください。洗浄培地(栄養混合物F-10(ハム)、10%ウマ血清、1xペン/連鎖球菌)を調製し、ポリエーテルスルホン(PES)メンブレンを通してポリスチレン容器にろ過します。解離バッファー(650 U/mLコラゲナーゼを添加した洗浄培地、タイプII)を調製し、氷上に保管します。CyTOFマスサイトメトリー測定は、汚染物質に対して非常に敏感です。このため、サンプル処理には最高レベルの分析グレードの試薬を使用することが不可欠です。金属汚染を防ぐために、多くの実験用石鹸には高レベルのバリウムが含まれているため、滅菌プラスチック製品と洗剤で洗浄されたことのない新しいガラス製品を使用することを強くお勧めします。試薬の調製には、二重ろ過、蒸留、脱イオン水を使用することをお勧めします。リン酸緩衝生理食塩水(PBS)は社内で調製されています。10xストックを1xに希釈し、1x PBSを0.2μmフィルターでろ過します。各実験の開始時に1x PBSを再度フィルタリングします。解剖ツールは、バリウムが存在するため、洗剤で洗浄してはなりません。
- 体重計、容器、イソフルランベースの麻酔ユニットを誘導ボックスで準備します。適切な解剖ツールを消毒します。
- 各マウスの50 mLチューブを調製し、5 mLの解離バッファーとシャーレで印印します。解離バッファーを氷上に保ちます。
- 誘導ボックス(3%イソフルラン、意識不明の場合は5%に増加)でマウスに麻酔をかけ、子宮頸部脱臼を行います。
6. 骨格筋の解剖と解離
- 両後肢からTA筋とGA筋を解剖し、ペトリ皿の蓋に移します。はさみを使用して、組織をみじん切りのスラリー(~1 mm3個)に切ります。5 mLの氷冷解離バッファーが入った50 mLチューブに移します。氷の上を保ってください。
- すべてのマウスが処理されるまで、安楽死手順(ステップ5.3)と骨格筋解剖および解離手順(ステップ6.1)を繰り返します。
- すべてのサンプルチューブを37°Cのウォーターバスで予熱し(2分間)、インキュベーター(37°C)で回転させて45分間インキュベートします。
- ボルテックスし、10mLの洗浄剤を加えて洗浄します。遠心分離(380 x g、 10分、室温[RT])し、4 mLまで吸引します。
- 0.5 mLのコラゲナーゼ(1000 U/mL)と0.5 mLのディスパーゼ(11 U/mL)を加えます。ボルテックスし、37°Cで回転させて20分間インキュベートします(例:インキュベーター内)。遠心分離(380 x g、1分、室温)し、5 mLピペットで再懸濁します。
- 50 mLチューブに40 μmのセルストレーナーを加え、5 mLの洗浄剤で事前に湿らせます。細胞懸濁液を吸引し、20Gの針が付いた5mLシリンジを使用して10回排出します。あらかじめ濡らした40μmセルストレーナーで濾します。50 mLチューブを10 mLの洗浄培地で洗浄し、40 μmの細胞ストレーナーに移し、細胞懸濁液を遠心分離(380 x g、10分、4°C)します。
7. シスプラチンおよびパラホルムアルデヒド固定による生死染色
注意:シスプラチンとパラホルムアルデヒド(PFA)は発がん性があります。取り扱い前にSDSをお読みください。パラホルムアルデヒド(PFA;16%)は、皮膚、眼、呼吸器を刺激する物質です。個人用保護具を着用し、これらの物質をドラフトの下で取り扱ってください。細胞の固定中、PFAの最終濃度は1.6%になります。正しい保護対策を講じ、廃棄物は地域の規制に従って処理する必要があります。
注:冷(4°C)および温(37°C)の無血清DMEMを準備します。10% FBSを添加したDMEMを調製し、PESメンブレンでろ過してポリスチレン容器に入れ、氷上に保管します。PBSおよび細胞染色培地(CSM;PBS、0.5% BSA、0.02% アジ化ナトリウム) を CyTOF 専用ガラス瓶に入れ、PES メンブレンでろ過します。CSMは4°Cで最大6ヶ月間保存できます。
- 上清を吸引し、ペレットをフリックし、1 mLの冷たい無血清DMEMに再懸濁します。細胞をカウントし、無血清DMEMで細胞密度を1 x 106 細胞/mLに調整します。
- シスプラチンストック(25 mM)を最終濃度25 μMまでVortex 10 sで添加し、正確に1分間インキュベートします(反応は非常に時間に敏感です)。氷冷したDMEM+10% FBS(サンプル量の3倍)で反応を急冷し、氷上に保ちます。遠心分離(380 x g、10分、4°C)し、上清を吸引し、ペレットを完全に再懸濁します(CSMで最大10 x 106 細胞/mL)。懸濁液を35 μmセルストレーナーでろ過します。
- 細胞懸濁液をろ過したPFAストック溶液(16%)で固定し、ピペットを上下させて(ドラフト内で実行)最終PFA濃度(1.6%)に到達させます(たとえば、100 μLの16% PFAを900 μLの細胞懸濁液に加えます)。ボルテックスで30秒間ボルテックスし、氷上で10分間インキュベートし、遠心分離(800 x g、5分間、RT)により2 mLのCSMで2回洗浄します。
注:この時点で、サンプルはドライアイス上で急速冷凍して-80°Cで保存するか、抗体染色に直接使用できます。細胞を凍結する場合は、ポリスチレンが低温で割れる可能性があるため、細胞を5mLのポリプロピレンチューブに移します。新たに固定した細胞を染色に使用する場合は、ステップ8.2に進みます。
8. 金属標識抗体による染色
注意:メタノール(MeOH)は引火性が高く、気道を腐食します。取り扱い前にSDSをお読みください。個人用保護具を着用し、本物質はドラフトの下で取り扱ってください。廃棄物は地域の規制に従って処理してください。
注:表面マーカーおよび細胞内マーカーを標的とする抗体(Ab)のリストは 、表2に記載されています。
抗体標識:このプロトコールで使用される抗体のほとんどは、市販されていなかったため、社内で標識されていました。抗体の金属標識のためのプロトコルは以前に発表されており、標識キットは現在市販されている37,38。免疫グロブリンG型(IgG)は、利用可能な標識プロトコルに適合します。金属標識に使用される抗体製剤には、システイン含有キャリアタンパク質(例えば、ウシ血清アルブミン(BSA))が含まれていないことが非常に重要です。これは、ポリマーの遊離マレイミド基を奪い合うことで標識効率に影響を与え、金属標識抗体の定量を妨げる可能性があります。ゼラチンのシステイン含有量は、BSAのシステイン含有量よりもはるかに低くなっています。ただし、抗体製剤にキャリアタンパク質が含まれている場合は、標識前にそのようなタンパク質を除去することをお勧めします。現在では、BSAフリーおよびゼラチンフリーの抗体をメーカーに請求することが可能になりました。低分子防腐剤(アジ化ナトリウム、グリセロール、トレハロースなど)は、金属結合プロトコル37,38に適合します。
抗体滴定:各金属標識の後、抗体を滴定して、最大のS/N比が得られる最適な抗体濃度を決定する必要があります。抗体滴定のために、6ステップの2倍段階希釈を行い、目的のタンパク質19,21,37,38を発現することが知られているサンプル(例えば、筋肉細胞、ポジティブコントロール)および欠損(ネガティブコントロール)の両方を染色する。
ストック液をPBS/1.6% PFAで0.1 μMに希釈して、新鮮なCell-ID Intercalator-Ir(ストック = 500 μM、インターカレーター-IR溶液)の作業溶液を調製します。
- 凍結したサンプルを室温で5分間解凍し、遠心分離(800 x g、1分間、室温)します。2 mLのCSMで遠心分離(800 x g、5分、RT)で洗浄します。
- CSMで2.5倍表面抗体(Ab)染色ミックスを調製します。上清を~60μLまで吸引し、ペレットを完全に再懸濁します。40 μLの表面Ab染色ミックスを添加し、室温で1時間インキュベートして細胞を染色します。
- サンプルを20分ごとにフリックして混合します。1 mLのCSMで遠心分離(800 x g、5分、RT)で2回洗浄します。上清を吸引し、ペレットをはじきます。
注:細胞内染色が不要な場合、メタノール透過化は必要ありません。ただし、表面染色のみを行う場合は、透過剤を含むバッファー(Maxpar fixやperm bufferなど)でインターカレーター-ir溶液を希釈して核膜を浸透させる必要があります。ステップ8.5に進み、透過剤と1.6%PFAを含むバッファーでCell-ID Intercalator-Irを希釈します。そうでない場合は、以下の細胞内染色を続行してください。
注意: イリジウムは危険であり、安全に取り扱うための予防措置を講じる必要があります。イリジウムは可燃性で、目や皮膚に刺激を与えます。ほこりや煙を発生させたり吸い込んだりしないでください。皮膚や目との接触を避けてください。ただし、インターカレーターとIR溶液の混合物は、水中で<1%の濃度で提供されており、化学物質の分類と表示に関する世界調和システム(GHS)によれば無害と見なされています。取り扱い前にStandard BiotoolsのSDSをお読みください。取り扱いの際は、個人用保護具を着用する必要があります。intercalator-ir溶液と接触した材料は、地域の安全規制に従って廃棄する必要があります。 - 細胞を透過処理するには、ボルテックスしながら0.5 mLの氷冷MeOHを滴下します。ドラフトの下で氷上で15分間インキュベートします。遠心分離(800 x g、5分、RT)した後、遠心分離(800 x g、5分、RT)により1 mLのCSMで2回洗浄します。最後の洗浄後、上清を~60μLに吸引し、ペレットを完全に再懸濁します。
- CSMで2.5倍細胞内Ab染色ミックスを調製します。細胞内Ab染色ミックス40μLを添加し、RTで1時間インキュベートして細胞を染色します。サンプルを20分ごとにフリックして混合します。
- 1 mLのCSMで遠心分離(800 x g、5分、RT)で2回洗浄します。上清を吸引し、ペレットをはじきます。サンプルを0.5 mLのインターカレーター-イリジウム溶液(表1)とボルテックスに再懸濁します。サンプルを室温で1時間、または4°Cで一晩(O / N)インキュベートします(以下の注を参照)。
注:サンプルは、インターカレーター-イリジウム溶液に4°Cで最大48時間保存できます。この研究で使用された染色プロトコルは、Nolan研究室{C}23による先駆的な研究に基づいて開発されました。これは、(i)社内調製バッファーを洗浄および染色に使用する、(ii)細胞を表面染色前に固定する、(iii)転写因子またはシグナル伝達分子に対する抗体による細胞内染色のために細胞をメタノールで透過処理する、という点で、Standard Biotoolsのプロトコルとは異なります。新しいプロトコールを開発する研究者は、抗体パネルと透過化剤としてのメタノールとの適合性を徹底的に試験する必要があります。パネルに新しい抗体を添加する場合は、金属の結合および滴定の前に、ポジティブおよびネガティブコントロールサンプルを使用したフローサイトメトリーによる抗体特異性試験を行うことが推奨されます。
9. マスサイトメーターにロードするためのサンプル調製
注:セルペレットは、CASバッファー中(材料表)では非常に緩んでいます。CASバッファーによる洗浄中は、乾燥を誤嚥しないでください。代わりに、以下で説明するように、残りのボリュームを保持します。
- サンプルをボルテックスして遠心分離(800 x g、10分、RT)します。上澄み液(PFA廃棄物として取り扱ってください)を注ぎ、渦巻きます。
- 1 mLのCSMで遠心分離(800 x g、10分、RT)で洗浄します。上清を吸引し、ペレットをはじきます。
- 1 mLのCASバッファーで遠心分離(800 x g、10分、室温)で洗浄します。~200 μL.ボルテックスに吸引し、CASバッファー1 mLを加えます。細胞数のために5μLのアリコートを取り出します。遠心分離(800 x g、10分、RT)し、≤50 μLまで慎重に吸引します。ペレットを邪魔しないでください。
- ペレットをCASバッファーで1–2 x 106 細胞/mLに再懸濁し、キャリブレーションビーズ(1x; 資料表)最終濃度を0.1倍にします(例えば、1xキャリブレーションビーズ100μLを細胞懸濁液900μLに加えます)。
- サンプルをマスサイトメーターにロードし、400〜500細胞/秒の流速でデータを収集します。
- CyTOFソフトウェアまたは以前に開発された正規化ツールを使用して、FCSファイルのデータ正規化を実行する39。
注:CyTOFマスサイトメーターの操作は、機器特異的です40,41。操作前にCyTOFユーザーマニュアルを参照することをお勧めします。キャリブレーションビーズは、金属同位体セリウム(140/142Ce)、ユーロピウム(151/153Eu)、ホルミウム(165Ho)、およびルテチウム(175/176Lu)の既知の濃度を含む金属包埋ポリスチレン正規化ビーズ標準物質です。キャリブレーションビーズは、主に生物学的材料の蓄積とプラズマイオン化の経時的な変動により、時間の経過とともに変化する可能性のある機械の感度を制御することができます。
10. CyTOFデータ解析
注:ダウンストリーム解析では、正規化されたFCSファイルをローカルで解析するか、Cytobank、Cell Engine、OMIQ、FCS Express42などのクラウドベースのソフトウェアソリューションにアップロードすることができます。
- 必要に応じて、各サンプルの個々のFCSファイルを1つのファイルに連結します。
- イリジウムインターカレーター陽性事象をゲーティングすることで単一細胞を同定し、デブリやダブレットから単核細胞を識別できます。
- シスプラチン陰性イベントを選択することにより、生細胞をゲートします。シスプラチンは、細胞タンパク質に共有結合し、死にかけている細胞や死んだ細胞に、生細胞よりも膜が損なわれている細胞をより大きく標識する43。
- 目的の集団、例えば、筋原性コンパートメント(Live/CD45-/CD31-/Sca1-/α7integrin+/CD9+)(図2A)にゲートし、幹細胞と前駆細胞の相対的な比率を定量化します。このアプローチでは、個々の集団を定義するために、細胞表面または細胞内マーカーの発現に関する予備知識が必要です。
- 複雑な集団内の以前に認識されていなかった希少細胞サブセットの同定を可能にする高次元分析を実行し、関心のある集団をエクスポートし、CyTOFデータ分析44のために特別に開発されたクラスタリングアルゴリズムを使用する。
注:以前の研究では、高次元空間で加重k最近傍密度推定(kNN-DE)を使用して、定義されたパラメータ19に基づいて教師なしクラスタリングを実行するXシフトアルゴリズムを採用していました。Xシフトは、希少な細胞集団の同定に非常に効果的であることが示されています45。 - X-shift 解析を行うには、vortex ソフトウェア パッケージ (Nolan Lab の GitHub ページ [https://github.com/nolanlab/vortex] から) と Java 64-bit46 をダウンロードします。手順については、https://github.com/nolanlab/vortex/wiki/Getting-Started を参照してください。
- エクスポートした細胞母集団をローカルデータベースにアップロードし、クラスタリングパラメーターを定義します。ユーザー定義のパラメータには、(i)クラスタリングに使用されるマーカー、(ii)k値の範囲(5〜150など)、および(iii)クラスタリングステップの数があります。
注:以前の研究では、クラスタリングマーカーとして、筋幹細胞で発現することが知られている表面マーカー、筋肉細胞および筋芽細胞のハイスループットフローサイトメトリースクリーニングで同定された新規表面マーカー、および筋形成のさまざまな段階を定義することが知られている筋原性転写因子(TF)の組み合わせを使用しました。このアプローチにより、CD9とCD104の2つの細胞表面マーカーの同定が可能になり、その共発現パターンが以前に認識されていなかった前駆細胞集団を区別する19。 クラスタリングマーカーを慎重に選択することで、研究者は特定の研究課題に答えることができます。例えば、分割する細胞サブセットの経時的な同定と解析が必要な場合は、クラスタリングマーカーの1つとしてIdUを含めることをお勧めします。X-shiftは、複数のk値でクラスタリングを実行し、「エルボーポイント」を計算することにより、最適なクラスター数をもたらすk値を自動的に特定できるため、クラスタリング不足や過度の断片化を回避できます。エルボ点を計算し、データの視覚化とダウンストリーム アプリケーションに最適な k 値によって定義されるクラスタリング解析を使用することをお勧めします。 - Xシフトクラスター内の細胞集団間の空間的関係を視覚化するには、力主導レイアウトを実行すると、クラスター間の距離が高次元表現型空間でのマーカー発現の類似性を示す2Dマップが生成されます。一度に1つのマーカーを使用してマップに色を付けることで、新しい細胞集団を発見し、そのダイナミクスを追うことができます。CytobankやCell Engineなどのソフトウェアでの手動ゲーティングによるフォローアップ定量が推奨されます。
- ヒートマップ解析を実施して、複数の表面および細胞内タンパク質の経時的な動的発現を定量化し、新たな傾向を明らかにします。
注:アディショナルタイムコースを実行する場合、すべてのタイムポイントのデータをクラスター化して、再生のマップを生成することができます。さらに、そのようなマップを個々の時点に解剖して、時間の経過に伴う再生の細胞および分子のダイナミクスを追跡することが可能である19。
11. FACSに対する蛍光色素標識抗体による染色
注:未染色の単色コントロールおよび蛍光マイナス1(FMO)コントロールに使用される細胞は、利用可能な場合は追加のマウスから設定されたTAおよびGAに由来する可能性があります。あるいは、大腿四頭筋(大腿前部上部筋)を解剖し、上記のTA+GAと同じ手順に従って単一細胞懸濁液に消化し、コントロールに使用することもできます。FACS緩衝液(PBS、2.5%ヤギ血清、2mM EDTA)を調製し、PESメンブレンでポリスチレン容器にろ過し、氷上に保管します。FACSバッファーは、4°Cで最大1ヶ月間保存することができます。FACSに使用される抗体のリストは、 表3に記載されています。
- 系統ミックスを準備します。各コントロールを50 μL(約3–5 x 105 細胞を含む)で染色します。必要な系統ミックスの量を計算します。ボリュームを 20% から 30% 過剰にします。系統ミックスに用いる抗体のストック濃度は0.2 mg/mLです。
- 0.5 mLチューブに抗CD45 APC-Cy7、抗CD31 APC-Cy7、抗Sca1 APC-Cy7、抗CD11b APC-Cy7を加えて、それぞれ1 μg/mL、2.5 μg/mL、2.5 μg/mL、0.63 μg/mLの最終濃度にします。
- オールステインミックスを準備します。全染色した各サンプルを500 μL(約3–5 x 106 細胞を含む)で染色します。オールステインミックスのボリュームを10%増やします。
- 1.5 mLチューブに、上記の系統ミックス抗体+抗α7 インテグリンPE、抗CD9 APC、および抗CD104 FITCを添加して、それぞれ2 μg/mL、1.2 μg/mL、および3 μg/mLの最終濃度に到達します。
- FACSバッファー+ DAPIを調製する:10 mLのFACSバッファーに対して、1 μLのDAPI(ストック= 1 mg/mL)を加えて、100 ng/mLの最終DAPI濃度にします。
注意:DAPI(4',6-ジアミジノ-2-フェニルインドール二塩酸塩)は、皮膚および呼吸器刺激性の可能性があると分類されています。ただし、GHSによると、<1%の濃度のDAPI溶液は無害と見なされます。取り扱い前にSDSをお読みください。取り扱いの際は、個人用保護具を着用する必要があります。DAPIと接触した材料は、地域の安全規制に従って廃棄する必要があります。 - セクション6:骨格筋の解剖と解離から細胞を再懸濁します。
- 全染色サンプルの場合は、1匹のマウスのTAおよびGAセットを500 μLのFACSバッファーに再懸濁し、15 mLチューブに移して染色します。
- コントロールには、TAセットとGAセット、または大腿四頭筋セットのいずれかを使用します。コントロールに1マウスを使用する場合は、750μLのFACSバッファーに細胞を再懸濁します。複数のマウスの場合は、各TAおよびGAまたはクワドリセップセットを500μLのFACSバッファーに再懸濁し、各サンプルから画分を採取してセットを1つの1mLサンプルに結合します。50 μLのコントロールセル(3–5 x 105 細胞)を5 mLポリプロピレンチューブに添加して染色します。
- 表4に記載されているように、暗所で4°Cで45分間染色します。
- 全染色サンプルを5 mLのFACSバッファーを加えて洗浄します。1 mLのFACSバッファーを加えてコントロールを洗浄し、遠心分離機(380 x g、10分、4°C)します。
- 全染色したサンプルを1 mLのFACSバッファー+ DAPIに再懸濁します。DAPIの有無にかかわらず、300μLのFACSバッファーにコントロールを再懸濁します。
- 細胞を4°Cの暗所で保持し、4つのレーザー(405 nm、488 nm、561 nm、633 nm)を備えたフローサイトメーターでソーティングします。
- ソーターでコントロールとサンプルを実行し、関連するソフトウェアを使用してソーティングゲートを作成します。未染色/単色コントロールとFMOコントロールの場合は、それぞれ1 x 104 および0.3–1 x 105 のイベントを記録します。全染色サンプルの場合、最大1 x 106 イベントを記録します。すべての全染色サンプルを選別するか、下流のアッセイ要件に応じて必要な分だけ選別します。ここで使用したフローサイトメーター(FACSAria III)は、70 mmノズルを使用して Purityモードで ソーティングします。
- ゲーティング戦略については、 図 4 を参照してください。
- 未染色および単色コントロールを使用して、すべての検出器の電圧を設定します。
- 単色コントロールを使用して、補正マトリックスを設定します。
- FMO コントロールを使用して、ソーティング ゲートを確立します。
- 異なる筋幹細胞と前駆細胞集団を氷冷FACSバッファーに選別します。
- 細胞集団を遠心分離(380 x g、10分、4°C)します。適切なバッファーに再懸濁し、カウントして、ダウンストリーム解析を続行します。
Access restricted. Please log in or start a trial to view this content.
結果
ここでは、(i) 骨格筋の幹細胞と前駆細胞の細胞および分子動態を研究するためのノテキシン注射による急性損傷時間経過の高次元 CyTOF 分析 (図 1、上のスキーム) を含む、この組み合わせアプローチを使用するための実験設定の概要を示します。(ii)幹細胞および前駆細胞のFACSは、CD9およびCD104の2つの細胞表面マーカーを使用して、これらの集?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
骨格筋の再生は、成体幹細胞の機能に依存するダイナミックなプロセスです。先行研究は、再生中の筋幹細胞の役割に焦点を当ててきたが、その子孫のin vivoは、主にこれらの細胞集団を同定し単離するためのツールが不足しているため、十分に研究されていなかった15,16,17,18。
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利益相反を宣言しません。
謝辞
オーフス大学生物医学科のFACSコアファシリティのメンバーの技術サポートに感謝します。私たちは、生物医学部門の質量サイトメトリーユニットのマネージャーであるAlexander Schmitz氏に、ディスカッションとサポートを提供していただいたことに感謝します。サイエンティフィックイラストレーションは Biorender.com を使用して作成されました。この研究は、オーフス大学フォルスニングスフォンド(AUFF)のスターティンググラントと、ノボノルディスク財団からE.P.へのスタートパッケージグラント(0071113)によって資金提供されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
参考文献
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462(2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. Mass Cytometry: Methods and Protocols. , Springer, Humana. New York, NY. (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556(2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, Pt 1 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , Chapter 13, Unit13.4 (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, Issue 1-2, 2021 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), PMID: 22330867; PMCID: PMC3276965 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632(2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425(2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398(2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394(2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , Chapter 10., Uni10.17 (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692(2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999(2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), e1658 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), eade9238 (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744(2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723(2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), e606 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557(2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , Chapter 8 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), e5 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved