Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Идентификация и анализ миогенных предшественников in vivo при остром повреждении скелетных мышц методом многомерной одноклеточной массовой цитометрии
В этой статье
Резюме
Представленный здесь протокол позволяет проводить идентификацию и многомерный анализ мышечных стволовых и прогениторных клеток с помощью одноклеточной массовой цитометрии и их очистку с помощью FACS для углубленного изучения их функции. Этот подход может быть применен для изучения динамики регенерации в моделях заболеваний и проверки эффективности фармакологических вмешательств.
Аннотация
Регенерация скелетных мышц — это динамический процесс, приводимый в движение взрослыми мышечными стволовыми клетками и их потомством. Взрослые мышечные стволовые клетки, находящиеся в основном в состоянии покоя в стационарном состоянии, активируются при повреждении мышц. После активации они размножаются, и большая часть их потомства дифференцируется для создания компетентных к слиянию мышечных клеток, в то время как оставшиеся самообновляются для пополнения пула стволовых клеток. В то время как идентичность мышечных стволовых клеток была определена более десяти лет назад на основе совместной экспрессии маркеров клеточной поверхности, миогенные предшественники были идентифицированы только недавно с использованием подходов к размерным одиночным клеткам. В данной работе мы представляем метод одноклеточной масс-цитометрии (цитометрия по времени пролета [CyTOF]) для анализа стволовых клеток и клеток-предшественников при остром мышечном повреждении для разрешения клеточной и молекулярной динамики, которая разворачивается во время регенерации мышц. Этот подход основан на одновременном обнаружении новых маркеров клеточной поверхности и ключевых миогенных факторов транскрипции, динамическая экспрессия которых позволяет идентифицировать активированные стволовые клетки и популяции клеток-предшественников, представляющие собой вехи миогенеза. Важно отметить, что описана стратегия сортировки, основанная на обнаружении маркеров клеточной поверхности CD9 и CD104, позволяющая проспективно выделять мышечные стволовые и прогениторные клетки с помощью флуоресцентно-активируемой сортировки клеток (FACS) для углубленного изучения их функции. Мышечные клетки-предшественники являются критически важным недостающим звеном для изучения контроля судьбы мышечных стволовых клеток, выявления новых терапевтических мишеней для мышечных заболеваний и разработки приложений клеточной терапии для регенеративной медицины. Представленный здесь подход может быть применен для изучения мышечных стволовых и прогениторных клеток in vivo в ответ на возмущения, такие как фармакологические вмешательства, нацеленные на конкретные сигнальные пути. Он также может быть использован для исследования динамики мышечных стволовых и прогениторных клеток на животных моделях мышечных заболеваний, углубляя наше понимание болезней стволовых клеток и ускоряя разработку методов лечения.
Введение
Скелетные мышцы представляют собой самую большую по массе ткань в организме и регулируют множество функций, от зрения до дыхания, от осанки до движения, а также обмен веществ1. Поэтому поддержание целостности и функции скелетных мышц имеет решающее значение для здоровья. Скелетная мышечная ткань, состоящая из плотно упакованных пучков многоядерных миоволокон, окруженных сложной сетью нервов и кровеносных сосудов, демонстрирует замечательный регенеративный потенциал1,2.
Основными факторами регенерации скелетных мышц являются взрослые мышечные стволовые клетки (MuSC). Также известные как сателлитные клетки, благодаря их уникальному анатомическому расположению рядом с плазматической мембраной миоволокна и под базальной пластинкой, они были впервые идентифицированы в 1961году. MuSC экспрессируют уникальный молекулярный маркер, фактор транскрипции в паре 7 (Pax7)4. В основном в состоянии покоя у здоровых взрослых, они активируются при повреждении мышц и размножаются, давая начало потомству, которое (i) дифференцируется в компетентные мышечные клетки, которые образуют новые миоволокна для восстановления мышечных повреждений, или (ii) самообновляются для пополненияпула стволовых клеток.
На клеточном и молекулярном уровнях процесс регенерации достаточно динамичен и включает в себя переходы в состояние клетки, характеризующиеся скоординированной экспрессией ключевых миогенных факторов транскрипции, также известных как миогенные регуляторные факторы (MRF)6,7. Предшествующие исследования развития in vivo, эксперименты по отслеживанию родословной и работа с культивированием клеток с использованием миобластов показали, что последовательная экспрессия этих транскрипционных факторов управляет миогенезом, при этом миогенный фактор 5 (Myf5) экспрессируется при активации, миогенная дифференцировка 1 (MyoD1) отмечает приверженность миогенной программе, а экспрессия миогенина (MyoG) отмечает дифференцировку 8,9,10,11, 12,13,14. Несмотря на эти знания и открытие маркеров клеточной поверхности для очистки MuSCs, стратегии и инструменты для идентификации и изоляции дискретных популяций вдоль пути миогенной дифференцировки и разрешения миогенной прогрессии in vivo отсутствовали 15,16,17,18.
Здесь мы представляем новый метод, основанный на недавно опубликованных исследованиях, который позволяет идентифицировать стволовые и прогениторные клетки в скелетных мышцах и анализировать их клеточное, молекулярное и пролиферативное динамики в контексте острого мышечного повреждения. Этот подход основан на масс-цитометрии одиночных клеток (также известной как цитометрия по времени пролета [CyTOF]) для одновременного обнаружения ключевых маркеров клеточной поверхности (α7 интегрина, CD9, CD44, CD98 и CD104), внутриклеточных миогенных факторов транскрипции (Pax7, Myf5, MyoD и MyoG) и нуклеозидного аналога (5-Йодо-2'-дезоксиуридина, IdU) для мониторинга клеток в S-фазе19,20. 21,22,23. Кроме того, протокол представляет стратегию, основанную на обнаружении двух маркеров клеточной поверхности, CD9 и CD104, для очистки этих клеточных популяций с помощью сортировки клеток, активируемой флуоресценцией (FACS), что позволяет в будущем провести углубленные исследования их функции в контексте травм и мышечных заболеваний. В то время как первичные миобласты широко использовались в прошлом для изучения поздних стадий миогенной дифференцировки in vitro, неизвестно, повторяют ли они молекулярное состояние мышечных клеток-предшественников, обнаруженных in vivo 24,25,26,27,28,29,30 . Производство миобластов является трудоемким и трудоемким процессом, а молекулярное состояние этой первичной культуры быстро изменяется при прохождении31. Следовательно, свежевыделенные миогенные предшественники, очищенные с помощью этого метода, обеспечат более физиологическую систему для изучения миогенеза и эффекта генетических или фармакологических манипуляций ex-vivo.
Представленный здесь протокол может быть применен для решения различных исследовательских вопросов, например, для изучения динамики миогенного компартмента in vivo на животных моделях мышечных заболеваний, в ответ на острые генетические манипуляции или при фармакологических вмешательствах, тем самым углубляя наше понимание дисфункции мышечных стволовых клеток в различных биологических контекстах и способствуя разработке новых терапевтических вмешательств.
протокол
Процедуры на животных были одобрены датской инспекцией по экспериментам на животных (протокол # 2022-15-0201-01293), а эксперименты проводились в соответствии с институциональными рекомендациями Орхусского университета. Анальгезия (бупренорфин) вводится в питьевую воду за 24 часа до травмы, чтобы мыши могли адаптироваться к вкусу. Подача бупренорфина в питьевую воду продолжается в течение 24 ч после травмы. Вместе с подкожной инъекцией бупренорфина во время острой мышечной травмы, бупренорфин в питьевой воде после инъекции нотексина облегчит боль, связанную с травмой. В то время как рекомендуется вводить внутривенно бупренорфин во время острой мышечной травмы, а затем бупренорфин в питьевой воде, бупренорфин в питьевой воде до травмы является необязательным. Тем не менее, исследователи должны следовать стандартам и рекомендациям по благополучию животных, установленным соответствующим регулирующим органом.
ПРИМЕЧАНИЕ: Для экспериментов по масс-цитометрии одиночных клеток (CyTOF) поврежденных мышц задних конечностей начните с раздела 1: Анальгезия в воде за 24 часа до мышечной травмы до 24 часов после травмы. Для сортировки мышечных стволовых и прогениторных клеток у неповрежденных мышей выполните разделы 5 и 6: Эвтаназия + Диссекция и диссоциация скелетных мышц, и перейдите к разделу 11: Окрашивание флуорофор-конъюгированными антителами к FACS. Обзор экспериментальной установки и протокола показан на рисунке 1.
1. Обезболивание в воде за 24 ч до мышечной травмы до 24 ч после травмы
- В темную бутылку для питья, завернутую в алюминиевую фольгу, добавьте 3 мл бупренорфина (0,3 мг/мл) и наполните до 100 мл фильтрованной водой до конечной концентрации 0,009 мг/мл за 24 часа до травмы. Прикрепите к клетке для мыши.
- Снимите поилку через 24 часа после травмы и снова подключите клетку для мыши к системе клапанов для питья.
2. Подготовка к процедуре острой травмы
ПРИМЕЧАНИЕ: Используйте 70% этанол для дезинфекции рабочего стола, установки носового обтекателя и индукционной коробки.
- Приготовьте пробирку объемом 1,5 мл с разведенным нотексином в PBS (5 мкг/мл). Разведите бупренорфин (0,3 мг/мл) в стерильном 0,9% физиологическом растворе до 0,015 мг/мл в светобезопасной пробирке объемом 1,5 мл. Держите на льду. Подготовьте инсулиновые шприцы для инъекций бупренорфина (28 Г, 0,5 мл) и нотексина (29 Г, 0,3 мл).
- Настройка анестетиков на основе изофлурана:
- Для анестезии в индукционном боксе используют 3% изофлуран с расходом 1,5 л/мин (50% О2, 50% атмосферного воздуха).
- Для технического обслуживания с использованием конуса носового обтекателя используйте 1,5% изофлуран с расходом 0,6 л/мин (50%O2, 50% атмосферного воздуха).
3. Острое повреждение в результате инъекции нотексина
Примечание: Нотексин обладает активностью фосфолипазыА2 и является основным компонентом яда австралийской тигровой змеи (Notechis scutatus) с внутривенным введением LD50 5–17 мг нотексина/кг у мышей32,33. В соответствии с настоящим протоколом в переднюю большеберцовую мышцу (ТА) каждой задней конечности вводится 10 мкл 5 мг/мл нотексина, а в икроножную мышцу (ГА) каждой задней конечности дважды (по одному разу в каждую головку мышцы) вводится 15 мкл 5 мг/мл нотексина. Важно правильно выполнять внутримышечные (в/м) инъекции, чтобы ограничить повреждение, и часто осматривать вводимых животных для обеспечения минимальной боли.
- Обезболите мышь в индукционной коробке (3% изофлуран). Когда мышь находится в бессознательном состоянии, снизьте уровень изофлурана до 1,5% в индукционном боксе.
- Взвесьте и индивидуально пометьте мышей в соответствии с утвержденными в учреждении процедурами. Под установкой носового конуса сбрейте задние конечности триммером и перенесите обратно в индукционную коробку.
- Рассчитайте объем бупренорфина для каждой мыши:
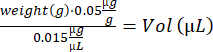
- Смешайте раствор нотексина с помощью пипетирования вверх и вниз. Подготовьте 2 инсулиновых шприца (29 г, 0,3 мл) с 10 мкл раствора нотексина (5 мкг/мл) для инъекций ТА и 4 инсулиновых шприца с 15 мкл раствора нотексина (5 мкг/мл) для инъекций ГА.
ПРИМЕЧАНИЕ: Передняя мышца большеберцовой кости (TA) расположена на передней стороне голени мыши и простирается от колена до лодыжки. Икроножная мышца (ГА) представляет собой двуглавую мышцу, которая расположена в задней части голени, поверхностно по отношению к камбаловидной мышце. Она проходит от двух головок (медиальной и латеральной) чуть выше колена до пятки, проходя в общей сложности через три сустава (коленный, голеностопный и подтаранный суставы). - Выполнение внутримышечных инъекций
- Инъекция ТА (всего 2 инъекции)
- Поместите мышь в лежачее положение под конусом носа и продезинфицируйте место инъекции стерильными спиртовыми салфетками (70% этанол или изопропанол). Введите иглу скошенной вниз иглой в брюхо ТА (дистальнее середины живота) под углом 30°. Продвигайте иглу вдоль мышцы, двигаясь параллельно большеберцовой кости, чтобы достичь середины живота ТА. Вводите нотексин медленно и непрерывно, оставляя иглу на месте в течение 10 с, прежде чем извлечь ее. Не вводите иглу слишком глубоко изначально (чтобы избежать введения нотексина ниже ТА в мышцу-разгибатель пальца ноги) и не слишком сильно проксимально при продвижении иглы (чтобы избежать введения слишком близко к колену).
- Инъекция GA (всего 4 инъекции)
- Введите иглу скосом вниз под углом ~45° в середину живота боковой головки ГА. Вводите нотексин медленно и непрерывно, оставляя иглу на месте в течение 10 секунд, прежде чем извлечь ее. Поверните заднюю конечность и введите нотексин в медиальную головку мышцы ГА, как указано выше. Следует соблюдать осторожность, чтобы не вводить иглу слишком глубоко.
- Инъекция ТА (всего 2 инъекции)
- Поверните мышь и введите бупренорфин в.к. с помощью инсулинового шприца (28 г, 0,5 мл). Переложите мышь в пустую клетку для восстановления на нагревательной пластине. Только половина дна клетки должна быть размещена над нагревательной пластиной, чтобы позволить мыши терморегулировать во время восстановления34. Повторите шаги 3.3–3.6 для оставшихся мышей.
- Когда мышь в клетке для восстановления полностью придет в себя, переместите ее обратно в исходную клетку. Верните его в конюшню и дополните смоченным чау. Удалите бупренорфин через 24 часа после инъекции.
- Наблюдение за мышами в течение 6 ч после инъекции нотексина, а затем каждые 12 ч в течение 2 дней на предмет признаков боли, нарушения подвижности и снижения потребления пищи35,36.
4. Инъекция 5-йодо-2'-дезоксиуридина
ВНИМАНИЕ: 5-йодо-2'-дезоксиуридин (IdU) подозревается в причинении генетических дефектов и причинении вреда фертильности или нерожденному ребенку. Перед обращением прочтите паспорт безопасности (SDS). Во время работы следует надевать средства индивидуальной защиты. При взвешивании порошка IdU используйте вытяжной шкаф. Материалы, которые контактировали с IdU, должны быть утилизированы в соответствии с местными правилами безопасности.
Примечание: Мечение IdU in vivo используется для мониторинга деления клеток во время травмы, поскольку IdU, аналог йодированного тимидина, встраивается в ДНК клеток в S-фазе. IdU вводят внутрибрюшинно (в/в) в дозе 20 мг/кг массы тела за 8 ч до умерщвления мыши.
- Используйте ультразвуковую терапию при 37 °C для приготовления стокового раствора IdU в концентрации 2 мг/мл в стерильном PBS. IdU светочувствительна; использовать в течение того же дня или заморозить при температуре -20 °C на срок до 3 месяцев. При использовании замороженного IdU: разморозить, сделать вихревой, центрифугировать при 10 000 x g в течение 30 с и использовать надосадочную жидкость для инъекций ниже.
- Обезболите мышь в индукционной коробке (3% изофлуран). Обратите внимание на целевое выделение, взвесьте мышей и рассчитайте объем решения IdU:
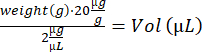
- Выполните внутримышечную инъекцию с помощью инсулинового шприца (28 г, 0,5 мл) и перенесите мышь в пустую клетку для восстановления на нагревательной пластине. Когда мышь активнется, вернитесь в исходное положение. Повторите шаги 4.2–4.3 для оставшихся мышей и верните их в стойло.
5. Эвтаназия
ПРИМЕЧАНИЕ: Рецепты буферных буферов см. в Таблице 1 . Приготовьте промывочный материал (питательная смесь F-10 (Ham's), 10% лошадиная сыворотка, 1x Pen/Strep) и отфильтруйте через мембрану из полиэфирсульфона (PES) в контейнер из полистирола. Приготовьте диссоциативный буфер (промывочный материал с добавлением 650 Ед/мл коллагеназы, тип II) и держите на льду. Измерения масс-цитометрии CyTOF очень чувствительны к загрязнениям. По этой причине для обработки образцов важно использовать реактивы высшего аналитического качества. Чтобы предотвратить загрязнение металлов, настоятельно рекомендуется использовать стерильную пластиковую посуду и новую стеклянную посуду, которая никогда не мылась моющим средством, потому что многие лабораторные мыла содержат высокий уровень бария. Для приготовления реагентов рекомендуется использовать дважды отфильтрованную, дистиллированную, деионизированную воду. Фосфатно-солевой буфер (PBS) готовится на месте. Разбавьте 10x stock до 1x и отфильтруйте 1x PBS с помощью фильтров 0,2 мкм. Фильтруйте 1x PBS еще раз в начале каждого эксперимента. Инструменты для вскрытия нельзя чистить моющим средством из-за наличия бария.
- Подготовьте весы, контейнер и анестетик на основе изофлурана с помощью индукционного бокса. Продезинфицируйте соответствующие инструменты для вскрытия.
- Подготовьте и разметьте пробирки по 50 мл для каждой мыши с 5 мл диссоциационного буфера и чашкой Петри. Держите буфер диссоциации на льду.
- Обезболить мышь в индукционном боксе (3% изофлуран, увеличить до 5% в бессознательном состоянии) и выполнить вывих шейки матки.
6. Диссекция и диссоциация скелетных мышц
- Рассеките мышцы ТА и ГА с обеих задних конечностей и перенесите в крышку чашки Петри. Ножницами разрежьте ткань на измельченную кашицу (~1 мм3 штуки). Переложите в пробирку объемом 50 мл, содержащую 5 мл ледяного буфера для диссоциации. Держите на льду.
- Повторяйте процедуру эвтаназии (шаг 5.3) и процедуру рассечения и диссоциации скелетных мышц (шаг 6.1) до тех пор, пока все мыши не будут обработаны.
- Предварительно нагрейте все пробирки с образцами на водяной бане при температуре 37 °C (2 минуты) и инкубируйте в течение 45 минут при вращении в инкубаторе (37 °C).
- Вортексируйте и промойте, добавив 10 мл промывочного материала. Центрифугу (380 x g, 10 мин, комнатная температура [RT]) и аспирацию до 4 мл.
- Добавьте 0,5 мл коллагеназы (1000 Ед/мл) и 0,5 мл диспазы (11 Ед/мл). Сделать вихрь и инкубировать в течение 20 мин при вращении при 37 °C (например, в инкубаторе). Центрифугируйте (380 x g, 1 мин, RT) и ресуспендируйте с помощью пипетки объемом 5 мл.
- Добавьте ситечки 40 мкм в пробирки объемом 50 мл и предварительно смочите 5 мл промывочного материала. Аспирировать и эфлектизировать клеточную суспензию 10 раз с помощью шприца объемом 5 мл с иглой 20 G. Процедите через предварительно увлажненное сетчатое фильтр 40 мкм. Промойте пробирку объемом 50 мл промывочной средой объемом 10 мл, переложите ее в сетчатое фильтр 40 μм и центрифугируйте (380 x g, 10 мин, 4 °C) клеточную суспензию.
7. Окрашивание живым/мертвым с фиксацией цисплатином и параформальдегидом
ВНИМАНИЕ: Цисплатин и параформальдегид (PFA) являются канцерогенами. Прочтите паспорт безопасности перед обработкой. Параформальдегид (PFA; 16%) является раздражителем кожи, глаз и дыхательных путей. Надевайте средства индивидуальной защиты и работайте с этими веществами под вытяжным шкафом. Во время фиксации клеток конечная концентрация PFA составит 1,6%. Должны быть приняты правильные меры защиты, а с отходами следует обращаться в соответствии с местными правилами.
ПРИМЕЧАНИЕ: Приготовьте холодный (4 °C) и теплый (37 °C) бессывороточный DMEM. Приготовьте DMEM с добавлением 10% FBS, профильтруйте через мембрану PES в контейнер из полистирола и держите на льду. Приготовьте PBS и среды для окрашивания клеток (CSM; PBS, 0,5% BSA, 0,02% азида натрия) в стеклянной бутылке, предназначенной для CyTOF, и фильтровать через мембрану PES. CSM может храниться при температуре 4 °C до 6 месяцев.
- Аспирируйте надосадочную жидкость, взбейте гранулу и повторно суспендируйте в 1 мл холодной сыворотки DMEM. Подсчитайте клетки и отрегулируйте плотность клеток до 1 x 106 клеток/мл в бессывороточном DMEM.
- Добавьте запас цисплатина (25 мМ) до конечной концентрации 25 мкМ. Vortex 10 с и инкубируйте ровно 1 мин (реакция очень чувствительна ко времени). Угасите реакцию с помощью ледяного DMEM + 10% FBS (в 3 раза больше объема образца) и держите его на льду. Центрифуга (380 x g, 10 мин, 4 °C), аспирация надосадочной жидкости и тщательная ресуспендия гранулы (до 10 x 106 клеток/мл в CSM). Отфильтруйте суспензию через сетчатое фильтр 35 мкм.
- Зафиксируйте клеточную суспензию отфильтрованным стоковым раствором PFA (16%) и пипеткой вверх и вниз (выполняйте под вытяжным шкафом) до достижения конечной концентрации PFA (1,6%) (например, добавьте 100 μл 16% PFA на 900 μл клеточной суспензии). Выдержать в течение 30 с, инкубировать в течение 10 минут на льду и дважды промыть 2 мл CSM центрифугированием (800 x g, 5 мин, RT).
ПРИМЕЧАНИЕ: На этом этапе образцы можно либо замораживать на сухом льду и хранить при температуре -80 °C, либо использовать непосредственно для окрашивания антител. Если клетки подлежат замораживанию, переложите их в полипропиленовые пробирки объемом 5 мл, так как полистирол может трескаться при низких температурах. Если для окрашивания используются свежезафиксированные клетки, переходите к пункту 8.2.
8. Окрашивание металл-конъюгированными антителами
ВНИМАНИЕ: Метанол (MeOH) легко воспламеняется и вызывает коррозию дыхательных путей. Прочтите паспорт безопасности перед обработкой. Надевайте средства индивидуальной защиты и обращайтесь с этим веществом под вытяжным шкафом. Обращайтесь с отходами в соответствии с местными нормами.
ПРИМЕЧАНИЕ: Список антител (Ab), нацеленных на поверхностные маркеры и внутриклеточные маркеры, можно найти в таблице 2.
Конъюгация антител: Большинство антител, используемых в этом протоколе, были конъюгированы внутри компании, потому что они не были коммерчески доступны. Ранее были опубликованы протоколы конъюгации антител металлами, а в настоящее время коммерчески доступнынаборы для конъюгации 37,38. Иммуноглобулин типа G (IgG) совместим с доступными протоколами конъюгации. Очень важно, чтобы композиция антитела, используемая для конъюгации металлов, не содержала цистеинсодержащих белков-носителей (например, бычьего сывороточного альбумина (БСА)), которые могут влиять на эффективность конъюгации, конкурируя за свободные малеимидные группы полимера, и могут мешать количественному определению металл-конъюгированного антитела. Содержание цистеина в желатине значительно ниже, чем в БСА. Тем не менее, рекомендуется, чтобы если композиция антитела содержит белки-переносчики, такие белки удаляли до конъюгации. Теперь можно запросить у производителя антитела, не содержащие БСА и желатина. Низкомолекулярные консерванты (например, азид натрия, глицерин и трегалоза) совместимы с протоколами конъюгации металлов37,38.
Титрование антител: После каждой конъюгации металлов антитела следует титровать, чтобы определить оптимальную концентрацию антител, обеспечивающую максимальное соотношение сигнал/шум. Для титрования антител проводят 6-ступенчатое двукратное серийное разведение и окрашивают оба образца, которые, как известно, экспрессируют (например, мышечные клетки, положительный контроль) и испытывают недостаток (отрицательный контроль) представляющего интерес белка 19,21,37,38.
Приготовьте свежий рабочий раствор Cell-ID Intercalator-Ir (запас = 500 мкМ; раствор интеркалятора-ir) путем разбавления исходного раствора до 0,1 мкМ в PBS/1,6% PFA.
- Разморозьте замороженные образцы в течение 5 минут на RT и центрифуге (800 x g, 1 minute, RT). Промыть 2 мл CSM центрифугированием (800 x g, 5 мин, RT).
- Приготовьте 2,5-кратную смесь для окрашивания поверхностных антител (Ab) в CSM. Отасуньте надосадочную жидкость до ~60 мкл и тщательно суспендируйте гранулу. Окрашивайте клетки, добавляя 40 μл поверхностной смеси для окрашивания Ab и инкубируя ее в течение 1 часа при RT.
- Перемешивайте образцы каждые 20 минут. Дважды промыть 1 мл CSM центрифугированием (800 x g, 5 мин, RT). Аспирируйте надосадочную жидкость и взбейте гранулу.
ПРИМЕЧАНИЕ: Если внутриклеточное окрашивание не требуется, пермеабилизация метанолом не требуется. Однако, если выполняется только поверхностное окрашивание, раствор интеркалятора-ir должен быть разбавлен в буфере, содержащем проникающий агент (например, фикс Maxpar и буфер для перманентной завивки) для проникновения через ядерную мембрану. Перейдите к шагу 8.5 и разведите Cell-ID Intercalator-Ir в буфере, содержащем проникающий агент и 1,6% PFA. В противном случае продолжайте внутриклеточное окрашивание, приведенное ниже.
ВНИМАНИЕ: Иридий опасен, поэтому необходимо соблюдать меры предосторожности для безопасного обращения. Иридий легко воспламеняется и является раздражителем для глаз / кожи. Избегайте образования и вдыхания пыли или дыма. Избегайте попадания на кожу и в глаза. Тем не менее, смесь интеркалятора и раствора IR обеспечивается в концентрации <1% в воде, которая считается неопасной в соответствии с Глобально гармонизированной системой классификации и маркировки химических веществ (GHS). Перед началом работы прочтите паспорт безопасности от Standard Biotools. Во время работы следует надевать средства индивидуальной защиты. Материалы, контактировавшие с раствором intercalator-ir, должны быть утилизированы в соответствии с местными правилами безопасности. - Чтобы проникнуть в клетки, добавьте 0,5 мл ледяного MeOH по каплям во время вортекса. Выдерживать в течение 15 минут на льду под вытяжным шкафом. Центрифугируйте (800 x g, 5 мин, RT), а затем дважды промойте 1 мл CSM центрифугированием (800 x g, 5 мин, RT). После последней промывки аспирируйте надосадочную жидкость до ~60 μл и тщательно суспендируйте гранулу.
- Приготовьте 2,5-кратную смесь для внутриклеточного окрашивания Ab в CSM. Окрашивайте клетки, добавляя 40 μL внутриклеточной смеси для окрашивания Ab, и инкубируйте в течение 1 часа при RT. Каждые 20 минут перемешивайте образцы.
- Дважды промыть 1 мл CSM центрифугированием (800 x g, 5 мин, RT). Аспирируйте надосадочную жидкость и взбейте гранулу. Ресуспендируйте образцы в 0,5 мл интеркалятора-иридия раствора (табл. 1) и вортеса. Инкубируйте образцы в течение 1 ч при RT или в течение ночи (O/N) при 4 °C (см. примечание ниже).
ПРИМЕЧАНИЕ: Образцы можно хранить в растворе интеркалятора-иридия при температуре 4 °C до 48 часов. Протокол окрашивания, используемый в этом исследовании, был разработан на основе новаторской работы лаборатории Нолана. Он отличается от стандартных протоколов Biotools тем, что (i) для промывания и окрашивания используются собственные приготовленные буферы, (ii) клетки фиксируются перед поверхностным окрашиванием, и (iii) клетки проникают метанолом для внутриклеточного окрашивания антителами к факторам транскрипции или сигнальным молекулам. Исследователи, разрабатывающие новый протокол, должны тщательно проверить совместимость своей панели антител с метанолом в качестве проникающего агента. При добавлении новых антител в панель рекомендуется проверять специфичность антител методом проточной цитометрии с использованием положительных и отрицательных контрольных образцов перед конъюгацией металлов и титрованием.
9. Пробоподготовка к загрузке в массовый цитометр
ПРИМЕЧАНИЕ: Гранулы ячеек очень сыпучие, когда находятся в буфере CAS (Таблица материалов). Во время стирки с буфером CAS не аспирируйте до сухой фазы. Вместо этого сохраните остаточный объем, как описано ниже.
- Вихревая и центрифуга (800 х г, 10 мин, RT) для отбора проб. Слейте надосадочную жидкость (ручка как отходы PFA) и завихрите.
- Промыть с 1 мл CSM центрифугированием (800 x g, 10 мин, RT). Аспирируйте надосадочную жидкость и взбейте гранулу.
- Промыть 1 мл буфера CAS методом центрифугирования (800 x g, 10 мин, RT). Отсадите до ~200 μL. Vortex и добавьте 1 мл буфера CAS. Выньте 5 мкл аликвоты для подсчета клеток. Центрифугируйте (800 x g, 10 мин, RT) и тщательно отсасывайте до ≤50 μл. Не тревожьте гранулы.
- Ресуспендировать гранулу до 1–2 x 106 клеток/мл в буфере CAS и добавить калибровочные шарики (1x; Таблица материалов) до конечной концентрации 0,1x (например, добавьте 100 мкл калибровочных шариков 1x к 900 мкл клеточной суспензии).
- Загрузите образец в массовый цитометр и соберите данные, используя скорость потока 400–500 клеток/с.
- Выполнение нормализации данных файлов FCS с помощью программного обеспечения CyTOF или ранее разработанных средств нормализации39.
ПРИМЕЧАНИЕ: Работа масс-цитометров CyTOF зависит от прибора40,41. Перед началом работы рекомендуется ознакомиться с инструкцией по эксплуатации CyTOF. Калибровочные валики представляют собой стандарты нормализующих гранул полистирола с металлическими вставками, содержащие известные концентрации изотопов металлов церия (140/142Ce), европия (151/153Eu), гольмия (165Ho) и лютеция (175/176Lu). Калибровочные валики позволяют контролировать чувствительность оборудования, которая может меняться со временем, в первую очередь из-за накопления биологического материала и изменений ионизации плазмы с течением времени.
10. Анализ данных CyTOF
ПРИМЕЧАНИЕ: Для последующего анализа нормализованные файлы FCS могут быть проанализированы локально или загружены в облачные программные решения, такие как Cytobank, Cell Engine, OMIQ или FCS Express42.
- При необходимости объедините отдельные файлы FCS для каждого образца в один файл.
- Идентификация отдельных клеток путем стробирования по положительным событиям интеркалятора Iridium, что позволяет отличать клетки с одним ядром от мусора или дублетов.
- Ворота для живых клеток путем отбора цисплатиноотрицательных событий. Цисплатин ковалентно связывается с клеточными белками и помечает умирающие и мертвые клетки с поврежденными мембранами в большей степени, чем живые клетки43.
- Определите интересующую популяцию, например, миогенный компартмент (Live/CD45-/CD31-/Sca1-/α7интегрин+/CD9+) (рисунок 2A) и количественно определите относительную долю стволовых и прогениторных клеток. Этот подход требует предварительных знаний о клеточной поверхности или экспрессии внутриклеточных маркеров для определения отдельных популяций.
- Для выполнения многомерного анализа, который позволит идентифицировать ранее нераспознанные подмножества редких клеток в сложной популяции, экспортировать интересующую популяцию и использовать алгоритмы кластеризации, разработанные специально для анализа данных CyTOF44.
Примечание: В предыдущей работе использовался алгоритм X-shift, который использует взвешенную оценку плотности k-ближайшего соседа (kNN-DE) в многомерном пространстве для выполнения кластеризации без учителя на основе определенных параметров19. Было показано, что X-shift обладает высокой эффективностью в идентификации популяций редких клеток45. - Для анализа X-shift загрузите программный пакет vortex (со страницы лаборатории Нолана на GitHub [https://github.com/nolanlab/vortex]) и Java64-bit 46. Инструкции можно найти здесь: https://github.com/nolanlab/vortex/wiki/Getting-Started.
- Загрузите экспортированные популяции ячеек в локальную базу данных и определите параметры кластеризации. Среди определяемых пользователем параметров можно выделить (i) маркеры, используемые для кластеризации, (ii) диапазон значений k (например, от 5 до 150) и (iii) количество шагов кластеризации.
Примечание: В предыдущей работе в качестве кластеризующих маркеров использовалась комбинация поверхностных маркеров, которые, как известно, экспрессируются в мышечных стволовых клетках, новых поверхностных маркеров, идентифицированных в высокопроизводительном цитометрическом скрининге мышечных клеток и миобластов, и миогенных транскрипционных факторов (ТФ), которые, как известно, определяют различные стадии миогенеза. Этот подход позволил идентифицировать два маркера клеточной поверхности, CD9 и CD104, характер коэкспрессии которых отличает ранее нераспознанные популяции клеток-предшественников19. Тщательный выбор маркеров кластеризации позволит исследователю ответить на конкретные исследовательские вопросы. Например, если требуется идентификация и анализ подмножеств делящихся клеток с течением времени, рекомендуется включить IdU в качестве одного из маркеров кластеризации. X-shift может выполнять кластеризацию при нескольких значениях k и автоматически определять, вычисляя «точку изгиба», значение k, которое приводит к оптимальному числу кластеров, тем самым избегая недостаточной кластеризации или чрезмерной фрагментации. Рекомендуется рассчитать точку изгиба и использовать кластерный анализ, определяемый оптимальным значением k, для визуализации данных и последующих приложений. - Чтобы визуализировать пространственные отношения между популяциями клеток в кластерах X-shift, выполните компоновку, направленную на силу, которая создаст 2D-карту, где расстояние между кластерами указывает на их сходство в экспрессии маркеров в многомерном фенотипическом пространстве. Раскрашивая карту с помощью одного маркера за раз, можно обнаружить новые клеточные популяции и проследить их динамику. Рекомендуется последующая количественная оценка с помощью ручного стробирования в программах, таких как Cytobank и Cell Engine.
- Выполняйте анализ тепловой карты для количественной оценки динамической экспрессии нескольких поверхностных и внутриклеточных белков на протяжении всего времени и выявления новых тенденций.
ПРИМЕЧАНИЕ: При выполнении временного курса травмы можно кластеризовать данные из всех временных точек вместе, чтобы создать карту регенерации. Кроме того, можно расчленить такую карту на отдельные временные точки, чтобы проследить клеточную и молекулярную динамику регенерации вовремени19.
11. Окрашивание флуорофор-конъюгированными антителами для FACS
ПРИМЕЧАНИЕ: Элементы, используемые для неокрашенных, одноцветных элементов управления и контроля флуоресценции минус один (FMO), могут быть получены из набора TA и GA от дополнительной мыши, если таковая имеется. В качестве альтернативы, квадрицепсы (верхняя передняя мышца бедра) могут быть рассечены и расщеплены в одноклеточную суспензию, следуя той же процедуре, что и для набора TA+GA выше, и используются для контроля. Приготовьте буфер FACS (PBS, 2,5% козья сыворотка, 2 мМ ЭДТА), отфильтруйте через мембрану PES в контейнер из полистирола и держите на льду. Буфер FACS может храниться при температуре 4 °C до 1 месяца. Список антител, используемых для FACS, можно найти в таблице 3.
- Приготовьте родовую смесь. Окрасьте каждый контроль в 50 μл (содержащий ок. 3–5 x10 5 клеток). Рассчитайте необходимое количество смеси родословных. Сделайте избыток объема на 20–30%. Исходная концентрация антител, используемых для линейной смеси, составляет 0,2 мг/мл.
- В пробирку объемом 0,5 мл добавьте анти-CD45 APC-Cy7, анти-CD31 APC-Cy7, анти-Sca1 APC-Cy7 и анти-CD11b APC-Cy7 для достижения конечных концентраций 1 г/мл, 2,5 г/мл, 2,5 мкг/мл и 0,63 мкг/мл соответственно.
- Приготовьте смесь для всех морилок. Окрашивайте каждый цельноокрашенный образец в 500 μл (содержащий ок. 3–5 x 106 клеток). Сделайте на 10% больше объема смеси для всех морилок.
- В пробирку объемом 1,5 мл добавьте антитела линейной смеси, как указано выше, + анти-α7 интегрин ПЭ, анти-CD9 APC и анти-CD104 FITC для достижения конечных концентраций 2 мкг/мл, 1,2 мкг/мл и 3 мкг/мл соответственно.
- Приготовьте буфер FACS + DAPI: Для получения 10 мл буфера FACS добавьте 1 мкл DAPI (запас = 1 мг/мл), чтобы достичь конечной концентрации DAPI 100 нг/мл.
ВНИМАНИЕ: DAPI (4',6-диамидино-2-фенилиндола дигидрохлорид) классифицируется как возможный раздражитель кожи и дыхательных путей. Тем не менее, раствор DAPI в концентрации <1% считается неопасным, согласно GHS. Прочтите паспорт безопасности перед обработкой. Во время работы следует надевать средства индивидуальной защиты. Материалы, которые контактировали с DAPI, должны быть утилизированы в соответствии с местными правилами безопасности. - Ресуспензия клеток из раздела 6: Диссекция и диссоциация скелетных мышц:
- Для полностью окрашенных образцов ресуспендируйте наборы TA и GA с одной мыши в 500 мкл буфера FACS и перенесите его в пробирки объемом 15 мл для окрашивания.
- Для управления используйте либо наборы TA и GA, либо наборы квадрицепсов. При использовании 1 мыши для контроля ресуспендируйте клетки в 750 мкл буфера FACS. Если мышей несколько, ресуспендируйте каждый набор TA и GA или квадрицепса в 500 мкл буфера FACS и объедините наборы в один образец объемом 1 мл, взяв фракцию из каждого образца. Добавьте 50 мкл контрольных ячеек (3–5 x 105 клеток) в полипропиленовые пробирки объемом 5 мл для окрашивания.
- Окрашивать, как описано в таблице 4 , в течение 45 минут при температуре 4 °C в темноте.
- Промойте полностью окрашенные образцы, добавив 5 мл буфера FACS. Промойте регуляторы, добавив 1 мл буфера FACS и центрифуги (380 x g, 10 мин, 4 °C).
- Суспендируйте все окрашенные образцы в 1 мл буфера FACS + DAPI. Снова приостановите элементы управления в буфере FACS объемом 300 мкл с DAPI или без него.
- Хранить клетки при температуре 4 °C в темноте до сортировки на проточном цитометре с 4 лазерами (405 нм, 488 нм, 561 нм, 633 нм).
- Запустите элементы управления и образцы на сортировщике и создайте сортировочные ворота с помощью соответствующего программного обеспечения. Для неокрашенных/одноцветных элементов управления и элементов управления FMO запишите события 1 x 104 и 0,3–1 x 105 соответственно. Для полностью окрашенных образцов запишите до 1 x 106 событий. Отсортируйте все полностью окрашенные образцы или столько, сколько необходимо, в зависимости от требований к анализу на последующих этапах. Для используемого здесь проточного цитометра (FACSAria III) отсортируйте в режиме чистоты с помощью сопла 70 мм.
- Стратегия стробирования приведена на рисунке 4 .
- Используйте неокрашенные и одноцветные элементы управления для установки напряжения для всех датчиков.
- Используйте одноцветные элементы управления для настройки компенсационной матрицы.
- Используйте элементы управления FMO для установки сортировочных ворот.
- Отдельные популяции мышечных стволовых и прогениторных клеток сортируются в ледяной буфер FACS.
- Центрифугируйте (380 x g, 10 мин, 4 °C) клеточные популяции. Повторная приостановка в соответствующем буфере, подсчет и продолжение анализа ниже по потоку.
Результаты
Здесь мы представляем обзор экспериментальной установки для использования этого комбинированного подхода, которая включает в себя: (i) многомерный анализ CyTOF временного течения острой травмы при введении нотексина для изучения клеточной и молекулярной динамики ство...
Обсуждение
Регенерация скелетных мышц – это динамический процесс, который опирается на функцию взрослых стволовых клеток. В то время как предыдущие исследования были сосредоточены на роли мышечных стволовых клеток во время регенерации, их потомство in vivo было недостаточно...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы благодарим членов Основного фонда FACS на факультете биомедицины Орхусского университета за техническую поддержку. Мы благодарим Александра Шмитца, руководителя отделения массовой цитометрии отделения биомедицины, за обсуждение и поддержку. Научные иллюстрации были созданы с использованием Biorender.com. Эта работа финансировалась за счет стартового гранта Орхусского университета Forskningsfond (AUFF) и гранта Start Package (0071113) от Фонда Novo Nordisk для E.P.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Fisher Scientific | 07-200-886 | |
| 20 G needle | KDM | KD-fine 900123 | |
| 28 G, 0.5 mL insulin syringe | BD | 329461 | |
| 29 G, 0.3 mL insulin syringe | BD | 324702 | |
| 3 mL syringes | Terumo medical | MDSS03SE | |
| 40 µm cell strainers | Fisher Scientific | 11587522 | |
| 5 mL polypropylene tubes | Fisher Scientific | 352002 | |
| 5 mL polystyrene test tubes with 35 µm cell strainer | Falcon | 352235 | |
| 5 mL syringes | Terumo medical | SS05LE1 | |
| 50 mL centrifuge tube | Fisher Scientific | 05-539-13 | |
| 5-Iodo-2-deoxyuridine (IdU) | Merck | I7125-5g | |
| anti-CD104 FITC (clone: 346-11A) | Biolegend | 123605 | Stock = 0.5 mg/mL |
| anti-CD11b APC-Cy7 (Clone: M1/70) | Biolegend | 101226 | Stock = 0.2 mg/mL |
| anti-CD31 APC-Cy7 (clone: 390) | Biolegend | 102440 | Stock = 0.2 mg/mL |
| anti-CD45 APC-Cy7 (Clone: 30-F11) | Biolegend | 103116 | Stock = 0.2 mg/mL |
| anti-CD9 APC (clone: KMC8) | ThermoFisher Scientific | 17-0091-82 | Stock = 0.2 mg/mL |
| anti-Sca1 (Ly6A/E) APC-Cy7 (clone: D7) | Biolegend | 108126 | Stock = 0.2 mg/mL |
| anti-α7 integrin PE (clone: R2F2)) | UBC AbLab | 67-0010-05 | Stock = 1 mg/mL |
| BD FACS Aria III (4 laser) instrument | BD Biosciences | N/A | 405, 488, 561, and 633 nm laser |
| Bovine Serum Albumin | Sigma Aldrich | A7030-50G | |
| Buprenorphine 0.3 mg/mL | Ceva | Vnr 054594 | |
| CD104 (Clone: 346-11A) | BD Biosciences | 553745 | Dy162; In-house conjugated |
| CD106/VCAM-1 (Clone: 429 MVCAM.A) | Biolegend | 105701 | Er170; In-house conjugated |
| CD11b (Clone: M1/70) | BD Biosciences | 553308 | Nd148; In-house conjugated |
| CD29/Integrin β1 (Clone: 9EG7) | BD Biosciences | 553715 | Tm169; In-house conjugated |
| CD31 (Clone: MEC 13.3) | BD Biosciences | 557355 | Sm154; In-house conjugated |
| CD34 (Clone: RAM34) | BD Biosciences | 551387 | Lu175; In-house conjugated |
| CD44 (Clone: IM7) | BD Biosciences | 550538 | Yb171; In-house conjugated |
| CD45 (Clone: MEC 30-F11) | BD Biosciences | 550539 | Sm147; In-house conjugated |
| CD9 (Clone: KMC8) | Thermo Fisher Scientific | 14-0091-85 | Yb174; In-house conjugated |
| CD90.2/Thy1.2 (Clone: 30-H12) | BD Biosciences | 553009 | Nd144; In-house conjugated |
| CD98 (Clone: H202-141) | BD Biosciences | 557479 | Pr141; In-house conjugated |
| Cell Acquisition Solution/Maxpar CAS-buffer | Standard Biotools | 201240 | |
| Cell-ID Intercalator-Iridium | Standard Biotools | 201192B | cationic nucleic acid intercalator |
| Cisplatin | Merck | P4394 | Pt195 |
| Cisplatin (cis-Diammineplatinum(II) dichloride) | Merck | P4394 | |
| Clear 1.5 mL tube | Fisher Scientific | 11926955 | |
| Collagenase, Type II | Worthington Biochemical Corporation | LS004177 | |
| Counting chamber | Merck | BR718620-1EA | |
| CXCR4/SDF1 (Clone: 2B11/CXCR4 ) | BD Biosciences | 551852 | Gd158; In-house conjugated |
| DAPI (1 mg/mL) | BD Biosciences | 564907 | |
| Dark 1.5 mL tube | Fisher Scientific | 15386548 | |
| Dispase II | Thermo Fisher Scientific | 17105041 | |
| Dissection Scissors | Fine Science Tools | 14568-09 | |
| DMEM (low glucose, with pyruvate) | Thermo Fisher Scientific | 11885-092 | |
| EDTA (Ethylenediaminetetraacetic acid disodium salt) | Merck | E5134 | Na2EDTA-2H20 |
| EQ Four Element Calibration Beads (EQ beads) | Standard Biotools | 201078 | Calibration beads |
| Fetal Bovine Serum, qualified, Brazil origin | Thermo Fisher Scientific | 10270106 | |
| Forceps Dumont #5SF | Fine Science Tools | 11252-00 | |
| Forceps Dumont #7 | Hounisen.com | 1606.3350 | |
| Goat serum | Thermo Fisher Scientific | 16210-072 | |
| Helios CyTOF system | Standard Biotools | N/A | |
| Horse Serum, heat inactivated, New Zealand origin | Thermo Fisher Scientific | 26-050-088 | |
| IdU | Merck | I7125 | I127 |
| Iridium-Intercalator | Standard Biotools | 201240 | Ir191/193 |
| Isoflurane/Attane Vet | ScanVet | Vnr 055226 | |
| Methanol | Fisher Scientific | M/3900/17 | |
| Myf5 (Clone: C-20) | Santa Cruz Biotechnology | Sc-302 | Yb173; In-house conjugated |
| MyoD (Clone: 5.8A) | BD Biosciences | 554130 | Dy164; In-house conjugated |
| MyoG (Clone: F5D) | BD Biosciences | 556358 | Gd160; In-house conjugated |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top 0.20 μM PES Filters | Thermo Fisher Scientific | 595-4520 | |
| Notexin | Latoxan | L8104 | Resuspend to 50 µg/ml in sterile PBS. Keep stocks (e.g. 50 µl) at -20 °C |
| Nutrient mixture F-10 (Ham's) | Thermo Fisher Scientific | 31550031 | |
| pAkt (Clone: D9E) | Standard Biotools | 3152005A | Sm152 |
| Pax7 (Clone: PAX7) | Santa Cruz Biotechnology | Sc-81648 | Eu153; In-house conjugated |
| Penicillin-Streptomycin (10,000 U/mL) (Pen/Strep) | Thermo Fisher Scientific | 15140122 | |
| PES Filter Units 0.20 μM | Fisher Scientific | 15913307 | |
| PES Syringe Filter | Fisher Scientific | 15206869 | |
| Petri dish | Sarstedt | 82.1472.001 | |
| PFA 16% EM grade | MP Biomedicals | 219998320 | |
| Potassium chloride (KCl) | Fisher Scientific | 10375810 | |
| Potassium phosphate, monobasic, anhydrous (KH2PO4) | Fisher Scientific | 10573181 | |
| pRb (Clone: J112-906) | Standard Biotools | 3166011A | Er166 |
| pS6 kinase (Clone: N7-548) | Standard Biotools | 3172008A | Yb172 |
| Sca-1 (Clone: E13-161.7) | BD Biosciences | 553333 | Nd142; In-house conjugated |
| Sodium Azide | Sigma Aldrich | S2002 | |
| Sodium chloride (NaCl) | Fisher Scientific | 10553515 | |
| Sodium phosphate, dibasic, heptahydrate (Na2HPO4-6H2O) | Merck | S9390 | |
| Sterile saline solution 0.9% | Fresenius | B306414/02 | |
| α7 integrin (Clone: 3C12) | MBL international | K0046-3 | Ho165; In-house conjugated |
Ссылки
- Mukund, K., Subramaniam, S. Skeletal muscle: A review of molecular structure and function in health and disease. Wiley Interdiscip Rev Syst Biol Med. 12 (1), e1462 (2020).
- Feige, P., Brun, C. E., Ritso, M., Rudnicki, M. A. Orienting muscle stem cells for regeneration in homeostasis, aging, and disease. Cell Stem Cell. 23 (5), 653-664 (2018).
- Mauro, A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol. 9 (2), 493-495 (1961).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Fuchs, E., Blau, H. M. Tissue stem cells: Architects of their niches. Cell Stem Cell. 27 (4), 532-556 (2020).
- Hernández-hernández, J. M., et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Semin Cell Dev Biol. 72, 10-18 (2017).
- Zammit, P. S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis. Semin Cell Dev Biol. 72, 19-32 (2017).
- Sabourin, L. A. The molecular regulation of myogenesis. Clin Genet. 57 (1), 16-25 (2000).
- Cooper, R. N., et al. In vivo satellite cell activation via Myf5 and MyoD in regenerating mouse skeletal muscle. J Cell Sci. 112 (17), 2895-2901 (1999).
- Rudnicki, M. A., Jaenisch, R. The MyoD family of transcription factors and skeletal myogenesis. Bioessays. 17 (3), 203-209 (1995).
- Braun, T., Arnold, H. H. Inactivation of Myf-6 and Myf-5 genes in mice leads to alterations in skeletal muscle development. EMBO J. 14 (6), 1176-1186 (1995).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Braun, T., et al. MyoD expression marks the onset of skeletal myogenesis in Myf-5 mutant mice. Development. 120 (11), 3083-3092 (1994).
- Rudnicki, M. A., et al. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell. 75 (7), 1351-1359 (1993).
- Montarras, D., et al. Developmental biology: Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Cerletti, M., et al. Highly efficient, functional engraftment of skeletal muscle stem cells in dystrophic muscles. Cell. 134 (1), 37-47 (2008).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat Protoc. 10 (10), 1612-1624 (2015).
- Porpiglia, E., et al. High-resolution myogenic lineage mapping by single-cell mass cytometry. Nat Cell Biol. 19 (5), 558-567 (2017).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry Part A. 81 (7), 552-566 (2012).
- Hartmann, F. J., et al. . Mass Cytometry: Methods and Protocols. , (2019).
- Devine, R. D., Behbehani, G. K. Use of the pyrimidine analog, 5-iodo-2'-deoxyuridine (IdU) with cell cycle markers to establish cell cycle phases in a mass cytometry platform. J Vis Exp. (176), e60556 (2021).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Nag, A. C., Foster, J. D. Myogenesis in adult mammalian skeletal muscle in vitro. J Anat. 132, 1-18 (1981).
- Le Moigne, A., et al. Characterization of myogenesis from adult satellite cells cultured in vitro). Int J Dev Biol. 34, 171-180 (1990).
- Yablonka-Reuveni, Z. Development and postnatal regulation of adult myoblasts. Microsc Res Tech. 30 (5), 366-380 (1995).
- Chu, C., Cogswell, J., Kohtz, D. S. MyoD functions as a transcriptional repressor in proliferating myoblasts. J Biol Chem. 272 (6), 3145-3148 (1997).
- Shah, B., Hyde-Dunn, J., Jones, G. E. Proliferation of murine myoblasts as measured by bromodeoxyuridine incorporation. Methods in Mol Biol. 75, 349-355 (1997).
- Springer, M. L., Blau, H. M. High-efficiency retroviral infection of primary myoblasts. Somat Cell Mol Genet. 23 (3), 203-209 (1997).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J Cell Biol. 125 (6), 1275-1287 (1994).
- Springer, M. L., Rando, T. A., Blau, H. M. Gene delivery to muscle. Curr Protoc Hum Genet. , (2002).
- Cull-Candy, S. G., Fohlman, J., Gustavsson, D., Lullmann-Rauch, R., Thesleff, S. The effects of taipoxin and notexin on the function and fine structure of the murine neuromuscular junction. Neuroscience. 1 (3), 175-180 (1976).
- Francis, B., John, T. R., Seebart, C., Kaiser, I. I. New toxins from the venom of the common tiger snake (Notechis scutatus scutatus). Toxicon. 29 (1), 85-96 (1991).
- Navarro, K. L., Huss, M., Smith, J. C., Sharp, P., Marx, J. O., Pacharinsak, C. Mouse Anesthesia: The Art and Science. ILAR Journal. 62, 238-273 (2021).
- Langford, D., Bailey, A., Chanda, M., et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods. 7, 447-449 (2010).
- Matsumiya, L. C., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wieskopf, J. S., Zaloum, A., King, O. D., Mogil, J. S. Using the Mouse Grimace Scale to reevaluate the efficacy of postoperative analgesics in laboratory mice. J Am Assoc Lab Anim Sci. 2012 (1), 42-49 (2012).
- Gonzalez, V. D., et al. High-grade serous ovarian tumor cells modulate NK cell function to create an immune-tolerant microenvironment. Cell Rep. 36 (9), 109632 (2021).
- Delgado-Gonzalez, A., et al. Measuring trogocytosis between ovarian tumor and natural killer cells. STAR Protoc. 3 (2), 101425 (2022).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry Part A. 83 (5), 483-494 (2013).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. J Vis Exp. (69), e4398 (2012).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample preparation for mass cytometry analysis. J Vis Exp. (122), e54394 (2017).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Curr Protoc Cytom. , (2010).
- Fienberg, H. G., Simonds, E. F., Fantl, W. J., Nolan, G. P., Bodenmiller, B. A platinum-based covalent viability reagent for single-cell mass cytometry. Cytometry Part A. 81 (6), 467-475 (2012).
- Kimball, A. K., et al. A beginner's guide to analyzing and visualizing mass cytometry data. J Immunol. 200 (1), 3-22 (2018).
- Weber, L. M., Robinson, M. D. Comparison of clustering methods for high-dimensional single-cell flow and mass cytometry data. Cytometry Part A. 89 (12), 1084-1096 (2016).
- Samusik, N., Good, Z., Spitzer, M. H., Davis, K. L., Nolan, G. P. Automated mapping of phenotype space with single-cell data. Nat Methods. 13 (6), 493-496 (2016).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Anal Chem. 80 (7), 2539-2547 (2008).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nat Commun. 12 (1), 692 (2021).
- de Morree, A., et al. Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence. Proc Natl Acad Sci U S A. 114 (43), E8996-E9005 (2017).
- Luo, D., et al. Deltex2 represses MyoD expression and inhibits myogenic differentiation by acting as a negative regulator of Jmjd1c. Proc Natl Acad Sci U S A. 114 (15), E3071-E3080 (2017).
- Wersto, R. P., et al. Doublet discrimination in DNA cell-cycle analysis. Cytometry. 46 (5), 296-306 (2001).
- Porpiglia, E., Blau, H. M. Plasticity of muscle stem cells in homeostasis and aging. Curr Opin Genet Dev. 77, 101999 (2022).
- Porpiglia, E., et al. Elevated CD47 is a hallmark of dysfunctional aged muscle stem cells that can be targeted to augment regeneration. Cell Stem Cell. 29 (12), 1653-1668 (2022).
- Brunet, A., Goodell, M. A., Rando, T. A. Ageing and rejuvenation of tissue stem cells and their niches. Nat Rev Mol Cell Biol. 24 (1), 45-62 (2022).
- Danielli, S. G., et al. Single-cell profiling of alveolar rhabdomyosarcoma reveals RAS pathway inhibitors as cell-fate hijackers with therapeutic relevance. Sci Adv. 9 (6), (2023).
- de Morree, A., Rando, T. A. Regulation of adult stem cell quiescence and its functions in the maintenance of tissue integrity. Nat Rev Mol Cell Biol. 24 (5), 334-354 (2023).
- Yucel, N., et al. Glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell glucose metabolism drives histone acetylation landscape transitions that dictate muscle stem cell function. Cell Rep. 27 (13), 3939-3955 (2019).
- Tierney, M. T., Sacco, A. Inducing and evaluating skeletal muscle injury by notexin and barium chloride. Methods Mol Biol. 1460, 53-60 (2016).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198 (2016).
- Call, J. A., Lowe, D. A. Eccentric contraction-induced muscle injury: Reproducible, quantitative, physiological models to impair skeletal muscle's capacity to generate force. Methods Mol Biol. 1460, 3-18 (2016).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin Induced Injury and Skeletal Muscle Regeneration. Methods Mol Biol. 1460, 61-71 (2016).
- Le, G., Lowe, D. A., Kyba, M. Freeze injury of the tibialis anterior muscle. Methods Mol Biol. 1460, 33-41 (2016).
- Borok, M., et al. Progressive and coordinated mobilization of the skeletal muscle niche throughout tissue repair revealed by single-cell proteomic analysis. Cells. 10 (4), 744 (2021).
- Petrilli, L. L., et al. High-dimensional single-cell quantitative profiling of skeletal muscle cell population dynamics during regeneration. Cells. 9 (7), 1723 (2020).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Mol Cell. 74 (3), 609-621 (2019).
- Hartmann, F. J., et al. Scalable conjugation and characterization of immunoglobulins with stable mass isotope reporters for single-cell mass cytometry analysis. Methods Mol Biol. 1989, 55-81 (2019).
- Frimand, Z., Das Barman, S., Kjær, T. R., Porpiglia, E., de Morrée, A. Isolation of quiescent stem cell populations from individual skeletal muscles. J Vis Exp. (190), e64557 (2022).
- Krutzik, P. O., Nolan, G. P. Intracellular phospho-protein staining techniques for flow cytometry: monitoring single cell signaling events. Cytometry A. 55 (2), 61-70 (2003).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat Biotechnol. 30 (9), 858-867 (2012).
- Schulz, K. R., Danna, E. A., Krutzik, P. O., Nolan, G. P. Single-cell phospho-protein analysis by flow cytometry. Curr Protoc Immunol. , 11-20 (2012).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. J Immunol. 175 (4), 2357-2365 (2005).
- Krutzik, P. O., Irish, J. M., Nolan, G. P., Perez, O. D. Analysis of protein phosphorylation and cellular signaling events by flow cytometry: techniques and clinical applications. Clin Immunol. 110 (3), 206-221 (2004).
- Han, G., Spitzer, M. H., Bendall, S. C., Fantl, W. J., Nolan, G. P. Metal-isotope-tagged monoclonal antibodies for high-dimensional mass cytometry. Nat Protoc. 13 (10), 2121-2148 (2018).
- Chevrier, S., et al. Compensation of signal spillover in suspension and imaging mass cytometry. Cell Syst. 6 (5), 612-620 (2018).
- Bjornson, Z. B., Nolan, G. P., Fantl, W. J. Single-cell mass cytometry for analysis of immune system functional states. Curr Opin Immunol. 25 (4), 484-494 (2013).
- Kalina, T., Lundsten, K., Engel, P. Relevance of antibody validation for flow cytometry. Cytometry A. 97 (2), 126-136 (2020).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J Immunol Methods. 243 (1-2), 77-97 (2000).
- Roederer, M. Spectral compensation for flow cytometry: visualization artifacts, limitations, and caveats. Cytometry. 45 (3), 194-205 (2001).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110 (3), 277-283 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены