A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
درجات Z لتقييم احتياطي المبيض لدى المرضى الصغار الذين يخضعون للحفاظ على الخصوبة
In This Article
Summary
يصف البروتوكول الحالي طريقة لتقييم احتياطي المبيض لدى المرضى الذين تقل أعمارهم عن 25 عاما والذين يحتاجون إلى الحفاظ على الخصوبة من خلال الحفاظ على أنسجة المبيض بالتبريد. تتضمن هذه الطريقة: (1) التقييم النسيجي لاحتياطي المبيض في العينات القشرية ، (2) المقارنة مع مجموعة البيانات المرجعية ، و (3) حساب درجات Z.
Abstract
تولد النساء بمجموعة غير متجددة من بصيلات المبيض ، يشار إليها باسم احتياطي المبيض. يتكون هذا الاحتياطي من بصيلات بدائية في المبايض ويمكن أن يتأثر بالعديد من العوامل ، مثل الاضطرابات الوراثية والغدد الصماء والتدخلات الطبية واضطرابات الغدد الصماء. يوصى بالحفاظ على الخصوبة عندما تكون العلاجات السامة للغدد التناسلية ضرورية. الخيارات المفضلة للنساء هي حفظ البويضات والأجنة بالتبريد. ومع ذلك ، في المرضى الصغار جدا غير الناضجين جنسيا ، فإن حفظ أنسجة المبيض بالتبريد هو الخيار الوحيد. تعد معرفة كثافة البصيلات لعينات الأنسجة المحفوظة بالتبريد أمرا ضروريا في استشارات الخصوبة للمرضى الصغار. يوضح هذا البروتوكول استخدام درجات Z لكثافة البصيلات القشرية كأداة لتقييم جودة أنسجة المبيض لدى الفتيات والشابات اللواتي تتراوح أعمارهن بين 25 عاما وما دون اللواتي يخضعن لحفظ الخصوبة. تتم مقارنة كثافة البصيلات في عينات المرضى بالمعايير المرجعية الطبيعية للعمر ، والتي طورها حسن وآخرون لتقدير الانحرافات المحتملة عن المعيار. يتم قياس كثافة المسام من خلال القياس الكمي النسيجي. لهذا الغرض ، يتم تثبيت قطعة صغيرة من الأنسجة القشرية للمبيض (~ 2 مم × 2 مم × 2 مم) إما في محلول بوين أو الفورمالديهايد ، مدمجة في البارافين ، مقسمة بسمك 4 ميكرومتر ، ملطخة بالهيماتوكسيلين والأيوزين ، ورقمنتها باستخدام ماسح ضوئي للشرائح. تتراوح مراحل البصيلات الموجودة في القشرة من البصيلات البدائية إلى البصيلات الأولية. كانت المنطقة القشرية على بعد 1 مم من الظهارة السطحية على الأقسام النسيجية. يتم حساب كثافة المسام باستخدام صيغة معدلة قدمها شميدت وآخرون ، ويتم تحديد درجة Z باستخدام المتوسط المرجعي والانحراف المعياري. تشير درجة Z إلى مدى انحراف القيمة المقاسة عن المتوسط المرجعي ، وتحديد احتياطي المبيض المنخفض (<-1.7 Z-score). بهذه الطريقة ، يمكن استخدام كثافة البصيلات كمقياس قيم لاحتياطي المبيض للمرضى الصغار الذين يحتاجون إلى الحفاظ على الخصوبة.
Introduction
المبيض هو عضو ديناميكي نشط من الغدد الصماء ، ويتكون من قشرة خارجية ونخاع داخلي. موزعة بشكل غير متجانس داخل المبايض هي بصيلات تحتوي على بويضة الغدد التناسلية محاطة بخلايا حبيبية لحمية1. تتشكل جميع البصيلات بالفعل أثناء نمو الجنين ، وتبلغ ذروتها في حوالي 20 أسبوعا من عمر الحمل ، يليها انخفاض أسي. عند الولادة ، يبقى 1-2 مليون بصيلة بدائية داخل القشرة ، ولا يعيش سوى بضع مئات من الآلاف من البصيلات حتى سنالبلوغ 2. يؤثر تجمع البصيلات غير المتنامية ، والذي يشار إليه أيضا باسم احتياطي المبيض ، على خصوبة المرأة ، من بين عوامل أخرى. يتواجد احتياطي المبيض داخل القشرة وينتقل إلى النخاع مع نمو البصيلات ونضجها. يدرك بعض الباحثين أن احتياطي المبيض يتكون من بصيلات بدائية فقط ، بينما يشمل البعض الآخر جميع البصيلات أحادية الصفيحة (أي البدائية والوسيطة والأولية) 3،4،5،6. خلال حياة المرأة ، تنضج 300-400 بصيلة فقط وتبقى على قيد الحياة لتخضع في النهاية للإباضة. يبدأ انقطاع الطمث عندما ينخفض عدد البصيلات إلى حوالي ألف ، والذي يحدث عادة في حوالي 50 عاما من العمر2،7. يوجد حاليا نقاش مستمر بشأن وجود الخلايا الجذعية الميضية (OSCs) في المبايض البشرية البالغة التي يمكن أن تشكل بويضات بعد زرع الأجانب. تقترح بعض الدراسات عزل الخلايا التي تعبر عن ملف تعريف جيني للخلايا الجرثومية البدائية وتتمايز إلى بويضات8،9 ، بينما يشير البعض الآخر إلى أن OSCs المزعومة هي خلايا حول الأوعية الدموية للأوعية الدموية10،11،12.
يتم تعريف قصور المبيض المبكر (POI) من خلال إيقاف الدورة الشهرية مع ارتفاع مستويات FSH قبل سن 40 عاما13 عاما. أسباب POI متعددة العوامل ويمكن أن تحدث مجهول السبب. ومع ذلك ، فإنه غالبا ما ينشأ نتيجة لحالاتطبية 14. على سبيل المثال ، ترتبط بعض الحالات الوراثية الخلقية ب POI بسبب انخفاض احتياطي المبيض بالفعل عند الولادة ، مثل متلازمة تيرنر15. يمكن أن يحدث POI أيضا كأثر جانبي للعلاجات السامة للغدد التناسلية ، والتي تمثل مشكلة خاصة في المرضى الصغار جدا لأنها قد تؤدي إلى عدم القدرة على الخضوع لسن البلوغ الطبيعي وتضعف بشكل كبير احتياطي المبيض. اعتمادا على مخاطر POI وعمر المريض ، تتوفر العديد من خيارات الحفاظ على الخصوبة ، مثل حفظ البويضات الناضجة بالتبريد ، والحفظ بالتبريد للأجنة بعد الإخصاب في المختبر ، وحفظ أنسجة المبيض بالتبريد (OTC). بالنسبة لمرضى ما قبل البلوغ ، فإن OTC هو الخيار الوحيد الممكن بسبب عدم نضجهم الجنسي16،17. في الولايات المتحدة ، تم اعتبار الحفاظ على الخصوبة من خلال OTC مؤخرا روتينا سريريا مقبولا18. ومع ذلك ، لا يزال OTC يعتبر تجريبيا في العديد من البلدان الأوروبية ، والموافقة الأخلاقية مطلوبة ، خاصة بالنسبة للزرع الذاتي19،20. لذلك ، يجب النظر بعناية في معايير إدراج بروتوكولات OTC ، ويجب إجراء تحليل المخاطر والفوائد لكل مريض. ليس كل الأطفال الذين يتلقون علاجات سامة الغدد التناسلية مؤهلين للحفاظ على الخصوبة. في السويد ، ينصح المرضى المعرضون لخطر مرتفع أو مرتفع جدا فقط بالخضوع للحفاظ على الخصوبة وفقا للمبادئ التوجيهية الخاصة بالحفاظ على الخصوبة الصادرة عن جمعية الشمال الأوروبي لأمراض الدم والأورام لدى الأطفال21. تشمل هذه المجموعة (1) أطفال ما قبل وبعد البلوغ الذين يحتاجون إلى زراعة الخلايا الجذعية أو تلقي العلاج الإشعاعي مع المبيض في مجال النطاق، و (2) أطفال ما بعد البلوغ بجرعات تراكمية عالية من العلاج الكيميائي المؤلكل. بالنسبة للفتيات قبل الحيض ، تشمل معايير إدراج المخاطر العالية جدا للعقم أولئك الذين عولجوا بأي مما يلي: جرعة إشعاعية >10 غراي للمبيض ، أو العلاج بالخلايا الجذعية المكونة للدم الخيفي أو الذاتي (HSCT). تشمل معايير الاستبعاد أولئك الذين يحتاجون إلى منتجات دم إضافية لمستحضرات أخرى مضادة للتخثر قبل الجراحة أو لديهم عدد العدلات <1. بالنسبة للفتيات/النساء بعد الحيض، تشمل معايير إدراج الاختطار المرتفع أو المرتفع جدا للعقم أولئك الذين عولجوا بأي مما يلي: جرعة إشعاعية >10 غراي للمبيض، أو HSCT الخيفي، سيكلوفوسفاميد >9 غ/م²، إيفوسفاميد >60 غ/م²، بروكاربازين، أو مركبات نيتروزوريا (BCNU/CCNU) >360 ملغم/م². تشمل معايير الاستبعاد أولئك الذين لديهم خطر متزايد للنزيف ، أو زيادة خطر الإصابة بالعدوى ، أو زيادة خطر حدوث مضاعفات جراحية ، أو زيادة خطر الإصابة بمشاكل الألم كما تم تقييمها من قبل الطبيب المسؤول.
بالنسبة لعلاج OTC ، يتم جمع أنسجة المبيض أثناء جراحات البطن عن طريق شق البطن أو تنظير البطن من خلال استئصال المبيض أو الخزعة. تتم إزالة النخاع من أنسجة المبيض المجمعة ، ثم يتم تقسيم القشرة المتبقية إلى أجزاء أصغر للحفظ بالتبريد من خلال التجميد أو التزجيج بمعدل التحكم لاستخدامه لاحقا في استعادة الخصوبة22. ثم يتم تخزين العينات في النيتروجين السائل حتى تتعافى المريضة من علاجها وترغب في تكوين أسرة. اعتمادا على نوع السرطان وفي حالة عدم وجود موانع لزرع أنسجة المبيض ، يتم بعد ذلك إذابة الأنسجة وتطعيمها تلقائيا لاستعادة الوظيفة الهرمونية والمبيضية. وقد ثبت أن العلاج بدون وصفة طبية ناجح، حيث بلغ معدل الحمل 50٪ وأكثر من 200 ولادة حية تم الإبلاغ عنها بعد تطعيم أنسجة المبيض المحفوظة بالتبريد التي تم جمعها خلال مرحلةالبلوغ 23,24,25. المواليد الأحياء المبلغ عنه بعد الزرع الذاتي لأنسجة المبيض التي تم جمعها أثناء الطفولة قليلة ، ولم يتم الإبلاغ عن أي منها بعد الزرع الذاتي لأنسجة المبيض قبل البلوغبلا شك 26،27،28،29،30. جودة الأنسجة هي شرط أساسي لاستعادة الخصوبة بنجاح31. لذلك ، من الضروري دراسة جودة عينات الأنسجة التي تم جمعها.
حاليا ، هناك طريقة لتقدير جودة أنسجة المبيض من خلال الأقسام النسيجية والعد اليدوي للبصيلات. ومع ذلك ، فإن تقييم طبيعية كثافة البصيلات أمر صعب بسبب التدهور الطبيعي للاحتياطي مع تقدم العمر والتوزيع غير المتجانس للبصيلات. بالإضافة إلى ذلك ، فإن المقارنة بالقيم المرجعية تمثل تحديا لأنها غير موحدة لحجم الخزعة والعمر. خيارات التقييم الأخرى ، مثل مستويات مصل AMH أو تلطيخ الأنسجة المهضومة بالكالسيين أو الأحمر المحايد ، إما غير راسخة أو تأتي مع حدودها الخاصة. نشر والاس وكيلسي سابقا نموذجا لاحتياطي المبيض الطبيعي فوق العمر من خلال جمع بيانات عن أعداد البصيلات من المبايض الكاملة للمرضى الذين ليس لديهم أمراض مبيضمعروفة 2. علاوة على ذلك ، نظرا لأن الخزعات لا تمثل المبيض بأكمله ، فقد طور شميدت وآخرون طريقة لتقدير العدد الإجمالي للبصيلات بناء على الخزعات القشرية32. باستخدام نسخة معدلة من هذه الطريقة ونموذج احتياطي المبيض الطبيعي ، تم إنشاء مجموعة بيانات مرجعية لكثافة البصيلات للنساء اللواتي تتراوح أعمارهن بين 0-25 عاما33.
توضح هذه المقالة استراتيجية تقييم طبيعية كثافة البصيلات بناء على عينات المبيض الصغيرة عن طريق (1) القياس الكمي المباشر للبصيلات باستخدام علم الأنسجة و (2) مقارنة النتائج بالمراجع القياسية الطبيعية للعمر عبر درجات Z. يصف استخدام درجات Z العلاقة بين كثافة بصيلات المبيض الحيوي بمتوسط المجموعة المرجعية المعيارية للعمر والحجم. سيكون هذا ذا قيمة كبيرة للأطباء في تقديم المشورة لمرضاهم للزرع الذاتي والعلاج الإضافي بعد الحفاظ على الخصوبة.
Protocol
تمت الموافقة على جميع الإجراءات التي تم إجراؤها من قبل هيئة المراجعة الأخلاقية السويدية (مرضى Sveafertil، Dnr: 2019-03802) ولجنة الأخلاقيات في مستشفى جامعة هلسنكي (مرضى سداسي كلور حلقي الهكسان ، Dnr 340/13/03/03/2015). تم تقديم معلومات مكتوبة وشفوية حول الدراسة من قبل ممرضات البحث ، وتم الحصول على الموافقة المستنيرة وفقا لإعلان هلسنكي. بالنسبة للمرضى الذين تقل أعمارهم عن 18 عاما ، تم الحصول على موافقة مستنيرة من الأوصياء القانونيين. تم تسمية جميع العينات ومعالجتها وفقا للائحة الأوروبية العامة لحماية البيانات (GDPR). تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. جمع أنسجة المبيض ومعالجتها
ملاحظة: تحديد جميع المرضى المؤهلين للحفاظ على الخصوبة عندما يكون هناك مؤشر على وجود خطر مرتفع أو مرتفع جدا للعقم باتباع الإرشادات المحلية (على سبيل المثال ، إرشادات محددة في الشمال أو أوروبا أو الدولية). في أوروبا ، قم بتجنيد المرضى دون السن القانونية فقط كجزء من برامج أبحاث الحفاظ على الخصوبة. حدد خطر العقم باستخدام إرشادات بلدك للحفاظ على الخصوبة.
- إجراء العملية الجراحية تحت التخدير العام. يجب تطبيق البروبوفول الوريدي (2 ملغم/كغ)، وسوفنتانيل (0.5 ميكروغرام/كغ)، وبروميد الروكورونيوم (0.6 ملغم/كغ) لتحريض التخدير.
- تنبيب وتهوية المريض بحجم مد وجزر 6-8 مل / كجم وضغط زفير إيجابي من 6-8 سم من H2O. توصيل سيفوفلوران 1٪ إلى 2٪ عبر أنبوب القصبة الهوائية للحفاظ على التخدير الاستنشاقي.
- الحفاظ على الحصار العصبي العضلي باستخدام بروميد الروكورونيوم (0.15 مجم / كغ) أثناء العملية الجراحية لتوفير استرخاء العضلات الكافي والسماح بتنظير البطن عند ضغوط النفخ داخل البطن السفلية.
- استخدم المؤشر ثنائي الطيف لتوجيه عمق التخدير لتسهيل الاستيقاظ السريع بجرعة مخدرة مخفضة. استعداء الكتلة العصبية العضلية المتبقية مع sugammadex (2-4 مجم / كغ).
- باستخدام تقنية ثلاثية المنافذ ، أدخل مبزلا مقاس 10 مم في التجويف البريتوني عند السرة لإدخال عدسة بصرية مع كاميرا متصلة ، ومبازلين مقاس 5 مم في المنطقتين الحرقفية اليمنى واليسرى (2 سم فوق و 2 سم وسطي للعمود الفقري الحرقفي الأمامي العلوي) تحت الرؤية المباشرة للأجهزة الجراحية واسترجاع الأنسجة. افحص أعضاء الحوض، بما في ذلك كلا المبيضين، للتأكد من وضعها طبيعيا.
- حدد المبيض الذي يسهل الوصول إليه ، ثم أمسكه. قم بقص حجما يبلغ حوالي ثلث المبيض (أو كما هو موضح في التصريح الأخلاقي الخاص بك) ، ثم استخدم الإنفاذ الحراري ، إذا لزم الأمر ، لتأمين الإرقاء.
ملاحظة: يجب إجراء الخزعة فقط في حالة عدم وجود موانع ، مثل عوامل الخطر للنزيف المفرط أثناء الجراحة أو بعدها أو زيادة خطر الإصابة بالعدوى. حدد بوضوح واتبع معايير الإدراج والاستبعاد في البلد. يمكن تناول المبيض بأكمله إذا كان خطر العقم مرتفعا جدا و / أو يعتبر خطر قطع جزء فقط مرتفعا جدا (على سبيل المثال ، بسبب النزيف). تجنب استخدام الإنفاذ الحراري قبل جمع العينة لأنه يمكن أن يتلف الأنسجة.
- حدد المبيض الذي يسهل الوصول إليه ، ثم أمسكه. قم بقص حجما يبلغ حوالي ثلث المبيض (أو كما هو موضح في التصريح الأخلاقي الخاص بك) ، ثم استخدم الإنفاذ الحراري ، إذا لزم الأمر ، لتأمين الإرقاء.
- أثناء التواجد في غرفة العمليات ، ضع الأنسجة في أنبوب يحتوي على 5 مل من 1x محلول ملحي عازل للفوسفات من Dulbecco (PBS) مع CaCl2 ، MgCl2 ، 1 جم / لتر D-glucose ، 36 مجم / لتر بيروفات ، إما يتم تسخينه إلى 37 درجة مئوية إذا تمت معالجة العينة على الفور في المختبر (في غضون 30 دقيقة) أو حفظها عند 4 درجات مئوية أثناء عمليات النقل الأطول (حتى 24 ساعة).
ملاحظة: تشمل حلول النقل مجموعة من حلول نقل الأعضاء / التروية المتاحة تجاريا بالإضافة إلى المخازن المؤقتة البسيطة مثل PBS و MEM34. - قطع قطعة صغيرة من أنسجة المبيض (2 مم × 2 مم × 2 مم) من سطح المبيض. تحتوي هذه القطعة على القشرة ، وهي الجزء الخارجي من المبيض حيث توجد بصيلات المبيض35.
تنبيه: تعامل مع الأنسجة البشرية مثل المبيض باستخدام ممارسات وإجراءات السلامة البيولوجية من المستوى 2.
ملاحظة: تقوم وحدة الطب التناسلي المتخصصة بالتبريد سريريا بالتبريد لاستخدامها المحتمل في المستقبل في استعادة الخصوبة للمرضى. - ضع الأنسجة في محلول 350 ميكرولتر من Bouin في درجة حرارة الغرفة لمدة ساعتين أو في 350 ميكرولتر من 4٪ فورمالديهايد عند 4 درجات مئوية طوال الليل ، مما يضمن غمر الأنسجة بالكامل. بعد الحضانة ، اغسل الأنسجة بنسبة 70٪ من الإيثانول ثلاث مرات.
- بالنسبة لمحلول Bouin ، اغسل حتى يختفي اللون الأصفر. قم بتضمين الأنسجة في شمع البارافين36. قم بقص ما لا يقل عن 30 قسما من الأنسجة التسلسلية بسمك 4 ميكرومتر وضعها على شرائح زجاجية.
تنبيه: تعامل مع محلول Bouin والفورمالديهايد داخل غطاء كيماوي وبمعدات الحماية المناسبة.
ملاحظة: قد يؤدي الفورمالديهايد إلى قطع أثرية مرتبطة بالانكماش في الأنسجة. لذلك فإن حل Bouin هو الخيار المفضل للحفاظ على الأنسجة. ومع ذلك ، فإن حل بوين ينطوي على مخاطر إضافية ، مما دفع العديد من المؤسسات إلى تفضيل استخدام الفورمالديهايد37.
- بالنسبة لمحلول Bouin ، اغسل حتى يختفي اللون الأصفر. قم بتضمين الأنسجة في شمع البارافين36. قم بقص ما لا يقل عن 30 قسما من الأنسجة التسلسلية بسمك 4 ميكرومتر وضعها على شرائح زجاجية.
2. تلطيخ الهيماتوكسيلين والإيوسين (H & E)
- قم بوزن 5 جم من مسحوق اليوزين Y في زجاجة زجاجية معقمة سعة 100 مل. أضف 800 مل من الإيثانول بنسبة 95٪ و 200 مل من الماء منزوع الأيونات لعمل محلول مخزون يوزين بنسبة 0.5٪. قم بإعداد محلول عمل اليوزين بنسبة 0.25٪ عن طريق تخفيف 200 مل من محلول مخزون اليوزين 0.5٪ مع 160 مل من الإيثانول بنسبة 100٪ ، و 1 مل من حمض الأسيتيك ، و 40 مل من الماء منزوع الأيونات.
ملاحظة: قد لا يذوب المسحوق تماما. قم بتصفية المحلول قبل الاستخدام لتقليل الترسيب. - ضع الشرائح في الرفوف. اغمر الرف مع الشرائح في الحاويات المقابلة بالترتيب التالي: 15 دقيقة في الزيلين ، 5 دقائق في 100٪ إيثانول ، اغمس 10 مرات في 70٪ إيثانول ، اغمس 10 مرات في 50٪ إيثانول ، ثم اغمس 10 مرات في الماء منزوع الأيونات.
- اغمر الرف مع الشرائح في محلول الهيماتوكسيلين لمدة 3 دقائق ، ثم انقل الرف مع الشرائح إلى وعاء به ماء صنبور مقطر لمدة 30 ثانية لغسل بقع الهيماتوكسيلين الزائدة.
- ضع الرف مع الشرائح في وعاء به محلول تمايز (1 مل من 37٪ حمض الهيدروكلوريك مضاف إلى 100 مل من 70٪ إيثانول) لمدة دقيقة واحدة ، ثم انقل الرف مع الشرائح إلى وعاء به ماء صنبور مقطر لمدة 30 ثانية.
ملاحظة: تأكد من غمر أقسام الأنسجة في السائل. أضف المزيد من الكاشف إلى الحاوية إذا لزم الأمر. قم بتغيير الزيلين بعد كل 5 استخدامات عند تلطيخ كميات كبيرة. قم بإعداد 50٪ من الإيثانول عن طريق تخفيف 70٪ من الإيثانول (على سبيل المثال ، أضف 35 مل من 70٪ إيثانول إلى 15 مل من DPBS لصنع 50 مل من الإيثانول بنسبة 50٪).
تنبيه: تعامل مع الزيلين داخل غطاء المحرك وباستخدام معدات الحماية المناسبة.
- ضع الرف مع الشرائح في ماء الصنبور الخاص بسكوت (المعروف أيضا باسم محلول الأزرق) لمدة 30-60 ثانية ، ثم انقل الرف مع الشرائح إلى وعاء به ماء صنبور مقطر لمدة 30 ثانية. اغمر الرف مع الشرائح في محلول عمل اليوزين لمدة 1 دقيقة.
- قم بتجفيف الشرائح عن طريق وضعها في الكواشف التالية: 100٪ إيثانول لمدة 30 ثانية ، وحاوية ثانية تحتوي على 100٪ إيثانول لمدة 30 ثانية ، ثم اغمسها مرتين في الزيلين. بعد إزالة الرف من محلول الزيلين ، اتركه يجف في وعاء زجاجي لمنع الزيلين من التساقط داخل الغطاء.
- قم بتركيب الشريحة بقطرتين من محلول التركيب. ضع شرائح الغطاء بحذر لتجنب الفقاعات واترك محلول التثبيت يجف.
تنبيه: تعامل مع الزيلين داخل غطاء المحرك وباستخدام معدات الحماية المناسبة.
- قم برقمنة الشرائح عن طريق مسحها ضوئيا باستخدام الماسحات الضوئية للشرائح إن أمكن. إذا لم يكن هذا الخيار متاحا ، فاستخدم مجهرا مقلوبا عاديا بتكبير 20-40x لحساب البصيلات مباشرة. تأكد من التقاط صورة للخزعة بأكملها لتسهيل قياس المنطقة في برنامج تحليل الصور.
3. عد البصيلات
- إذا تم رقمنة الشرائح ، فافتح الملفات باستخدام البرامج المناسبة (على سبيل المثال ، برنامج مفتوح المصدر QuPath38). إذا لم يتم رقميته ، فقم بإجراء التحليل مباشرة باستخدام مجهر مقلوب والبرامج الخاصة به.
- اسحب الملف إلى نافذة QuPath الرئيسية. اضبط نوع الصورة على Brightfield H& E (انظر الشكل 1 أ). حدد 1 مم من ظهارة السطح (طبقة واحدة من الخلايا المستطيلة المبطنة للسطح) باستخدام شريط المقياس. انقر فوق أداة القطع الناقص وقم بالتعليق على البصيلات (انظر الشكل 1 ب).
- احسب عدد البصيلات داخل هذه المنطقة التي يبلغ طولها 1 مم ، من المرحلة البدائية إلى المرحلة الأولية. تحديد مرحلة كل بصيلة (بدائية - طبقة من الخلايا الحبيبية المسطحة المحيطة بالبويضة ؛ المرحلة المتوسطة - خليط من الخلايا الحبيبية المسطحة والمستطيلة ؛ الأولية - طبقة كاملة من الخلايا الحبيبية المستطيلة المحيطة بالبويضة).
- أدخل معرف العينة والعمر وعدد البصيلات لكل شريحة وسمك القسم والقسم n المحسوبة في الورقة المسماة Follicle بالمم3 على ملف Excel لحاسبة Follicle Z-score (انظر الملف التكميلي 1 والشكل 2 أ).
ملاحظة: نظرا لقطر البصيلات (أصغر بصيلات >35 ميكرومتر) ، قد تظهر نفس المسام في أقسام متتالية. توخي الحذر الشديد عند عد الأقسام حيث تكون المسافة بين الأقسام أقل من قطر الجريب. يفضل ، عد البصيلات منكل قسم 10 (على سبيل المثال ، القسم # 10 ، # 20 ، # 30). قد تنفصل الظهارة السطحية أثناء معالجة الأنسجة وقد تكون موجودة جزئيا فقط في الشرائح. عد البصيلات ذات السيتوبلازم المرئي فقط. لمراقبة الجودة ، اطلب من شخصين حساب البصيلات بشكل مستقل وتحديد مدى محاذاة أعدادهما. احسب التوافق بين المراقبين باستخدام دالة ارتباط بسيطة بين عدد البصيلات لكل مراقب لنفس العينة.
- حدد أكبر 10٪ من البصيلات في كل قسم محسوبة عن طريق مقلة العين. قم بقياس متوسط قطر هذه البويضات بالنقر فوق أداة الخط ، ورسم خطين متعامدين عبر غشاء البويضة ، وتحديد قياس ، ثم إظهار قياسات التعليقات التوضيحية (انظر الشكل 1 ج).
- سجل القياسات أسفل العمود الطول ميكرومتر (انظر الشكل 1 د). أدخل متوسط قطر جميع البويضات في حقل متوسط قطر البويضة (ميكرومتر) لكل شريحة في ملف Excel لحاسبة Follicle Z-score (المسام بالملم3 ، انظر الملف التكميلي 1 والشكل 2 أ).
- ضع الصورة في وسط الشاشة في QuPath ، ثم انقر فوق أيقونة ImageJ . حدد إرسال لقطة إلى ImageJ (انظر الشكل 3 أ). في ImageJ، حدد 1 مم من الحدود باستخدام أداة الفرشاة . انقر فوق الصورة ، ثم الكتابة ، وحدد 8 بت (انظر الشكل 3 ب).
- انقر فوق أداة الخط ، وارسم خطا على شريط المقياس في الجزء السفلي الأيسر من الشاشة (انظر الشكل 3C). انقر فوق تحليل ، ثم تعيين مقياس ، أدخل الطول الموضح في شريط المقياس في حقل المسافة المعروفة ، وانقر فوق موافق (انظر الشكل 3C). انقر فوق الصورة ، ثم ضبط ، السطوع / التباين ، وحدد تلقائي (انظر الشكل 3D).
- انقر فوق صورة ، ثم ضبط ، عتبة ، وحدد تلقائي (انظر الشكل 3E). انقر فوق أداة العصا ، وحدد المنطقة ، ثم اضغط على Ctrl + M (انظر الشكل 3F). أدخل قيمة المنطقة في ملف Excel لحاسبة Follicle Z-score (المسام في مم3 ، انظر الملف التكميلي 1 والشكل 2 أ).
4. كثافة البصيلات والحجم القشري وحسابات درجة Z
- استخدم ملف Excel الخاص بحاسبة Follicle Z-score المتوفر لإجراء العمليات الحسابية الموضحة أدناه تلقائيا. ستظهر النتائج في ورقة "Z-score (بصيلات لكل مم مكعب)" في حاسبة Excel (انظر الملف التكميلي 1) ، بشرط إدخال التفاصيل المشار إليها في القسم 3 في ورقة "بصيلات بالمليمتر مكعب".
- لحساب كثافة البصيلات في هذه الأقسام ، استخدم الصيغة المعدلة التي قدمها شميدت وآخرون 32. أولا ، قم بتطبيق عامل التصحيح α لحساب العد المزدوج لنفس الجريب الصيغة المعدلة هي كما يلي:
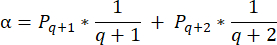
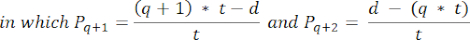
ملاحظة: في هذه الصيغة ، t هو سمك المقطع ، d هو قطر البويضة ، و q هو حاصل قطر المسام مقسوما على سمك المقطع. - استقراء العدد الإجمالي للبصيلات (n بصيلات) في القشرة من عدد البصيلات في القسم باستخدام الصيغةالتالية 33:
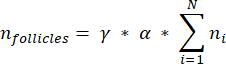
ملاحظة: تمثل هذه الصيغة أيضا جميع الأقسام غير المحسوبة. هنا يمثل γ عدد الأقسام التي لم يتم حسابها (على سبيل المثال ، γ = 10 إذا تم حسابكل قسم 10) ، α هو عامل التصحيح المحسوب في 4.1 ، N هو عدد الأقسام التي تم عدها ، و n i هو العدد الإجمالي للبصيلات في الأقسام التي تم عدها.- استقراء الحجم القشري بالكامل (V) من المناطق التي تم عدها باستخدام الصيغةالتالية 33:
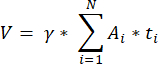
ملاحظة: هنا ، Ai هي مساحة القسم ، و ti هي سمك الأنسجة. يرجى التحقق من الخطوة 4.2 للعلامات γ و N. - استخدم الصيغةالتالية 33 لحساب كثافة البصيلات:
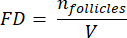
- استقراء الحجم القشري بالكامل (V) من المناطق التي تم عدها باستخدام الصيغةالتالية 33:
- حدد ما إذا كان هناك انخفاض في احتياطي المبيض (<-1.7 درجة Z) عن طريق حساب الدرجة Z باستخدام الصيغة33:
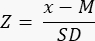
ملاحظة: يتم حساب درجة Z تلقائيا في الورقة "درجة Z (بصيلات لكل مممكعب)" في حاسبة Excel (انظر الملف التكميلي 1) بناء على المعلومات الواردة في القسم 3 (عد البصيلات) (الشكل 2 ب). في هذه الصيغة ، يمثل Z درجة Z ، x هي كثافة البصيلات المحسوبة (بصيلات /سم 3) لعينة الدراسة (الخطوة 4.4) ، M هو متوسط كثافة البصيلات للفئة العمرية المعنية ، و SD هو الانحراف المعياري للفئة العمرية المعنية. وقد حددت القيم المرجعية للنساء اللواتي تتراوح أعمارهن بين 0-25 سنة في الحسان وآخرين.33. يمكن العثور على الوسائل والانحرافات المعيارية لكثافة البصيلات للفئات العمرية المعنية في ملف Excel لحاسبة Follicle Z-score (الملف التكميلي 1) واستخدامها لحسابات Z-score.
النتائج
يتم قياس بصيلات المبيض بعد التقسيم والتلوين والمسح الضوئي للشرائح بنجاح. يتم تمييز المراحل المختلفة وصحة البصيلات وتحليلها بشكل أكبر. في الشكل 4 أ ، يتم عرض مقطع عرضي ملطخ ب HEلمبيض مثبت ببوين من شخص بالغ ، مع أمثلة على الأنسجة القشرية والنخاعية.
Discussion
تولد النساء بمجموعة محدودة من البويضات ، والتي لا يمكن تجديدها. احتياطي المبيض هو محدد رئيسي للإمكانات الإنجابية للمرأة. توضح هذه المقالة طريقة للقياس الكمي النسيجي لكثافة البصيلات ومقارنتها بالمعايير المرجعية باستخدام درجات Z لكثافة جريب المبيض القشري لدى المرضى الص?...
Disclosures
لا يوجد تضارب في المصالح بين المؤلفين.
Acknowledgements
نود أن نشكر المتخصصين في الرعاية الصحية الذين ساعدونا في تجنيد المشاركين وجمع الأنسجة وجميع المرضى الذين تبرعوا بأنسجة المبيض. كما نعترف بصندوق سرطان الطفولة (PR2020-0096) ومعهد كارولينسكا لتمويل الدكتوراه KID ، اللذين جعل تمويلهما هذا العمل ممكنا. نود أيضا أن نشكر مرفق تحليل النمط الظاهري المورفولوجي على إعداد الشرائح النسيجية. نعرب عن تقديرنا لنيكولا بايرز لتحرير هذه المخطوطة باللغة
Materials
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
References
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved