Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Z-критерий для оценки овариального резерва у молодых пациенток, находящихся на консервации фертильности
В этой статье
Резюме
В настоящем протоколе описан метод оценки овариального резерва у пациенток в возрасте до 25 лет, которым требуется сохранение фертильности путем криоконсервации ткани яичников. Этот метод включает в себя: (1) гистологическую оценку овариального резерва в образцах коры головного мозга, (2) сравнение с референсным набором данных и (3) расчет Z-баллов.
Аннотация
Женщины рождаются с невозобновляемым пулом фолликулов яичников, называемым овариальным резервом. Этот резерв состоит из примордиальных фолликулов в яичниках и может быть подвержен влиянию многих факторов, таких как генетические и эндокринные нарушения, медицинские вмешательства и эндокринные разрушители. Сохранение фертильности рекомендуется при необходимости гонадотоксического лечения. Предпочтительными вариантами для женщин являются криоконсервация ооцитов и эмбрионов. Тем не менее, у очень молодых, сексуально незрелых пациенток криоконсервация ткани яичников является единственным вариантом. Знание плотности фолликулов в криоконсервированных образцах тканей имеет важное значение в консультировании по вопросам фертильности для молодых пациентов. Этот протокол демонстрирует использование Z-показателей плотности кортикальных фолликулов в качестве инструмента для оценки качества ткани яичников у девушек и молодых женщин в возрасте 25 лет и младше, которые проходят процесс сохранения фертильности. Плотность фолликулов в образцах пациентов сравнивается с нормализованными по возрасту эталонными стандартами, разработанными Hassan et al. для оценки возможных отклонений от стандарта. Плотность фолликулов измеряется с помощью гистологической количественной оценки. Для этого небольшой кусочек кортикальной ткани яичников (~2 мм x 2 мм x 2 мм) фиксируют либо в растворе Буэна, либо в растворе формальдегида, погружают в парафин, разрезают на толщину 4 мкм, окрашивают гематоксилином и эозином и оцифровывают с помощью сканера предметных стекол. Фолликулярные стадии, присутствующие в коре головного мозга, варьируются от первичных до первичных фолликулов. Площадь коры головного мозга на гистологических срезах находилась на расстоянии 1 мм от поверхностного эпителия. Плотность фолликулов рассчитывается по модифицированной формуле, представленной Schmidt et al., а Z-оценка определяется с использованием референсного среднего и стандартного отклонения. Z-критерий показывает, насколько измеряемая величина отклоняется от референсного среднего, определяя сниженный (<-1,7 Z-критерий) овариальный резерв. С помощью этого метода плотность фолликулов может быть использована в качестве ценного показателя овариального резерва для молодых пациенток, нуждающихся в сохранении фертильности.
Введение
Яичник – динамичный, эндокринологически активный орган, состоящий из наружной коры и внутреннего мозгового вещества. В яичниках неоднородно распределены фолликулы, которые содержат гонадный ооцит, окруженный клетками стромальной гранулезы1. Все фолликулы формируются уже во время внутриутробного развития, достигая пика примерно на 20 неделе гестационного возраста, за которым следует экспоненциальное снижение. При рождении 1-2 миллиона примордиальных фолликулов остаются в коре головного мозга, и только несколько сотен тысяч фолликулов доживают дополового созревания 2. Нерастущий пул фолликулов, также называемый овариальным резервом, влияет на фертильность женщины, среди других факторов. Овариальный резерв находится в коре головного мозга и перемещается в мозговое вещество по мере роста и созревания фолликулов. Некоторые исследователи признают, что овариальный резерв состоит только из первичных фолликулов, в то время как другие включают все униламинарные фолликулы (т.е. первичные, промежуточные и первичные)3,4,5,6. В течение жизни женщины созревает и выживает только 300-400 фолликулов, чтобы в конечном итоге подвергнуться овуляции. Менопауза начинается, когда количество фолликулов падает примерно до тысячи, что обычно происходит в возрастеоколо 50 лет. В настоящее время продолжаются дебаты относительно наличия оогониальных стволовых клеток (ОСК) в яичниках взрослого человека, которые могут образовывать ооциты после ксенотрансплантации. Некоторые исследования предполагают выделение клеток, которые экспрессируют генный профиль примитивных половых клеток и дифференцируются в ооциты 8,9, в то время как другие указывают на то, что предполагаемые OSC являются периваскулярными клетками кровеносных сосудов 10,11,12.
Преждевременная недостаточность яичников (ПОИ) определяется прекращением менструального цикла с повышением уровня ФСГ в возрасте до 40лет13. Причины POI являются многофакторными и могут возникать идиопатически; Тем не менее, он часто возникает в результате медицинских состояний14. Например, некоторые врожденные генетические заболевания связаны с POI из-за сниженного овариального резерва уже при рождении, такие как синдром Тернера15. POI также может возникать в качестве побочного эффекта гонадотоксичного лечения, что особенно проблематично у очень молодых пациенток, поскольку это может привести к неспособности пройти нормальное половое созревание и резко ухудшить овариальный резерв. В зависимости от риска POI и возраста пациента доступно несколько вариантов сохранения фертильности, таких как криоконсервация зрелых ооцитов, криоконсервация эмбрионов после экстракорпорального оплодотворения и криоконсервация ткани яичников (OTC). Для пациентов препубертатного возраста безрецептурный режим является единственным возможным вариантом из-за их сексуальной незрелости16,17. В Соединенных Штатах сохранение фертильности с помощью безрецептурных препаратов в последнее время считается приемлемой клинической процедурой18. Тем не менее, безрецептурные препараты до сих пор считаются экспериментальными во многих европейских странах, и требуется этическое одобрение, особенно для аутотрансплантации. Поэтому критерии включения в безрецептурные протоколы должны быть тщательно проработаны, а для каждого пациента должен быть проведен анализ риска и пользы. Не все дети, получающие гонадотоксичную терапию, имеют право на сохранение фертильности. В Швеции только пациентам с высоким или очень высоким риском рекомендуется проходить процедуру сохранения фертильности в соответствии с рекомендациями по сохранению фертильности Северного общества детской гематологии и онкологии21. В эту группу входят (1) дети до и после полового созревания, нуждающиеся в трансплантации стволовых клеток или получающие лучевую терапию с яичником в области диапазона, и (2) дети постпубертатного возраста с высокими кумулятивными дозами алкилирующей химиотерапии. Для девочек до менархе критерии включения с очень высоким риском бесплодия включают тех, кто получает любую из следующих доз: дозу облучения яичников >10 Гр или аллогенную или аутологичную терапию гемопоэтическими стволовыми клетками (ТГСК). К критериям исключения относятся те, кто нуждается в дополнительных продуктах крови для других антикоагулянтных препаратов перед операцией или имеет количество нейтрофилов <1. Для девочек/женщин после менархе критерии включения в группу с высоким или очень высоким риском бесплодия включают тех, кто получал любую из следующих доз: доза облучения яичников >10 Гр, или аллогенная ТГСК, циклофосфамид >9 г/м², ифосфамид >60 г/м², прокарбазин или соединения нитрозомочевины (BCNU/CCNU) >360 мг/м². Критерии исключения включают тех, кто имеет повышенный риск кровотечения, повышенный риск инфекции, повышенный риск хирургических осложнений или повышенный риск проблем с болью по оценке лечащего врача.
При безрецептурных препаратах ткань яичников собирают во время операций на брюшной полости с помощью лапаротомии или лапароскопии посредством односторонней овариэктомии или биопсии. Мозговое вещество удаляют из собранной ткани яичника, а оставшуюся кору затем разрезают на более мелкие фрагменты для криоконсервации с помощью контролируемой скорости замораживания или витрификации для последующего использованияпри восстановлении фертильности. Затем образцы хранятся в жидком азоте до тех пор, пока пациентка не оправится от лечения и не захочет создать семью. В зависимости от типа рака и при отсутствии противопоказаний к трансплантации ткани яичника, ткань затем размораживается и аутотрансплантируется для восстановления гормонального фона и функции яичников. Безрецептурные препараты оказались успешными: 50% случаев наступления беременности и более 200 живорождений после пересадки криоконсервированной ткани яичников, собранной во взрослом возрасте, 23,24,25. Зарегистрированных случаев живорождения после аутотрансплантации ткани яичников, собранной в детстве, немного, и ни одного из них не было зарегистрировано после аутотрансплантации, несомненно, препубертатной ткани яичников 26,27,28,29,30. Качество тканей является предпосылкой для успешного восстановления фертильности31. Поэтому важно изучить качество собранных образцов тканей.
В настоящее время одним из способов оценки качества ткани яичников является гистологические срезы и ручной подсчет фолликулов. Однако оценка нормальности плотности фолликулов затруднена из-за естественного снижения резерва с увеличением возраста и неоднородного распределения фолликулов. Кроме того, сравнение с референсными значениями является сложной задачей, поскольку они не стандартизированы по размеру и возрасту биопсии. Другие варианты оценки, такие как уровень АМГ в сыворотке крови или окрашивание переваренной ткани кальцеином или нейтральным красным цветом, либо не очень хорошо известны, либо имеют свои собственные ограничения. Уоллес и Келси ранее опубликовали модель нормального овариального резерва с возрастом, собрав данные о количестве фолликулов из цельных яичников пациенток без известных патологийяичников. Кроме того, поскольку биопсия не является репрезентативной для всего яичника, Schmidt et al. разработали метод оценки общего количества фолликулов на основе биопсии коры головного мозга32. С помощью модифицированной версии этого метода и модели нормального овариального резерва был создан референсный набор данных по плотности фолликулов женщин в возрасте 0-25лет33.
В данной статье описана стратегия оценки нормальности плотности фолликулов на основе небольших образцов яичников путем (1) прямой количественной оценки фолликулов с помощью гистологии и (2) сравнения результатов с нормализованными по возрасту стандартными показателями с помощью Z-показателей. Использование Z-оценок описывает связь плотности фолликулов биопиколов яичников со средним значением стандартизированной референтной группы по возрасту и размеру. Это будет иметь большое значение для врачей при консультировании своих пациентов по поводу аутотрансплантации и дальнейшего лечения после сохранения фертильности.
протокол
Все проведенные процедуры были одобрены Шведским органом по этическому надзору (пациенты Sveafertil, Dnr: 2019-03802) и Комитетом по этике Университетской больницы Хельсинки (пациенты HCH, Dnr 340/13/03/03/2015). Письменная и устная информация об исследовании была предоставлена медсестрами-исследователями, а также получено информированное согласие в соответствии с Хельсинкской декларацией. Для пациентов младше 18 лет было получено информированное согласие законных опекунов. Все образцы были переведены в анонимную форму и обработаны в соответствии с Европейским общим регламентом по защите данных (GDPR). Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Забор и обработка ткани яичников
ПРИМЕЧАНИЕ: Определите всех пациентов, отвечающих критериям для сохранения фертильности, когда есть показания к высокому или очень высокому риску бесплодия, в соответствии с местными рекомендациями (например, скандинавскими, европейскими или международными специальными рекомендациями). В Европе набирают несовершеннолетних пациентов только в рамках исследовательских программ по сохранению фертильности. Определите риск бесплодия, используя рекомендации вашей страны по сохранению фертильности.
- Проведите хирургическое вмешательство под общим наркозом. Введите внутривенно пропофол (2 мг/кг), суфентанил (0,5 мкг/кг) и рокурония бромид (0,6 мг/кг) для индукции анестезии.
- Интубируйте и проведите вентиляцию легких пациента с дыхательным объемом 6-8 мл/кг и положительным давлением выдоха 6-8 см отН2О. Подайте севофлуран в 1-2% через эндотрахеальную трубку для поддержания ингаляционной анестезии.
- Поддерживайте нервно-мышечную блокаду с помощью рокурония бромида (0,15 мг/кг) во время хирургической процедуры для обеспечения адекватного расслабления мышц и проведения лапароскопии при более низком внутрибрюшном инсуффляционном давлении.
- Используйте биспектральный индекс для определения глубины анестетика, чтобы способствовать быстрому пробуждению при уменьшенной дозе анестетика. Противодействовать остаточному нервно-мышечному блоку сугаммадексом (2-4 мг/кг).
- Используя трехпортовую технику, введите троакар диаметром 10 мм в брюшную полость в области пупка, чтобы ввести оптическую линзу с прикрепленной камерой, и два троакара диаметром 5 мм в левую и правую подвздошные области (на 2 см выше и на 2 см медиально по отношению к соответствующему переднему верхнему подвздошному отделу позвоночника) под прямым наблюдением для хирургического инструментария и забора тканей. Осмотрите органы малого таза, включая оба яичника, чтобы подтвердить норму.
- Определите яичник, к которому легче всего получить доступ, затем возьмитесь за него. Отрежьте объем, который составляет примерно одну треть яичника (или как указано в вашем этическом разрешении), затем при необходимости используйте диатермию для обеспечения гемостаза.
ПРИМЕЧАНИЕ: Проводите биопсию только в том случае, если нет противопоказаний, таких как факторы риска чрезмерного внутри- или послеоперационного кровотечения или повышенный риск инфекции. Четко укажите и следуйте критериям включения и исключения страны. Весь яичник может быть взят, если риск бесплодия очень высок и/или риск разрезания только части считается слишком высоким (например, из-за кровотечения). Избегайте использования диатермии перед сбором образца, так как это может повредить ткань.
- Определите яичник, к которому легче всего получить доступ, затем возьмитесь за него. Отрежьте объем, который составляет примерно одну треть яичника (или как указано в вашем этическом разрешении), затем при необходимости используйте диатермию для обеспечения гемостаза.
- Находясь в операционной, поместите ткань в пробирку, содержащую 5 мл 1 фосфатного буферного раствора Дульбекко (PBS) с CaCl2, MgCl2, 1 г/л D-глюкозы, 36 мг/л пирувата, либо подогретую до 37 °C, если образец немедленно обрабатывается в лаборатории (в течение 30 минут), либо при длительной транспортировке (до 24 часов) при температуре 4 °C.
Примечание: Решения для транспортировки включают в себя ряд коммерчески доступных решений для транспортировки/перфузии органов, а также простые буферы, такие как PBS и MEM34. - Отрежьте небольшой кусочек ткани яичника (2 мм х 2 мм х 2 мм) от поверхности яичника. Эта часть содержит кору головного мозга, которая является внешней частью яичника, где находятся фолликулы яичников35.
ВНИМАНИЕ: Обрабатывайте человеческие ткани, такие как яичник, используя методы и процедуры уровня биобезопасности 2.
ПРИМЕЧАНИЕ: Специализированное отделение репродуктивной медицины клинически криоконсервирует остальную ткань яичников для потенциального будущего использования в восстановлении фертильности пациентов. - Поместите салфетку в раствор Буэна с концентрацией 350 мкл при комнатной температуре на 2 ч или в 350 мкл 4% формальдегида при температуре 4 °C на ночь, убедившись, что ткань полностью погружена в воду. После инкубации промойте ткань с 70% этанолом три раза.
- Для раствора Буина умывайтесь до исчезновения желтого цвета. Погрузите ткань в парафин36. Вырежьте минимум 30 серийных участков ткани толщиной 4 мкм и поместите их на предметные стекла.
ВНИМАНИЕ: Обрабатывайте раствор Буэна и формальдегид в химическом колпаке и с надлежащими защитными средствами.
ПРИМЕЧАНИЕ: Формальдегид может привести к образованию артефактов в ткани, связанных с усадкой. Таким образом, решение Буэна является предпочтительным выбором для сохранения гистологии. Тем не менее, решение Буэна несет в себе дополнительные риски, что приводит к тому, что некоторые учреждения предпочитают использовать формальдегид37.
- Для раствора Буина умывайтесь до исчезновения желтого цвета. Погрузите ткань в парафин36. Вырежьте минимум 30 серийных участков ткани толщиной 4 мкм и поместите их на предметные стекла.
2. Окрашивание гематоксилином и эозином (H&E)
- Взвесьте 5 г порошка эозина Y в автоклавный стеклянный флакон объемом 100 мл. Добавьте 800 мл 95% этанола и 200 мл деионизированной воды, чтобы получить 0,5% исходный раствор эозина. Приготовьте рабочий раствор 0,25% эозина, разбавив 200 мл 0,5% стокового раствора эозина 160 мл 100% этанола, 1 мл уксусной кислоты и 40 мл деионизированной воды.
ПРИМЕЧАНИЕ: Порошок должен раствориться не полностью. Отфильтруйте раствор перед использованием, чтобы уменьшить количество осадков. - Разместите горки в стеллажах. Погрузите стеллаж с предметными стеклами в соответствующие емкости в следующем порядке: 15 мин в ксилол, 5 мин в 100% этанол, 10 раз опустить в 70% этанол, 10 раз опустить в 50% этанол, а затем 10 раз опустить в деионизированную воду.
- Погрузите стеллаж с предметными стеклами в раствор гематоксилина на 3 мин, затем переложите стеллаж с предметными стеклами в емкость с дистиллированной водопроводной водой на 30 с, чтобы смыть излишки пятна гематоксилином.
- Поместите стеллаж со слайдами в емкость с дифференцирующим раствором (1 мл 37% HCl добавлено к 100 мл 70% этанола) на 1 мин, затем переложите стеллаж со слайдами в емкость с дистиллированной водопроводной водой на 30 с.
ПРИМЕЧАНИЕ: Убедитесь, что срезы ткани погружены в жидкость. При необходимости добавьте в контейнер еще реагента. Меняйте ксилол через каждые 5 использований при окрашивании больших количеств. Приготовьте 50% этанол путем разбавления 70% этанола (например, добавьте 35 мл 70% этанола к 15 мл DPBS, чтобы получить 50 мл 50% этанола).
ВНИМАНИЕ: Обращайтесь с ксилолом в капюшоне и с надлежащими защитными средствами.
- Поместите решетку со слайдами в водопроводную воду Скотта (также известную как раствор воронения) на 30-60 с, затем переложите решетку с горками в емкость с дистиллированной водой из-под крана на 30 с. Погрузите штатив со слайдами в рабочий раствор эозина на 1 мин.
- Обезвоживайте предметные стекла, поместив их в следующие реагенты: 100% этанол на 30 с, второй контейнер со 100% этанолом на 30 с, а затем дважды опустите в ксилол. После извлечения решетки из раствора ксилола дайте ей высохнуть в стеклянной емкости, чтобы ксилол не капнул внутрь вытяжки.
- Закрепите слайд с помощью 2 капель монтажного раствора. Осторожно установите защитные стекла, чтобы избежать образования пузырей и дать монтажному раствору высохнуть.
ВНИМАНИЕ: Обращайтесь с ксилолом в капюшоне и с надлежащими защитными средствами.
- Оцифруйте слайды, по возможности отсканировав их с помощью сканеров слайдов. Если такой вариант недоступен, используйте обычный инвертированный микроскоп с 20-40-кратным увеличением для прямого подсчета фолликулов. Обязательно сделайте снимок всей биопсии, чтобы облегчить измерение площади в программном обеспечении для анализа изображений.
3. Подсчет фолликулов
- Если слайды были оцифрованы, откройте файлы с помощью соответствующего программного обеспечения (например, программного обеспечения с открытым исходным кодом QuPath38). Если анализ не оцифрован, выполните его непосредственно с помощью инвертированного микроскопа и соответствующего программного обеспечения.
- Перетащите файл в главное окно QuPath. Установите тип изображения на Brightfield H&E (см. рис. 1A). Определите эпителий на расстоянии 1 мм от поверхности (один слой кубовидных клеток, выстилающих поверхность) с помощью масштабной линейки. Нажмите на инструмент «Эллипс» и аннотируйте фолликулы (см. Рисунок 1B).
- Подсчитайте количество фолликулов в пределах этой области размером 1 мм, от примордиальной до первичной стадии. Определить стадию каждого фолликула (первичная – слой уплощенных гранулезных клеток, окружающих ооцит; промежуточная стадия – смесь уплощенных и кубовидных гранулезных клеток; первичная – один полный слой кубовидных гранулезных клеток, окружающих ооцит).
- Введите идентификатор образца, возраст, количество фолликулов для каждого предметного стекла, толщину среза иn-й срез, подсчитанный в лист с именем Фолликул в мм3 в файле Excel калькулятора Z-оценки фолликулов (см. Дополнительный файл 1 и Рисунок 2A).
ПРИМЕЧАНИЕ: Из-за диаметра фолликулов (самых маленьких фолликулов >35 мкм) один и тот же фолликул может появляться на последовательных участках. Соблюдайте особую осторожность при подсчете участков, расстояние между которыми меньше диаметра фолликула. Предпочтительно подсчитывать фолликулы из каждого10-го отдела (например, из отдела #10, #20, #30). Поверхностный эпителий может отслаиваться во время обработки тканей и может присутствовать на предметных стеклах лишь частично. Подсчитывают только фолликулы с видимой цитоплазмой. Для контроля качества попросите двух человек независимо друг от друга посчитать фолликулы и определить, насколько хорошо их количество совпадает. Рассчитайте согласованность между наблюдателями с помощью простой корреляционной функции между количеством фолликулов каждого наблюдателя для одного и того же образца.
- Определите самые большие 10% фолликулов в каждом подсчитанном участке с помощью глазного яблока. Измерьте средний диаметр этих ооцитов, щелкнув по инструменту «Линия », проведя две перпендикулярные линии через мембрану ооцита и выбрав «Измерить», а затем «Показать измерения аннотации » (см. рисунок 1C).
- Запишите измерения в столбце Длина μм (см. Рисунок 1D). Введите средний диаметр всех ооцитов в поле Средний диаметр ооцитов (мкм) для каждого слайда в файле Excel калькулятора Z-оценки фолликулов (Фолликул в мм3, см. Дополнительный файл 1 и Рисунок 2A).
- Поместите изображение в центр экрана в QuPath, затем нажмите на значок ImageJ . Выберите Send snapshot to ImageJ (см. рис. 3A). В ImageJ разграничьте границу на расстоянии 1 мм с помощью инструмента «Кисть ». Нажмите на изображение, затем на Type и выберите 8-бит (см. рисунок 3B).
- Нажмите на инструмент «Линия », нарисуйте линию на масштабной линейке в левом нижнем углу экрана (см. Рисунок 3C). Нажмите « Анализ», затем «Установить масштаб», введите длину, указанную на масштабной линейке в поле «Известное расстояние», и нажмите « ОК» (см. рисунок 3C). Нажмите на Изображение, затем Настройка, Яркость/Контрастность и выберите Авто (см. Рисунок 3D).
- Нажмите на Изображение, затем Настройка, Порог и выберите Авто (см. Рисунок 3E). Кликните по инструменту-палочке , выделите область, затем нажмите Ctrl + M (см. Рисунок 3F). Введите значение площади в файл Excel калькулятора Z-оценки фолликула (фолликул в мм3, см. дополнительный файл 1 и рисунок 2A).
4. Расчет плотности фолликулов, объема коры головного мозга и Z-оценки
- Используйте прилагаемый файл Excel калькулятора Z-оценки фолликулов для автоматического выполнения расчетов, описанных ниже. Результаты появятся на листе «Z-score (фолликул на мм³)» в калькуляторе Excel (см. Дополнительный файл 1) при условии, что данные, указанные в разделе 3, будут внесены в лист «фолликулы в мм³».
- Для расчета плотности фолликулов в этих срезах используйте модифицированную формулу, представленную Schmidt et al.32. Во-первых, примените поправочный коэффициент α для учета двойного подсчета одного и того же фолликула. Модифицированная формула выглядит следующим образом:
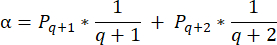
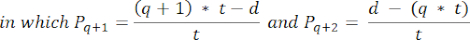
Примечание: В этой формуле t — толщина среза, d — диаметр ооцита, а q — частное от диаметра фолликула, деленное на толщину среза. - Экстраполируйте общее количество фолликулов (n фолликулов) в коре головного мозга из количества фолликулов в срезе по следующей формуле33:
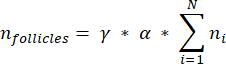
ПРИМЕЧАНИЕ: Эта формула также учитывает все невычисляемые разделы. Здесь γ представляет собой количество секций, которые не были рассчитаны (например, γ = 10, если учитывается каждый10-й секция), α — поправочный коэффициент, рассчитанный в 4,1, N — количество подсчитанных секций, а n i — общее количество фолликулов в подсчитанных секциях.- Экстраполируйте весь объем коры головного мозга (V) из подсчитанных областей по следующей формуле33:
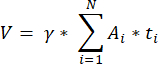
ПРИМЕЧАНИЕ: Здесь Ai — это площадь разреза, а ti — толщина ткани. Пожалуйста, проверьте шаг 4.2 на предмет γ и N. - Используйте следующую формулу33 для расчета плотности фолликулов:
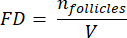
- Экстраполируйте весь объем коры головного мозга (V) из подсчитанных областей по следующей формуле33:
- Определить, есть ли сниженный (<-1,7 Z-score) овариальный резерв, рассчитав Z-показатель по формуле33:
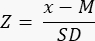
ПРИМЕЧАНИЕ: Z-оценка автоматически рассчитывается на листе «Z-оценка (фолликул на мм³)» в калькуляторе Excel (см. Дополнительный файл 1) на основе информации, представленной в разделе 3 (Подсчет фолликулов) (Рисунок 2B). В этой формуле Z представляет Z-оценку, x — расчетную плотность фолликулов (фолликулы/см3) исследуемой выборки (шаг 4.4), M — среднюю плотность фолликулов соответствующей возрастной группы, а SD — стандартное отклонение соответствующей возрастной группы. Референсные значения для женщин в возрасте от 0 до 25 лет были установлены в работе Hassan et al.33. Средние значения и стандартные отклонения плотности фолликулов соответствующих возрастных групп можно найти в файле Excel калькулятора Z-оценки фолликулов (Дополнительный файл 1) и использовать для расчета Z-оценки.
Результаты
Фолликулы яичников количественно оцениваются после успешного разрезания, окрашивания и сканирования предметных стекол. Различаются различные стадии и состояние фолликулов и дополнительно анализируются. На рисунке 4А показан окрашенный HE поперечны?...
Обсуждение
Женщины рождаются с ограниченным пулом ооцитов, который не может быть восполнен. Овариальный резерв является ключевым фактором, определяющим репродуктивный потенциал женщины. В данной статье представлен метод гистологической количественной оценки плотности фолли?...
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы хотели бы поблагодарить медицинских работников, которые помогли нам с набором участников и сбором тканей, а также всех пациентов, которые пожертвовали свои ткани яичников. Мы также выражаем признательность Фонду борьбы с детским раком (PR2020-0096) и доктору философии Каролинского института, финансирующим KID, чье финансирование сделало эту работу возможной. Мы также хотели бы поблагодарить центр морфологического анализа фенотипов за подготовку гистологических препаратов. Выражаем признательность Николе Байерс за редактирование этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
Ссылки
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены