需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
评估接受生育力保留的年轻患者卵巢储备的 Z 评分
摘要
本方案描述了一种评估需要通过卵巢组织冷冻保存来保持生育能力的 25 岁以下患者的卵巢储备的方法。该方法涉及:(1) 皮质样本中卵巢储备的组织学评估,(2) 与参考数据集的比较,以及 (3) Z 分数的计算。
摘要
女性出生时有一个不可再生的卵巢卵泡库,称为卵巢储备。这种储备由卵巢中的原始卵泡组成,可能受到许多因素的影响,例如遗传和内分泌疾病、医疗干预和内分泌干扰物。当需要性腺毒性治疗时,建议保留生育能力。女性的首选选择是卵母细胞和胚胎冷冻保存。然而,对于非常年轻、性未成熟的患者,卵巢组织冷冻保存是唯一的选择。了解冷冻保存的组织样本的滤泡密度对于年轻患者的生育咨询至关重要。该协议演示了使用皮质卵泡密度的 Z 分数作为评估正在接受生育力保留的 25 岁及以下女孩和年轻女性卵巢组织质量的工具。将患者样本中的卵泡密度与 Hassan 等人开发的年龄标准化参考标准进行比较,以估计可能与标准的偏差。通过组织学定量测量卵泡密度。为此,将一小块卵巢皮质组织 (~2 mm x 2 mm x 2 mm) 固定在 Bouin 或甲醛溶液中,包埋在石蜡中,以 4 μm 的厚度切片,用苏木精和伊红染色,并使用载玻片扫描仪进行数字化。皮层中存在的卵泡阶段范围从原始卵泡到初级卵泡。皮质面积距组织学切片表面上皮 1 mm。使用 Schmidt 等人提出的修改后的公式计算卵泡密度,并使用参考平均值和标准差确定 Z 分数。Z 分数表示测量值与参考平均值的偏差程度,确定卵巢储备减少 (<-1.7 Z 分数)。通过这种方法,卵泡密度可以用作需要保留生育能力的年轻患者的卵巢储备的宝贵指标。
引言
卵巢是一个充满活力的、内分泌活跃的器官,由外皮层和内延髓组成。卵泡在卵巢内异质分布,其中包含被基质颗粒细胞包围的性腺卵母细胞1。所有卵泡都在胎儿发育过程中形成,在胎龄 20 周左右达到顶峰,然后呈指数级下降。出生时,1-200 万个原始卵泡留在皮层内,只有几十万个卵泡存活到青春期2。非生长卵泡池,也称为卵巢储备,除其他因素外,会影响女性的生育能力。卵巢储备位于皮层内,并随着卵泡的生长和成熟而进入髓质。一些研究人员认为卵巢储备仅由原始卵泡组成,而另一些研究人员则包括所有单层卵泡(即原始卵泡、中间卵泡和原卵泡)3,4,5,6。在女性的一生中,只有 300-400 个卵泡成熟并存活并最终排卵。当卵泡数量下降到一千左右时,更年期开始,这通常发生在 50 岁左右 2,7。目前关于成人卵巢中存在卵干细胞 (OSC) 的争论仍在继续,这些细胞可以在异种移植后形成卵母细胞。一些研究表明分离表达原始生殖细胞基因图谱并分化为卵母细胞的细胞 8,9,而另一些研究表明,所谓的 OSC 是血管的血管周围细胞 10,11,12。
卵巢早衰 (POI) 定义为在 40 岁之前 FSH 水平升高而月经周期停止13。POI 的病因是多因素的,可特发性发生;然而,它通常是由于医疗条件14 而引起的。例如,某些先天性遗传病与 POI 有关,因为出生时卵巢储备已经减少,例如特纳综合征15。POI 也可能是性腺毒性治疗的副作用,这在非常年轻的患者中尤其成问题,因为它可能导致无法正常进入青春期并严重损害卵巢储备。根据 POI 的风险和患者的年龄,有几种生育力保存选项可供选择,例如成熟卵母细胞的冷冻保存、体外受精后胚胎的冷冻保存和卵巢组织冷冻保存 (OTC)。对于青春期前的患者,由于他们的性不成熟,OTC 是唯一可行的选择16,17。在美国,通过 OTC 保持生育能力最近被认为是一种可接受的临床常规18。然而,OTC 在许多欧洲国家仍然被认为是实验性的,需要伦理批准,特别是对于自体移植19,20。因此,必须仔细考虑 OTC 方案的纳入标准,并应为每位患者进行风险-获益分析。并非所有接受性腺毒性治疗的儿童都符合保留生育能力的条件。在瑞典,根据北欧儿科血液学和肿瘤学会21 的生育力保存指南,仅建议高风险或极高危患者进行生育力保留。该组包括 (1) 需要干细胞移植或接受范围区域卵巢放射治疗的青春期前和青春期后儿童,以及 (2) 具有高累积剂量烷化化疗的青春期后儿童。对于月经初潮前的女孩,不孕症极高风险的纳入标准包括接受以下任何治疗的患者:对卵巢的辐射剂量 >10 Gy,或同种异体或自体造血干细胞疗法 (HSCT)。排除标准包括那些在手术前需要额外的血液制品进行其他抗凝剂制剂或中性粒细胞计数 <1 的人。对于初潮后的女孩/妇女,不孕症高风险或极高风险的纳入标准包括接受以下任何一项治疗的女孩/妇女:对卵巢的辐射剂量 >10 Gy,或同种异体 HSCT、环磷酰胺 >9 g/m²、异环磷酰胺 >60 g/m²、丙卡巴肼或亚硝基脲化合物 (BCNU/CCNU) >360 mg/m²。排除标准包括那些由主治医师评估的出血风险增加、感染风险增加、手术并发症风险增加或疼痛问题风险增加的人。
对于 OTC,在腹部手术期间通过剖腹手术或腹腔镜通过单侧卵巢切除术或活检收集卵巢组织。从收集的卵巢组织中取出髓质,然后将剩余的皮质切成更小的片段,通过可控速率冷冻或玻璃化冷冻保存,以便以后用于生育能力恢复22。然后将样本储存在液氮中,直到患者从治疗中恢复并希望组建家庭。根据癌症的类型,在没有卵巢组织移植禁忌症的情况下,然后将组织解冻并自体移植以恢复荷尔蒙和卵巢功能。OTC 已被证明是成功的,怀孕率为 50%,据报道,在移植成年期收集的冷冻保存的卵巢组织后,有 200 多例活产婴儿 23,24,25。据报道,儿童时期收集的卵巢组织自体移植后活产婴儿很少,而且在无疑是青春期前卵巢组织自体移植后也没有报道 26,27,28,29,30。组织质量是成功恢复生育能力的先决条件31。因此,研究收集的组织样本的质量至关重要。
目前,估计卵巢组织质量的一种方法是通过组织学切片和卵泡的手动计数。然而,由于储备随着年龄的增长而自然下降,并且卵泡的分布异质性,因此很难评估卵泡密度的正常性。此外,与参考值进行比较具有挑战性,因为它们没有针对活检大小和年龄进行标准化。其他评估选项,例如 AMH 血清水平或用钙黄绿素或中性红对消化组织进行染色,要么没有得到很好的确立,要么有其自身的局限性。Wallace 和 Kelsey 之前通过收集无已知卵巢病变患者的整个卵巢卵泡数量数据,发表了一个随年龄变化的正常卵巢储备模型2。此外,由于活检不能代表整个卵巢,Schmidt 等人开发了一种基于皮质活检估计卵泡总数的方法32。使用该方法的修改版本和正常卵巢储备模型,建立了 0-25 岁女性卵泡密度的参考数据集33。
本文介绍了基于小卵巢样本评估卵泡密度正常性的策略,方法是 (1) 使用组织学直接量化卵泡和 (2) 通过 Z 分数将结果与年龄标准化标准参考进行比较。Z 分数的使用描述了卵巢生物的卵泡密度与年龄和大小标准化参考组平均值的关系。这对于医生在咨询患者进行自体移植和保留生育能力后的进一步治疗方面将具有重要价值。
研究方案
所进行的所有程序均已获得瑞典伦理审查局(Sveafertil 患者,Dnr:2019-03802)和赫尔辛基大学医院伦理委员会(HCH 患者,Dnr 340/13/03/03/2015)的批准。研究护士提供有关该研究的书面和口头信息,并根据赫尔辛基宣言获得知情同意。对于 18 岁以下的患者,已获得法定监护人的知情同意。所有样本均采用假名化处理,并根据欧洲通用数据保护条例 (GDPR) 进行处理。本研究中使用的试剂和设备的详细信息列在 材料表中。
1. 卵巢组织采集和处理
注意:当有不孕症高风险或极高风险的适应症时,按照当地指南(例如,北欧、欧洲或国际特定指南),确定所有符合保留生育能力条件的患者。在欧洲,仅招募未成年患者作为生育力保存研究计划的一部分。使用您所在国家/地区的生育力保存指南确定不孕症的风险。
- 在全身麻醉下进行外科手术。静脉注射异丙酚 (2 mg/kg)、舒芬太尼 (0.5 μg/kg) 和罗库溴铵 (0.6 mg/kg) 以诱导麻醉。
- 以 6-8 mL/kg 的潮气量和 6-8 cm 的呼气正压 H2O 为患者插管通气。 通过 气管插管输送 1% 至 2% 的七氟烷以维持吸入麻醉。
- 在外科手术过程中用罗库溴铵 (0.15 mg/kg) 维持神经肌肉阻滞,以提供足够的肌肉松弛,并允许在较低的腹腔内吹气压力下进行腹腔镜检查。
- 使用双频指数来指导麻醉剂深度,以促进减少麻醉剂剂量的快速觉醒。用舒更葡糖(2-4 mg / kg)拮抗残留的神经肌肉阻滞。
- 使用三端口技术,将一个 10 mm 套管针插入脐部的腹膜腔,在直视下在左右髂区(上方 2 cm 和各自髂前上棘内侧 2 cm)引入一个 5 mm 套管针,用于手术器械和组织取回。检查盆腔器官,包括两个卵巢,以确认正常。
- 确定最容易进入的卵巢,然后抓住它。切开大约占卵巢三分之一的体积(或根据您的道德许可),然后在需要时使用透热疗法来确保止血。
注意:只有在没有禁忌症的情况下才进行活检,例如术中或术后出血过多或感染风险增加的危险因素。明确指定并遵循国家/地区的纳入和排除标准。如果不孕的风险非常高和/或被认为仅切开一部分的风险太高(例如,由于出血),则可以采集整个卵巢。在采集样本之前避免使用透热疗法,因为它会损坏组织。
- 确定最容易进入的卵巢,然后抓住它。切开大约占卵巢三分之一的体积(或根据您的道德许可),然后在需要时使用透热疗法来确保止血。
- 在手术室中,将组织放入含有 5 mL 1x Dulbecco 磷酸盐缓冲盐水 (PBS) 的试管中,其中含有 CaCl2、MgCl2、1 g/L D-葡萄糖、36 mg/L 丙酮酸,如果样品立即在实验室处理(在 30 分钟内),则加热至 37 °C,或在较长的运输过程中保持在 4 °C(长达 24 小时)。
注:运输解决方案包括一系列市售的器官运输/灌注解决方案以及简单的缓冲液,例如 PBS 和 MEM34。 - 从卵巢表面切下一小块卵巢组织 (2 mm x 2 mm x2 mm)。这块包含皮层,它是卵巢卵泡所在的卵巢外部35。
注意: 使用生物安全 2 级实践和程序处理卵巢等人体组织。
注意:专门的生殖医学部门在临床上冷冻保存其余的卵巢组织,以备将来用于患者的生育能力恢复。 - 将组织在室温下的 350 μL Bouin 溶液中放置 2 小时,或在 4 °C 下放入 350 μL 4% 甲醛中过夜,确保组织完全浸没。孵育后,用 70% 乙醇洗涤组织 3 次。
- 对于 Bouin 溶液,请清洗至黄色消失。将组织包埋在石蜡36 中。切下至少 30 个厚度为 4 μm 的连续组织切片,并将它们放在载玻片上。
注意:将 Bouin 溶液和甲醛放在化学罩内,并使用适当的防护设备。
注意:甲醛可能会导致组织中出现与收缩相关的伪影。因此,Bouin 溶液是保留组织学的首选。然而,Bouin 的解决方案存在额外的风险,导致一些机构更喜欢使用甲醛37。
- 对于 Bouin 溶液,请清洗至黄色消失。将组织包埋在石蜡36 中。切下至少 30 个厚度为 4 μm 的连续组织切片,并将它们放在载玻片上。
2. 苏木精和伊红 (H&E) 染色
- 称取 5 g 伊红 Y 粉末放入 100 mL 高压灭菌玻璃瓶中。加入 800 mL 95% 乙醇和 200 mL 去离子水,制成 0.5% 伊红储备液。用 160 mL 100% 乙醇、1 mL 乙酸和 40 mL 去离子水稀释 200 mL 0.5% 曙红储备液,制备 0.25% 曙红工作溶液。
注意:粉末可能无法完全溶解。使用前过滤溶液以减少沉淀。 - 将玻片放在机架中。按以下顺序将带有玻片的架子浸入相应的容器中:在二甲苯中 15 分钟,在 100% 乙醇中 5 分钟,在 70% 乙醇中浸入 10 次,在 50% 乙醇中浸入 10 次,然后在去离子水中浸入 10 次。
- 将带有载玻片的架子浸入苏木精溶液中 3 分钟,然后将带有载玻片的架子转移到装有蒸馏自来水的容器中 30 秒,以洗去多余的苏木精污渍。
- 将带有玻片的架子放入装有分化溶液(1 mL 37% HCl 添加到 100 mL 70% 乙醇中)的容器中 1 分钟,然后将带有玻片的架子转移到装有蒸馏自来水的容器中 30 秒。
注意:确保组织切片浸没在液体中。如果需要,向容器中添加更多试剂。大量染色时,每 5 次使用后更换二甲苯。通过稀释 70% 乙醇制备 50% 乙醇(例如,将 35 mL 70% 乙醇添加到 15 mL DPBS 中,制成 50 mL 50% 乙醇)。
注意: 将二甲苯放在罩内并使用适当的防护设备处理。
- 将带有载玻片的架子放入 Scott 的自来水(也称为发蓝溶液)中 30-60 秒,然后将带有载玻片的架子转移到装有蒸馏自来水的容器中 30 秒。将带有载玻片的架子浸入 eosin 工作溶液中 1 分钟。
- 将载玻片放入以下试剂中脱水:100% 乙醇 30 秒,第二个容器含 100% 乙醇 30 秒,然后在二甲苯中浸入两次。从二甲苯溶液中取出架子后,在玻璃容器中晾干,以防止二甲苯滴入罩内。
- 用 2 滴安装液安装载玻片。小心放置盖玻片以避免气泡,并让封片剂干燥。
注意: 将二甲苯放在罩内并使用适当的防护设备处理。
- 如果可能,使用玻片扫描仪扫描玻片,将玻片数字化。如果此选项不可用,请使用 20-40 倍放大倍率的普通倒置显微镜直接计数卵泡。确保拍摄整个活检的图像,以便于在图像分析软件中进行面积测量。
3. 卵泡计数
- 如果幻灯片已数字化,请使用适当的软件(例如,开源软件 QuPath38)打开文件。如果未数字化,请直接使用倒置显微镜及其相应的软件进行分析。
- 将文件拖到 QuPath 的主窗口上。将图像类型设置为 明场 H&E (参见 图 1A)。使用比例尺定义距表面上皮(衬在表面的单层长方体细胞)1 mm。单击 椭圆 工具并注释毛囊(参见 图 1B)。
- 计算此 1 mm 区域内从原始阶段到初级阶段的卵泡数。确定每个卵泡的分期(原始阶段 - 围绕卵母细胞的一层扁平的颗粒细胞;中间阶段 - 扁平和立方体颗粒细胞的混合物;初级阶段 - 围绕卵母细胞的一整层立方体颗粒细胞)。
- 将 样品 ID、年龄、每张载玻片的卵泡数 、 切片厚度和第 n 个 切片输入到卵泡 Z 分数计算器 Excel 文件上名为 Follicle in mm3 的表中(参见 补充文件 1 和 图 2A)。
注:由于卵泡的直径(最小的卵泡 >35 μm),相同的卵泡可能会出现在连续的切片中。在对切片之间的距离小于毛囊直径的切片进行计数时,请格外小心。优选地,从每 10个 部分(例如,部分 #10、#20、#30)中计数卵泡。表面上皮可能在组织处理过程中脱落,并且可能仅部分存在于载玻片中。仅计数具有可见细胞质的卵泡。为了进行质量控制,让两个人独立计数卵泡并确定他们的计数一致性。使用同一样本的每个观察者的卵泡计数之间的简单相关函数计算观察者之间的一致性。
- 通过目测确定每个计数部分中最大的 10% 的卵泡。通过单击 线条 工具,画两条穿过卵母细胞膜的垂直线 ,然后选择测量,然后选择显示 注释测量值 (参见 图 1C)来测量这些卵母细胞的平均直径。
- 记录柱 长 μm 下的测量值(参见 图 1D)。将所有卵母细胞的平均直径输入卵泡 Z 分数计算器 Excel 文件中每张载玻片的平均 卵母细胞直径 (μm) 字段(卵泡以mm 3 为单位, 参见 补充文件 1 和 图 2A)。
- 将图像放在 QuPath 中的屏幕中央,然后单击 ImageJ 图标。选择 将快照发送到 ImageJ (参见 图 3A)。在 ImageJ 中,使用 画笔 工具从边界划定 1 毫米。单击 Image,然后单击 Type,然后选择 8 位 (参见 图 3B)。
- 单击线条工具,在屏幕左下角的比例尺上画一条线(参见图 3C)。单击 Analyze,然后单击 Set Scale,在 Known Distance 字段中输入比例尺中指示的长度,然后单击 OK(参见图 3C)。单击 Image,然后单击 Adjust、Brightness/Contrast,然后选择 Auto(参见图 3D)。
- 单击 Image,然后单击 Adjust、Threshold,然后选择 Auto (参见 图 3E)。单击 魔杖 工具,选择 区域,然后按 Ctrl + M(参见 图 3F)。将面积值输入毛囊 Z 分数计算器 Excel 文件(毛囊以mm 3 为单位, 参见 补充文件 1 和 图 2A)。
4. 卵泡密度、皮质体积和 Z 分数计算
- 使用提供的毛囊 Z 分数计算器 Excel 文件自动执行下面概述的计算。结果将显示在 Excel 计算器的"Z 分数(卵泡/mm³)"表中(参见 补充文件 1),前提是将第 3 节中指示的详细信息输入到"卵泡数(以 mm³ 为单位的卵泡)"表中。
- 要计算这些部分中的卵泡密度,请使用 Schmidt 等人 32 提出的修改后的公式。首先,应用 α 校正因子来考虑同一卵泡的重复计数。修改后的公式如下:
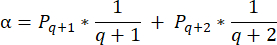
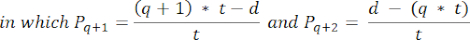
注意:在这个公式中, t 是切片厚度, d 是卵母细胞的直径, q 是卵泡直径除以切片厚度的商。 - 使用以下公式33 从该部分中的卵泡计数推断皮层中的卵泡总数(n 个卵泡):
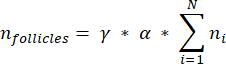
注意:此公式还考虑了所有未计算的部分。这里 γ 表示未计算的部分数(例如,如果每 10个 部分计算一次,则 γ = 10),α 是以 4.1 计算的校正因子, N 是计数的部分数, n i 是计数部分中的毛囊总数。- 使用以下公式33 从计数区域推断整个皮质体积 (V):
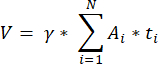
注意:这里, Ai 是截面的面积, ti 是组织厚度。请查看步骤 4.2 以了解 γ 和 N。 - 使用以下公式33 计算毛囊密度:
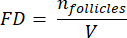
- 使用以下公式33 从计数区域推断整个皮质体积 (V):
- 通过使用公式33 计算 Z 分数来确定卵巢储备是否减少 (<-1.7 Z 评分):
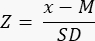
注意:Z 分数是根据第 3 节(卵泡计数)(图 2B)中提供的信息,在 Excel 计算器(参见补充文件 1)的"Z 分数(卵泡/mm³)"表中自动计算的。在这个公式中,Z 代表 Z 分数,x 是研究样本的计算卵泡密度(卵泡/cm3)(步骤 4.4),M 是相应年龄组的平均卵泡密度,SD 是相应年龄组的标准差。Hassan 等人 33 已经确定了 0-25 岁女性的参考值。各个年龄组的卵泡密度的平均值和标准差可以在卵泡 Z 分数计算器 Excel 文件(补充文件 1)中找到,并用于 Z 分数计算。
结果
在成功切片、染色和扫描载玻片后,对卵巢卵泡进行定量。区分并进一步分析卵泡的不同阶段和健康状况。在 图 4A 中,显示了来自成人的 Bouin 固定卵巢的 HE 染色横截面,以及皮质和髓质组织的示例。 图 4B 显示了儿童卵巢的代表性图片,并带有表面上皮的示例。卵巢储备(即非生长卵泡池)和生长中的小卵泡位于皮层中。使...
讨论
女性出生时卵母细胞库有限,无法补充。卵巢储备是女性生殖潜力的关键决定因素。本文概述了一种卵泡密度的组织学量化方法,以及使用年轻患者和 25 岁以下女性卵巢皮质卵泡密度的 Z 评分与参考标准的比较。
在该方案中,卵巢组织是从接受 OTC 以保持生育能力的不孕症高风险或极高风险的女孩和妇女或接受变性手术的患者那里获得的。使用一小?...
披露声明
作者没有利益冲突。
致谢
我们要感谢帮助我们进行参与者招募和组织采集的医疗保健专业人员,以及所有捐献卵巢组织的患者。我们还感谢儿童癌症基金会 (PR2020-0096) 和卡罗林斯卡医学院博士资助 KID,他们的资助使这项工作成为可能。我们还要感谢形态学表型分析机构制备组织学载玻片。我们感谢 Nicola Byers 对本手稿进行语言编辑。
材料
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
参考文献
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。