Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Puntuaciones Z para la evaluación de la reserva ovárica en pacientes jóvenes sometidas a preservación de la fertilidad
En este artículo
Resumen
El presente protocolo describe un método para evaluar la reserva ovárica en pacientes menores de 25 años que requieren preservación de la fertilidad mediante criopreservación de tejido ovárico. Este método implica: (1) la evaluación histológica de la reserva ovárica en muestras corticales, (2) la comparación con un conjunto de datos de referencia y (3) el cálculo de las puntuaciones Z.
Resumen
Las mujeres nacen con un grupo no renovable de folículos ováricos, lo que se conoce como reserva ovárica. Esta reserva está formada por folículos primordiales de los ovarios y puede verse afectada por muchos factores, como trastornos genéticos y endocrinos, intervenciones médicas y disruptores endocrinos. Se recomienda la preservación de la fertilidad cuando son necesarios tratamientos gonadotóxicos. Las opciones preferidas para las mujeres son la criopreservación de ovocitos y embriones. Sin embargo, en pacientes muy jóvenes y sexualmente inmaduras, la criopreservación de tejido ovárico es la única opción. Conocer la densidad folicular de las muestras de tejido criopreservado es esencial en el asesoramiento sobre fertilidad de pacientes jóvenes. Este protocolo demuestra el uso de puntuaciones Z para la densidad del folículo cortical como herramienta para evaluar la calidad del tejido ovárico en niñas y mujeres jóvenes de 25 años o menos que están en proceso de preservación de la fertilidad. La densidad de folículos en muestras de pacientes se compara con los estándares de referencia normalizados por edad, desarrollados por Hassan et al. para estimar las posibles desviaciones del estándar. La densidad del folículo se mide a través de la cuantificación histológica. Para ello, se fija un pequeño trozo de tejido cortical ovárico (~2 mm x 2 mm x 2 mm) en solución de Bouin o de formaldehído, se incrusta en parafina, se secciona a 4 μm de grosor, se tiñe con hematoxilina y eosina y se digitaliza con un escáner de portaobjetos. Las etapas foliculares presentes en la corteza van desde los folículos primordiales hasta los primarios. El área cortical estaba a 1 mm del epitelio superficial en los cortes histológicos. La densidad de folículos se calcula utilizando una fórmula modificada presentada por Schmidt et al., y la puntuación Z se determina utilizando la media de referencia y la desviación estándar. La puntuación Z indica cuánto se desvía el valor medido de la media de referencia, determinando la reserva ovárica reducida (<-1,7 puntuación Z). Con este método, las densidades de los folículos se pueden utilizar como una medida valiosa de la reserva ovárica para pacientes jóvenes que requieren preservación de la fertilidad.
Introducción
El ovario es un órgano dinámico, endocrinológicamente activo, formado por una corteza externa y una médula interna. Dentro de los ovarios se distribuyen heterogéneamente los folículos, que contienen el ovocito gonadal rodeado de células estromales de la granulosa1. Todos los folículos ya se forman durante el desarrollo fetal, alcanzando su punto máximo alrededor de las 20 semanas de edad gestacional, seguido de una disminución exponencial. Al nacer, 1-2 millones de folículos primordiales permanecen dentro de la corteza, y solo unos pocos cientos de miles de folículos sobreviven hasta la pubertad2. El acervo de folículos que no crece, también conocido como reserva ovárica, influye en la fertilidad de la mujer, entre otros factores. La reserva ovárica reside dentro de la corteza y se mueve hacia la médula a medida que los folículos crecen y maduran. Algunos investigadores reconocen que la reserva ovárica está compuesta únicamente por folículos primordiales, mientras que otros incluyen todos los folículos unilaminares (es decir, primordial, intermediario y primario)3,4,5,6. Durante la vida de una mujer, solo 300-400 folículos maduran y sobreviven para finalmente sufrir la ovulación. La menopausia comienza cuando el número de folículos desciende a alrededor de mil, lo que generalmente ocurre alrededor de los 50 años de edad 2,7. Actualmente existe un debate en curso sobre la presencia de células madre oogoniales (OSC) en ovarios humanos adultos que pueden formar ovocitos después de un xenotrasplante. Algunos estudios sugieren aislar células que expresan un perfil genético de células germinales primitivas y se diferencian en ovocitos 8,9, mientras que otros indican que las supuestas OSC son células perivasculares de los vasos sanguíneos 10,11,12.
La insuficiencia ovárica prematura (IOP) se define por la interrupción del ciclo menstrual con niveles elevados de FSH antes de los 40 años13. Las causas de la IOP son multifactoriales y pueden ocurrir de forma idiopática; sin embargo, a menudo surge como resultado de condiciones médicas14. Por ejemplo, ciertas condiciones genéticas congénitas se asocian con POI debido a una reserva ovárica reducida ya en el nacimiento, como el síndrome de Turner15. La POI también puede ocurrir como un efecto secundario de los tratamientos gonadotóxicos, lo cual es particularmente problemático en pacientes muy jóvenes, ya que puede conducir a una incapacidad para experimentar una pubertad normal y afectar drásticamente la reserva ovárica. Dependiendo del riesgo de IOP y de la edad de la paciente, existen varias opciones de preservación de la fertilidad, como la criopreservación de ovocitos maduros, la criopreservación de embriones después de la fertilización in vitro y la criopreservación de tejido ovárico (OTC). Para los pacientes prepúberes, la OTC es la única opción factible debido a su inmadurez sexual 16,17. En los Estados Unidos, la preservación de la fertilidad a través de OTC ha sido considerada recientemente como una rutina clínica aceptable18. Sin embargo, la OTC todavía se considera experimental en muchos países europeos, y se requiere aprobación ética, particularmente para el autotrasplante19,20. Por lo tanto, los criterios de inclusión para los protocolos de venta libre deben considerarse cuidadosamente y se debe realizar un análisis de riesgo-beneficio para cada paciente. No todos los niños que reciben terapias gonadotóxicas son elegibles para la preservación de la fertilidad. En Suecia, solo se recomienda que los pacientes con riesgo alto o muy alto se sometan a la preservación de la fertilidad de acuerdo con las directrices sobre la preservación de la fertilidad de la Sociedad Nórdica de Hematología y Oncología Pediátrica21. Este grupo incluye (1) niños prepúberes y pospúberes que requieren trasplante de células madre o que reciben radioterapia con el ovario en el campo de rango, y (2) niños pospúberes con dosis acumulativas altas de quimioterapia alquilante. Para las niñas antes de la menarquia, los criterios de inclusión para el riesgo muy alto de infertilidad incluyen aquellas tratadas con cualquiera de los siguientes tratamientos: dosis de radiación >10 Gy al ovario, o terapia alogénica o autóloga con células madre hematopoyéticas (TCMH). Los criterios de exclusión incluyen a aquellos que necesitan productos sanguíneos adicionales para otras preparaciones anticoagulantes antes de la cirugía o que tienen un recuento de neutrófilos <1. Para las niñas/mujeres después de la menarquia, los criterios de inclusión para riesgo alto o muy alto de infertilidad incluyen aquellas tratadas con cualquiera de los siguientes tratamientos: dosis de radiación >10 Gy al ovario, o TCMH alogénico, ciclofosfamida >9 g/m², ifosfamida >60 g/m², procarbazina o compuestos de nitrosourea (BCNU/CCNU) >360 mg/m². Los criterios de exclusión incluyen aquellos con un mayor riesgo de sangrado, mayor riesgo de infección, mayor riesgo de complicaciones quirúrgicas o mayor riesgo de problemas de dolor según lo evaluado por el médico a cargo.
En el caso de la venta libre, el tejido ovárico se recolecta durante las cirugías abdominales mediante laparotomía o laparoscopia mediante ooforectomía unilateral o biopsia. La médula se extrae del tejido ovárico recolectado y la corteza restante se secciona en fragmentos más pequeños para la criopreservación mediante congelación o vitrificación a tasa controlada para su uso posterior en la restauración de la fertilidad22. Luego, las muestras se almacenan en nitrógeno líquido hasta que la paciente se recupera de su tratamiento y desea formar una familia. Dependiendo del tipo de cáncer y en ausencia de contraindicaciones para el trasplante de tejido ovárico, el tejido se descongela y se autoinjerta para restaurar la función hormonal y ovárica. La OTC ha demostrado ser exitosa, con una tasa de embarazo del 50% y más de 200 nacidos vivos reportados después del injerto de tejido ovárico criopreservado recolectado durante la edad adulta 23,24,25. Los nacidos vivos reportados después del autotrasplante de tejido ovárico recolectado durante la infancia son pocos, y ninguno ha sido reportado después del autotrasplante de tejido ovárico indudablemente prepuberal 26,27,28,29,30. La calidad de los tejidos es un requisito previo para el éxito de la restauración de la fertilidad31. Por lo tanto, es fundamental estudiar la calidad de las muestras de tejido recolectadas.
En la actualidad, una forma de estimar la calidad del tejido ovárico es a través de cortes histológicos y recuento manual de los folículos. Sin embargo, es difícil evaluar la normalidad de la densidad folicular debido a la disminución natural de la reserva con el aumento de la edad y a la distribución heterogénea de los folículos. Además, la comparación con los valores de referencia es un desafío, ya que no están estandarizados para el tamaño y la edad de la biopsia. Otras opciones de evaluación, como los niveles séricos de AMH o la tinción del tejido digerido con calceína o rojo neutro, no están bien establecidas o tienen sus propias limitaciones. Wallace y Kelsey publicaron previamente un modelo de reserva ovárica normal a lo largo de la edad mediante la recopilación de datos sobre el número de folículos de ovarios enteros de pacientes sin patologías ováricas conocidas2. Además, dado que las biopsias no son representativas de todo el ovario, Schmidt et al. desarrollaron un método para estimar el número total de folículos basado en biopsias corticales32. Utilizando una versión modificada de este método y el modelo de reserva ovárica normal, se estableció un conjunto de datos de referencia para la densidad de folículos de mujeres de 0 a 25 años33.
Este artículo describe la estrategia para evaluar la normalidad de la densidad de folículos basada en muestras ováricas pequeñas mediante (1) la cuantificación directa de los folículos mediante histología y (2) la comparación de los resultados con referencias estándar normalizadas por edad a través de puntuaciones Z. El uso de puntuaciones Z describe la relación de la densidad de folículos de una biopsia ovárica con una media de grupo de referencia estandarizada por edad y tamaño. Esto será de gran valor para los médicos a la hora de aconsejar a sus pacientes para el autotrasplante y el tratamiento posterior después de la preservación de la fertilidad.
Protocolo
Todos los procedimientos realizados fueron aprobados por la Autoridad Sueca de Revisión Ética (pacientes de Sveafertil, Dnr: 2019-03802) y por el Comité de Ética del Hospital Universitario de Helsinki (pacientes con HCH, Dnr 340/13/03/03/2015). Las enfermeras investigadoras proporcionaron información escrita y oral sobre el estudio y se obtuvo el consentimiento informado de acuerdo con la Declaración de Helsinki. Para los pacientes menores de 18 años, se obtuvo el consentimiento informado de los tutores legales. Todas las muestras fueron seudonimizadas y procesadas de acuerdo con el Reglamento General de Protección de Datos (RGPD) europeo. Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Recolección y procesamiento de tejido ovárico
NOTA: Identifique a todos los pacientes elegibles para la preservación de la fertilidad cuando exista una indicación de un riesgo alto o muy alto de infertilidad siguiendo las pautas locales (p. ej., pautas específicas nórdicas, europeas o internacionales). En Europa, reclutar pacientes menores de edad solo como parte de los programas de investigación de preservación de la fertilidad. Determine el riesgo de infertilidad utilizando las directrices de su país para la preservación de la fertilidad.
- Realizar el procedimiento quirúrgico bajo anestesia general. Administrar propofol (2 mg/kg) por vía intravenosa, sufentanilo (0,5 microgramos/kg) y bromuro de rocuronio (0,6 mg/kg) para la inducción de la anestesia.
- Intubar y ventilar al paciente con un volumen corriente de 6-8 mL/kg y una presión espiratoria positiva de 6-8 cm deH2O. Administrar sevoflurano al 1% a 2% a través del tubo endotraqueal para mantener la anestesia inhalatoria.
- Mantener el bloqueo neuromuscular con bromuro de rocuronio (0,15 mg/kg) durante el procedimiento quirúrgico para proporcionar una adecuada relajación muscular y permitir la laparoscopia a presiones de insuflación intraabdominal más bajas.
- Utilice el índice biespectral para guiar la profundidad anestésica y facilitar el despertar rápido con una dosis de anestésico reducida. Antagonizar el bloqueo neuromuscular residual con sugammadex (2-4 mg/kg).
- Utilizando una técnica de tres puertos, se inserta un trócar de 10 mm en la cavidad peritoneal en el ombligo para introducir una lente óptica con una cámara acoplada, y dos trócares de 5 mm en las regiones ilíacas izquierda y derecha (2 cm por encima y 2 cm medial a la respectiva columna ilíaca anterosuperior) bajo visión directa para la instrumentación quirúrgica y la extracción de tejido. Inspeccionar los órganos pélvicos, incluidos ambos ovarios, para confirmar la normalidad.
- Identifique el ovario al que es más fácil acceder y luego agárrelo. Corte un volumen que sea aproximadamente un tercio del ovario (o como se indique en su permiso ético), luego use diatermia, si es necesario, para asegurar la hemostasia.
NOTA: Realice la biopsia solo si no existen contraindicaciones, como factores de riesgo de hemorragia excesiva intra o postoperatoria o mayor riesgo de infección. Especificar claramente y seguir los criterios de inclusión y exclusión del país. Se puede extraer todo el ovario si el riesgo de infertilidad es muy alto y/o si el riesgo de cortarse solo una parte se considera demasiado alto (por ejemplo, debido a un sangrado). Evite el uso de diatermia antes de recolectar la muestra porque puede dañar el tejido.
- Identifique el ovario al que es más fácil acceder y luego agárrelo. Corte un volumen que sea aproximadamente un tercio del ovario (o como se indique en su permiso ético), luego use diatermia, si es necesario, para asegurar la hemostasia.
- Durante el quirófano, coloque el tejido en un tubo que contenga 5 mL de solución salina tampón de fosfato (PBS) 1x Dulbecco con CaCl2, MgCl2, 1 g/L de D-glucosa, 36 mg/L de piruvato, ya sea calentado a 37 °C si la muestra se procesa inmediatamente en el laboratorio (dentro de los 30 min) o mantenido a 4 °C durante transportes más largos (hasta 24 h).
NOTA: Las soluciones de transporte incluyen una variedad de soluciones de transporte/perfusión de órganos disponibles en el mercado, así como tampones simples como PBS y MEM34. - Corta un pequeño trozo de tejido ovárico (2 mm x 2 mm x 2 mm) de la superficie del ovario. Esta pieza contiene la corteza, que es la porción externa del ovario donde se encuentran los folículos ováricos35.
PRECAUCIÓN: Manipule tejidos humanos, como el ovario, utilizando prácticas y procedimientos de Bioseguridad de Nivel 2.
NOTA: Una unidad especializada en medicina reproductiva criopreserva clínicamente el resto del tejido ovárico para su posible uso futuro en la restauración de la fertilidad de las pacientes. - Coloque el tejido en 350 μL de solución de Bouin a temperatura ambiente durante 2 h o en 350 μL de formaldehído al 4% a 4 °C durante la noche, asegurándose de que el tejido esté completamente sumergido. Después de la incubación, lavar el tejido con etanol al 70% tres veces.
- Para la solución de Bouin, lave hasta que el color amarillo desaparezca. Incruste el tejido en cera de parafina36. Corte un mínimo de 30 secciones de tejido en serie con un grosor de 4 μm y colóquelas en portaobjetos de vidrio.
PRECAUCIÓN: Manipule la solución de Bouin y el formaldehído dentro de una cubierta química y con el equipo de protección adecuado.
NOTA: El formaldehído puede provocar artefactos relacionados con la contracción en el tejido. Por lo tanto, la solución de Bouin es la opción preferida para preservar la histología. Sin embargo, la solución de Bouin conlleva riesgos adicionales, lo que lleva a varias instituciones a preferir el uso de formaldehído37.
- Para la solución de Bouin, lave hasta que el color amarillo desaparezca. Incruste el tejido en cera de parafina36. Corte un mínimo de 30 secciones de tejido en serie con un grosor de 4 μm y colóquelas en portaobjetos de vidrio.
2. Tinción de hematoxilina y eosina (H&E)
- Pesa 5 g de polvo de eosina Y en un frasco de vidrio esterilizado en autoclave de 100 ml. Agregue 800 mL de etanol al 95% y 200 mL de agua desionizada para hacer una solución madre de eosina al 0,5%. Prepare una solución de trabajo de eosina al 0,25% diluyendo 200 ml de la solución madre de eosina al 0,5% con 160 ml de etanol al 100%, 1 ml de ácido acético y 40 ml de agua desionizada.
NOTA: Es posible que el polvo no se disuelva por completo. Filtre la solución antes de usar para reducir el precipitado. - Coloque los portaobjetos en estantes. Sumerja la rejilla con correderas en los recipientes correspondientes en el siguiente orden: 15 min en xileno, 5 min en etanol al 100%, sumérjalo 10 veces en etanol al 70%, sumérjalo 10 veces en etanol al 50% y luego sumérjalo 10 veces en agua desionizada.
- Sumerja la rejilla con portaobjetos en solución de hematoxilina durante 3 minutos, luego transfiera la rejilla con portaobjetos a un recipiente con agua destilada del grifo durante 30 s para lavar el exceso de mancha de hematoxilina.
- Coloque la rejilla con portaobjetos en un recipiente con solución de diferenciación (1 mL de HCl al 37% añadido a 100 mL de etanol al 70%) durante 1 min, luego transfiera la rejilla con portaobjetos a un recipiente con agua destilada del grifo durante 30 s.
NOTA: Asegúrese de que las secciones de tejido estén sumergidas en el líquido. Agregue más reactivo al recipiente si es necesario. Cambie el xileno después de cada 5 usos cuando tiña grandes cantidades. Prepare etanol al 50% diluyendo etanol al 70% (por ejemplo, agregue 35 mL de etanol al 70% a 15 mL de DPBS para hacer 50 mL de etanol al 50%).
PRECAUCIÓN: Manipule el xileno dentro de una capucha y con el equipo de protección adecuado.
- Coloque la rejilla con portaobjetos en el agua del grifo de Scott (también conocida como solución azulada) durante 30-60 s, luego transfiera la rejilla con portaobjetos a un recipiente con agua del grifo destilada durante 30 s. Sumerja la rejilla con portaobjetos en la solución de trabajo de eosina durante 1 min.
- Deshidratar los portaobjetos colocándolos en los siguientes reactivos: etanol al 100% durante 30 s, un segundo recipiente con etanol al 100% durante 30 s y luego sumergir dos veces en xileno. Después de retirar la rejilla de la solución de xileno, déjela secar en un recipiente de vidrio para evitar que el xileno gotee dentro de la campana.
- Monte la corredera con 2 gotas de solución de montaje. Coloque con cuidado las correderas de la cubierta para evitar burbujas y deje que la solución de montaje se seque.
PRECAUCIÓN: Manipule el xileno dentro de una capucha y con el equipo de protección adecuado.
- Digitalice las diapositivas escaneándolas con escáneres de diapositivas si es posible. Si esta opción no está disponible, utilice un microscopio invertido normal con un aumento de 20-40x para contar directamente los folículos. Asegúrese de tomar una imagen de toda la biopsia para facilitar la medición del área en el software de análisis de imágenes.
3. Recuento de folículos
- Si las diapositivas se digitalizaron, abra los archivos con el software adecuado (por ejemplo, el software de código abierto QuPath38). En caso de no estar digitalizado, realizar el análisis directamente utilizando un microscopio invertido y su respectivo software.
- Arrastre el archivo a la ventana principal de QuPath. Establezca el tipo de imagen en Brightfield H&E (consulte la Figura 1A). Defina 1 mm del epitelio de la superficie (una sola capa de células cuboidales que recubren la superficie) utilizando la barra de escala. Haga clic en la herramienta elipse y anote los folículos (consulte la Figura 1B).
- Cuente el número de folículos dentro de esta área de 1 mm, desde la etapa primordial hasta la primaria. Identifique la etapa de cada folículo (primordial: una capa de células granulosas aplanadas que rodea al ovocito; etapa intermedia: una mezcla de células granulosas aplanadas y cuboidales; primaria: una capa completa de células granulosas cuboidales que rodean el ovocito).
- Ingrese el ID de la muestra, la edad, el número de folículos para cada portaobjetos, el grosor de la sección y la nésima sección contada en la hoja denominada Folículo enmm 3 en el archivo de Excel de la calculadora de puntuación Z del folículo (consulte el Archivo complementario 1 y la Figura 2A).
NOTA: Debido al diámetro de los folículos (folículos más pequeños >35 μm), el mismo folículo puede aparecer en secciones consecutivas. Tenga mucho cuidado al contar secciones en las que la distancia entre secciones sea menor que el diámetro del folículo. Preferiblemente, cuente los folículos de cada10 secciones ( por ejemplo, sección # 10, # 20, # 30). El epitelio de la superficie puede desprenderse durante el procesamiento del tejido y puede estar solo parcialmente presente en los portaobjetos. Cuente solo los folículos con citoplasma visible. Para el control de calidad, haga que dos personas cuenten los folículos de forma independiente y determinen qué tan bien se alinean sus recuentos. Calcule la concordancia entre observadores utilizando una función de correlación simple entre los recuentos de folículos de cada observador para la misma muestra.
- Identifique el 10% más grande de los folículos en cada sección contada mediante la observación ocular. Mida el diámetro medio de estos ovocitos haciendo clic en la herramienta de línea , dibujando dos líneas perpendiculares a través de la membrana del ovocito y seleccionando Medir, luego Mostrar medidas de anotación (ver Figura 1C).
- Registre las mediciones en la columna Longitud μm (consulte la figura 1D). Introduzca el diámetro medio de todos los ovocitos en el campo Diámetro medio del ovocito (μm) para cada portaobjetos en el archivo de Excel de la calculadora de puntuación Z del folículo (Folículo en mm3, ver Archivo complementario 1 y Figura 2A).
- Coloque la imagen en el centro de la pantalla en QuPath, luego haga clic en el icono ImageJ . Seleccione Enviar instantánea a ImageJ (consulte la figura 3A). En ImageJ, demarque 1 mm del borde con la herramienta de pincel . Haga clic en la imagen, luego en Tipo y seleccione 8 bits (consulte la Figura 3B).
- Haga clic en la herramienta de línea , dibuje una línea en la barra de escala en la parte inferior izquierda de la pantalla (consulte la Figura 3C). Haga clic en Analizar, luego en Establecer escala, ingrese la longitud indicada en la barra de escala en el campo Distancia conocida y haga clic en Aceptar (consulte la Figura 3C). Haga clic en Imagen, luego en Ajustar, Brillo/Contraste y seleccione Automático (consulte la Figura 3D).
- Haga clic en Imagen, luego en Ajustar, Umbral y seleccione Automático (consulte la Figura 3E). Haga clic en la herramienta de varita , seleccione el área, luego presione Ctrl + M (consulte la Figura 3F). Introduzca el valor del área en el archivo de Excel de la calculadora de puntuación Z del folículo (folículo en mm3, véase el archivo complementario 1 y la figura 2A).
4. Cálculos de densidad de folículos, volumen cortical y puntuación Z
- Utilice el archivo de Excel de la calculadora de puntuación Z del folículo que se proporciona para realizar automáticamente los cálculos que se describen a continuación. Los resultados aparecerán en la hoja "Z-score (folículo por mm³)" de la calculadora Excel (ver Fichero Complementario 1), siempre que los datos indicados en el apartado 3 se introduzcan en la hoja "folículos en mm³".
- Para calcular las densidades de folículos en estas secciones, se utiliza la fórmula modificada presentada por Schmidt et al.32. En primer lugar, aplique el factor de corrección α para tener en cuenta el doble recuento del mismo folículo. La fórmula modificada es la siguiente:
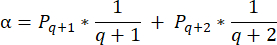
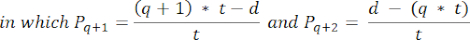
NOTA: En esta fórmula, t es el grosor de la sección, d es el diámetro del ovocito y q es el cociente del diámetro del folículo dividido por el grosor de la sección. - Extrapola el número total de folículos (n folículos) en la corteza a partir del recuento de folículos en la sección usando la siguiente fórmula33:
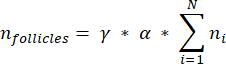
NOTA: Esta fórmula también tiene en cuenta todas las secciones no calculadas. Aquí γ representa el número de secciones que no se calculan (por ejemplo, γ = 10 si se cuenta cada 10secciones ), α es el factor de corrección calculado en 4.1, N es el número de secciones contadas y n i es el número total de folículos en las secciones contadas.- Extrapola todo el volumen cortical (V) de las áreas contadas usando la siguiente fórmula33:
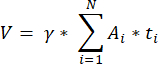
NOTA: Aquí, Ai es el área de la sección, y ti es el grosor del tejido. Consulte el paso 4.2 para ver γ y N. - Utilice la siguiente fórmula33 para calcular la densidad del folículo:
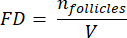
- Extrapola todo el volumen cortical (V) de las áreas contadas usando la siguiente fórmula33:
- Determine si hay una reserva ovárica reducida (<-1,7 Z) calculando la puntuación Z utilizando la fórmula33:
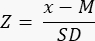
NOTA: La puntuación Z se calcula automáticamente en la hoja "Puntuación Z (folículo por mm³)" en la calculadora de Excel (ver Archivo Complementario 1) en función de la información proporcionada en la Sección 3 (Recuento de folículos) (Figura 2B). En esta fórmula, Z representa la puntuación Z, x es la densidad de folículos calculada (folículos/cm3) de la muestra de estudio (paso 4.4), M es la densidad media de folículos del grupo de edad respectivo y SD es la desviación estándar del grupo de edad respectivo. Los valores de referencia para las mujeres de 0 a 25 años se han establecido en Hassan et al.33. Las medias y desviaciones estándar de las densidades de folículos de los respectivos grupos de edad se pueden encontrar en el archivo de Excel de la calculadora de puntuación Z de folículos (Archivo complementario 1) y se utilizan para los cálculos de la puntuación Z.
Resultados
Los folículos ováricos se cuantifican después de una sección, tinción y escaneo exitosos de los portaobjetos. Se distinguen y analizan las diferentes etapas y la salud de los folículos. En la Figura 4A, se muestra una sección transversal teñida con HE de un ovario fijado a Bouin de un adulto, con ejemplos de tejido cortical y medular. La figura 4B muestra una imagen representativa del ovario de un niño con un ejemplo de...
Discusión
Las mujeres nacen con un grupo finito de ovocitos, que no se pueden reponer. La reserva ovárica es un determinante clave del potencial reproductivo de una mujer. En este artículo se describe un método para la cuantificación histológica de la densidad folicular y su comparación con los estándares de referencia utilizando puntuaciones Z de las densidades de folículos corticales ováricos en pacientes jóvenes y mujeres de hasta 25 años de edad.
En este ...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Nos gustaría agradecer a los profesionales de la salud que nos ayudaron con el reclutamiento de participantes y la recolección de tejidos y a todas las pacientes que donaron su tejido ovárico. También reconocemos al Fondo de Cáncer Infantil (PR2020-0096) y al Instituto Karolinska PhD que financia KID, cuya financiación hizo posible este trabajo. También nos gustaría agradecer al servicio de Análisis de Fenotipos Morfológicos por la preparación de las láminas histológicas. Agradecemos a Nicola Byers por la edición lingüística de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
Referencias
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados