È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Z-Score per la valutazione della riserva ovarica in pazienti giovani sottoposte a preservazione della fertilità
In questo articolo
Riepilogo
Il presente protocollo descrive un metodo per valutare la riserva ovarica in pazienti di età inferiore ai 25 anni che necessitano di preservazione della fertilità attraverso la crioconservazione del tessuto ovarico. Questo metodo comporta: (1) la valutazione istologica della riserva ovarica nei campioni corticali, (2) il confronto con un set di dati di riferimento e (3) il calcolo degli Z-score.
Abstract
Le donne nascono con un pool non rinnovabile di follicoli ovarici, indicato come riserva ovarica. Questa riserva è costituita da follicoli primordiali nelle ovaie e può essere influenzata da molti fattori, come disturbi genetici ed endocrini, interventi medici e interferenti endocrini. La preservazione della fertilità è consigliata quando sono necessari trattamenti gonadotossici. Le opzioni preferite dalle donne sono la crioconservazione degli ovociti e degli embrioni. Tuttavia, in pazienti molto giovani e sessualmente immature, la crioconservazione del tessuto ovarico è l'unica opzione. Conoscere la densità follicolare dei campioni di tessuto crioconservati è essenziale nella consulenza sulla fertilità per i giovani pazienti. Questo protocollo dimostra l'uso dei punteggi Z per la densità dei follicoli corticali come strumento per valutare la qualità del tessuto ovarico nelle ragazze e nelle giovani donne di età pari o inferiore a 25 anni che sono sottoposte a conservazione della fertilità. La densità dei follicoli nei campioni dei pazienti viene confrontata con gli standard di riferimento normalizzati per età, sviluppati da Hassan et al. per stimare possibili deviazioni dallo standard. La densità dei follicoli viene misurata attraverso la quantificazione istologica. Per questo, un piccolo pezzo di tessuto corticale ovarico (~2 mm x 2 mm x 2 mm) viene fissato in una soluzione di Bouin o di formaldeide, incorporato in paraffina, sezionato a 4 μm di spessore, colorato con ematossilina ed eosina e digitalizzato utilizzando uno scanner per vetrini. Gli stadi follicolari presenti nella corteccia vanno dai follicoli primordiali a quelli primari. L'area corticale era a 1 mm dall'epitelio superficiale sulle sezioni istologiche. La densità follicolare viene calcolata utilizzando una formula modificata presentata da Schmidt et al. e il punteggio Z viene determinato utilizzando la media di riferimento e la deviazione standard. Lo Z-score indica quanto il valore misurato si discosta dalla media di riferimento, determinando una riserva ovarica ridotta (<-1,7 Z-score). Con questo metodo, la densità dei follicoli può essere utilizzata come misura preziosa della riserva ovarica per le pazienti giovani che necessitano di preservazione della fertilità.
Introduzione
L'ovaio è un organo dinamico, endocrinologicamente attivo, costituito da una corteccia esterna e da un midollo interno. Eterogeneamente distribuiti all'interno delle ovaie sono i follicoli, che contengono l'ovocita gonadico circondato da cellule della granulosa stromale1. Tutti i follicoli si formano già durante lo sviluppo fetale, con un picco intorno alle 20 settimane di età gestazionale, seguito da un declino esponenziale. Alla nascita, 1-2 milioni di follicoli primordiali rimangono all'interno della corteccia e solo poche centinaia di migliaia di follicoli sopravvivono fino alla pubertà2. Il pool di follicoli non in crescita, noto anche come riserva ovarica, influenza la fertilità di una donna, tra gli altri fattori. La riserva ovarica risiede all'interno della corteccia e si sposta nel midollo man mano che i follicoli crescono e maturano. Alcuni ricercatori riconoscono che la riserva ovarica è composta solo da follicoli primordiali, mentre altri includono tutti i follicoli unilaminari (cioè primordiali, intermedi e primari)3,4,5,6. Durante la vita di una donna, solo 300-400 follicoli maturano e sopravvivono per andare incontro all'ovulazione. La menopausa inizia quando il numero di follicoli scende a circa mille, che in genere si verifica intorno ai 50 anni di età 2,7. Attualmente è in corso un dibattito sulla presenza di cellule staminali oogoniali (OSC) nelle ovaie umane adulte che possono formare ovociti dopo lo xenotrapianto. Alcuni studi suggeriscono di isolare cellule che esprimono un profilo genico di cellule germinali primitive e si differenziano in ovociti 8,9, mentre altri indicano che le presunte OSC sono cellule perivascolari dei vasi sanguigni 10,11,12.
L'insufficienza ovarica prematura (POI) è definita dall'interruzione del ciclo mestruale con livelli elevati di FSH prima dei 40 anni e13 anni. Le cause dei POI sono multifattoriali e possono verificarsi in modo idiopatico; Tuttavia, spesso insorge a causa di condizioni mediche14. Ad esempio, alcune condizioni genetiche congenite sono associate alla POI a causa di una ridotta riserva ovarica già alla nascita, come la sindrome di Turner15. La POI può verificarsi anche come effetto collaterale dei trattamenti gonadotossici, che è particolarmente problematica nelle pazienti molto giovani in quanto può portare all'incapacità di sottoporsi alla normale pubertà e compromettere drasticamente la riserva ovarica. A seconda del rischio di POI e dell'età della paziente, sono disponibili diverse opzioni di conservazione della fertilità, come la crioconservazione di ovociti maturi, la crioconservazione di embrioni dopo fecondazione in vitro e la crioconservazione del tessuto ovarico (OTC). Per i pazienti in età pre-puberale, l'OTC è l'unica opzione praticabile a causa della loro immaturità sessuale16,17. Negli Stati Uniti, la preservazione della fertilità attraverso l'OTC è stata recentemente considerata una routine clinica accettabile18. Tuttavia, l'OTC è ancora considerato sperimentale in molti paesi europei ed è necessaria un'approvazione etica, in particolare per l'autotrapianto19,20. Pertanto, i criteri di inclusione per i protocolli OTC devono essere attentamente considerati e deve essere eseguita un'analisi rischio-beneficio per ciascun paziente. Non tutti i bambini che ricevono terapie gonadotossiche sono idonei per la conservazione della fertilità. In Svezia, solo i pazienti con rischio alto o molto alto sono raccomandati di sottoporsi alla preservazione della fertilità in conformità con le linee guida sulla preservazione della fertilità della Nordic Society of Paediatric Haematology and Oncology21. Questo gruppo comprende (1) bambini pre e post-puberi che necessitano di trapianto di cellule staminali o sottoposti a radioterapia con l'ovaio nel campo del range e (2) bambini post-puberali con alte dosi cumulative di chemioterapia alchilante. Per le ragazze prima del menarca, i criteri di inclusione per un rischio molto elevato di infertilità includono quelle trattate con una delle seguenti: dose di radiazioni >10 Gy all'ovaio o terapia allogenica o autologa con cellule staminali ematopoietiche (HSCT). I criteri di esclusione includono coloro che necessitano di emoderivati aggiuntivi per altri preparati anticoagulanti prima dell'intervento chirurgico o hanno una conta dei neutrofili <1. Per le ragazze/donne dopo il menarca, i criteri di inclusione per un rischio alto o molto alto di infertilità includono quelle trattate con uno dei seguenti: dose di radiazioni >10 Gy all'ovaio, HSCT allogenico, ciclofosfamide >9 g/m², ifosfamide >60 g/m², procarbazina o composti nitrosourea (BCNU/CCNU) >360 mg/m². I criteri di esclusione includono quelli con un aumentato rischio di sanguinamento, un aumento del rischio di infezione, un aumento del rischio di complicanze chirurgiche o un aumento del rischio di problemi di dolore come valutato dal medico responsabile.
Per l'OTC, il tessuto ovarico viene raccolto durante gli interventi chirurgici addominali mediante laparotomia o laparoscopia mediante ovariectomia unilaterale o biopsia. Il midollo viene rimosso dal tessuto ovarico raccolto e la corteccia rimanente viene quindi sezionata in frammenti più piccoli per la crioconservazione attraverso il congelamento o la vitrificazione a velocità controllata per un uso successivo nel ripristino della fertilità22. I campioni vengono quindi conservati in azoto liquido fino a quando la paziente non si riprende dal trattamento e desidera creare una famiglia. A seconda del tipo di cancro e in assenza di controindicazioni al trapianto di tessuto ovarico, il tessuto viene quindi scongelato e autotrapiantato per ripristinare la funzione ormonale e ovarica. L'OTC si è dimostrata efficace, con un tasso di gravidanza del 50% e più di 200 nati vivi riportati dopo l'innesto di tessuto ovarico crioconservato raccolto durante l'età adulta 23,24,25. I nati vivi riportati dopo l'autotrapianto di tessuto ovarico raccolto durante l'infanzia sono pochi, e nessuno è stato riportato dopo l'autotrapianto di tessuto ovarico indubbiamente pre-puberale 26,27,28,29,30. La qualità dei tessuti è un prerequisito per il successo del ripristino della fertilità31. Pertanto, è essenziale studiare la qualità dei campioni di tessuto raccolti.
Attualmente, un modo per stimare la qualità del tessuto ovarico è attraverso sezioni istologiche e il conteggio manuale dei follicoli. Tuttavia, valutare la normalità della densità follicolare è difficile a causa del naturale declino della riserva con l'aumentare dell'età e della distribuzione eterogenea dei follicoli. Inoltre, il confronto con i valori di riferimento è impegnativo in quanto non sono standardizzati per le dimensioni e l'età della biopsia. Altre opzioni di valutazione, come i livelli sierici di AMH o la colorazione del tessuto digerito con calceina o rosso neutro, non sono ben consolidate o presentano i propri limiti. Wallace e Kelsey hanno precedentemente pubblicato un modello di riserva ovarica normale nel corso dell'età raccogliendo dati sul numero di follicoli da ovaie intere di pazienti senza patologie ovariche note2. Inoltre, poiché le biopsie non sono rappresentative dell'intera ovaia, Schmidt et al. hanno sviluppato un metodo per stimare il numero totale di follicoli basato su biopsie corticali32. Utilizzando una versione modificata di questo metodo e il modello di riserva ovarica normale, è stato stabilito un set di dati di riferimento per la densità follicolare delle donne di età compresa tra 0 e 25 anni33.
Questo articolo descrive la strategia per valutare la normalità della densità follicolare sulla base di piccoli campioni ovarici mediante (1) quantificazione diretta dei follicoli utilizzando l'istologia e (2) confronto dei risultati con riferimenti standard normalizzati per età tramite punteggi Z. L'uso degli Z-score descrive la relazione tra la densità follicolare di una biopia ovarica e una media di gruppo di riferimento standardizzata per età e dimensioni. Questo sarà di grande valore per i medici nel consigliare i loro pazienti per l'autotrapianto e ulteriori trattamenti dopo la conservazione della fertilità.
Protocollo
Tutte le procedure condotte sono state approvate dall'Autorità svedese per la revisione etica (pazienti Sveafertil, Dnr: 2019-03802) e dal Comitato Etico dell'Ospedale Universitario di Helsinki (pazienti HCH, Dnr 340/13/03/03/2015). Le informazioni scritte e orali sullo studio sono state fornite dagli infermieri di ricerca e il consenso informato è stato ottenuto in conformità con la Dichiarazione di Helsinki. Per i pazienti di età inferiore ai 18 anni, il consenso informato è stato ottenuto dai tutori legali. Tutti i campioni sono stati pseudonimizzati ed elaborati secondo il Regolamento generale europeo sulla protezione dei dati (GDPR). I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Raccolta e lavorazione del tessuto ovarico
NOTA: Identificare tutti i pazienti idonei per la conservazione della fertilità quando vi è un'indicazione per un rischio alto o molto alto di infertilità seguendo le linee guida locali (ad esempio, linee guida specifiche nordiche, europee o internazionali). In Europa, reclutare pazienti minorenni solo come parte di programmi di ricerca sulla preservazione della fertilità. Determina il rischio di infertilità utilizzando le linee guida del tuo paese per la conservazione della fertilità.
- Eseguire la procedura chirurgica in anestesia generale. Somministrare propofol per via endovenosa (2 mg/kg), sufentanil (0,5 microgrammi/kg) e rocuronio bromuro (0,6 mg/kg) per l'induzione dell'anestesia.
- Intubare e ventilare il paziente con un volume corrente di 6-8 ml/kg e una pressione espiratoria positiva di 6-8 cm di H2O. Erogare sevoflurano dall'1% al 2% attraverso il tubo endotracheale per mantenere l'anestesia per inalazione.
- Mantenere il blocco neuromuscolare con rocuronio bromuro (0,15 mg/kg) durante la procedura chirurgica per fornire un adeguato rilassamento muscolare e consentire la laparoscopia a pressioni di insufflazione intra-addominali più basse.
- Utilizzare l'indice bispettrale per guidare la profondità dell'anestetico per facilitare un rapido risveglio con una dose ridotta di anestetico. Antagonizzare il blocco neuromuscolare residuo con sugammadex (2-4 mg/kg).
- Utilizzando una tecnica a tre porte, inserire un trocar da 10 mm nella cavità peritoneale all'ombelico per introdurre una lente ottica con una telecamera collegata e due trocar da 5 mm nelle regioni iliache sinistra e destra (2 cm sopra e 2 cm medialmente alla rispettiva spina iliaca antero-superiore) sotto visione diretta per la strumentazione chirurgica e il prelievo dei tessuti. Ispezionare gli organi pelvici, comprese entrambe le ovaie, per confermare la normalità.
- Identifica l'ovaio di più facile accesso, quindi afferrala. Taglia un volume che sia circa un terzo dell'ovaio (o come indicato nel tuo permesso etico), quindi usa la diatermia, se necessario, per garantire l'emostasi.
NOTA: Eseguire la biopsia solo se non ci sono controindicazioni, come fattori di rischio per un'eccessiva emorragia intra o post-operatoria o un aumento del rischio di infezione. Specificare chiaramente e seguire i criteri di inclusione ed esclusione del paese. L'intera ovaia può essere prelevata se il rischio di infertilità è molto alto e/o il rischio di tagliare solo una parte è considerato troppo alto (ad esempio, a causa di sanguinamento). Evitare di utilizzare la diatermia prima di prelevare il campione perché può danneggiare il tessuto.
- Identifica l'ovaio di più facile accesso, quindi afferrala. Taglia un volume che sia circa un terzo dell'ovaio (o come indicato nel tuo permesso etico), quindi usa la diatermia, se necessario, per garantire l'emostasi.
- In sala operatoria, posizionare il tessuto in una provetta contenente 5 mL di 1x Soluzione Tampone Fosfato di Dulbecco (PBS) con CaCl2, MgCl2, 1 g/L di D-glucosio, 36 mg/L di piruvato, riscaldato a 37 °C se il campione viene immediatamente processato in laboratorio (entro 30 minuti) o mantenuto a 4 °C durante i trasporti più lunghi (fino a 24 ore).
NOTA: Le soluzioni di trasporto includono una serie di soluzioni di trasporto/perfusione di organi disponibili in commercio, nonché semplici tamponi come PBS e MEM34. - Tagliare un piccolo pezzo di tessuto ovarico (2 mm x 2 mm x 2 mm) dalla superficie dell'ovaio. Questo pezzo contiene la corteccia, che è la parte esterna dell'ovaio dove si trovano i follicoli ovarici35.
ATTENZIONE: Maneggiare i tessuti umani come l'ovaio utilizzando pratiche e procedure di biosicurezza di livello 2.
NOTA: Un'unità specializzata in medicina riproduttiva crioconserva clinicamente il resto del tessuto ovarico per un potenziale uso futuro nel ripristino della fertilità delle pazienti. - Porre il tessuto in 350 μL di soluzione di Bouin a temperatura ambiente per 2 ore o in 350 μL di formaldeide al 4% a 4 °C per una notte, assicurandosi che il tessuto sia completamente sommerso. Dopo l'incubazione, lavare il fazzoletto con etanolo al 70% tre volte.
- Per la soluzione di Bouin, lavare fino a quando il colore giallo scompare. Incorporare il fazzoletto nella cera di paraffina36. Tagliare un minimo di 30 sezioni di tessuto seriali con uno spessore di 4 μm e posizionarle su vetrini.
ATTENZIONE: Maneggiare la soluzione di Bouin e la formaldeide all'interno di una cappa chimica e con adeguati dispositivi di protezione.
NOTA: La formaldeide potrebbe portare ad artefatti legati al restringimento nel tessuto. La soluzione di Bouin è quindi la scelta preferita per preservare l'istologia. Tuttavia, la soluzione di Bouin comporta ulteriori rischi, portando diverse istituzioni a preferire l'uso della formaldeide37.
- Per la soluzione di Bouin, lavare fino a quando il colore giallo scompare. Incorporare il fazzoletto nella cera di paraffina36. Tagliare un minimo di 30 sezioni di tessuto seriali con uno spessore di 4 μm e posizionarle su vetrini.
2. Colorazione con ematossilina ed eosina (H&E)
- Pesare 5 g di polvere di eosina Y in un flacone di vetro autoclavato da 100 ml. Aggiungere 800 mL di etanolo al 95% e 200 mL di acqua deionizzata per ottenere una soluzione madre di eosina allo 0,5%. Preparare una soluzione di lavoro di eosina allo 0,25% diluendo 200 mL della soluzione madre di eosina allo 0,5% con 160 mL di etanolo al 100%, 1 mL di acido acetico e 40 mL di acqua deionizzata.
NOTA: La polvere potrebbe non dissolversi completamente. Filtrare la soluzione prima dell'uso per ridurre il precipitato. - Posizionare i vetrini nelle rastrelliere. Immergere la griglia con i vetrini nei contenitori corrispondenti nel seguente ordine: 15 minuti in xilene, 5 minuti in etanolo al 100%, immergere 10 volte in etanolo al 70%, immergere 10 volte in etanolo al 50% e quindi immergere 10 volte in acqua deionizzata.
- Immergere il rack con i vetrini in una soluzione di ematossilina per 3 minuti, quindi trasferire il rack con i vetrini in un contenitore con acqua di rubinetto distillata per 30 s per lavare via la macchia di ematossilina in eccesso.
- Posizionare il rack con i vetrini in un contenitore con soluzione di differenziazione (1 mL di HCl al 37% aggiunto a 100 mL di etanolo al 70%) per 1 minuto, quindi trasferire il rack con i vetrini in un contenitore con acqua di rubinetto distillata per 30 s.
NOTA: Assicurarsi che le sezioni di tessuto siano immerse nel liquido. Se necessario, aggiungere altro reagente al contenitore. Cambiare lo xilene ogni 5 utilizzi quando si colorano grandi quantità. Preparare etanolo al 50% diluendo etanolo al 70% (ad esempio, aggiungere 35 mL di etanolo al 70% a 15 mL di DPBS per ottenere 50 mL di etanolo al 50%).
ATTENZIONE: Maneggiare lo xilene all'interno di una cappa e con adeguati dispositivi di protezione.
- Posizionare il rack con i vetrini nell'acqua del rubinetto di Scott (nota anche come soluzione bluing) per 30-60 s, quindi trasferire il rack con i vetrini in un contenitore con acqua di rubinetto distillata per 30 s. Immergere la griglia con i vetrini nella soluzione di lavoro eosina per 1 minuto.
- Disidratare i vetrini inserendoli nei seguenti reagenti: etanolo al 100% per 30 s, un secondo contenitore con etanolo al 100% per 30 s, quindi immergerli due volte nello xilene. Dopo aver tolto la griglia dalla soluzione di xilene, lasciarla asciugare in un contenitore di vetro per evitare che lo xilene goccioli all'interno della cappa.
- Montare la guida con 2 gocce di soluzione di montaggio. Posizionare con cura le guide del coperchio per evitare bolle e lasciare asciugare la soluzione di montaggio.
ATTENZIONE: Maneggiare lo xilene all'interno di una cappa e con adeguati dispositivi di protezione.
- Digitalizza le diapositive scansionandole utilizzando gli scanner per diapositive, se possibile. Se questa opzione non è disponibile, utilizzare un normale microscopio invertito con ingrandimento 20-40x per contare direttamente i follicoli. Assicurarsi di acquisire un'immagine dell'intera biopsia per facilitare la misurazione dell'area nel software di analisi delle immagini.
3. Conteggio dei follicoli
- Se le diapositive sono state digitalizzate, aprire i file utilizzando un software appropriato (ad esempio, il software open source QuPath38). Se non digitalizzato, eseguire l'analisi direttamente utilizzando un microscopio invertito e il relativo software.
- Trascina il file nella finestra principale di QuPath. Impostare il tipo di immagine su Campo chiaro H&E (vedere la Figura 1A). Definisci 1 mm dall'epitelio superficiale (un singolo strato di cellule cuboidali che rivestono la superficie) usando la barra della scala. Fare clic sullo strumento ellisse e annotare i follicoli (vedere la Figura 1B).
- Conta il numero di follicoli all'interno di quest'area di 1 mm, dallo stadio primordiale a quello primario. Identificare lo stadio di ciascun follicolo (primordiale - uno strato di cellule della granulosa appiattite che circonda l'ovocita; stadio intermedio - una miscela di cellule della granulosa appiattite e cuboidali; primario - uno strato completo di cellule della granulosa cuboidale che circonda l'ovocita).
- Inserire l'ID del campione, l'età, il numero di follicoli per ciascun vetrino, lo spessore della sezione e l'ennesima sezione conteggiata nel foglio denominato Follicolo in mm3 nel file Excel del calcolatore Z-score del follicolo (vedere il file supplementare 1 e la Figura 2A).
NOTA: A causa del diametro dei follicoli (follicoli più piccoli >35 μm), lo stesso follicolo potrebbe apparire in sezioni consecutive. Prestare particolare attenzione quando si contano le sezioni in cui la distanza tra le sezioni è inferiore al diametro del follicolo. Preferibilmente, contare i follicoli di ogni 10sezioni (ad esempio, sezione #10, #20, #30). L'epitelio superficiale può staccarsi durante il processamento dei tessuti e potrebbe essere presente solo parzialmente nei vetrini. Conta solo i follicoli con citoplasma visibile. Per il controllo di qualità, chiedi a due persone di contare in modo indipendente i follicoli e determinare quanto bene si allineano i loro conteggi. Calcola la concordanza inter-osservatore utilizzando una semplice funzione di correlazione tra i conteggi dei follicoli di ciascun osservatore per lo stesso campione.
- Identificare il 10% più grande dei follicoli in ogni sezione contata osservando a occhio. Misurare il diametro medio di questi ovociti facendo clic sullo strumento linea , tracciando due linee perpendicolari attraverso la membrana dell'ovocita e selezionando Misura, quindi Mostra misure di annotazione (vedi Figura 1C).
- Registrare le misurazioni sotto la colonna Lunghezza μm (vedi Figura 1D). Inserire il diametro medio di tutti gli ovociti nel campo Diametro medio degli ovociti (μm) per ogni vetrino nel file Excel del calcolatore Z-score del follicolo (Follicolo in mm3, vedere il file supplementare 1 e la Figura 2A).
- Posiziona l'immagine al centro dello schermo in QuPath, quindi fai clic sull'icona ImageJ . Selezionare Invia snapshot a ImageJ (vedere la Figura 3A). In ImageJ, demarcate 1 mm dal bordo utilizzando lo strumento pennello . Fare clic sull'immagine, quindi su Digita e selezionare 8 bit (vedere la Figura 3B).
- Fare clic sullo strumento linea , disegnare una linea sulla barra della scala in basso a sinistra dello schermo (vedere la Figura 3C). Fare clic su Analizza, quindi su Imposta scala, inserire la lunghezza indicata nella barra della scala nel campo Distanza nota e fare clic su OK (vedere la Figura 3C). Fare clic su Immagine, quindi su Regola, Luminosità/Contrasto e selezionare Auto (vedere la Figura 3D).
- Fare clic su Immagine, quindi su Regola, Soglia e selezionare Auto (vedere la Figura 3E). Fare clic sullo strumento bacchetta , selezionare l'area, quindi premere Ctrl + M (vedere la Figura 3F). Inserire il valore dell'area nel file Excel del calcolatore Z-score del follicolo (follicolo in mm3, vedere il file supplementare 1 e la Figura 2A).
4. Calcoli della densità follicolare, del volume corticale e dello Z-score
- Utilizzare il file Excel del calcolatore Z-score del follicolo fornito per eseguire automaticamente i calcoli descritti di seguito. I risultati appariranno nella scheda "Z-score (follicolo per mm³)" nella calcolatrice Excel (vedi File supplementare 1), a condizione che i dettagli indicati nella sezione 3 siano inseriti nella scheda "follicoli in mm³".
- Per calcolare le densità dei follicoli in queste sezioni, utilizzare la formula modificata presentata da Schmidt et al.32. Innanzitutto, applica il fattore di correzione α per tenere conto del doppio conteggio dello stesso follicolo. La formula modificata è la seguente:
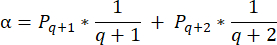
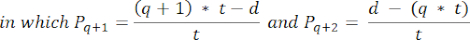
NOTA: In questa formula, t è lo spessore della sezione, d è il diametro dell'ovocita e q è il quoziente del diametro del follicolo diviso per lo spessore della sezione. - Estrapolare il numero totale di follicoli (n follicoli) nella corteccia dal conteggio dei follicoli nella sezione utilizzando la seguente formula33:
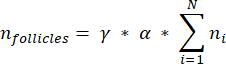
NOTA: questa formula tiene conto anche di tutte le sezioni non calcolate. Qui γ rappresenta il numero di sezioni che non vengono calcolate (ad esempio, γ = 10 se viene contata ogni 10sezioni ), α è il fattore di correzione calcolato in 4.1, N è il numero di sezioni contate e n i è il numero totale di follicoli nelle sezioni contate.- Estrapolare l'intero volume corticale (V) dalle aree contate utilizzando la seguente formula33:
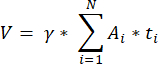
NOTA: Qui, Ai è l'area della sezione e ti è lo spessore del tessuto. Si prega di controllare il passaggio 4.2 per γ e N. - Utilizzare la seguente formula33 per calcolare la densità dei follicoli:
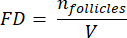
- Estrapolare l'intero volume corticale (V) dalle aree contate utilizzando la seguente formula33:
- Determina se c'è una riserva ovarica ridotta (<-1,7 Z-score) calcolando lo Z-score utilizzando la formula33:
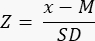
NOTA: Lo Z-score viene calcolato automaticamente nella scheda "Z-score (follicolo per mm³)" nel calcolatore Excel (vedere il file supplementare 1) sulla base delle informazioni fornite nella Sezione 3 (Conteggio dei follicoli) (Figura 2B). In questa formula, Z rappresenta il punteggio Z, x è la densità follicolare calcolata (follicoli/cm3) del campione in studio (passaggio 4.4), M è la densità mediana dei follicoli della rispettiva fascia di età e SD è la deviazione standard della rispettiva fascia di età. I valori di riferimento per le donne di età compresa tra 0 e 25 anni sono stati stabiliti in Hassan et al.33. Le medie e le deviazioni standard delle densità follicolari delle rispettive fasce d'età sono disponibili nel file Excel del calcolatore Z-score dei follicoli (File supplementare 1) e utilizzate per i calcoli dello Z-score.
Risultati
I follicoli ovarici vengono quantificati dopo il sezionamento, la colorazione e la scansione dei vetrini. I diversi stadi e la salute dei follicoli vengono distinti e ulteriormente analizzati. Nella Figura 4A, è mostrata una sezione trasversale colorata con HE di un'ovaia fissata da Bouin di un adulto, con esempi di tessuto corticale e midollare. La Figura 4B mostra un'immagine rappresentativa dell'ovaio di un bambino con un es...
Discussione
Le donne nascono con un pool finito di ovociti, che non possono essere reintegrati. La riserva ovarica è un fattore determinante del potenziale riproduttivo di una donna. Questo articolo delinea un metodo per la quantificazione istologica della densità follicolare e il suo confronto con gli standard di riferimento utilizzando i punteggi Z delle densità dei follicoli corticali ovarici in pazienti giovani e donne fino a 25 anni di età.
In questo protocollo, ...
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Vorremmo ringraziare gli operatori sanitari che ci hanno aiutato con il reclutamento dei partecipanti e la raccolta dei tessuti e tutte le pazienti che hanno donato il loro tessuto ovarico. Ringraziamo anche il Fondo per il cancro infantile (PR2020-0096) e il Karolinska Institutet PhD che finanziano KID, il cui finanziamento ha reso possibile questo lavoro. Si ringrazia inoltre la struttura di Analisi del Fenotipo Morfologico per la preparazione dei vetrini istologici. Ringraziamo Nicola Byers per l'editing linguistico di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
Riferimenti
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon