Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğurganlığın Korunması Uygulanan Genç Hastalarda Yumurtalık Rezervini Değerlendirmek için Z-Skorları
Bu Makalede
Özet
Bu protokol, yumurtalık dokusu kriyoprezervasyonu yoluyla doğurganlığın korunmasına ihtiyaç duyan 25 yaşın altındaki hastalarda yumurtalık rezervinin değerlendirilmesi için bir yöntemi tanımlamaktadır. Bu yöntem şunları içerir: (1) kortikal örneklerde yumurtalık rezervinin histolojik değerlendirmesi, (2) bir referans veri seti ile karşılaştırma ve (3) Z-skorlarının hesaplanması.
Özet
Kadınlar, yumurtalık rezervi olarak adlandırılan, yenilenemeyen bir yumurtalık folikülü havuzuyla doğarlar. Bu rezerv yumurtalıklardaki ilkel foliküllerden oluşur ve genetik ve endokrin bozukluklar, tıbbi müdahaleler ve endokrin bozucular gibi birçok faktörden etkilenebilir. Gonadotoksik tedaviler gerekli olduğunda doğurganlığın korunması önerilir. Kadınlar için tercih edilen seçenekler oosit ve embriyo kriyoprezervasyonudur. Bununla birlikte, çok genç, cinsel olarak olgunlaşmamış hastalarda, yumurtalık dokusunun kriyoprezervasyonu tek seçenektir. Dondurularak saklanmış doku örneklerinin foliküler yoğunluğunu bilmek, genç hastalar için doğurganlık danışmanlığında çok önemlidir. Bu protokol, doğurganlığın korunması geçiren 25 yaş ve altı kızlarda ve genç kadınlarda yumurtalık dokusunun kalitesini değerlendirmek için bir araç olarak kortikal folikül yoğunluğu için Z-skorlarının kullanımını göstermektedir. Hasta örneklerindeki folikül yoğunluğu, standarttan olası sapmaları tahmin etmek için Hassan ve ark. tarafından geliştirilen yaşa göre normalleştirilmiş referans standartlarla karşılaştırılır. Folikül yoğunluğu histolojik miktar tayini ile ölçülür. Bunun için, küçük bir yumurtalık kortikal dokusu parçası (~ 2 mm x 2 mm x 2 mm) Bouin veya formaldehit çözeltisine sabitlenir, parafin içine gömülür, 4 μm kalınlığında kesit alınır, hematoksilen ve eozin ile boyanır ve bir slayt tarayıcı kullanılarak sayısallaştırılır. Kortekste bulunan foliküler aşamalar ilkelden birincil foliküllere kadar değişir. Histolojik kesitlerde kortikal alan yüzey epitelinden 1 mm uzaktaydı. Folikül yoğunluğu, Schmidt ve ark. tarafından sunulan modifiye edilmiş bir formül kullanılarak hesaplanır ve Z-skoru, referans ortalama ve standart sapma kullanılarak belirlenir. Z-skoru, ölçülen değerin referans ortalamadan ne kadar saptığını gösterir ve azalmış (<-1.7 Z-skoru) yumurtalık rezervini belirler. Bu yöntemle, folikül yoğunlukları, doğurganlığın korunmasına ihtiyaç duyan genç hastalar için değerli bir yumurtalık rezervi ölçüsü olarak kullanılabilir.
Giriş
Yumurtalık, bir dış korteks ve bir iç medulladan oluşan dinamik, endokrinolojik olarak aktif bir organdır. Yumurtalıklar içinde heterojen olarak dağılmış, stromal granüloza hücreleri1 ile çevrili gonadal oosit içeren foliküllerdir. Tüm foliküller fetal gelişim sırasında zaten oluşmuştur, yaklaşık 20 haftalık gebelik haftasında zirve yapar ve ardından üstel bir düşüş olur. Doğumda korteks içinde 1-2 milyon ilkel folikül kalır ve ergenlik2'ye kadar sadece birkaç yüz bin folikül hayatta kalır. Yumurtalık rezervi olarak da adlandırılan büyümeyen folikül havuzu, diğer faktörlerin yanı sıra bir kadının doğurganlığını etkiler. Yumurtalık rezervi korteks içinde bulunur ve foliküller büyüyüp olgunlaştıkça medullaya doğru hareket eder. Bazı araştırmacılar yumurtalık rezervinin sadece ilkel foliküllerden oluştuğunu kabul ederken, diğerleri tüm unilaminar folikülleri (yani ilkel, ara ve birincil) içerir3,4,5,6. Bir kadının yaşamı boyunca, sadece 300-400 folikül olgunlaşır ve sonunda yumurtlama geçirmek için hayatta kalır. Menopoz, folikül sayısı yaklaşık bine düştüğünde başlar ve bu tipik olarak yaklaşık 50 yaşında ortaya çıkar 2,7. Şu anda, ksenotransplantasyondan sonra oosit oluşturabilen yetişkin insan yumurtalıklarında oogonial kök hücrelerin (OSC'ler) varlığı ile ilgili devam eden bir tartışma vardır. Bazı çalışmalar, ilkel germ hücrelerinin bir gen profilini ifade eden ve oositlerefarklılaşan hücrelerin izole edilmesini önerirken, diğerleri iddia edilen OSC'lerin kan damarlarının perivasküler hücreleriolduğunu göstermektedir 10,11,12.
Erken yumurtalık yetmezliği (POI), 40 yaşından önce FSH seviyelerinin yükselmesi ile adet döngüsünün kesilmesi ile tanımlanır13. POI'nin nedenleri multifaktöriyel olup idiyopatik olarak ortaya çıkabilir; Bununla birlikte, genellikle tıbbi durumların bir sonucu olarak ortaya çıkar14. Örneğin, bazı konjenital genetik durumlar, Turner sendromu15 gibi doğumda zaten azalmış bir yumurtalık rezervi nedeniyle POI ile ilişkilidir. POI, gonadotoksik tedavilerin bir yan etkisi olarak da ortaya çıkabilir, bu da özellikle çok genç hastalarda problemlidir, çünkü normal ergenliğe girememeye ve yumurtalık rezervini büyük ölçüde bozmaya neden olabilir. POI riskine ve hastanın yaşına bağlı olarak, olgun oositlerin dondurularak saklanması, in vitro fertilizasyondan sonra embriyoların dondurularak saklanması ve yumurtalık dokusunun dondurularak saklanması (OTC) gibi çeşitli doğurganlık koruma seçenekleri mevcuttur. Ergenlik öncesi hastalar için, cinsel olgunlaşmamışlıkları nedeniyle OTC tek uygun seçenektir16,17. Amerika Birleşik Devletleri'nde, OTC yoluyla doğurganlığın korunması son zamanlarda kabul edilebilir bir klinik rutin olarak kabul edilmiştir18. Bununla birlikte, OTC birçok Avrupa ülkesinde hala deneysel olarak kabul edilmektedir ve özellikle oto-transplantasyon için etik onay gereklidir19,20. Bu nedenle, OTC protokolleri için dahil etme kriterleri dikkatlice düşünülmeli ve her hasta için bir risk-fayda analizi yapılmalıdır. Gonadotoksik tedavi alan tüm çocuklar doğurganlığın korunması için uygun değildir. İsveç'te, İskandinav Pediatrik Hematoloji ve OnkolojiDerneği'nin doğurganlığın korunmasına ilişkin yönergelere uygun olarak yalnızca yüksek veya çok yüksek riskli hastaların doğurganlığın korunması önerilmektedir 21. Bu grup, (1) kök hücre nakli gerektiren veya menzil alanındaki yumurtalık ile radyasyon tedavisi alan ergenlik öncesi ve sonrası çocukları ve (2) yüksek dozda kümülatif alkilleyici kemoterapisi olan ergenlik sonrası çocukları içerir. Menarş öncesi kızlar için, çok yüksek kısırlık riski için dahil etme kriterleri, aşağıdakilerden herhangi biri ile tedavi edilenleri içerir: yumurtalığa radyasyon dozu >10 Gy veya allojenik veya otolog hematopoietik kök hücre tedavisi (HSCT). Dışlama kriterleri, ameliyat öncesi diğer antikoagülan preparatlar için ek kan ürünlerine ihtiyaç duyan veya nötrofil sayısı <1 olanları içerir. Menarş sonrası kızlar / kadınlar için, yüksek veya çok yüksek infertilite riski için dahil etme kriterleri, aşağıdakilerden herhangi biri ile tedavi edilenleri içerir: yumurtalığa radyasyon dozu >10 Gy veya allojenik HSCT, siklofosfamid >9 g / m², ifosfamid >60 g / m², prokarbazin veya nitrosourea bileşikleri (BCNU / CCNU) >360 mg / m². Dışlama kriterleri, sorumlu doktor tarafından değerlendirildiği gibi kanama riski artmış, enfeksiyon riski artmış, cerrahi komplikasyon riski artmış veya ağrı sorunları riski artmış olanları içerir.
OTC için, karın ameliyatları sırasında yumurtalık dokusu laparotomi veya laparoskopi ile tek taraflı ooferektomi veya biyopsi yoluyla toplanır. Medulla, toplanan yumurtalık dokusundan çıkarılır ve kalan korteks daha sonra doğurganlık restorasyonunda22 kullanılmak üzere kontrollü oranlı dondurma veya vitrifikasyon yoluyla kriyoprezervasyon için daha küçük parçalara ayrılır. Numuneler daha sonra hasta tedavisinden iyileşene ve bir aile kurmak isteyene kadar sıvı nitrojen içinde saklanır. Kanserin türüne bağlı olarak ve yumurtalık dokusu transplantasyonuna kontrendikasyon olmaması durumunda, doku daha sonra hormonal ve yumurtalık fonksiyonunu eski haline getirmek için çözülür ve otogreftlenir. Yetişkinlik döneminde toplanan dondurularak saklanmış yumurtalık dokusunun greftlenmesinden sonra bildirilen %50 gebelik oranı ve 200'den fazla canlı doğum ile OTC'nin başarısı kanıtlanmıştır 23,24,25. Çocukluk çağında toplanan yumurtalık dokusunun ototransplantasyonundan sonra bildirilen canlı doğumlar azdır ve şüphesiz prepubertal yumurtalık dokusunun ototransplantasyonundan sonra hiçbiri bildirilmemiştir 26,27,28,29,30. Doku kalitesi, başarılı bir fertilite restorasyonu için bir ön koşuldur31. Bu nedenle, toplanan doku örneklerinin kalitesini incelemek önemlidir.
Şu anda, yumurtalık dokusunun kalitesini tahmin etmenin bir yolu, histolojik kesitler ve foliküllerin manuel olarak sayılmasıdır. Bununla birlikte, folikül yoğunluğunun normalliğini değerlendirmek, artan yaşla birlikte rezervin doğal olarak azalması ve foliküllerin heterojen dağılımı nedeniyle zordur. Ek olarak, biyopsi boyutu ve yaşı için standardize edilmedikleri için referans değerlerle karşılaştırma yapmak zordur. AMH serum seviyeleri veya sindirilmiş dokunun kalsein veya nötr kırmızı ile boyanması gibi diğer değerlendirme seçenekleri ya iyi bilinmemiştir ya da kendi sınırlamaları ile birlikte gelir. Wallace ve Kelsey daha önce, bilinen yumurtalık patolojileri olmayan hastaların tüm yumurtalıklarından folikül sayıları hakkında veri toplayarak yaş boyunca normal yumurtalık rezervi modeli yayınladılar2. Ayrıca, biyopsiler tüm yumurtalığı temsil etmediğinden, Schmidt ve ark. kortikal biyopsilere dayanarak toplam folikül sayısını tahmin etmek için bir yöntem geliştirmiştir32. Bu yöntemin değiştirilmiş bir versiyonu ve normal yumurtalık rezervi modeli kullanılarak, 0-25 yaş arası kadınların folikül yoğunluğu için bir referans veri seti oluşturulmuştur33.
Bu makale, (1) histoloji kullanılarak foliküllerin doğrudan ölçülmesi ve (2) sonuçların Z-skorları aracılığıyla yaşa göre normalleştirilmiş standart referanslarla karşılaştırılması yoluyla küçük yumurtalık örneklerine dayalı folikül yoğunluğunun normalliğini değerlendirme stratejisini açıklamaktadır. Z-skorlarının kullanımı, bir yumurtalık biyopysinin folikül yoğunluğunun yaş ve boyuta standardize edilmiş bir referans grubu ortalaması ile ilişkisini tanımlar. Bu, doktorlar için hastalarına oto-transplantasyon ve doğurganlığın korunmasından sonra daha ileri tedavi için danışmanlık yapmada çok değerli olacaktır.
Protokol
Yapılan tüm işlemler İsveç Etik İnceleme Kurumu (Sveafertil patients, Dnr: 2019-03802) ve Helsinki Üniversite Hastanesi Etik Kurulu (HCH patients, Dnr 340/13/03/03/2015) tarafından onaylanmıştır. Araştırma hemşireleri tarafından çalışma ile ilgili yazılı ve sözlü bilgilendirme yapılmış, Helsinki Bildirgesi'ne uygun olarak bilgilendirilmiş onam alınmıştır. 18 yaşın altındaki hastalar için yasal vasilerden bilgilendirilmiş onam alındı. Tüm örnekler takma ad verildi ve Avrupa Genel Veri Koruma Yönetmeliği'ne (GDPR) göre işlendi. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Yumurtalık dokusunun toplanması ve işlenmesi
NOT: Yerel yönergeleri izleyerek yüksek veya çok yüksek kısırlık riski belirtisi olduğunda doğurganlığın korunması için tüm uygun hastaları tanımlayın (ör., İskandinav, Avrupa veya uluslararası özel yönergeler). Avrupa'da, reşit olmayan hastaları yalnızca doğurganlığı koruma araştırma programlarının bir parçası olarak işe alın. Ülkenizin doğurganlığın korunmasına ilişkin yönergelerini kullanarak kısırlık riskini belirleyin.
- Cerrahi işlemi genel anestezi altında gerçekleştirin. Anestezi indüksiyonu için intravenöz propofol (2 mg / kg), sufentanil (0.5 mikrogram / kg) ve roküronyum bromür (0.6 mg / kg) uygulayın.
- Hastayı 6-8 mL / kg tidal hacim ve 6-8 cm H2O pozitif ekspiratuar basınç ile entübe edin ve ventilasyon yapın İnhalasyon anestezisini sürdürmek için endotrakeal tüp yoluyla % 1 ila% 2 sevofluran verin.
- Yeterli kas gevşemesi sağlamak ve daha düşük karın içi insuflasyon basınçlarında laparoskopiye izin vermek için cerrahi prosedür sırasında roküronyum bromür (0.15 mg / kg) ile nöromüsküler blokajı koruyun.
- Azaltılmış anestezik dozu ile hızlı uyanmayı kolaylaştırmak için anestezik derinliği yönlendirmek için bispektral indeks kullanın. Rezidüel nöromüsküler bloğu sugammadeks (2-4 mg / kg) ile antagonize edin.
- Üç portlu bir teknik kullanarak, göbek deliğindeki periton boşluğuna 10 mm'lik bir trokar yerleştirin ve bir kamera takılı bir optik lens yerleştirin ve sol ve sağ iliak bölgelerde iki adet 5 mm'lik trokar yerleştirin (ilgili ön superior iliak omurganın 2 cm üstünde ve 2 cm medial) cerrahi enstrümantasyon ve doku alımı için doğrudan görüş altında. Normalliği doğrulamak için her iki yumurtalık da dahil olmak üzere pelvik organları inceleyin.
- Erişilmesi en kolay olan yumurtalığı belirleyin, ardından kavrayın. Yumurtalığın yaklaşık üçte biri kadar (veya etik izninizde belirtildiği gibi) bir hacim kesin, ardından hemostazı güvence altına almak için gerekirse diyatermi kullanın.
NOT: Biyopsiyi yalnızca aşırı intraoperatif veya sonrası kanama için risk faktörleri veya artmış enfeksiyon riski gibi kontrendikasyonlar yoksa gerçekleştirin. Açıkça belirtin ve ülkenin dahil etme ve hariç tutma kriterlerine uyun. Kısırlık riski çok yüksekse ve/veya sadece bir parçanın kesilme riskinin çok yüksek olduğu düşünülüyorsa (örneğin kanama nedeniyle) yumurtalığın tamamı alınabilir. Dokuya zarar verebileceği için numuneyi almadan önce diatermi kullanmaktan kaçının.
- Erişilmesi en kolay olan yumurtalığı belirleyin, ardından kavrayın. Yumurtalığın yaklaşık üçte biri kadar (veya etik izninizde belirtildiği gibi) bir hacim kesin, ardından hemostazı güvence altına almak için gerekirse diyatermi kullanın.
- Ameliyathanedeyken, dokuyu CaCl2, MgCl2, 1 g/L D-glikoz, 36 mg/L piruvat içeren 5 mL 1x Dulbecco'nun Fosfat Tampon Salin (PBS) içeren bir tüpe yerleştirin, numune laboratuvarda hemen işlenirse 37 °C'ye ısıtılır (30 dakika içinde) veya daha uzun taşımalar sırasında (24 saate kadar) 4 °C'de tutulur.
NOT: Taşıma çözümleri, piyasada bulunan bir dizi organ taşıma/perfüzyon çözümünün yanı sıra PBS ve MEM34 gibi basit tamponları içerir. - Yumurtalık yüzeyinden yumurtalık dokusunun küçük bir parçasını (2 mm x 2 mm x 2 mm) kesin. Bu parça, yumurtalık foliküllerinin bulunduğu yumurtalığın dış kısmı olan korteksi içerir35.
DİKKAT: Biyogüvenlik Seviye 2 uygulamalarını ve prosedürlerini kullanarak yumurtalık gibi insan dokularını kullanın.
NOT: Özel bir üreme tıbbı ünitesi, hastaların doğurganlık restorasyonunda gelecekteki potansiyel kullanım için yumurtalık dokusunun geri kalanını klinik olarak dondurarak korur. - Dokuyu oda sıcaklığında 2 saat boyunca 350 μL Bouin solüsyonuna veya gece boyunca 4 °C'de 350 μL% 4 formaldehit içine yerleştirin ve dokunun tamamen suya batırıldığından emin olun. İnkübasyondan sonra, dokuyu üç kez% 70 etanol ile yıkayın.
- Bouin'in solüsyonu için sarı renk kaybolana kadar yıkayın. Dokuyu parafin mumu36 içine gömün. 4 μm kalınlığında en az 30 seri doku kesiti kesin ve bunları cam slaytlar üzerine yerleştirin.
DİKKAT: Bouin solüsyonunu ve formaldehiti kimyasal bir başlık içinde ve uygun koruyucu ekipmanla kullanın.
NOT: Formaldehit, dokuda büzülme ile ilgili artefaktlara yol açabilir. Bu nedenle Bouin'in çözümü, histolojiyi korumak için tercih edilen seçimdir. Bununla birlikte, Bouin'in çözümü ek riskler taşır ve bu da birçok kurumun formaldehit37 kullanımını tercih etmesine neden olur.
- Bouin'in solüsyonu için sarı renk kaybolana kadar yıkayın. Dokuyu parafin mumu36 içine gömün. 4 μm kalınlığında en az 30 seri doku kesiti kesin ve bunları cam slaytlar üzerine yerleştirin.
2. Hematoksilen ve Eozin (H & E) boyama
- 5 g eozin Y tozunu 100 mL'lik otoklavlanmış bir cam şişeye tartın. % 0.5 eozin stok çözeltisi yapmak için 800 mL %95 etanol ve 200 mL deiyonize su ekleyin. %0.5 eozin stok çözeltisinin 200 mL'sini 160 mL %100 etanol, 1 mL asetik asit ve 40 mL deiyonize su ile seyrelterek %0.25'lik bir eozin çalışma solüsyonu hazırlayın.
NOT: Toz tamamen çözülmeyebilir. Çökeltiyi azaltmak için kullanmadan önce çözeltiyi süzün. - Slaytları raflara yerleştirin. Slaytlı rafı aşağıdaki sırayla ilgili kaplara daldırın: 15 dakika ksilene, 5 dakika %100 etanole, 10 kez %70 etanole batırın, 10 kez %50 etanole batırın ve ardından 10 kez deiyonize suya batırın.
- Slaytlı rafı 3 dakika hematoksilen çözeltisine batırın, ardından fazla hematoksilen lekesini yıkamak için slaytlı rafı 30 saniye boyunca damıtılmış musluk suyu içeren bir kaba aktarın.
- Slaytlı rafı 1 dakika boyunca farklılaştırma solüsyonu (100 mL %70 etanole 1 mL %37 HCl eklenir) içeren bir kaba yerleştirin, ardından slaytlı rafı 30 saniye boyunca damıtılmış musluk suyu içeren bir kaba aktarın.
NOT: Doku bölümlerinin sıvıya batırıldığından emin olun. Gerekirse kaba daha fazla reaktif ekleyin. Büyük miktarlarda boyama yaparken her 5 kullanımdan sonra sileni değiştirin. %70 etanolü seyrelterek %50 etanol hazırlayın (örneğin, 50 mL %50 etanol yapmak için 15 mL DPBS'ye 35 mL %70 etanol ekleyin).
DİKKAT: Ksileni bir davlumbazın içinde ve uygun koruyucu ekipmanla tutun.
- Slaytlı rafı 30-60 saniye boyunca Scott'ın musluk suyuna (mavileştirme solüsyonu olarak da bilinir) yerleştirin, ardından slaytlı rafı 30 saniye boyunca damıtılmış musluk suyu içeren bir kaba aktarın. Slaytlı rafı 1 dakika boyunca eosin çalışma solüsyonuna daldırın.
- Slaytları aşağıdaki reaktiflere yerleştirerek kurutun: 30 saniye boyunca% 100 etanol, 30 saniye boyunca% 100 etanol içeren ikinci bir kap ve ardından iki kez ksilene batırın. Rafı ksilen çözeltisinden çıkardıktan sonra, ksilenin davlumbazın içine damlamasını önlemek için bir cam kapta kurumaya bırakın.
- Sürgüyü 2 damla montaj solüsyonu ile monte edin. Kabarcıkları önlemek için kapak kızaklarını dikkatlice yerleştirin ve montaj solüsyonunun kurumasını bekleyin.
DİKKAT: Ksileni bir davlumbazın içinde ve uygun koruyucu ekipmanla tutun.
- Slaytları mümkünse slayt tarayıcıları kullanarak tarayarak dijitalleştirin. Bu seçenek mevcut değilse, folikülleri doğrudan saymak için 20-40x büyütmede normal bir ters mikroskop kullanın. Görüntü analiz yazılımında alan ölçümünü kolaylaştırmak için tüm biyopsinin görüntüsünü aldığınızdan emin olun.
3. Folikül sayımı
- Slaytlar dijitalleştirilmişse, dosyaları uygun yazılımı (örneğin, açık kaynaklı yazılım QuPath38) kullanarak açın. Sayısallaştırılmamışsa, analizi doğrudan ters çevrilmiş bir mikroskop ve ilgili yazılımını kullanarak gerçekleştirin.
- Dosyayı QuPath'in ana penceresine sürükleyin. Görüntü türünü Brightfield H&E olarak ayarlayın (bkz. Şekil 1A). Ölçek çubuğunu kullanarak yüzey epitelinden (yüzeyi kaplayan tek bir küboidal hücre tabakası) 1 mm tanımlayın. Elips aracına tıklayın ve foliküllere açıklama ekleyin (bkz. Şekil 1B).
- Bu 1 mm'lik alandaki folikül sayısını, ilkelden birincil aşamaya kadar sayın. Her folikülün aşamasını tanımlayın (ilkel - oositi çevreleyen düzleştirilmiş granüloza hücrelerinin bir tabakası; ara aşama - düzleştirilmiş ve küboidal granüloza hücrelerinin bir karışımı; birincil - oositi çevreleyen bir tam küboidal granüloza hücresi tabakası).
- Folikül Z-skoru hesaplayıcı Excel dosyasında Folikül adlı kağıda mm3 cinsinden Folikül adlı kağıda numune kimliğini, yaşını, her slayt için folikül sayısını, kesit kalınlığını ve sayılann'inci bölümü girin (bkz. Ek Dosya 1 ve Şekil 2A).
NOT: Foliküllerin çapı nedeniyle (en küçük foliküller >35 μm), aynı folikül ardışık bölümlerde görünebilir. Bölümler arasındaki mesafenin folikül çapından daha az olduğu bölümleri sayarken ekstra dikkatli olun. Tercihen, her 10. bölümden folikülleri sayın (örneğin, bölüm # 10, # 20, # 30). Yüzey epiteli doku işleme sırasında ayrılabilir ve slaytlarda sadece kısmen bulunabilir. Sadece görünür sitoplazmalı folikülleri sayın. Kalite kontrol için, iki kişinin folikülleri bağımsız olarak saymasını ve sayımlarının ne kadar iyi hizalandığını belirlemesini sağlayın. Aynı örnek için her bir gözlemcinin folikül sayıları arasında basit bir korelasyon fonksiyonu kullanarak gözlemciler arası uyumu hesaplayın.
- Sayılan her bölümdeki foliküllerin en büyük% 10'unu göz küresi ile tanımlayın. Çizgi aracına tıklayarak, oosit zarından iki dik çizgi çizerek ve Ölç'ü ve ardından Ek açıklama ölçümlerini göster'i seçerek bu oositlerin ortalama çapını ölçün (bkz. Şekil 1C).
- Ölçümleri Uzunluk μm sütunu altına kaydedin (bkz. Şekil 1D). Folikül Z-skoru hesaplayıcı Excel dosyasındaki her slayt için Ortalama oosit çapı (μm) alanına tüm oositlerin ortalama çapını girin (mmcinsinden folikül, bkz. Ek Dosya 1 ve Şekil 2A).
- Görüntüyü QuPath'te ekranın ortasına yerleştirin, ardından ImageJ simgesine tıklayın. ImageJ'ye anlık görüntü gönder'i seçin (bkz. Şekil 3A). ImageJ'de, fırça aracını kullanarak kenarlıktan 1 mm ayırın. Görüntüye tıklayın, ardından Yazın ve 8 bit'i seçin (bkz. Şekil 3B).
- Çizgi aracına tıklayın, ekranın sol alt kısmındaki ölçek çubuğuna bir çizgi çizin (bkz. Şekil 3C). Analiz Et'e tıklayın, ardından Ölçeği Ayarla'ya tıklayın, Bilinen Mesafe alanına ölçek çubuğunda belirtilen uzunluğu girin ve Tamam'a tıklayın (bkz. Şekil 3C). Görüntü'ye tıklayın, ardından Ayarla, Parlaklık/Kontrast'a tıklayın ve Otomatik'i seçin (bkz. Şekil 3D).
- Görüntü'ye tıklayın, ardından Ayarla, Eşik'e tıklayın ve Otomatik'i seçin (bkz. Şekil 3E). Değnek aracına tıklayın, alanı seçin ve ardından Ctrl + M tuşlarına basın (bkz. Şekil 3F). Alan değerini Folikül Z-skoru hesaplayıcı Excel dosyasına girin (Folikül mm3 cinsinden, Ek Dosya 1 ve Şekil 2A'ya bakın).
4. Folikül yoğunluğu, kortikal hacim ve Z-skoru hesaplamaları
- Aşağıda özetlenen hesaplamaları otomatik olarak gerçekleştirmek için sağlanan Follicle Z-skoru hesaplayıcı Excel dosyasını kullanın. Sonuçlar, Excel hesap makinesinde "Z-skoru (mm³ başına folikül)" sayfasında görünecektir (Ek Dosya 1'e bakınız), bölüm 3'te belirtilen ayrıntıların "mm³ cinsinden foliküller" sayfasına girilmesi şartıyla.
- Bu bölümlerdeki folikül yoğunluklarını hesaplamak için Schmidt ve ark.32 tarafından sunulan değiştirilmiş formülü kullanın. İlk olarak, aynı folikülün çift sayımını hesaba katmak için α düzeltme faktörünü uygulayın. Değiştirilen formül aşağıdaki gibidir:
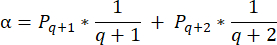
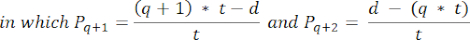
NOT: Bu formülde, t kesit kalınlığıdır, d oositin çapıdır ve q , folikül çapının kesit kalınlığına bölünmesiyle elde edilen bölümdür. - Aşağıdaki formül33'ü kullanarak bölümdeki folikül sayısından korteksteki toplam folikül sayısını (n folikül) tahmin edin:
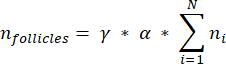
NOT: Bu formül aynı zamanda hesaplanmayan tüm bölümleri de hesaba katar. Burada γ, hesaplanmayan bölümlerin sayısını temsil eder (örneğin, her 10. bölüm sayılırsa γ = 10), α 4.1'de hesaplanan düzeltme faktörüdür, N sayılan bölüm sayısıdır ve n, i sayılan bölümlerdeki toplam folikül sayısıdır.- Aşağıdaki formül33'ü kullanarak sayılan alanlardan tüm kortikal hacmi (V) tahmin edin:
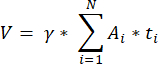
NOT: Burada, Ai kesitin alanıdır ve ti doku kalınlığıdır. Lütfen γ ve N için adım 4.2'yi kontrol edin. - Folikül yoğunluğunu hesaplamak için aşağıdaki formülü33 kullanın:
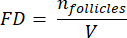
- Aşağıdaki formül33'ü kullanarak sayılan alanlardan tüm kortikal hacmi (V) tahmin edin:
- Formül33'ü kullanarak Z-skorunu hesaplayarak yumurtalık rezervinin azalıp azalmadığını (<-1.7 Z-skoru) belirleyin:
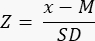
NOT: Z-skoru, Bölüm 3'te (Folikül Sayımı) (Şekil 2B) sağlanan bilgilere dayalı olarak Excel hesap makinesindeki (Ek Dosya 1'e bakınız) "Z-skoru (mm³ başına folikül)" sayfasında otomatik olarak hesaplanır. Bu formülde Z, Z-skorunu temsil eder, x, çalışma örneğinin hesaplanan folikül yoğunluğudur (foliküller/cm3) (adım 4.4), M, ilgili yaş grubunun ortalama folikül yoğunluğudur ve SD, ilgili yaş grubunun standart sapmasıdır. 0-25 yaş arası kadınlar için referans değerler Hassan ve ark.33'te belirlenmiştir. İlgili yaş gruplarının folikül yoğunluklarının ortalamaları ve standart sapmaları, Folikül Z-skoru hesaplayıcı Excel dosyasında (Ek Dosya 1) bulunabilir ve Z-skoru hesaplamaları için kullanılabilir.
Sonuçlar
Yumurtalık folikülleri, slaytların başarılı bir şekilde kesilmesi, boyanması ve taranmasından sonra ölçülür. Foliküllerin farklı aşamaları ve sağlığı ayırt edilir ve daha fazla analiz edilir. Şekil 4A'da, bir yetişkinden Bouin ile sabitlenmiş bir yumurtalığın HE ile boyanmış bir kesiti, kortikal ve medüller doku örnekleriyle birlikte gösterilmektedir. Şekil 4B , bir yüzey epitel örneği ile bi...
Tartışmalar
Kadınlar, yenilenemeyen sınırlı bir oosit havuzuyla doğarlar. Yumurtalık rezervi, bir kadının üreme potansiyelinin önemli bir belirleyicisidir. Bu makale, genç hastalarda ve 25 yaşına kadar olan kadınlarda yumurtalık kortikal folikül yoğunluklarının Z-skorlarını kullanarak folikül yoğunluğunun histolojik olarak ölçülmesi ve referans standartlarla karşılaştırılması için bir yöntemi özetlemektedir.
Bu protokolde doğurganlığ...
Açıklamalar
Yazarların herhangi bir çıkar çatışması yoktur.
Teşekkürler
Katılımcı temini ve doku toplanması konusunda bize yardımcı olan sağlık çalışanlarına ve yumurtalık dokusunu bağışlayan tüm hastalara teşekkür ederiz. Ayrıca, finansmanı bu çalışmayı mümkün kılan Çocukluk Çağı Kanseri Fonu'na (PR2020-0096) ve Karolinska Institutet Doktora fonu KID'e de teşekkür ediyoruz. Histolojik slaytların hazırlanması için Morfolojik Fenotip Analizi tesisine de teşekkür ederiz. Bu el yazmasını dil düzenlemesi için Nicola Byers'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
Referanslar
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır