A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ציוני Z להערכת רזרבה שחלתית בחולות צעירות העוברות שימור פוריות
In This Article
Summary
הפרוטוקול הנוכחי מתאר שיטה להערכת רזרבה שחלתית במטופלות מתחת לגיל 25 הזקוקות לשימור פוריות באמצעות שימור בהקפאה של רקמת השחלה. שיטה זו כוללת: (1) הערכה היסטולוגית של רזרבה שחלתית בדגימות קליפת המוח, (2) השוואה למערך נתוני ייחוס, ו-(3) חישוב ציוני Z.
Abstract
נשים נולדות עם מאגר לא מתחדש של זקיקי השחלות, המכונה הרזרבה השחלתית. שמורה זו מורכבת מזקיקים קדמוניים בשחלות ויכולה להיות מושפעת מגורמים רבים, כגון הפרעות גנטיות ואנדוקריניות, התערבויות רפואיות ומשבשים אנדוקריניים. שימור פוריות מומלץ כאשר יש צורך בטיפולים גונדוטוקסיים. האפשרויות המועדפות לנשים הן שימור ביציות ועוברים. עם זאת, במטופלות צעירות מאוד, לא בוגרות מינית, שימור רקמת השחלות היא האפשרות היחידה. הכרת צפיפות הזקיקים של דגימות רקמה בהקפאה חיונית בייעוץ פוריות למטופלות צעירות. פרוטוקול זה מדגים את השימוש בציוני Z עבור צפיפות זקיקים בקליפת המוח ככלי להערכת איכות רקמת השחלה אצל נערות ונשים צעירות בגילאי 25 ומטה העוברות שימור פוריות. צפיפות הזקיקים בדגימות חולים מושווית לתקני ייחוס מנורמלים לגיל, שפותחו על ידי חסן ואחרים כדי להעריך סטיות אפשריות מהתקן. צפיפות הזקיק נמדדת באמצעות כימות היסטולוגי. לשם כך, חתיכה קטנה של רקמת קליפת המוח השחלתית (~ 2 מ"מ x 2 מ"מ x 2 מ"מ) קבועה בתמיסת Bouin או פורמלדהיד, משובצת בפרפין, חתוכה בעובי 4 מיקרומטר, מוכתמת בהמטוקסילין ואאוזין, ועוברת דיגיטציה באמצעות סורק שקופיות. שלבי הזקיקים הקיימים בקליפת המוח נעים בין זקיקים ראשוניים לזקיקים ראשוניים. אזור קליפת המוח היה 1 מ"מ מאפיתל פני השטח על חתכים היסטולוגיים. צפיפות הזקיקים מחושבת באמצעות נוסחה שונה שהוצגה על ידי Schmidt et al., וציון Z נקבע באמצעות ממוצע הייחוס וסטיית התקן. ציון Z מציין עד כמה הערך הנמדד חורג מממוצע הייחוס, וקובע רזרבה שחלתית מופחתת (<-1.7 ציון Z). בשיטה זו, צפיפות זקיקים יכולה לשמש כמדד חשוב של רזרבה שחלתית עבור מטופלות צעירות הזקוקות לשימור פוריות.
Introduction
השחלה היא איבר דינמי, פעיל אנדוקרינולוגית, המורכב מקליפת המוח החיצונית ומדולה פנימית. מופצים הטרוגנית בתוך השחלות הם זקיקים, המכילים את ביצית גונדל מוקף תאי גרנולוזה סטרומה1. כל הזקיקים נוצרים כבר במהלך התפתחות העובר, ומגיעים לשיא בסביבות 20 שבועות של גיל הריון, ואחריו ירידה אקספוננציאלית. בלידה, 1-2 מיליון זקיקים קדמוניים נשארים בתוך קליפת המוח, ורק כמה מאות אלפי זקיקים שורדים עד גילההתבגרות 2. מאגר הזקיקים שאינו גדל, המכונה גם הרזרבה השחלתית, משפיע בין היתר על פוריות האישה. הרזרבה השחלתית שוכנת בתוך קליפת המוח ועוברת למדולה כאשר הזקיקים גדלים ומתבגרים. חלק מהחוקרים מכירים ברזרבה השחלתית כמורכבת מזקיקים קדמוניים בלבד, בעוד שאחרים כוללים את כל הזקיקים החד-למינריים (כלומר, ראשוניים, מתווכים וראשוניים)3,4,5,6. במהלך חיי האישה, רק 300-400 זקיקים מתבגרים ושורדים עד שבסופו של דבר עוברים ביוץ. גיל המעבר מתחיל כאשר מספר הזקיק יורד בסביבות אלף, אשר מתרחשת בדרך כלל בסביבות 50 שנים של גיל 2,7. כיום קיים ויכוח מתמשך לגבי נוכחותם של תאי גזע ביציים (OSCs) בשחלות אנושיות בוגרות שיכולות ליצור ביציות לאחר השתלת קסנו. מחקרים מסוימים מציעים לבודד תאים המבטאים פרופיל גנטי של תאי נבט פרימיטיביים ומתמיינים לביציות 8,9, בעוד שאחרים מצביעים על כך שה- OSCs לכאורה הם תאים פריווסקולריים של כלי הדם 10,11,12.
אי ספיקת שחלות מוקדמת (POI) מוגדרת על ידי הפסקת המחזור החודשי עם רמות FSH גבוהות לפני גיל 40 שנים13. הגורמים ל- POI הם רב-תכליתיים ויכולים להתרחש באופן אידיופתי; עם זאת, לעתים קרובות היא מתעוררת כתוצאה ממצבים רפואיים14. לדוגמה, מצבים גנטיים מולדים מסוימים קשורים ל- POI עקב רזרבה שחלתית מופחתת כבר בלידה, כגון תסמונת טרנר15. POI יכול להתרחש גם כתופעת לוואי של טיפולים גונדוטוקסיים, וזה בעייתי במיוחד במטופלות צעירות מאוד מכיוון שהוא עלול להוביל לחוסר יכולת לעבור התבגרות מינית תקינה ולפגוע באופן דרסטי ברזרבה השחלתית. בהתאם לסיכון של POI וגיל המטופל, מספר אפשרויות שימור פוריות זמינות, כגון שימור בהקפאה של ביציות בוגרות, שימור בהקפאה של עוברים לאחר הפריה חוץ גופית, ושימור בהקפאה של רקמת השחלות (OTC). עבור חולים לפני גיל ההתבגרות, OTC היא האפשרות המעשית היחידה בשל חוסר הבשלות המינית שלהם 16,17. בארצות הברית, שימור פוריות באמצעות OTC נחשב לאחרונה לשגרה קלינית מקובלת18. עם זאת, OTC עדיין נחשב ניסיוני במדינות רבות באירופה, ונדרש אישור אתי, במיוחד עבור השתלה אוטומטית19,20. לכן, יש לשקול בקפידה את קריטריוני ההכללה של פרוטוקולי OTC, ולבצע ניתוח סיכון-תועלת עבור כל מטופל. לא כל הילדים המקבלים טיפולים גונדוטוקסיים זכאים לשימור פוריות. בשוודיה, רק חולים בסיכון גבוה או גבוה מאוד מומלץ לעבור שימור פוריות בהתאם להנחיות לשימור פוריות של האגודה הנורדית להמטולוגיה ואונקולוגיה ילדים21. קבוצה זו כוללת (1) ילדים לפני ואחרי ההתבגרות המינית הזקוקים להשתלת תאי גזע או לקבלת הקרנות עם השחלה בתחום הטווח, ו-(2) ילדים לאחר גיל ההתבגרות עם מינונים מצטברים גבוהים של כימותרפיה אלקילטית. עבור בנות לפני הווסת, קריטריוני הכללה לסיכון גבוה מאוד לאי פוריות כוללים את אלה שטופלו בכל אחד מהבאים: מינון קרינה >10 Gy לשחלה, או טיפול בתאי גזע המטופויטיים אלוגניים או אוטולוגיים (HSCT). קריטריוני ההחרגה כוללים את אלה הזקוקים למוצרי דם נוספים עבור תכשירים נוגדי קרישה אחרים לפני ניתוח או שיש להם ספירת נויטרופילים <1. עבור נערות / נשים לאחר הווסת, קריטריוני הכללה לסיכון גבוה או גבוה מאוד לאי פוריות כוללים את אלה שטופלו בכל אחד מהבאים: מינון קרינה >10 Gy לשחלה, או HSCT אלוגני, ציקלופוספמיד >9 גרם / מ"ר, ifosfamide >60 גרם / מ"ר, procarbazine, או תרכובות nitrosourea (BCNU / CCNU) >360 מ"ג / מ"ר. קריטריוני ההחרגה כוללים אנשים עם סיכון מוגבר לדימום, סיכון מוגבר לזיהום, סיכון מוגבר לסיבוכים כירורגיים או סיכון מוגבר לבעיות כאב כפי שהוערך על ידי הרופא האחראי.
עבור OTC, רקמת השחלה נאספת במהלך ניתוחי בטן על ידי laparotomy או לפרוסקופיה באמצעות כריתת שחלות חד צדדית או ביופסיה. המדולה מוסרת מרקמת השחלה שנאספת, וקליפת המוח הנותרת מחולקת לאחר מכן למקטעים קטנים יותר לצורך שימור בהקפאה באמצעות הקפאה בקצב מבוקר או ויטריפיקציה לשימוש מאוחר יותר בשיקום פוריות22. הדגימות מאוחסנות בחנקן נוזלי עד שהמטופלת מתאוששת מהטיפול ומעוניינת להקים משפחה. בהתאם לסוג הסרטן ובהיעדר התוויות נגד להשתלת רקמת שחלה, הרקמה מופשרת ומושתלת אוטומטית כדי לשחזר את התפקוד ההורמונלי והשחלתי. OTC הוכח כמוצלח, עם שיעור הריונות של 50% ויותר מ -200 לידות חי שדווחו לאחר השתלת רקמת שחלה שמורה בהקפאה שנאספה במהלך הבגרות 23,24,25. לידות החי המדווחות לאחר השתלה עצמית של רקמת שחלה שנאספה במהלך הילדות הן מעטות, ואף אחת מהן לא דווחה לאחר השתלה אוטומטית של רקמת שחלה ללא ספק לפני גיל ההתבגרות 26,27,28,29,30. איכות הרקמה היא תנאי מוקדם לשיקום פוריות מוצלח31. לכן, חיוני ללמוד את איכות דגימות הרקמה שנאספו.
כיום, דרך להעריך את איכות רקמת השחלה היא באמצעות חתכים היסטולוגיים וספירה ידנית של הזקיקים. עם זאת, הערכת הנורמליות של צפיפות הזקיקים קשה בשל הירידה הטבעית של השמורה עם העלייה בגיל ואת ההתפלגות ההטרוגנית של זקיקים. בנוסף, ההשוואה לערכי הייחוס מאתגרת מכיוון שהם אינם מתוקננים לגודל הביופסיה ולגילה. אפשרויות הערכה אחרות, כגון רמות סרום AMH או צביעה של רקמה מעוכלת עם calcein או אדום נייטרלי, אינם מבוססים היטב או לבוא עם מגבלות משלהם. וואלאס וקלסי פרסמו בעבר מודל של רזרבה שחלתית תקינה מעל גיל על ידי איסוף נתונים על מספרי זקיקים משחלות שלמות של מטופלות ללא פתולוגיות שחלות ידועות2. יתר על כן, מכיוון שהביופסיות אינן מייצגות את השחלה כולה, שמידט ועמיתיו פיתחו שיטה להערכת המספר הכולל של זקיקים בהתבסס על ביופסיות קליפת המוח32. באמצעות גרסה שונה של שיטה זו והמודל של רזרבה שחלתית תקינה, נקבע מערך נתוני ייחוס לצפיפות זקיקים של נשים בגילאי 0-25 שנים33.
מאמר זה מתאר את האסטרטגיה להערכת תקינות צפיפות הזקיקים בהתבסס על דגימות שחלות קטנות על ידי (1) כימות ישיר של הזקיקים באמצעות היסטולוגיה ו-(2) השוואת התוצאות להפניות סטנדרטיות מנורמלות גיל באמצעות ציוני Z. השימוש בציוני Z מתאר את הקשר בין צפיפות זקיק השחלה של ביופי לממוצע של קבוצת ייחוס מתוקננת לגיל ולגודל. זה יהיה בעל ערך רב עבור רופאים בייעוץ המטופלים שלהם להשתלה עצמית וטיפול נוסף לאחר שימור פוריות.
Protocol
כל ההליכים שנערכו אושרו על ידי הרשות השבדית לביקורת אתית (Sveafertil patients, Dnr: 2019-03802) ועל ידי ועדת האתיקה של בית החולים האוניברסיטאי הלסינקי (HCH patients, Dnr 340/13/03/03/2015). מידע בכתב ובעל פה על המחקר נמסר על ידי אחיות המחקר, והסכמה מדעת התקבלה בהתאם להצהרת הלסינקי. עבור מטופלים מתחת לגיל 18, התקבלה הסכמה מדעת מהאפוטרופוסים החוקיים. כל הדגימות עברו פסאודונימיזציה ועובדו בהתאם לתקנה האירופית הכללית להגנה על נתונים (GDPR). פרטי הריאגנטים והציוד ששימשו במחקר זה מפורטים בטבלת החומרים.
1. איסוף רקמות השחלות ועיבודן
הערה: זהה את כל המטופלות המתאימות לשימור פוריות כאשר קיימת אינדיקציה לסיכון גבוה או גבוה מאוד לאי פוריות בהתאם להנחיות מקומיות (למשל, הנחיות ספציפיות נורדיות, אירופאיות או בינלאומיות). באירופה, לגייס מטופלות קטינות רק כחלק מתוכניות מחקר לשימור פוריות. קבע את הסיכון לאי פוריות באמצעות הנחיות המדינה שלך לשימור פוריות.
- לבצע את ההליך הכירורגי בהרדמה כללית. מתן פרופופול תוך ורידי (2 מ"ג/ק"ג), סופנטניל (0.5 מיקרוגרם/ק"ג) ורוקורוניום ברומיד (0.6 מ"ג/ק"ג) להשראת הרדמה.
- יש לבצע אינטובציה ולאוורר את המטופל עם נפח גאות של 6-8 מ"ל/ק"ג ולחץ תפוגה חיובי של 6-8 ס"מ של H2O. לספק סבופלורן 1% עד 2% דרך הצינור האנדוטרכאלי כדי לשמור על הרדמה בשאיפה.
- לשמור על חסימה עצבית-שרירית עם רוקורוניום ברומיד (0.15 מ"ג/ק"ג) במהלך ההליך הכירורגי כדי לספק הרפיית שרירים נאותה ולאפשר לפרוסקופיה בלחצי אינפלציה תוך בטניים תחתונים.
- השתמש באינדקס ביספקטרלי כדי להנחות את עומק ההרדמה כדי להקל על התעוררות מהירה עם מינון הרדמה מופחת. אנטגוניז שאריות בלוק עצבי-שרירי עם sugammadex (2-4 מ"ג / ק"ג).
- באמצעות טכניקה של שלוש יציאות, הכנס טרוקאר 10 מ"מ לתוך חלל הצפק בטבור כדי להציג עדשה אופטית עם מצלמה מחוברת, ושני טרוקרים 5 מ"מ באזור האיליאק השמאלי והימני (2 ס"מ מעל ו 2 ס"מ מדיאלי לעמוד השדרה האיליאק העליון הקדמי בהתאמה) תחת ראייה ישירה עבור מכשור ניתוח ושליפת רקמות. בדוק את איברי האגן, כולל שתי השחלות, כדי לאשר נורמליות.
- זהה את השחלה הקלה ביותר לגישה, ואז אחוז בה. חתכי נפח שהוא כשליש מהשחלה (או כפי שמצוין בהיתר האתי שלך), ולאחר מכן השתמשי בדיאטרמיה, במידת הצורך, כדי לאבטח המוסטאזיס.
הערה: בצע את הביופסיה רק אם אין התוויות נגד, כגון גורמי סיכון לדימום תוך או אחרי הניתוח או סיכון מוגבר לזיהום. ציין בבירור ופעל בהתאם לקריטריוני ההכללה וההדרה של המדינה. ניתן ליטול את השחלה כולה אם הסיכון לאי פוריות גבוה מאוד ו/או הסיכון לחיתוך חלק בלבד נחשב גבוה מדי (למשל עקב דימום). הימנע משימוש בדיאתרמיה לפני איסוף הדגימה מכיוון שהיא עלולה להזיק לרקמה.
- זהה את השחלה הקלה ביותר לגישה, ואז אחוז בה. חתכי נפח שהוא כשליש מהשחלה (או כפי שמצוין בהיתר האתי שלך), ולאחר מכן השתמשי בדיאטרמיה, במידת הצורך, כדי לאבטח המוסטאזיס.
- בזמן השהייה בחדר הניתוח, הניחו את הרקמה בצינור המכיל 5 מ"ל של 1x מלח חיץ פוספט של דולבקו (PBS) עם CaCl2, MgCl2, 1 גרם / L D-גלוקוז, 36 מ"ג / ליטר פירובט, או מחומם ל 37 ° C אם הדגימה מעובדת מיד במעבדה (בתוך 30 דקות) או נשמר ב 4 ° C במהלך משלוחים ארוכים יותר (עד 24 שעות).
הערה: פתרונות תחבורה כוללים מערך של פתרונות שינוע/זילוח איברים הזמינים באופן מסחרי וכן מאגרים פשוטים כגון PBS ו-MEM34. - לחתוך חתיכה קטנה של רקמת השחלה (2 מ"מ x 2 מ"מ x 2 מ"מ) מפני השטח של השחלה. חלק זה מכיל את קליפת המוח, שהיא החלק החיצוני של השחלה שבו זקיקי השחלות נמצאים35.
התראה: יש לטפל ברקמות אנושיות כגון השחלה באמצעות שיטות ונהלים ברמת בטיחות ביולוגית 2.
הערה: יחידה מיוחדת לרפואת רבייה משמרת קלינית את שאר רקמת השחלה לשימוש עתידי פוטנציאלי בשיקום פוריות של המטופלות. - הניחו את הרקמה בתמיסה של 350 μL Bouin בטמפרטורת החדר למשך שעתיים או ב-350 μL של פורמלדהיד 4% ב-4°C למשך הלילה, וודאו שהרקמה שקועה במלואה. לאחר הדגירה, לשטוף את הרקמה עם 70% אתנול שלוש פעמים.
- עבור הפתרון של Bouin, לשטוף עד הצבע הצהוב נעלם. הטמע את הרקמה בשעוות פרפין36. חותכים מינימום של 30 קטעי רקמה טוריים בעובי של 4 מיקרומטר ומניחים אותם על שקופיות זכוכית.
אזהרה: יש לטפל בתמיסת Bouin ובפורמלדהיד בתוך מכסה מנוע כימי ועם ציוד מגן מתאים.
הערה: פורמלדהיד עלול להוביל לממצאים הקשורים להתכווצות ברקמה. הפתרון של בואין הוא אפוא הבחירה המועדפת לשימור ההיסטולוגיה. עם זאת, הפתרון של Bouin טומן בחובו סיכונים נוספים, מה שמוביל מספר מוסדות להעדיף את השימוש בפורמלדהיד37.
- עבור הפתרון של Bouin, לשטוף עד הצבע הצהוב נעלם. הטמע את הרקמה בשעוות פרפין36. חותכים מינימום של 30 קטעי רקמה טוריים בעובי של 4 מיקרומטר ומניחים אותם על שקופיות זכוכית.
2. צביעת המטוקסילין ואוסין (H&E)
- שוקלים 5 גרם של אבקת eosin Y לתוך בקבוק זכוכית autoclaved 100 מ"ל. הוסף 800 מ"ל של 95% אתנול ו 200 מ"ל של מים deionized כדי ליצור 0.5% תמיסת מלאי eosin. הכינו תמיסת עבודה של 0.25% eosin על ידי דילול 200 מ"ל של תמיסת מלאי eosin 0.5% עם 160 מ"ל של 100% אתנול, 1 מ"ל של חומצה אצטית ו-40 מ"ל של מים שעברו דה-יוניזציה.
הערה: ייתכן שהאבקה לא תתמוסס לחלוטין. סנן את התמיסה לפני השימוש כדי להפחית את המשקע. - מקם שקופיות בארונות תקשורת. טבלו את המדף עם שקופיות לתוך המיכלים המתאימים בסדר הבא: 15 דקות בקסילן, 5 דקות ב-100% אתנול, טבלו 10 פעמים באתנול 70%, טבלו 10 פעמים באתנול 50% ולאחר מכן טבלו 10 פעמים במים נטולי יונים.
- טבלו את המדף עם שקופיות בתמיסת המטוקסילין למשך 3 דקות, ולאחר מכן העבירו את המדף עם המגלשות למיכל עם מי ברז מזוקקים למשך 30 שניות כדי לשטוף את כתם המטוקסילין העודף.
- הניחו את המדף עם המגלשות במיכל עם תמיסת בידול (1 מ"ל של 37% HCl שנוסף ל-100 מ"ל של 70% אתנול) למשך דקה אחת, ולאחר מכן העבירו את המדף עם המגלשות למיכל עם מי ברז מזוקקים למשך 30 שניות.
הערה: ודא שחלקי הרקמה שקועים בנוזל. הוסף מגיב נוסף למכל במידת הצורך. יש להחליף קסילן לאחר כל 5 שימושים בעת צביעת כמויות גדולות. הכינו 50% אתנול על ידי דילול 70% אתנול (למשל, הוסיפו 35 מ"ל של 70% אתנול ל-15 מ"ל של DPBS כדי לייצר 50 מ"ל של 50% אתנול).
אזהרה: יש לטפל בקסילן בתוך מכסה מנוע ועם ציוד מגן מתאים.
- הניחו את המדף עם המגלשות במי הברז של סקוט (הידוע גם כתמיסת הדבקה) למשך 30-60 שניות, ולאחר מכן העבירו את המדף עם המגלשות למיכל עם מי ברז מזוקקים למשך 30 שניות. סחף את ארון התקשורת עם שקופיות בתמיסת העבודה של eosin למשך דקה אחת.
- יש לייבש את השקופיות על ידי הכנסתן לריאגנטים הבאים: 100% אתנול למשך 30 שניות, מיכל שני עם 100% אתנול למשך 30 שניות, ולאחר מכן לטבול פעמיים בקסילן. לאחר הסרת המדף מתמיסת הקסילן, הניחו לו להתייבש במיכל זכוכית כדי למנוע טפטוף קסילן בתוך מכסה המנוע.
- הר את המגלשה עם 2 טיפות של פתרון הרכבה. הניחו בזהירות את מגלשות הכיסוי כדי למנוע בועות והניחו לתמיסת ההרכבה להתייבש.
אזהרה: יש לטפל בקסילן בתוך מכסה מנוע ועם ציוד מגן מתאים.
- הפוך שקופיות לדיגיטליות על-ידי סריקתן באמצעות סורקי שקופיות, במידת האפשר. אם אפשרות זו אינה זמינה, השתמש במיקרוסקופ הפוך רגיל בהגדלה של 20-40x כדי לספור זקיקים ישירות. הקפד לצלם את הביופסיה כולה כדי להקל על מדידת השטח בתוכנת ניתוח תמונה.
3. ספירת זקיקים
- אם השקופיות עברו דיגיטציה, פתח את הקבצים באמצעות תוכנה מתאימה (לדוגמה, תוכנת קוד פתוח QuPath38). אם לא עבר דיגיטציה, בצע את הניתוח ישירות באמצעות מיקרוסקופ הפוך והתוכנה המתאימה לו.
- גרור את הקובץ לחלון הראשי של QuPath. הגדר את סוג התמונה ל- Brightfield H&E (ראה איור 1A). הגדר 1 מ"מ מהאפיתל של פני השטח (שכבה אחת של תאים קובואידים המרפדים את פני השטח) באמצעות סרגל קנה המידה. לחצו על כלי האליפסה והוסיפו הערות לזקיקים (ראו איור 1B).
- ספור את מספר הזקיקים באזור זה של 1 מ"מ, מהשלב הראשוני ועד השלב הראשוני. זהה את השלב של כל זקיק (ראשוני - שכבה של תאי גרנולוזה שטוחים המקיפים את הביצית; שלב ביניים - תערובת של תאי גרנולוזה שטוחים וקובואידיים; ראשוני - שכבה אחת מלאה של תאי גרנולוזה קובואידים המקיפים את הביצית).
- הזן את מזהה הדגימה, גיל, מספר הזקיקים עבור כל שקופית, עובי מקטע וחלקn שנספר בגיליון בשם זקיק במ"מ3 בקובץ Excel של מחשבון זקיק Z-score (ראה קובץ משלים 1 ואיור 2A).
הערה: בשל קוטר הזקיקים (הזקיקים הקטנים ביותר >35 מיקרומטר), אותו זקיק עשוי להופיע במקטעים עוקבים. יש לנקוט משנה זהירות בעת ספירת מקטעים שבהם המרחק בין המקטעים קטן מקוטר הזקיק. רצוי, לספור זקיקיםמכל סעיף 10 (למשל, סעיף #10, #20, #30). אפיתל פני השטח עשוי להתנתק במהלך עיבוד הרקמה ועשוי להיות נוכח רק באופן חלקי בשקופיות. לספור רק זקיקים עם ציטופלסמה גלויה. לצורך בקרת איכות, בקש משני אנשים לספור באופן עצמאי את הזקיקים ולקבוע עד כמה הספירה שלהם מתיישרת. חישוב קונקורדנציה בין צופים באמצעות פונקציית מתאם פשוטה בין ספירות הזקיקים של כל צופה עבור אותה דגימה.
- זהה את 10% הגדולים ביותר של הזקיקים בכל קטע שנספר על ידי גלגול עיניים. מדדו את הקוטר הממוצע של הביציות האלה על-ידי לחיצה על כלי הקו , ציור שני קווים ניצבים דרך קרום הביציות, בחירה באפשרות מדידה, ולאחר מכן הצגת מדידות ביאור (ראו איור 1C).
- רשום את המדידות מתחת לעמודה אורך מיקרומטר (ראה איור 1D). הזן את הקוטר הממוצע של כל הביציות בשדה קוטר ביציות ממוצע (μm) עבור כל שקופית בקובץ Excel של מחשבון זקיק Z-score (זקיק במ"מ3, ראה קובץ משלים 1 ואיור 2A).
- מקם את התמונה במרכז המסך ב- QuPath, ולאחר מכן לחץ על סמל ImageJ . בחר שלח תמונה אל ImageJ (ראה איור 3A). ב- ImageJ, תחמו 1 מ"מ מהגבול בעזרת הכלי מברשת . לחץ על התמונה, לאחר מכן הקלד ובחר 8 סיביות (ראה איור 3B).
- לחצו על כלי הקו , ציירו קו על סרגל קנה המידה בפינה השמאלית התחתונה של המסך (ראו איור 3C). לחצו על 'נתח', לאחר מכן על 'קבע קנה מידה', הזינו את האורך המצוין בסרגל קנה המידה בשדה 'מרחק ידוע', ולחצו על 'אשר ' (ראו איור 3C). לחצו על 'תמונה', לאחר מכן על 'התאמה', 'בהירות/ניגודיות' ובחרו 'אוטומטי ' (ראו איור תלת-ממדי).
- לחצו על Image, לאחר מכן על Adjust, Threshold ובחרו Auto (ראו איור 3E). לחץ על כלי השרביט , בחר את האזור ולאחר מכן הקש Ctrl + M (ראה איור 3F). הזן את ערך האזור בקובץ Excel של מחשבון זקיק Z-score (זקיק במ"מ3, ראה קובץ משלים 1 ואיור 2A).
4. צפיפות זקיקים, נפח קליפת המוח וחישובי ציון Z
- השתמש בקובץ Excel של מחשבון ציון Z של זקיק שסופק כדי לבצע באופן אוטומטי את החישובים המפורטים להלן. התוצאות יופיעו בגיליון "Z-score (follicle per mm³)" במחשבון Excel (ראה קובץ משלים 1), בתנאי שהפרטים המצוינים בסעיף 3 מוזנים בגיליון "זקיקים במ"מ³".
- כדי לחשב את צפיפות הזקיקים בסעיפים אלה, השתמש בנוסחה ששונתה שהוצגה על ידי Schmidt et al.32. ראשית, להחיל את גורם התיקון α כדי לקחת בחשבון ספירה כפולה של אותו זקיק. הנוסחה ששונתה היא כדלקמן:
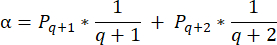
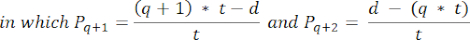
הערה: בנוסחה זו, t הוא עובי המקטע, d הוא קוטר הביצית, ו-q הוא המנה של קוטר הזקיק חלקי עובי המקטע. - הסק את המספר הכולל של זקיקים (n זקיקים) בקליפת המוח מספירת הזקיקים בקטע באמצעות הנוסחה הבאה33:
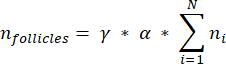
הערה: נוסחה זו לוקחת בחשבון גם את כל המקטעים שאינם מחושבים. כאן γ מייצג את מספר המקטעים שאינם מחושבים (למשל, γ = 10 אם כל קטע10 נספר), α הוא מקדם התיקון המחושב ב- 4.1, N הוא מספר הסעיפים שנספרו, ו - n i הוא המספר הכולל של זקיקים בקטעים שנספרו.- בצע אקסטרפולציה של כל נפח קליפת המוח (V) מהאזורים שנספרו באמצעות הנוסחה הבאה33:
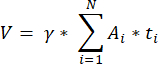
הערה: כאן, Ai הוא האזור של המקטע, ו - ti הוא עובי הרקמה. בדוק את שלב 4.2 עבור γ ו - N. - השתמש בנוסחההבאה 33 כדי לחשב את צפיפות הזקיק:
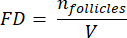
- בצע אקסטרפולציה של כל נפח קליפת המוח (V) מהאזורים שנספרו באמצעות הנוסחה הבאה33:
- קבע אם יש רזרבה שחלתית מופחתת (<-1.7 Z-score) על ידי חישוב ציון Z באמצעות הנוסחה33:
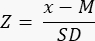
הערה: ציון Z מחושב באופן אוטומטי בגיליון "Z-score (זקיק למ"מ³)" במחשבון Excel (ראה קובץ משלים 1) בהתבסס על המידע המופיע בסעיף 3 (ספירת זקיקים) (איור 2B). בנוסחה זו, Z מייצג את ציון Z, x הוא צפיפות הזקיק המחושבת (זקיקים/ס"מ 3) של מדגם המחקר (שלב 4.4), M הוא צפיפות הזקיק הממוצעת של קבוצת הגיל המתאימה, ו-SD הוא סטיית התקן של קבוצת הגיל המתאימה. ערכי ייחוס לנשים בגילאי 0-25 שנים נקבעו בחסן ואח' 33. אמצעים וסטיות תקן של צפיפות זקיקים של קבוצות הגיל בהתאמה ניתן למצוא בקובץ Excel של מחשבון ציון Z של זקיק (קובץ משלים 1) ולהשתמש בהם לחישובי ציון Z.
תוצאות
זקיקי השחלות מכומתים לאחר חתך מוצלח, צביעה וסריקה של שקופיות. השלבים השונים ובריאות הזקיקים נבדלים ומנותחים עוד יותר. באיור 4A, מוצג חתך רוחב מוכתם ב-HE, של שחלה מקובעת Bouin ממבוגר, עם דוגמאות של רקמה קורטיקלית ומדולרית. איור 4B מראה תמונה מייצ?...
Discussion
נשים נולדות עם מאגר סופי של ביציות, שלא ניתן לחדש. שמורת השחלות היא גורם מפתח בפוטנציאל הרבייה של האישה. מאמר זה מתאר שיטה לכימות היסטולוגי של צפיפות זקיקים והשוואתה לתקני ייחוס באמצעות ציוני Z של צפיפות זקיקים בקליפת המוח בשחלות אצל מטופלות צעירות ונשים עד גיל 25.
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
ברצוננו להודות לאנשי המקצוע בתחום הבריאות שסייעו לנו בגיוס המשתתפים ואיסוף הרקמות ולכל המטופלות שתרמו את רקמת השחלה שלהן. אנו מודים גם לקרן סרטן הילדות (PR2020-0096) ולמכון קרולינסקה לדוקטורט במימון KID, שמימונם איפשר עבודה זו. ברצוננו להודות גם למתקן לניתוח פנוטיפ מורפולוגי על הכנת השקפים ההיסטולוגיים. אנו מודים לניקולה באיירס על עריכת כתב היד בשפה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
References
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved