É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Escores Z para avaliação da reserva ovariana em pacientes jovens submetidos à preservação da fertilidade
Neste Artigo
Resumo
O presente protocolo descreve um método para avaliar a reserva ovariana em pacientes com menos de 25 anos que necessitam de preservação da fertilidade por meio da criopreservação do tecido ovariano. Este método envolve: (1) avaliação histológica da reserva ovariana em amostras corticais, (2) comparação com um conjunto de dados de referência e (3) cálculo de escores Z.
Resumo
As mulheres nascem com um pool não renovável de folículos ovarianos, conhecido como reserva ovariana. Essa reserva consiste em folículos primordiais nos ovários e pode ser afetada por muitos fatores, como distúrbios genéticos e endócrinos, intervenções médicas e desreguladores endócrinos. A preservação da fertilidade é recomendada quando tratamentos gonadotóxicos são necessários. As opções preferidas para as mulheres são a criopreservação de oócitos e embriões. No entanto, em pacientes muito jovens e sexualmente imaturas, a criopreservação do tecido ovariano é a única opção. Conhecer a densidade folicular de amostras de tecido criopreservado é essencial no aconselhamento de fertilidade para pacientes jovens. Este protocolo demonstra o uso de escores Z para densidade folicular cortical como uma ferramenta para avaliar a qualidade do tecido ovariano em meninas e mulheres jovens com 25 anos ou menos que estão em preservação da fertilidade. A densidade folicular em amostras de pacientes é comparada aos padrões de referência normalizados por idade, desenvolvidos por Hassan et al. para estimar possíveis desvios do padrão. A densidade do folículo é medida por meio de quantificação histológica. Para isso, um pequeno pedaço de tecido cortical ovariano (~ 2 mm x 2 mm x 2 mm) é fixado em solução de Bouin ou formaldeído, embebido em parafina, seccionado com 4 μm de espessura, corado com hematoxilina e eosina e digitalizado usando um scanner de lâminas. Os estágios foliculares presentes no córtex variam de folículos primordiais a primários. A área cortical foi de 1 mm do epitélio superficial nos cortes histológicos. A densidade folicular é calculada usando uma fórmula modificada apresentada por Schmidt et al., e o escore Z é determinado usando a média de referência e o desvio padrão. O escore Z indica o quanto o valor medido se desvia da média de referência, determinando a reserva ovariana reduzida (<-1,7 escore Z). Com este método, as densidades foliculares podem ser usadas como uma medida valiosa da reserva ovariana para pacientes jovens que necessitam de preservação da fertilidade.
Introdução
O ovário é um órgão dinâmico e endocrinologicamente ativo, consistindo de um córtex externo e uma medula interna. Heterogeneamente distribuídos dentro dos ovários estão os folículos, que contêm o oócito gonadal circundado por células estromais da granulosa1. Todos os folículos já são formados durante o desenvolvimento fetal, atingindo o pico por volta das 20 semanas de idade gestacional, seguido por um declínio exponencial. Ao nascer, 1-2 milhões de folículos primordiais permanecem dentro do córtex e apenas algumas centenas de milhares de folículos sobrevivem até a puberdade2. O pool de folículos que não cresce, também conhecido como reserva ovariana, influencia a fertilidade da mulher, entre outros fatores. A reserva ovariana reside no córtex e se move para a medula à medida que os folículos crescem e amadurecem. Alguns pesquisadores reconhecem a reserva ovariana como sendo composta apenas por folículos primordiais, enquanto outros incluem todos os folículos unilaminares (ou seja, primordiais, intermediários e primários)3,4,5,6. Durante a vida de uma mulher, apenas 300-400 folículos amadurecem e sobrevivem para eventualmente passar pela ovulação. A menopausa começa quando o número de folículos cai para cerca de mil, o que geralmente ocorre por volta dos 50 anos de idade 2,7. Atualmente, há um debate em andamento sobre a presença de células-tronco oogoníacas (OSCs) em ovários humanos adultos que podem formar oócitos após o xenotransplante. Alguns estudos sugerem o isolamento de células que expressam um perfil genético de células germinativas primitivas e se diferenciam em oócitos 8,9, enquanto outros indicam que as supostas OSCs são células perivasculares dos vasos sanguíneos 10,11,12.
A insuficiência ovariana prematura (IOP) é definida pela interrupção do ciclo menstrual com níveis elevados de FSH antes dos 40 anosde idade 13. As causas da IOP são multifatoriais e podem ocorrer de forma idiopática; no entanto, muitas vezes surge como resultado de condições médicas14. Por exemplo, certas condições genéticas congênitas estão associadas à IOP devido a uma reserva ovariana reduzida já no nascimento, como a síndrome de Turner15. A IOP também pode ocorrer como efeito colateral dos tratamentos gonadotóxicos, o que é particularmente problemático em pacientes muito jovens, pois pode levar à incapacidade de se submeter à puberdade normal e prejudicar drasticamente a reserva ovariana. Dependendo do risco de IOP e da idade do paciente, várias opções de preservação da fertilidade estão disponíveis, como criopreservação de oócitos maduros, criopreservação de embriões após fertilização in vitro e criopreservação de tecido ovariano (OTC). Para pacientes pré-púberes, a OTC é a única opção viável devido à sua imaturidade sexual16,17. Nos Estados Unidos, a preservação da fertilidade por meio de OTC tem sido recentemente considerada uma rotina clínica aceitável18. No entanto, a venda de medicamentos isentos de venda livre ainda é considerada experimental em muitos países europeus, sendo necessária aprovação ética, particularmente para o autotransplante19,20. Portanto, os critérios de inclusão para protocolos OTC devem ser cuidadosamente considerados, e uma análise de risco-benefício deve ser realizada para cada paciente. Nem todas as crianças que recebem terapias gonadotóxicas são elegíveis para preservação da fertilidade. Na Suécia, recomenda-se que apenas pacientes com risco alto ou muito alto sejam submetidos à preservação da fertilidade de acordo com as diretrizes sobre preservação da fertilidade da Sociedade Nórdica de Hematologia e OncologiaPediátrica 21. Este grupo inclui (1) crianças pré e pós-púberes que necessitam de transplante de células-tronco ou recebem radioterapia com o ovário no campo de alcance, e (2) crianças pós-púberes com altas doses cumulativas de quimioterapia alquilante. Para meninas antes da menarca, os critérios de inclusão para risco muito alto de infertilidade incluem aquelas tratadas com qualquer um dos seguintes: dose de radiação >10 Gy no ovário ou terapia com células-tronco hematopoiéticas (TCTH) alogênicas ou autólogas. Os critérios de exclusão incluem aqueles que precisam de hemoderivados adicionais para outras preparações anticoagulantes antes da cirurgia ou têm uma contagem de neutrófilos <1. Para meninas/mulheres após a menarca, os critérios de inclusão para risco alto ou muito alto de infertilidade incluem aquelas tratadas com qualquer um dos seguintes: dose de radiação >10 Gy no ovário ou TCTH alogênico, ciclofosfamida >9 g/m², ifosfamida >60 g/m², procarbazina ou compostos de nitrosoureia (BCNU/CCNU) >360 mg/m². Os critérios de exclusão incluem aqueles com risco aumentado de sangramento, aumento do risco de infecção, aumento do risco de complicações cirúrgicas ou aumento do risco de problemas de dor, conforme avaliado pelo médico responsável.
Para a OTC, o tecido ovariano é coletado durante cirurgias abdominais por laparotomia ou laparoscopia por meio de ooforectomia ou biópsia unilateral. A medula é removida do tecido ovariano coletado e o córtex restante é então seccionado em fragmentos menores para criopreservação por meio de congelamento ou vitrificação em taxa controlada para uso posterior na restauração da fertilidade22. As amostras são então armazenadas em nitrogênio líquido até que o paciente se recupere do tratamento e deseje constituir família. Dependendo do tipo de câncer e na ausência de contra-indicações ao transplante de tecido ovariano, o tecido é então descongelado e autoenxertado para restaurar a função hormonal e ovariana. A OTC tem se mostrado bem-sucedida, com uma taxa de gravidez de 50% e mais de 200 nascidos vivos relatados após enxerto de tecido ovariano criopreservado coletado durante a idade adulta 23,24,25. Os nascidos vivos relatados após o autotransplante de tecido ovariano coletado durante a infância são poucos, e nenhum foi relatado após o autotransplante de tecido ovariano indubitavelmente pré-púbere 26,27,28,29,30. A qualidade do tecido é um pré-requisito para a restauração bem-sucedidada fertilidade 31. Portanto, é essencial estudar a qualidade das amostras de tecido coletadas.
Atualmente, uma forma de estimar a qualidade do tecido ovariano é por meio de cortes histológicos e contagem manual dos folículos. No entanto, avaliar a normalidade da densidade folicular é difícil devido ao declínio natural da reserva com o aumento da idade e à distribuição heterogênea dos folículos. Além disso, a comparação com os valores de referência é um desafio, pois eles não são padronizados para o tamanho e a idade da biópsia. Outras opções de avaliação, como níveis séricos de AMH ou coloração de tecido digerido com calceína ou vermelho neutro, não estão bem estabelecidas ou apresentam suas próprias limitações. Wallace e Kelsey publicaram anteriormente um modelo de reserva ovariana normal ao longo da idade, coletando dados sobre o número de folículos de ováriosinteiros de pacientes sem patologias ovarianas conhecidas. Além disso, como as biópsias não são representativas de todo o ovário, Schmidt et al. desenvolveram um método para estimar o número total de folículos com base em biópsias corticais32. Usando uma versão modificada deste método e o modelo de reserva ovariana normal, foi estabelecido um conjunto de dados de referência para a densidade folicular de mulheres de 0 a 25 anos33.
Este artigo descreve a estratégia para avaliar a normalidade da densidade folicular com base em pequenas amostras ovarianas por (1) quantificação direta dos folículos usando histologia e (2) comparação dos resultados com referências padrão normalizadas por idade por meio de escores Z. O uso de escores Z descreve a relação da densidade folicular de uma biografia ovariana com a média de um grupo de referência padronizado por idade e tamanho. Isso será de grande valor para os médicos no aconselhamento de seus pacientes para autotransplante e tratamento adicional após a preservação da fertilidade.
Protocolo
Todos os procedimentos realizados foram aprovados pela Autoridade Sueca de Revisão Ética (pacientes com Sveafertil, Dnr: 2019-03802) e pelo Comitê de Ética do Hospital Universitário de Helsinque (pacientes com HCH, Dnr 340/13/03/03/2015). Informações escritas e orais sobre o estudo foram fornecidas pelas enfermeiras pesquisadoras, e o consentimento informado foi obtido de acordo com a Declaração de Helsinque. Para os pacientes menores de 18 anos, o consentimento informado foi obtido dos responsáveis legais. Todas as amostras foram pseudonimizadas e processadas de acordo com o Regulamento Geral de Proteção de Dados (GDPR) europeu. Os detalhes dos reagentes e equipamentos usados neste estudo estão listados na Tabela de Materiais.
1. Coleta e processamento de tecido ovariano
NOTA: Identifique todos os pacientes elegíveis para preservação da fertilidade quando houver indicação de risco alto ou muito alto de infertilidade seguindo as diretrizes locais (por exemplo, diretrizes específicas nórdicas, europeias ou internacionais). Na Europa, recrute pacientes menores de idade apenas como parte de programas de pesquisa de preservação da fertilidade. Determine o risco de infertilidade usando as diretrizes do seu país para preservação da fertilidade.
- Realize o procedimento cirúrgico sob anestesia geral. Administre propofol intravenoso (2 mg / kg), sufentanil (0,5 micrograma / kg) e brometo de rocurônio (0,6 mg / kg) para a indução da anestesia.
- Intubar e ventilar o paciente com um volume corrente de 6-8 mL/kg e pressão expiratória positiva de 6-8 cm de H2O. Administrar sevoflurano 1% a 2% através do tubo endotraqueal para manter a anestesia inalatória.
- Manter o bloqueio neuromuscular com brometo de rocurônio (0,15 mg/kg) durante o procedimento cirúrgico para proporcionar relaxamento muscular adequado e permitir a laparoscopia com pressões de insuflação intra-abdominal mais baixas.
- Use o índice bispectral para guiar a profundidade do anestésico para facilitar o despertar rápido com uma dose reduzida de anestésico. Antagonize o bloqueio neuromuscular residual com sugamadex (2-4 mg/kg).
- Usando uma técnica de três portas, insira um trocarte de 10 mm na cavidade peritoneal no umbigo para introduzir uma lente óptica com uma câmera acoplada e dois trocartes de 5 mm nas regiões ilíacas esquerda e direita (2 cm acima e 2 cm medial à respectiva espinha ilíaca ântero-superior) sob visão direta para a instrumentação cirúrgica e recuperação de tecido. Inspecione os órgãos pélvicos, incluindo ambos os ovários, para confirmar a normalidade.
- Identifique o ovário mais fácil de acessar e agarre-o. Corte um volume que seja aproximadamente um terço do ovário (ou conforme indicado em sua licença ética) e, em seguida, use diatermia, se necessário, para garantir a hemostasia.
NOTA: Realize a biópsia somente se não houver contraindicações, como fatores de risco para hemorragia intra ou pós-operatória excessiva ou aumento do risco de infecção. Especifique claramente e siga os critérios de inclusão e exclusão do país. O ovário inteiro pode ser tomado se o risco de infertilidade for muito alto e/ou o risco de cortar apenas uma parte for considerado muito alto (por exemplo, devido a sangramento). Evite usar diatermia antes de coletar a amostra, pois pode danificar o tecido.
- Identifique o ovário mais fácil de acessar e agarre-o. Corte um volume que seja aproximadamente um terço do ovário (ou conforme indicado em sua licença ética) e, em seguida, use diatermia, se necessário, para garantir a hemostasia.
- Enquanto estiver na sala de cirurgia, coloque o tecido em um tubo contendo 5 mL de 1x Dulbecco's Phosphate Buffer Saline (PBS) com CaCl2, MgCl2, 1 g/L D-glicose, 36 mg/L piruvato, aquecido a 37 °C se a amostra for imediatamente processada no laboratório (dentro de 30 min) ou mantido a 4 °C durante transportes mais longos (até 24 h).
NOTA: As soluções de transporte incluem uma variedade de soluções de transporte/perfusão de órgãos disponíveis comercialmente, bem como tampões simples, como PBS e MEM34. - Corte um pequeno pedaço do tecido ovariano (2 mm x 2 mm x 2 mm) da superfície do ovário. Esta peça contém o córtex, que é a porção externa do ovário onde os folículos ovarianos são encontrados35.
CUIDADO: Manuseie tecidos humanos, como o ovário, usando práticas e procedimentos de Nível 2 de Biossegurança.
NOTA: Uma unidade especializada em medicina reprodutiva criopreserva clinicamente o resto do tecido ovariano para uso futuro potencial na restauração da fertilidade dos pacientes. - Coloque o tecido em 350 μL de solução de Bouin em temperatura ambiente por 2 h ou em 350 μL de formaldeído a 4% a 4 ° C durante a noite, garantindo que o tecido esteja totalmente submerso. Após a incubação, lave o tecido com etanol a 70% três vezes.
- Para a solução de Bouin, lave até que a cor amarela desapareça. Incorpore o tecido em cera de parafina36. Corte um mínimo de 30 seções de tecido em série com uma espessura de 4 μm e coloque-as em lâminas de vidro.
CUIDADO: Manuseie a solução de Bouin e o formaldeído dentro de uma capa química e com equipamento de proteção adequado.
NOTA: O formaldeído pode levar a artefatos relacionados ao encolhimento no tecido. A solução de Bouin é, portanto, a escolha preferida para preservar a histologia. No entanto, a solução de Bouin traz riscos adicionais, levando várias instituições a preferir o uso de formaldeído37.
- Para a solução de Bouin, lave até que a cor amarela desapareça. Incorpore o tecido em cera de parafina36. Corte um mínimo de 30 seções de tecido em série com uma espessura de 4 μm e coloque-as em lâminas de vidro.
2. Coloração de hematoxilina e eosina (H&E)
- Pesar 5 g de pó de eosina Y em um frasco de vidro autoclavado de 100 mL. Adicione 800 mL de etanol a 95% e 200 mL de água deionizada para fazer uma solução estoque de eosina a 0,5%. Prepare uma solução de trabalho de eosina a 0,25% diluindo 200 mL da solução estoque de eosina a 0,5% com 160 mL de etanol a 100%, 1 mL de ácido acético e 40 mL de água deionizada.
NOTA: O pó pode não se dissolver completamente. Filtre a solução antes de usar para reduzir o precipitado. - Coloque as lâminas em prateleiras. Mergulhe o rack com corrediças nos recipientes correspondentes na seguinte ordem: 15 min em xileno, 5 min em etanol 100%, mergulhe 10 vezes em etanol 70%, mergulhe 10 vezes em etanol 50% e, em seguida, mergulhe 10 vezes em água deionizada.
- Mergulhe o rack com lâminas em solução de hematoxilina por 3 min e, em seguida, transfira o rack com lâminas para um recipiente com água da torneira destilada por 30 s para remover o excesso de mancha de hematoxilina.
- Coloque a grelha com lâminas em um recipiente com solução de diferenciação (1 mL de HCl a 37% adicionado a 100 mL de etanol a 70%) por 1 min, depois transfira a grelha com lâminas para um recipiente com água da torneira destilada por 30 s.
NOTA: Certifique-se de que as seções de tecido estejam submersas no líquido. Adicione mais reagente ao recipiente, se necessário. Troque o xileno a cada 5 usos ao manchar grandes quantidades. Prepare etanol a 50% diluindo etanol a 70% (por exemplo, adicione 35 mL de etanol a 70% a 15 mL de DPBS para fazer 50 mL de etanol a 50%).
CUIDADO: Manuseie o xileno dentro de um capuz e com equipamento de proteção adequado.
- Coloque o rack com lâminas na água da torneira de Scott (também conhecida como solução azulada) por 30-60 s e, em seguida, transfira o rack com slides para um recipiente com água da torneira destilada por 30 s. Mergulhe o rack com lâminas na solução de trabalho eosin por 1 min.
- Desidrate as lâminas colocando-as nos seguintes reagentes: etanol 100% por 30 s, um segundo recipiente com etanol 100% por 30 s e, em seguida, mergulhe duas vezes em xileno. Depois de remover a grade da solução de xileno, deixe-a secar em um recipiente de vidro para evitar que o xileno pingue dentro do exaustor.
- Monte a corrediça com 2 gotas de solução de montagem. Coloque cuidadosamente as corrediças da tampa para evitar bolhas e deixe a solução de montagem secar.
CUIDADO: Manuseie o xileno dentro de um capuz e com equipamento de proteção adequado.
- Digitalize slides digitalizando-os usando scanners de slides, se possível. Se esta opção não estiver disponível, use um microscópio invertido comum com ampliação de 20-40x para contar diretamente os folículos. Certifique-se de tirar uma imagem de toda a biópsia para facilitar a medição da área no software de análise de imagem.
3. Contagem de folículos
- Se os slides foram digitalizados, abra os arquivos usando o software apropriado (por exemplo, o software de código aberto QuPath38). Se não digitalizado, realize a análise diretamente usando um microscópio invertido e seu respectivo software.
- Arraste o arquivo para a janela principal do QuPath. Defina o tipo de imagem para Campo claro H&E (consulte a Figura 1A). Defina 1 mm do epitélio da superfície (uma única camada de células cuboidais que revestem a superfície) usando a barra de escala. Clique na ferramenta de elipse e anote os folículos (veja a Figura 1B).
- Conte o número de folículos dentro dessa área de 1 mm, desde o estágio primordial até o primário. Identifique o estágio de cada folículo (primordial - uma camada de células da granulosa achatada ao redor do oócito; estágio intermediário - uma mistura de células da granulosa achatada e cuboidal; primário - uma camada completa de células da granulosa cuboidal ao redor do oócito).
- Insira o ID da amostra, idade, número de folículos para cada lâmina, espessura da seção e nésima seção contada na folha chamada Folículo em mm3 no arquivo Excel da calculadora Folículo Z-score (consulte Arquivo Suplementar 1 e Figura 2A).
NOTA: Devido ao diâmetro dos folículos (folículos menores >35 μm), o mesmo folículo pode aparecer em seções consecutivas. Tenha cuidado extra ao contar seções em que a distância entre as seções é menor que o diâmetro do folículo. De preferência, conte os folículos a cada 10ª seção (por exemplo, seção # 10, # 20, # 30). O epitélio da superfície pode se desprender durante o processamento do tecido e pode estar apenas parcialmente presente nas lâminas. Conte apenas folículos com citoplasma visível. Para controle de qualidade, peça a duas pessoas que contem os folículos de forma independente e determinem o alinhamento de suas contagens. Calcule a concordância interobservador usando uma função de correlação simples entre as contagens de folículos de cada observador para a mesma amostra.
- Identifique os 10% maiores dos folículos em cada seção contada por globo ocular. Meça o diâmetro médio desses oócitos clicando na ferramenta de linha , desenhando duas linhas perpendiculares através da membrana do oócito e selecionando Medir e, em seguida, Mostrar medidas de anotação (consulte a Figura 1C).
- Registar as medições na coluna «Comprimento μm» (ver figura 1D). Insira o diâmetro médio de todos os oócitos no campo Diâmetro médio do oócito (μm) para cada lâmina no arquivo Excel da calculadora de pontuação Z do folículo (Folículo em mm3, consulte o Arquivo Suplementar 1 e a Figura 2A).
- Coloque a imagem no centro da tela no QuPath e clique no ícone ImageJ . Selecione Enviar instantâneo para ImageJ (consulte a Figura 3A). No ImageJ, demarque 1 mm da borda usando a ferramenta pincel . Clique na imagem, depois em Tipo e selecione 8 bits (consulte a Figura 3B).
- Clique na ferramenta de linha , desenhe uma linha na barra de escala no canto inferior esquerdo da tela (consulte a Figura 3C). Clique em Analyze (Analisar), depois em Definir escala, insira o comprimento indicado na barra de escala no campo Distância conhecida e clique em OK (consulte a Figura 3C). Clique em Imagem, depois em Ajustar, Brilho/Contraste e selecione Auto (consulte a Figura 3D).
- Clique em Image, depois em Adjust, Threshold e selecione Auto (consulte a Figura 3E). Clique na ferramenta varinha , selecione a área e pressione Ctrl + M (consulte a Figura 3F). Insira o valor da área no arquivo Excel da calculadora Folículo Z-score (Folículo em mm3, consulte o Arquivo Suplementar 1 e a Figura 2A).
4. Cálculos de densidade folicular, volume cortical e escore Z
- Use o arquivo Excel da calculadora Follicle Z-score fornecido para executar automaticamente os cálculos descritos abaixo. Os resultados aparecerão na planilha "Z-score (folículo por mm³)" na calculadora Excel (ver Arquivo Suplementar 1), desde que os detalhes indicados na seção 3 sejam inseridos na planilha "folículos em mm³".
- Para calcular as densidades foliculares nessas seções, use a fórmula modificada apresentada por Schmidt et al.32. Primeiro, aplique o fator de correção α para contabilizar a contagem dupla do mesmo folículo. A fórmula modificada é a seguinte:
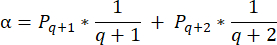
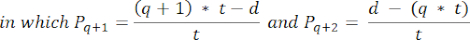
NOTA: Nesta fórmula, t é a espessura da seção, d é o diâmetro do oócito e q é o quociente do diâmetro do folículo dividido pela espessura da seção. - Extrapole o número total de folículos (n folículos) no córtex a partir da contagem de folículos na seção usando a seguinte fórmula33:
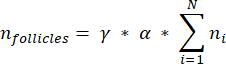
NOTA: Esta fórmula também leva em conta todas as seções não calculadas. Aqui γ representa o número de seções que não são calculadas (por exemplo, γ = 10 se cada 10seções são contadas), α é o fator de correção calculado em 4.1, N é o número de seções contadas e n i é o número total de folículos nas seções contadas.- Extrapolar todo o volume cortical (V) das áreas contadas usando a seguinte fórmula33:
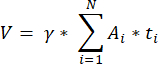
NOTA: Aqui, Ai é a área da seção e ti é a espessura do tecido. Verifique a etapa 4.2 para γ e N. - Use a seguinte fórmula33 para calcular a densidade do folículo:
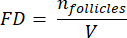
- Extrapolar todo o volume cortical (V) das áreas contadas usando a seguinte fórmula33:
- Determine se há reserva ovariana reduzida (<-1,7 Z-score) calculando o Z-score usando a fórmula33:
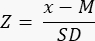
NOTA: O Z-score é calculado automaticamente na planilha "Z-score (folículo por mm³)" na calculadora Excel (consulte o Arquivo Suplementar 1) com base nas informações fornecidas na Seção 3 (Contagem de folículos) (Figura 2B). Nesta fórmula, Z representa o escore Z, x é a densidade folicular calculada (folículos/cm3) da amostra do estudo (etapa 4.4), M é a densidade folicular média da respectiva faixa etária e DP é o desvio padrão da respectiva faixa etária. Valores de referência para mulheres de 0 a 25 anos foram estabelecidos em Hassan et al.33. As médias e desvios-padrão das densidades foliculares das respectivas faixas etárias podem ser encontradas no arquivo Excel da calculadora Folículo Z-score (Arquivo Suplementar 1) e usadas para os cálculos do Z-score.
Resultados
Os folículos ovarianos são quantificados após secção, coloração e digitalização bem-sucedidas das lâminas. Os diferentes estágios e saúde dos folículos são distinguidos e analisados posteriormente. Na Figura 4A, é exibida uma seção transversal corada com HE de um ovário fixado em Bouin de um adulto, com exemplos de tecido cortical e medular. A Figura 4B mostra uma imagem representativa do ovário de uma crianç...
Discussão
As mulheres nascem com um pool finito de oócitos, que não pode ser reabastecido. A reserva ovariana é um determinante chave do potencial reprodutivo de uma mulher. Este artigo descreve um método para a quantificação histológica da densidade folicular e sua comparação com padrões de referência usando escores Z de densidades de folículos corticais ovarianos em pacientes jovens e mulheres de até 25 anos de idade.
Neste protocolo, o tecido ovariano é...
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer aos profissionais de saúde que nos ajudaram no recrutamento de participantes e coleta de tecidos e a todas as pacientes que doaram seu tecido ovariano. Também agradecemos ao Fundo de Câncer Infantil (PR2020-0096) e ao Karolinska Institutet PhD que financia o KID, cujo financiamento tornou este trabalho possível. Gostaríamos também de agradecer ao Centro de Análise de Fenótipo Morfológico pela preparação das lâminas histológicas. Agradecemos a Nicola Byers pela edição de linguagem deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco's Phosphate Buffered Saline | Thermo Fisher | 14190144 | |
| 1x Phosphate Buffered Saline w/ CaCl2, MgCl2, 1 g/L D-glucose, 36 mg/L pyruvate | Thermo Fisher | 14287-080 | |
| 37% Hydrochloric acid | Sigma-Aldrich | 1.09057.1000 | |
| 70% ethanol | Histolabs | 01370.01L | |
| 95% ethanol | Fisher scientific | 10572143 | |
| Absolute ethanol | Histolabs | 01399.01L | |
| Bouin's solution | Sigma-Aldrich | HT10132-1L | |
| Eosin Y Free acid | Sigma-Aldrich | E4009-5G | |
| Formaldehyde | Thermo Fisher | 28908 | |
| Haematoxylin solution according to Delafield | Sigma-Aldrich | 03971-250ML | |
| ImageJ | |||
| Microsoft Excel | |||
| Microtome | |||
| Pertex mounting solution | Histolabs | 00840-05 | |
| Propofol | Baxter Holding B.V. | N01AX10 | ATC-code provided instead of catalog number |
| QuPath | https://qupath.github.io/ | ||
| Rocuronium bromide | B. Braun Melsungen AG | M03AC09 | ATC-code provided instead of catalog number |
| Scott's tap water substitute concentrate | Sigma-Aldrich | S5134-6x100ml | |
| Sevoflurane | Baxter Medical AB | N01AB08 | ATC-code provided instead of catalog number |
| Slide scanner | |||
| Sufentanil | Hameln Pharma gmbh | N01AH03 | ATC-code provided instead of catalog number |
| Sugammadex | Baxter Holding B.V. | V03AB35 | ATC-code provided instead of catalog number |
| SuperFrost plus white | Histolabs | 06400 | |
| SuperFrost Plus White microscope slides | Histolabs | 06400 | |
| Xylene | Saveen Werner | 131769.1611 |
Referências
- Richards, J. A. S. The ovarian cycle. Vitam Horm. 107, 1-25 (2018).
- Wallace, W. H. B., Kelsey, T. W. Human ovarian reserve from conception to the menopause. PLoS One. 5 (1), 1-9 (2010).
- Monniaux, D., et al. The ovarian reserve of primordial follicles and the dynamic reserve of antral growing follicles: What is the link. Biol Reprod. 90 (4), 1-11 (2014).
- Gougeon, A., Trounson, A., Gosden, R., Eichenlaub-Ritter, U. . The early stages of follicular growth in biology and pathology of the oocyte. , 50-61 (2013).
- Gougeon, A. Human ovarian follicular development: From activation of resting follicles to preovulatory maturation. Ann Endocrinol. 71 (3), 132-143 (2010).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and non-growing follicle counts according to the stages of reproductive aging workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Gold, E. B. The timing of the age at which natural menopause occurs. Obstet Gynecol Clin North Am. 38 (3), 425-440 (2011).
- Alberico, H., et al. Workflow optimization for identification of female germline or oogonial stem cells in human ovarian cortex using single-cell RNA sequence analysis. Stem Cells. 40, 523-536 (2022).
- White, Y. A. R., et al. Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women. Nat Med. 18 (3), 413-422 (2012).
- Wagner, M., et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun. 11, 1147 (2020).
- Yoshihara, M., et al. In reply: Revisiting claims of the continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41 (2), 205-206 (2023).
- Yoshihara, M., et al. The continued absence of functional germline stem cells in adult ovaries. Stem Cells. 41, 105-110 (2023).
- Van Kasteren, Y. M., Schoemaker, J. Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Hum Reprod Update. 5 (5), 483-492 (1999).
- McGlacken-Byrne, S. M., Conway, G. S. Premature ovarian insufficiency. Best Pract Res Clin Obstet Gynaecol. 81, 98-110 (2022).
- Viuff, M., Gravholt, C. H. Turner syndrome and fertility. Ann Endocrinol. 83 (4), 244-249 (2022).
- Poirot, C., et al. Ovarian tissue cryopreservation for fertility preservation in 418 girls and adolescents up to 15 years of age facing highly gonadotoxic treatment: Twenty years of experience at a single center. Acta Obstet Gynecol Scand. 98 (5), 630-637 (2019).
- Jensen, A. K., et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: Focus on pubertal development. Hum Reprod. 32 (1), 154-164 (2017).
- The Practice Committee of the American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: A committee opinion. Fertil Steril. 112 (6), 1022-1033 (2019).
- . ART Fact Sheet Available from: https://www.eshre.eu/Press-Room/Resources (2020)
- Antonouli, S., et al. A comprehensive review and update on human fertility cryopreservation methods and tools. Front Vet Sci. 10, 1151254 (2023).
- Bahroudi, Z., et al. Review of ovarian tissue cryopreservation techniques for fertility preservation. J Gynecol Obstet Hum Reprod. 51 (2), 102290 (2022).
- Jensen, A. K., et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34 (3), 325-336 (2017).
- Donnez, J., Dolmans, M. -. M. Fertility preservation in women. N Engl J Med. 377 (17), 1657-1665 (2017).
- Dolmans, M. M., Falcone, T., Patrizio, P. Importance of patient selection to analyze in vitro fertilization outcome with transplanted cryopreserved ovarian tissue. Fertil Steril. 114 (2), 279-280 (2020).
- Demeestere, I., et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod. 30 (9), 2107-2109 (2015).
- Ernst, E., Kjærsgaard, M., Birkebæk, N. H., Clausen, N., Andersen, C. Y. Case report: Stimulation of puberty in a girl with chemo- and radiation therapy-induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. Eur J Cancer. 49 (4), 911-914 (2013).
- Rodriguez-Wallberg, K. A., et al. Successful pregnancies after transplantation of ovarian tissue retrieved and cryopreserved at time of childhood acute lymphoblastic leukemia - a case report. Haematologica. 106 (10), 2783-2787 (2021).
- Matthews, S. J., Picton, H., Ernst, E., Andersen, C. Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol. 70 (4), 432-435 (2018).
- Kristensen, S. G., et al. Use of cryopreserved ovarian tissue in the Danish fertility preservation cohort. Fertil Steril. 116 (4), 1098-1106 (2021).
- Donfack, N. J., et al. Expectations and limitations of ovarian tissue transplantation. Zygote. 25 (4), 391-403 (2017).
- Schmidt, K. L. T., Byskov, A. G., Andersen, A. N., Müller, J., Andersen, C. Y. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries. Hum Reprod. 18 (6), 1158-1164 (2003).
- Hassan, J., et al. Reference standards for follicular density in ovarian cortex from birth to sexual maturity. Reprod Biomed Online. 47, 103287 (2023).
- Vilela, J. d. e. M. V., Dolmans, M. M., Amorim, C. A. Ovarian tissue transportation: A systematic review. Reprod Biomed Online. 42 (2), 351-365 (2021).
- Gibson, E., Mahdy, H. . Anatomy, abdomen and pelvis, ovary. , (2023).
- Nagaraj, A. S., et al. Establishment and analysis of tumor slice explants as a prerequisite for diagnostic testing. J Vis Exp. (141), e58569 (2018).
- Adeniran, B. V., Bjarkadottir, B. D., Appeltant, R., Lane, S., Williams, S. A. Improved preservation of ovarian tissue morphology that is compatible with antigen detection using a fixative mixture of formalin and acetic acid. Hum Reprod. 36 (7), 1871-1890 (2021).
- Bankhead, P., et al. QuPath: Open-source software for digital pathology image analysis. Sci Rep. 7 (1), 1-7 (2017).
- Björvang, R. D., et al. Persistent organic pollutants and the size of ovarian reserve in reproductive-aged women. Environ Int. 155, 106589 (2021).
- Kwok, R., Johnson, N. P. Ovarian biopsy has no role as a routine diagnostic test of ovarian reserve: A systematic review. Reprod Biomed Online. 24, 492-495 (2012).
- Ahmad, A., et al. High-throughput spatial sensitive, quantitative phase microscopy using low spatial and high temporal coherent illumination. Sci Rep. 11 (1), 1-13 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados