Method Article
تزجيج أنسجة قشرة المبيض لتحقيق حالة زجاجية من التراكم
In This Article
Summary
يتم تقديم بروتوكول لتزجيج أنسجة المبيض ، كطريقة بديلة للحفظ بالتبريد لبروتوكول التجميد البطيء المستخدم على نطاق واسع.
Abstract
يعد حفظ أنسجة المبيض بالتبريد (OTC) خيارا مهما للحفاظ على الخصوبة. بالنسبة للمرضى الذين لا يمكن تأجيل علاجاتهم السامة للغدد التناسلية أو للفتيات قبل سن البلوغ ، غالبا ما يكون الخيار الوحيد لحماية الخصوبة. يمكن إجراء الحفظ بالتبريد إما عن طريق التزجيج أو عن طريق التجميد البطيء. التجميد البطيء هو النهج القياسي حاليا. يشير عدد متزايد من الدراسات إلى أن التزجيج يمكن أن يحل محل التجميد البطيء في مختبرات الإخصاب في المختبر الحديثة (IVF) ، مما يحسن بشكل كبير معدلات البقاء على قيد الحياة في الذوبان ويبسط الجوانب التقنية للحفظ بالتبريد. تم وصف بروتوكول عالي الإنتاجية قائم على الشبكة المعدنية للتزجيج السريع لأنسجة قشرة المبيض ، وهو مناسب للروتين السريري. يضمن تعقيم الشبكات المعدنية والنيتروجين السائل جودة عالية ، وتلبية معايير ممارسات التصنيع الجيدة (GMP). تم إجراء التزجيج لضمان معدلات تبريد فائقة السرعة. بدلا من الذوبان ببطء ، تم تسخين العينات بسرعة. لتقييم صلاحية البصيلات ، تم إجراء تلطيخ الكالسين قبل الحفظ بالتبريد وبعد الاحترار السريع. تم الإبلاغ عن التطبيق الناجح للتزجيج والاحترار السريع باستخدام الشبكات المعدنية. لم يلاحظ أي فروق ذات دلالة إحصائية في صلاحية البصيلات قبل التزجيج وبعد الاحترار السريع. تثبت هذه النتائج القدرة العالية على تزجيج الأنسجة للتطبيقات الروتينية السريرية كبديل محتمل لطريقة التجميد البطيء المستخدمة على نطاق واسع.
Introduction
يعد الحفاظ على أنسجة المبيض بالتبريد خيارا مهما للحفاظ على الخصوبة. يتم الحفاظ على الأنسجة المزروعة التي تحتوي على بصيلات المبيض ، والتي يتم تضمين البويضات فيها. بعد التخزين ، يمكن إذابة أنسجة المبيض وتسخينها وإعادة زراعتها في المريض. بالنسبة للخلايا أو الأنسجة القابلة للحياة ، تتوفر طريقتان للحفظ بالتبريد: التجميد البطيء والتزجيج1.
يستخدم التزجيج للحفاظ على المواد البيولوجية ، مثل الأجنة والبويضات ، بمعدلات بقاء أعلى مقارنة ببروتوكول التجميد البطيء1،2،3،4. التجميد البطيء له قيود ، مثل تكوين بلورات الجليد ، والتي يمكن أن تلحق الضرر بهياكل الخلايا والأنسجة. ومع ذلك ، فإن التجميد البطيء هو نهج مهم للحفظ بالتبريد يسهل تخزين العينات البيولوجية على المدى الطويل ، وقد أثبتت وظيفة هذه الطريقة على نطاقواسع 5. يؤدي التزجيج إلى حالة زجاجية من التراكم ، مما يمنع تكوين بلورات الجليد6،7. على المستوى الفني ، يبسط التزجيج بشكل كبير إجراء الحفظ بالتبريد عن طريق تقليل صيانة المعدات ، وتقليل احتمالية حدوث أخطاء فنية ، وتقصير مدة عملية الحفظ بالتبريد8،9. في الحفاظ على خصوبة الإناث ، يعد حفظ أنسجة المبيض بالتبريد نهجا حاسما قبل علاج السرطان10. أثبتت مجموعات مختلفة بنجاح مفهوم حفظ الأنسجة بالتبريد وإذابتها وزرعها بناء على بروتوكول التجميد البطيء11،12،13،14 ، والذي يعتبر حاليا النهج القياسي15.
يعتبر تزجيج أنسجة المبيض طريقة بديلة واعدة16،17،18،19،20،21 ، من حيث توفير الموارد22 ، ومعدلات بقاء البصيلات ، ومستويات تجزئة الحمض النووي ، وإمكانات الأوعية الدموية المتوازنة23،24،25،26،27. يتم إثبات ذلك من خلال عمليات التسليم الناجحة في اليابان28 ، والولايات المتحدةالأمريكية 29 ، وألمانيا30.
تتعارض مقارنة الخيارين لتزجيج أنسجة المبيض بالتبريد (OTC) مقابل الإجراء القياسي لنتائج التجميد البطيء جزئيا في التحليلات التلويةالحالية 16. قد تكون هناك عدة عوامل قد ساهمت في ذلك ، حيث تختلف بروتوكولات التزجيج الحالية اختلافا كبيرا. تشمل هذه الاختلافات اختيار مادة الواقيات بالتبريد أو مجموعة من المواد الواقية ، وتركيزها ، وتكوين الوسائط التي تصرف بدون وصفة طبية ، وحجم شظايا الأنسجة ، والجهاز المستخدم كحامل للأنسجة. وفقا لذلك ، لا يوجد بروتوكول احترار موحد.
نظرا لأن المؤلفين وجدوا طريقة تؤدي إلى نتائج مقنعة من حيث المعالجة ، والجدوى ، وظهور موت الخلايا المبرمج ، وإطلاق العوامل الوعائية ، وحتى تقرير عن الولادة بعد إعادة الزرع9،27 ، يتم توفير وصف مفصل للغاية للبروتوكول. تقدم الطريقة الموصوفة بروتوكولا صالحا وفعالا قد يساهم في توحيد تزجيج أنسجة المبيض.
Protocol
تمت الموافقة على الدراسة من قبل لجنة الأخلاقيات في مستشفى بون الجامعي (007/09). تم الحصول على موافقة خطية مستنيرة من كل مريض. تضمنت مجموعة الدراسة أنسجة المبيض البشري من 50 مريضا بمتوسط عمر 27.4 عاما قبل الحفظ بالتبريد ، كما هو موضح في الشكل 1. الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تحضير أجهزة التحميل
- قم بإعداد مقص جراحي وشبكات معدنية للتخصيص. قم بقص الشبكات إلى شرائح بقياس 25 مم × 8 مم ، كما هو موضح في الشكل 2 أ.
- ضع الشبكات المعدنية المخصصة في حاوية تعقيم وأوتوكلاف لمدة ساعتين (الشكل 2 ب). بعد التعقيم ، ضع حاوية التعقيم وقوارير 1.8 مل تحت مقعد التدفق الرقائقي.
- قم بتشغيل الأشعة فوق البنفسجية (UV) لمقعد التدفق الصفحي لمدة 30 دقيقة للتعقيم الإضافي عند الطول الموجي 254 نانومتر.
- افتح حاوية التعقيم ، وقم بإزالة الشبكات المعدنية ، وقم بوضعها في أغطية القوارير سعة 1.8 مل ، كما هو موضح في الشكل 2 ج. أغلق القوارير سعة 1.8 مل.
ملاحظة: يجب إجراء جميع أعمال زراعة الأنسجة الموضحة أعلاه في غطاء التدفق الصفحي من الدرجة الثانية. قم بتنظيف مقعد التدفق الصفحي بمطهر السطح أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
2. تحضير وسائط التزجيج
- قم بإعداد ماصة مصلية واحدة سعة 10 مل ، وماصة إلكترونية واحدة ، وثلاثة أنابيب سعة 50 مل لمحلول التزجيج 1 (VS1) ، ومحلول التزجيج 2 (VS2) ، ومحلول التزجيج 3 (VS3) ، وكذلك لتسجيل تاريخ التحضير. قم بتشغيل الأشعة فوق البنفسجية (UV) لمقعد التدفق الصفحي لمزيد من التعقيم.
- بالنسبة ل VS1 (15 مل) ، ماصة 12 مل من وسط مناولة البويضات (مكمل بألبومين مصل بشري من قبل الشركة المصنعة) ، و 1.5 مل من SSS (مكمل بديل للمصل) ، و 1.5 مل من جلايكول الإيثيلين في أنبوب واحد سعة 50 مل.
- بالنسبة إلى VS2 (15 مل)، ماصة 10.5 مل من وسط مناولة البويضات (مكمل بألبومين مصل بشري من قبل الشركة المصنعة)، 3 مل من جلايكول الإيثيلين، و1.5 مل من SSS في أنبوب واحد سعة 50 مل.
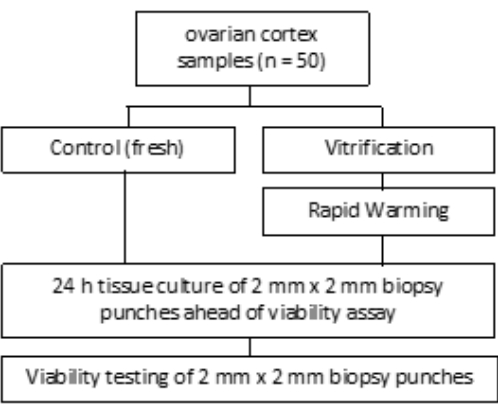
- بالنسبة إلى VS3 ، ماصة 8.5 مل من وسط مناولة البويضات (مكملة بألبومين مصل بشري من قبل الشركة المصنعة) ، و 5.25 مل من جلايكول الإيثيلين ، وأضف 2.57 جم من السكروز و 0.75 جم من بولي فينيل بيروليدون (PVP) في أنبوب واحد سعة 50 مل. انظر الشكل 3 للحصول على التفاصيل. امزج جميع المحاليل عن طريق الدوامة عند 3,000 دورة في الدقيقة.
ملاحظة: يجب إجراء جميع أعمال زراعة الأنسجة الموضحة أعلاه في غطاء التدفق الصفحي من الدرجة الثانية. قم بتنظيف مقعد التدفق الصفحي بمطهر أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
3. إعداد التزجيج
- قم بتنظيف مقعد التدفق الصفحي بمطهر السطح أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
- قم بإعداد طبق واحد من 6 آبار ، ومصفاة خلوية ، ومشرط ، وملاقط ، وخزعة 2 مم ، وطبقين دائريين مقاس 90 مم. أيضا ، قم بإعداد الوسائط: محلول الحفظ لزراعة الأنسجة و VS1-3. ماصة 5 مل من كل محلول مبرد (VS1-3) في آبار منفصلة وانتظر 30 دقيقة حتى تصل المحاليل إلى درجة حرارة الغرفة.
- تعقيم النيتروجين السائل بنظام تشعيع الأشعة فوق البنفسجية الآلي ؛ بدلا من ذلك ، استخدم الأشعة فوق البنفسجية لغطاء التدفق الصفحي لمدة 120 دقيقة.
4. تزجيج الأنسجة
- تحضير أنسجة قشرة المبيض عن طريق إزالة النخاع. نظرا لأن القشرة عادة ما تكون أصعب من النخاع ، فيمكن تمييزها وفصلها بسهولة.
- قطع أنسجة قشرة المبيض إلى الأشكال المرغوبة (10 مم × 5 مم للزرع ؛ 2 مم × 2 مم لكمات لعد البصيلات القابلة للحياة قبل وبعد التزجيج) ، كما هو موضح في الشكل 4 أ.
ملاحظة: تجنب إتلاف الأنسجة عن طريق الضغط بقوة ، والتعامل معها بعناية. قد تختلف عينات الأنسجة بين المرضى.
- قطع أنسجة قشرة المبيض إلى الأشكال المرغوبة (10 مم × 5 مم للزرع ؛ 2 مم × 2 مم لكمات لعد البصيلات القابلة للحياة قبل وبعد التزجيج) ، كما هو موضح في الشكل 4 أ.
- ضع مصفاة خلوية في البئر الأول من اللوحة المكونة من 6 آبار مع VS1. قم بموازنة أنسجة قشرة المبيض لمدة 5 دقائق في 5 مل من VS1 في البئر 1 من الصفيحة المكونة من 6 آبار باستخدام مصفاة الخلية.
- بعد ذلك ، انقل مصفاة الخلية بأنسجة القشرة إلى البئر 2 التي تحتوي على 5 مل من VS2 ، وتوازن لمدة 5 دقائق. أخيرا ، قم بالتوازن لمدة 6 دقائق في 5 مل من VS3 ، كما هو موضح في الشكل 3 والجدول 1.
- افتح المبردات المعدة. املأ القوارير بالنيتروجين السائل المعقم وضعها في وعاء التبريد المملوء بالنيتروجين السائل. قم بتحميل عينات الأنسجة على الشبكة المعدنية لجهاز التزجيج في غضون 1 دقيقة (الشكل 4 ب ، ج).
- أدخل عينات الأنسجة المحملة على الشبكة المعدنية في النيتروجين السائل في المبردات المحضرة القائمة على الشبكة (الشكل 4 د).
ملاحظة: يعد التجميد السريع للأنسجة المحملة على الشبكة المعدنية أمرا ضروريا لنجاح هذه الطريقة. يجب إجراء جميع أعمال زراعة الأنسجة الموضحة أعلاه في غطاء التدفق الصفحي من الدرجة الثانية. قم بتنظيف مقعد التدفق الصفحي بمطهر السطح أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
- أدخل عينات الأنسجة المحملة على الشبكة المعدنية في النيتروجين السائل في المبردات المحضرة القائمة على الشبكة (الشكل 4 د).
5. إعداد وسائط الاحترار السريع
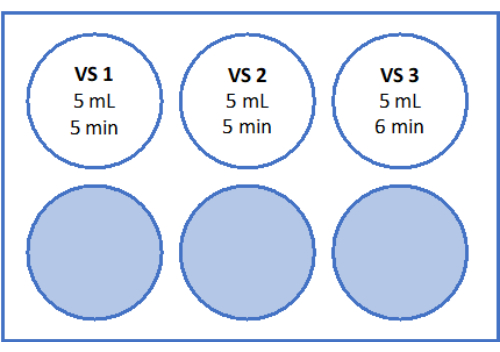
- قم بإعداد الحلول كما هو مذكور في الشكل 5 والجدول 2. قم بوزن السكروز لمحلول الاحترار السريع (RWS) ومحلول التوازن (ES) وانقله إلى الأنبوب. أضف وسيط مناولة البويضات (المكمل بألبومين مصل بشري من قبل الشركة المصنعة) باستخدام ماصة مصلية ومساعد على سحب العينات. أضف SSS والسكروز كما هو مذكور في الجدول 2.
- أغلق الأنابيب واتركها تتحرك على شاكر دحرجة حتى تذوب تماما.
ملاحظة: يجب إجراء جميع أعمال زراعة الأنسجة الموضحة أعلاه في غطاء التدفق الصفحي من الدرجة الثانية. قم بتنظيف مقعد التدفق الصفحي بمطهر السطح أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
6. التحضير السريع للاحترار
- قبل يوم واحد من الاحترار السريع ، قم بإعداد المواد الاستهلاكية وتطهيرها باستخدام ضوء الأشعة فوق البنفسجية في مقعد التدفق الرقائقي: قم بإعداد دورق العينة ل RWS ، واللوحة المكونة من 6 آبار ل ES و RS1 و RS2 ، ودورق العينة لنقل الأنسجة بعد الاحترار السريع. ضع ملاقط معقمة يمكن التخلص منها ومعدات سحب العينات والمواد الاستهلاكية الأخرى في مقعد التدفق الرقائقي.
- سخن لوح التسخين إلى 37.2 درجة مئوية. احتضان RWS عند 37 درجة مئوية لمدة 1 ساعة على الأقل.
- قم بإعداد صفيحة معقمة مكونة من 6 آبار مع 6 مل من ES و 6 مل من RS ل "RS1" و 6 مل أخرى من RS ل "RS2" في مقعد التدفق الرقائقي. راجع الشكل 5 للحصول على رسم تخطيطي للوحة المكونة من 6 آبار. دعها تحتضن في درجة حرارة الغرفة لمدة 1 ساعة قبل تسخين الأنسجة.
- انقل RWS إلى دورق عينة معقم في ظروف معقمة وضعه على لوح التسخين. يجب الحفاظ على RWS عند 37 درجة مئوية.
ملاحظة: يتطلب الاحترار السريع معدل تسخين سريع. من الأهمية بمكان تثبيت RWS عند 37 درجة مئوية لضمان نجاح الخطوة الأولى.
7. الاحترار السريع لأنسجة المبيض
- انقل القوارير المحفوظة بالتبريد التي تحتوي على أنسجة قشرية المبيض المزجج في النيتروجين السائل إلى مقعد التدفق الرقائقي. افتح القوارير أثناء غمرها جزئيا تحت النيتروجين السائل. اغمر الشبكة بسرعة مع الأنسجة المزججة في RWS واترك الأنسجة تجلس هناك لمدة دقيقة واحدة عند 37 درجة مئوية.
ملاحظة: هذه هي الخطوة الأكثر أهمية أثناء الاحترار السريع ويجب إجراؤها دون أي تأخير. - باستخدام ملقط معقم ، انقل الأنسجة إلى ES واحتضانها لمدة 3 دقائق مع رجها برفق على شاكر هزاز.
- اشطف المنديل في درجة حرارة الغرفة لمدة 10 دقائق باستخدام كل منهما باستخدام RS1 و RS2 على شاكر هزاز ، كما هو موضح في الشكل 5.
- انقل الأنسجة الدافئة إلى دورق عينة معقم يحتوي على 5 مل من محلول الحفظ لزراعة الأنسجة ، والذي يجب الاحتفاظ به عند 4 درجات مئوية لنقله إلى موقع الزرع.
ملاحظة: يجب إجراء جميع أعمال زراعة الأنسجة الموضحة أعلاه في غطاء التدفق الصفحي من الدرجة الثانية. قم بتنظيف مقعد التدفق الصفحي بمطهر السطح أثناء ارتداء قفازات المختبر التي تستخدم لمرة واحدة ؛ يوصى باستخدام القفازات غير المسحوقة.
8. تحديد صلاحية البصيلات
- أحضر ثنائي ميثيل سلفوكسيد (DMSO) إلى درجة حرارة الغرفة طوال الليل للحصول على حالة سائلة. ماصة 100 ميكرولتر من DMSO في قارورة واحدة من الكالسين وإعادة تعليقها لإذابة الكالسين. ماصة 3 ميكرولتر من الكالسين المذاب في قاع أنبوب واحد سعة 1.5 مل وتخزين القوارير عند -20 درجة مئوية.
- ضع 0.007 جم من الكولاجيناز في أنبوب واحد سعة 1.5 مل واحفظه عند -20 درجة مئوية.
- أضف 997 ميكرولتر من DPBS إلى 3 ميكرولتر من الكالسيين المقتبسة والمجمدة في أنبوب واحد سعة 1.5 مل ، وأعد تعليقها لإذابة الكالسين. أضف 0.007 جم من الكولاجيناز للحصول على 1000 ميكرولتر من محلول العمل.
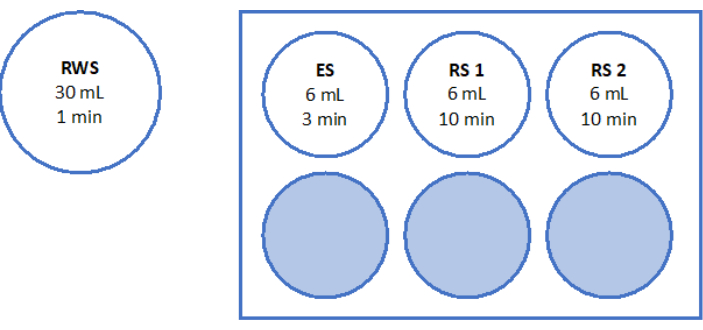
- استخدم 500 ميكرولتر من محلول العمل لهضم قطعتين من شظايا قشرة المبيض مقاس 2 مم لمدة 90 دقيقة عند 37 درجة مئوية ، محمية من الضوء ، في طبق مكون من 4 آبار. بعد 60 دقيقة و 70 دقيقة ، أعد تعليق المحلول بشكل متكرر. أخيرا ، حدد صلاحية البصيلات عن طريق الفحص المجهري الفلوري ، كما هو موضح في الشكل 6.
النتائج
يعرض هذا البروتوكول إجراءات تحضير وسائط التزجيج ، وأجهزة التحميل ، والتزجيج ، وإعداد وسائط الاحترار السريع ، والاحترار السريع ، وتحديد صلاحية البصيلات. تم التحقق من صحة مقارنة مباشرة بين قابلية البصيلات والعوامل الوعائية بين التجميد البطيء والتزجيج ونشرها31،32.
تم تقييم النجاح العام لبروتوكول التزجيج الموصوف من خلال مقارنة عدد البصيلات الحيوية قبل وبعد التزجيج / الاحترار السريع. يظهر الإعداد التجريبي في الشكل 1 ، ويتم عرض النتائج في الشكل 6. في 50 مريضا ، لوحظ متوسط عدد 77.98 بصيلات حيوية قبل التزجيج و 62.99 بعد التزجيج / الاحترار السريع ، مما يعكس معدل بقاء قدره 80.8٪. لم يكن هذا مختلفا بشكل كبير وفقا لاختبار ويلكوكسون33.
يتم تخصيص الشبكات المعدنية بشكل فردي بمقص حاد بحجم 25 مم × 8 مم ، والذي يتناسب مع أغطية 1.8 مل من التبريد ، كما هو موضح في الشكل 2 أ ، ج. بعد التعقيم باستخدام التعقيم بالبخار ، يتم تجميع الشبكات والأغطية المكونة من قوارير 1.8 مل تحت مقعد تدفق رقائقي ، كما هو موضح في الشكل 2 ب. يوفر هذا الإعداد ثباتا آمنا في الغطاء دون الحاجة إلى إجراءات إضافية ويوفر مساحة كافية للأنسجة ذات الأحجام المختلفة. عادة ما تكون قطع الأنسجة من 5 مم × 10 مم للزراعة وقطع قطرها 2 مم لتقييم عدد البصيلات الحيوية بعد الذوبان السريع مزججة. كلا الحجمين يتناسبان تماما مع الشبكات المعدنية.
يتم إجراء التوازن مع محاليل التزجيج (VS1 و VS2 و VS3) في صفيحة مكونة من 6 آبار على شاكر هزاز في درجة حرارة الغرفة تحت مقعد تدفق رقائقي ، كما هو موضح في الشكل 3. تضمن الأطر الزمنية في المخطط الامتصاص الفعال للإيثيلين جلايكول المجعد. يوصى باستخدام صفيحة مكونة من 6 آبار فوق أوعية مفردة لأنها تسهل الحركة السريعة للأنسجة بين المحاليل وتساعد على منع الاختلاط.
من أجل التزجيج الرأسي السريع في النيتروجين السائل ، يتم تقطيع أنسجة قشرة المبيض إلى قطع مناسبة (الشكل 4 أ). يتم وضع عينات قشرة المبيض على أجهزة التحميل (الشكل 4 ب ، ج) ويتم غمرها عموديا في النيتروجين السائل (الشكل 4 د) لتحقيق حالة زجاجية من التجميع من خلال التزجيج. تسمح الشبكات المعدنية المختارة بالتعامل الرأسي مع الأنسجة ، كما هو موضح في الشكل 4 د. بالإضافة إلى ذلك ، فإن الشبكات المعدنية عالية التوصيل حراريا ، مما يضمن معدلات تبريد سريعة من 22 درجة مئوية إلى -196 درجة مئوية ، وهي خطوة مهمة للغاية في عملية التزجيج.
للاحترار السريع ، يتم تحضير RWS في كوب معقم عند 37 درجة مئوية ، ويتم تحضير ES و RS1 و RS2 في صفيحة من 6 آبار على شاكر هزاز في درجة حرارة الغرفة ، كما هو موضح في الشكل 5. يمنع الحجم الكبير من RWS الدافئ مسبقا المحلول من التبريد بشكل مفرط عند إضافة الأنسجة المزججة ويضمن بيئة دافئة باستمرار للأنسجة طوال عملية الاحترار السريع.
لتقييم وضمان معايير الجودة العالية ، يتم تلطيخ لكمات الخزعة 2 مم × 2 مم بالكالسين قبل التزجيج وبعد الاحترار السريع لتحديد صلاحية البصيلات باستخدام الفحص المجهري الفلوري34،35 (الشكل 6). تنبعث من بصيلات قابلة للحياة مضان أخضر عند 495 نانومتر بعد امتصاص الكالسين داخل الخلايا. بدلا من ذلك ، يمكن تقييم صلاحية البصيلات (الجدول 3) باستخدام أصباغ حمراء محايدة36.
باتباع الخطوات الموضحة في هذا البروتوكول ، يتم تحويل أنسجة المبيض إلى حالة زجاجية من التراكم ، مما يسهل معدلات البقاء على قيد الحياة المرتفعة بعد الاحترار السريع ، كما يؤكده الفحص المجهري الفلوري.
الشكل 1: تصميم الدراسة. تم فحص عينات قشرية المبيض من 50 مريضا قبل (طازجة) وبعد التزجيج والاحترار السريع لعدد البصيلات القابلة للحياة. لكل مجموعة ، تم زراعة قطعتين من الأنسجة بقطر 2 مم لمدة 24 ساعة قبل تقييم عدد البصيلات. تم هضم الأنسجة بالكولاجيناز وتلطيخها بالكالسين لتقييم الجدوى. تم تحديد عدد البصيلات القابلة للحياة باستخدام المجهر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير أجهزة التحميل. تم قطع الشبكات المعدنية بحجم 8 مم × 25 مم (A). تم تعقيم الشبكات المعدنية المخصصة عن طريق التعقيم (ب). ثم تم إدخال الشبكات المعدنية المعقمة في أغطية من قوارير سعة 1.8 مل ، جاهزة للاستخدام (C). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: تحضير محاليل التزجيج. تم تحضير محاليل التزجيج (VS) ونقلها إلى صفيحة من 6 آبار. تظهر الآبار حجم كل محلول وأوقات الحضانة الفردية المستخدمة في بروتوكول التزجيج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: معالجة قشرة المبيض وتزجيجها. تمت معالجة أنسجة قشرة المبيض للحفظ بالتبريد عن طريق إزالة النخاع وتقطيع الأنسجة إلى قطع 5 مم × 10 مم (A). بعد الحضانة في محاليل التزجيج الموضحة في الشكل 3 ، تم تحميل الأنسجة على جهاز تحميل التزجيج (B ، C). من أجل التزجيج الرأسي السريع لعينات قشرة المبيض ، تم إدخال الأغطية ذات الأنسجة المحملة بسرعة في النيتروجين السائل المعقم (D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: تحضير حلول الاحترار السريع. تم تحضير محلول الاحترار السريع (RWS) ومحلول التوازن (ES) ومحاليل الشطف (RS) 1 و 2 ونقلها إلى صفيحة مكونة من 6 آبار. تظهر الأوعية والآبار حجم كل محلول وأوقات الحضانة المقابلة. لاحظ أن RWS يتم الحفاظ عليه عند 37.2 درجة مئوية على لوحة التسخين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
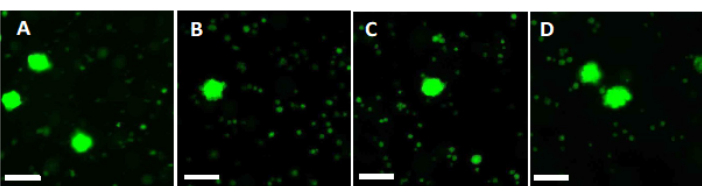
الشكل 6: عدد الجدوى. لتقييم عدد البصيلات القابلة للحياة ، تم هضم قطع الأنسجة التي يبلغ قطرها 2 مم بالكولاجيناز وتلطيخها بالكالسين. تظهر الصور التمثيلية (أ) تلطيخ الكالسين ل 3 بصيلات مستردة قبل التزجيج. (ب) جريب قابل للحياة بعد التزجيج والاحترار السريع. (ج) جريب قابل للحياة تم استرداده قبل التجميد البطيء. (د) استعادة بصيلات قابلة للحياة بعد التجميد والذوبان البطيء. يشار إلى صلاحية البصيلات بواسطة الكالسيين ، وهي صبغة فلورية خضراء تنبعث منها مضان أخضر عند تحويلها إنزيميا بواسطة خلايا قابلة للحياة عند 495 نانومتر. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مقابل 1 (15 مل) | جلايكول الإيثيلين | 10% | 1.5 مل |
| SSS | 10% | 1.5 مل | |
| جي MOPS + | 12 مل | ||
| VS 2 (15 مل) | جلايكول الإيثيلين | 20% | 3 مل |
| SSS | 10% | 1.5 مل | |
| جي MOPS + | 10.5 مل | ||
| VS 3 (15 مل) | جلايكول الإيثيلين | 35% | 5.25 مل |
| SSS | 10% | 1.5 مل | |
| سكروز | 0.5 مول / لتر | 2.57 جرام | |
| لاعب ضد لاعب | 5 ٪ (وزن حجمي) | 0.75 جرام | |
| جي MOPS + | إعلان 15 مل |
الجدول 1: تكوين محاليل التزجيج (VS).
| RWS (30 مل) | سكروز | 0.8 مول / لتر | |
| 8.22 جرام | |||
| SSS | 10% | 3 مل | |
| جي MOPS + | إعلان 30 مل | ||
| ES (15 مل) | سكروز | 0.4 مول / لتر | 2.05 جرام |
| SSS | 10% | 1.5 مل | |
| جي MOPS + | إعلان 15 مل | ||
| RS 1 & 2 (15 مل) | SSS | 10% | 1.5 مل |
| جي MOPS + | إعلان 15 مل |
الجدول 2: تكوين محلول الاحترار السريع (RWS) ، ومحلول التوازن (ES) ، ومحاليل الشطف (RS). يوفر هذا الجدول مكونات وتركيزات محلول الاحترار السريع (RWS) ومحلول التوازن (ES) ومحاليل الشطف (RS) المستخدمة في معالجة ما بعد التزجيج.
| البارامتر | طازج | فترة | تسخين سريع بعد التزجيج | فترة | n | *قيمة P |
| [سد] | [سد] | |||||
| عدد الجدوى الجرابية [ن] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| * اختبار ويلكوكسون |
الجدول 3: النتائج التمثيلية للبقاء الجريبي. يعرض هذا الجدول نتائج تقييمات صلاحية البصيلات قبل الحفظ بالتبريد وبعد الاحترار السريع. تم استخدام قطعتين من الأنسجة بقطر 2 مم لكل مريض لحساب عدد البصيلات القابلة للحياة قبل وبعد التزجيج / الاحترار السريع. تم تحليل عينات الأنسجة المزدوجة من 50 مريضا باستخدام اختبار ويلكوكسون.
Discussion
هنا ، يتم تقديم بروتوكول للتزجيج عالي الإنتاجية لأنسجة قشرة المبيض البشرية ، مناسب للروتين السريري. على غرار تزجيج البويضات أو الأجنة ، يتطلب التطبيق الناجح للإجراء التزاما مفصلا بالبروتوكول المتعلق بدرجة حرارة محاليل التزجيج والاحترار ، بالإضافة إلى فترة التوازن. من الضروري أيضا الامتثال لتوجيهات الاتحاد الأوروبيللأنسجة 37 فيما يتعلق بجودة الهواء والعقيم.
ينتج عن إجراء التزجيج حالة غير بلورية أو غير متبلورة أو زجاجية. بشكل عام ، يعد التزجيج عملية متعددة الاستخدامات لها آثار كبيرة في مختلف المجالات العلمية والتكنولوجية. الفائدة الأساسية للتزجيج هي قدرته على تحويل الأنسجة إلى حالة زجاجية ، وبالتالي منع تكوين بلورات الثلج38،39،40 ، مما قد يؤثر سلبا على سلامة الأنسجة ومكوناتها.
تسمح مكملات عوامل الحماية من التبريد (CPAs) بالبولي فينيل بيروليدون (PVP) بتقليل تركيز CPA دون المساس بجودة محاليل التزجيج41،42. علاوة على ذلك ، يوفر استخدام الشبكات المعدنية موصلية حرارية عالية مقارنة بأنظمة الناقل القائمة على البلاستيك. يسهل هيكل الشبكة أيضا التصاق السطح ، مما يضمن الحفظ بالتبريد الآمن والآمن لعينات الأنسجة ولكمات القشرة الصغيرة لتدابير الجودة. إذا تم استخدام أوعية التبريد من الشركات المصنعة الأخرى ، فمن المهم اختبار حجم الشبكات المعدنية مسبقا لضمان الثبات والقبضة المناسبة داخل غطاء cryovessel ، بالإضافة إلى ملاءمتها بشكل جيد للوعاء.
تشمل الخطوات الحاسمة لضمان التزجيج الناجح التزجيج السريع عن طريق غمر الأنسجة في النيتروجين السائل المعقم وإجراء الاحترار السريع دون تأخير لتجنب النتائج السلبية. من حيث الفعالية من حيث التكلفة ، فإن تزجيج الأنسجة أقل تطلبا مقارنة بإجراء التجميد البطيء ، مما قد يؤثر على تخطيط نشر الأفراد. بالإضافة إلى ذلك ، يلغي التزجيج الحاجة إلى شراء وخدمة المعدات اللازمة للتجميد البطيء.
أظهرت المقاييس البيولوجية والتحليلات التلوية قابلية المقارنة أو حتى مزايا التزجيج مقارنة بالتجميدالبطيء 43. ومع ذلك، يمكن أن تعزى الاختلافات في النتائج بعد التزجيج إلى عدم وجود تقييس في كل من جهاز التزجيج والبروتوكول، بما في ذلك المحاليل المستخدمة، والتي تختلف عبر الدراسات. يجب أن تستكشف الأبحاث المستقبلية إمكانات زراعة البصيلات من الأنسجة المزججة / سريعة التسخين لمراقبة النمو في المختبر ، كما هو موضح بنجاح في أنسجة مبيض الفأر من قبل عدة مجموعات44،45،46،47،48،49،50.
باختصار ، يعد تزجيج أنسجة المبيض بديلا مهما لبروتوكول التجميد البطيء المستخدم على نطاق واسع ، مدعوما بخمس ولادات ناجحة أبلغت عنها سوزوكي51 (اليابان) ، سيلبر52 (الولايات المتحدة الأمريكية) ، وسانجر53 (ألمانيا). على عكس وسائط ومجموعات التزجيج المتاحة تجاريا للخلايا ، هناك عدد قليل من الأنظمة المعتمدة من إدارة الغذاء والدواء الأمريكية / CE لأنسجة المبيض ، والتي قد تحد من تطبيقها في البيئات السريرية. لذلك ، يوصى بتطوير مجموعات ووسائط معتمدة من إدارة الغذاء والدواء الأمريكية / CE للتزجيج والاحترار السريع لأنسجة المبيض30.
Disclosures
اي.
Acknowledgements
نشكر كارا فاربر على التدقيق اللغوي. كاتارينا وولرسهايم ومارتن ماهلبيرج وليا كورتي وجاسمين ريبهولز لمساعدتهم الفنية.
Materials
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
References
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved