Method Article
Vitrifikation des Gewebes der Ovarialrinde, um einen glasartigen Aggregatzustand zu erreichen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Es wird ein Protokoll für die Vitrifikation von Ovarialgewebe als Alternative zu dem weit verbreiteten Protokoll des langsamen Einfrierens vorgestellt.
Zusammenfassung
Die Kryokonservierung des Ovarialgewebes (OTC) ist eine wichtige Option zur Erhaltung der Fruchtbarkeit. Für Patientinnen, deren gonadotoxische Behandlungen nicht aufgeschoben werden können, oder für Mädchen vor der Pubertät ist es oft die einzige Option zum Schutz der Fruchtbarkeit. Die Kryokonservierung kann entweder durch Vitrifikation oder durch langsames Einfrieren durchgeführt werden. Slow Freezing ist derzeit der Standardansatz. Eine zunehmende Zahl von Studien deutet darauf hin, dass die Vitrifikation das langsame Einfrieren in den hochmodernen Laboratorien für In-vitro-Fertilisation (IVF) ersetzen kann, wodurch die Überlebensraten beim Auftauen erheblich verbessert und die technischen Aspekte der Kryokonservierung vereinfacht werden. Es wird ein Metallgitter-basiertes Hochdurchsatzprotokoll für die schnelle Vitrifikation von Ovarialrindengewebe beschrieben, das für die klinische Routine geeignet ist. Die Sterilisation von Metallgittern und flüssigem Stickstoff gewährleistet eine hohe Qualität und entspricht den GMP-Standards (Good Manufacturing Practice). Die Verglasung wurde durchgeführt, um ultraschnelle Abkühlraten zu gewährleisten. Anstatt langsam aufzutauen, wurden die Proben schnell erwärmt. Um die Follikelviabilität zu beurteilen, wurde die Calcein-Färbung sowohl vor der Kryokonservierung als auch nach einer schnellen Erwärmung durchgeführt. Es wird über die erfolgreiche Anwendung der Vitrifikation und der schnellen Erwärmung mit Metallgittern berichtet. Es wurden keine signifikanten Unterschiede in der Follikelviabilität vor der Vitrifikation und nach einer schnellen Erwärmung beobachtet. Diese Ergebnisse untermauern die hohe Kapazität der Gewebevitrifikation für klinische Routineanwendungen als potenziellen Ersatz für die weit verbreitete Slow-Freeze-Methode.
Einleitung
Die Kryokonservierung von Eierstockgewebe ist eine wichtige Option zur Erhaltung der Fruchtbarkeit. Explantiertes Gewebe mit Ovarialfollikeln, in das Eizellen eingebettet sind, wird kryokonserviert. Nach der Lagerung kann das Eierstockgewebe aufgetaut, erwärmt und der Patientin wieder implantiert werden. Für lebensfähige Zellen oder Gewebe stehen zwei Kryokonservierungsmethoden zur Verfügung: langsames Einfrieren und Vitrifikation1.
Die Vitrifikation wird verwendet, um biologisches Material wie Embryonen und Eizellen zu konservieren, mit überlegenen Überlebensraten im Vergleich zum Protokoll des langsamen Einfrierens 1,2,3,4. Das langsame Einfrieren hat Einschränkungen, wie z. B. die Bildung von Eiskristallen, die Zell- und Gewebestrukturen schädigen können. Das langsame Einfrieren ist jedoch ein wichtiger Kryokonservierungsansatz, der die Langzeitlagerung biologischer Proben erleichtert, und die Funktionalität dieser Methode ist weithin bewiesen5. Die Verglasung induziert einen glasartigen Aggregatzustand, der die Bildung von Eiskristallen verhindert 6,7. Auf technischer Ebene vereinfacht die Vitrifikation das Kryokonservierungsverfahren erheblich, indem sie den Wartungsaufwand der Geräte reduziert, die Wahrscheinlichkeit technischer Fehler verringert und die Dauer des Kryokonservierungsprozesses verkürzt 8,9. Bei der Erhaltung der weiblichen Fruchtbarkeit ist die Kryokonservierung des Ovarialgewebes ein entscheidender Ansatz vor der Krebsbehandlung10. Verschiedene Gruppen haben erfolgreich das Konzept der Kryokonservierung, des Auftauens und der Transplantation von Gewebe auf der Grundlage des langsamen Einfrierprotokolls 11,12,13,14 demonstriert, das derzeit als Standardansatz 15 angesehen wird.
Die Vitrifikation von Eierstockgewebe gilt als vielversprechende alternative Methode 16,17,18,19,20,21 in Bezug auf ressourcenschonende22, follikuläre Überlebensraten, DNA-Fragmentierungsniveaus und ausgewogenes angiogenes Potenzial 23,24,25,26,27. Dies belegen erfolgreiche Auslieferungen in Japan28, USA29 und Deutschland30.
Der Vergleich der beiden Optionen der Kryokonservierung des Ovarialgewebes (OTC)-Vitrifikation mit dem Standardverfahren des langsamen Einfrierens ist in aktuellen Metaanalysen teilweise widersprüchlich16. Mehrere Faktoren könnten dazu beigetragen haben, da die aktuellen Vitrifikationsprotokolle sehr unterschiedlich sind. Zu diesen Unterschieden gehören die Wahl des Kryoprotektivums oder der Kombination von Schutzmitteln, deren Konzentration, die Zusammensetzung der OTC-Medien, die Größe der Gewebefragmente und das als Gewebeträger verwendete Gerät. Dementsprechend gibt es kein standardisiertes Erwärmungsprotokoll.
Da die Autoren eine Methode gefunden haben, die überzeugende Ergebnisse in Bezug auf Handhabung, Lebensfähigkeit, Apoptosebeginn, Freisetzung angiogener Faktoren und sogar einen Bericht über eine Geburt nach Reimplantation liefert 9,27, wird eine sehr detaillierte Beschreibung des Protokolls gegeben. Die beschriebene Methode bietet ein valides und effektives Protokoll, das zur Standardisierung der Vitrifikation von Ovarialgewebe beitragen kann.
Protokoll
Die Studie wurde von der Ethikkommission des Universitätsklinikums Bonn genehmigt (007/09). Von jedem Patienten wurde eine schriftliche Einverständniserklärung eingeholt. Die Studiengruppe umfasste menschliches Eierstockgewebe von 50 Patientinnen mit einem Durchschnittsalter von 27,4 Jahren vor der Kryokonservierung, wie in Abbildung 1 dargestellt. Die in dieser Studie verwendeten Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Ladevorrichtungen
- Bereiten Sie chirurgische Scheren und Metallgitter für die Anpassung vor. Schneiden Sie die Maschen in Streifen mit den Maßen 25 mm x 8 mm, wie in Abbildung 2A gezeigt.
- Legen Sie die kundenspezifischen Metallgewebe in einen Sterilisationsbehälter und autoklavieren Sie sie für 2 Stunden (Abbildung 2B). Stellen Sie nach dem Autoklavieren den Sterilisationsbehälter und die 1,8-ml-Fläschchen unter die Laminar-Flow-Bank.
- Schalten Sie die ultraviolette (UV) Strahlung der Laminar-Flow-Bank für 30 Minuten ein, um eine zusätzliche Sterilisation bei einer Wellenlänge von 254 nm zu ermöglichen.
- Öffnen Sie den Sterilisationsbehälter, entfernen Sie die Metallgitter und setzen Sie sie in die Verschlüsse der 1,8-ml-Fläschchen ein, wie in Abbildung 2C gezeigt. Verschließen Sie die 1,8-ml-Durchstechflaschen.
HINWEIS: Alle oben beschriebenen Gewebekulturen sollten in einer Laminar-Flow-Haube der Klasse II durchgeführt werden. Reinigen Sie die Laminar-Flow-Bank mit einem Flächendesinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
2. Vorbereitung der Vitrifikationsmedien
- Bereiten Sie eine serologische 10-ml-Pipette, eine elektronische Pipette und drei 50-ml-Röhrchen für Vitrifikationslösung 1 (VS1), Vitrifikationslösung 2 (VS2) und Vitrifikationslösung 3 (VS3) sowie für die Aufzeichnung des Vorbereitungsdatums vor. Schalten Sie die ultraviolette (UV) Strahlung der Laminar-Flow-Bank für eine zusätzliche Sterilisation ein.
- Für VS1 (15 ml) pipettieren Sie 12 ml Eizellhandhabungsmedium (vom Hersteller mit Humanserumalbumin ergänzt), 1,5 ml SSS (Serum Substitute Supplement) und 1,5 ml Ethylenglykol in ein 50-ml-Röhrchen.
- Für VS2 (15 ml) pipettieren Sie 10,5 ml Eizellhandhabungsmedium (vom Hersteller mit humanem Serumalbumin ergänzt), 3 ml Ethylenglykol und 1,5 ml SSS in ein 50-ml-Röhrchen.
- Für VS3 pipettieren Sie 8,5 ml Eizellhandhabungsmedium (vom Hersteller mit Humanserumalbumin ergänzt), 5,25 ml Ethylenglykol und geben Sie 2,57 g Saccharose und 0,75 g Polyvinylpyrrolidon (PVP) in ein 50-ml-Röhrchen. Weitere Informationen finden Sie in Abbildung 3 . Mischen Sie alle Lösungen durch Vortexen bei 3.000 U/min.
HINWEIS: Alle oben beschriebenen Gewebekulturen sollten in einer Laminar-Flow-Haube der Klasse II durchgeführt werden. Reinigen Sie die Laminar-Flow-Bank mit einem Desinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
3. Vorbereitung der Vitrifikation
- Reinigen Sie die Laminar-Flow-Bank mit einem Flächendesinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
- Bereiten Sie eine 6-Well-Platte, ein Zellsieb, ein Skalpell, eine Pinzette, einen 2-mm-Biopsiestempel und zwei 90-mm-Schalen mit rundem Boden vor. Bereiten Sie auch das Medium vor: Konservierungslösung für die Gewebetransplantation und VS1-3. Pipettieren Sie 5 ml jeder gekühlten Lösung (VS1-3) in separate Vertiefungen und warten Sie 30 Minuten, bis die Lösungen Raumtemperatur erreicht haben.
- Sterilisieren Sie flüssigen Stickstoff mit einem automatisierten UV-Bestrahlungssystem; alternativ können Sie die UV-Bestrahlung der Laminar-Flow-Haube für 120 min nutzen.
4. Vitrifikation von Gewebe
- Bereiten Sie das Gewebe der Eierstockrinde vor, indem Sie das Mark entfernen. Da die Hirnrinde in der Regel härter ist als die Medulla, können sie leicht unterschieden und getrennt werden.
- Schneiden Sie das Gewebe der Ovarialrinde in die gewünschten Formen (10 mm x 5 mm für die Transplantation; 2 mm x 2 mm Stanzen für die lebensfähige Follikelzählung vor und nach der Vitrifikation), wie in Abbildung 4A gezeigt.
HINWEIS: Vermeiden Sie es, das Taschentuch durch zu starkes Drücken zu beschädigen, und gehen Sie vorsichtig damit um. Die Anzahl der Gewebeproben kann von Patient zu Patient variieren.
- Schneiden Sie das Gewebe der Ovarialrinde in die gewünschten Formen (10 mm x 5 mm für die Transplantation; 2 mm x 2 mm Stanzen für die lebensfähige Follikelzählung vor und nach der Vitrifikation), wie in Abbildung 4A gezeigt.
- Setzen Sie ein Zellsieb in die erste Vertiefung der 6-Well-Platte mit VS1 ein. Äquilibrieren Sie das Gewebe der Ovarialrinde für 5 Minuten in 5 ml VS1 in Vertiefung 1 der 6-Well-Platte mit dem Zellsieb.
- Bewegen Sie dann das Zellsieb mit dem Kortexgewebe in Vertiefung 2 mit 5 ml VS2 und äquilibrieren Sie es 5 Minuten lang. Zum Schluss wird für 6 min in 5 mL VS3 äquilibriert, wie in Abbildung 3 und Tabelle 1 gezeigt.
- Öffnen Sie die vorbereiteten Kryofläschchen. Füllen Sie die Fläschchen mit sterilisiertem Flüssigstickstoff und geben Sie sie in das mit flüssigem Stickstoff gefüllte Kryo-Dewargefäß. Laden Sie die Gewebeproben innerhalb von 1 min auf das Metallgitter des Vitrifikationsgeräts (Abbildung 4B,C).
- Geben Sie die auf dem Metallgitter geladenen Gewebeproben in den flüssigen Stickstoff in den vorbereiteten gitterbasierten Kryoröhrchen (Abbildung 4D).
HINWEIS: Das schnelle Einfrieren des auf das Metallgitter geladenen Gewebes ist für den Erfolg dieser Methode unerlässlich. Alle oben beschriebenen Gewebekulturarbeiten sollten in einer Laminar-Flow-Haube der Klasse II durchgeführt werden. Reinigen Sie die Laminar-Flow-Bank mit einem Flächendesinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
- Geben Sie die auf dem Metallgitter geladenen Gewebeproben in den flüssigen Stickstoff in den vorbereiteten gitterbasierten Kryoröhrchen (Abbildung 4D).
5. Vorbereitung von schnell erwärmenden Medien
- Bereiten Sie die Lösungen vor, wie in Abbildung 5 und Tabelle 2 beschrieben. Wiegen Sie die Saccharose für die Schnellerwärmungslösung (RWS) und die Äquilibriationslösung (ES) und geben Sie sie in das Röhrchen. Geben Sie das Eizellhandhabungsmedium (vom Hersteller mit Humanserumalbumin ergänzt) mit einer serologischen Pipette und einer Pipettierhilfe hinzu. SSS und Saccharose wie in Tabelle 2 aufgeführt zugeben.
- Verschließen Sie die Röhrchen und lassen Sie sie auf einem rollenden Schüttler rühren, bis sie sich vollständig aufgelöst haben.
HINWEIS: Alle oben beschriebenen Gewebekulturen sollten in einer Laminar-Flow-Haube der Klasse II durchgeführt werden. Reinigen Sie die Laminar-Flow-Bank mit einem Flächendesinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
6. Schnelle wärmende Zubereitung
- Bereiten Sie einen Tag vor der Schnellerwärmung die Verbrauchsmaterialien vor und dekontaminieren Sie sie mit UV-Licht in der Laminar-Flow-Bank: Bereiten Sie das Probenbecherglas für RWS, die 6-Well-Platte für ES, RS1 und RS2 und das Probenbecherglas für den Gewebetransport nach der Schnellerwärmung vor. Legen Sie sterile Einwegpinzetten, Pipettiergeräte und andere Verbrauchsmaterialien in die Laminar-Flow-Bank.
- Eine Heizplatte auf 37.2 °C vorheizen. RWS bei 37 °C mindestens 1 h inkubieren.
- Bereiten Sie eine sterile 6-Well-Platte mit 6 mL ES, 6 mL RS für "RS1" und weiteren 6 mL RS für "RS2" in der Laminar-Flow-Bank vor. In Abbildung 5 finden Sie eine schematische Darstellung der 6-Well-Platte. Lassen Sie diese 1 h bei Raumtemperatur inkubieren, bevor Sie das Gewebe erwärmen.
- RWS unter sterilen Bedingungen in ein steriles Probenbecherglas überführen und auf die Heizplatte legen. Der RWS-Wert sollte bei 37 °C gehalten werden.
HINWEIS: Eine schnelle Erwärmung erfordert eine schnelle Erwärmungsrate. Es ist entscheidend, den RWS bei 37 °C zu halten, um den Erfolg des ersten Schritts sicherzustellen.
7. Schnelle Erwärmung des Eierstockgewebes
- Transportieren Sie die kryokonservierten Fläschchen mit vitrifiziertem kortikalem Ovarialgewebe in flüssigem Stickstoff zur Laminar-Flow-Bank. Öffnen Sie die Durchstechflaschen, während sie teilweise unter flüssigem Stickstoff getaucht sind. Tauchen Sie das Netz mit dem verglasten Gewebe schnell in das RWS ein und lassen Sie das Gewebe dort 1 Minute lang bei 37 °C ruhen.
HINWEIS: Dies ist der kritischste Schritt während einer schnellen Erwärmung und muss ohne Verzögerung durchgeführt werden. - Übertragen Sie das Gewebe mit einer sterilen Pinzette in das ES und inkubieren Sie es 3 Minuten lang, während Sie es vorsichtig auf einem Schaukelschüttler schütteln.
- Spülen Sie das Tuch bei Raumtemperatur jeweils 10 Minuten lang mit RS1 und RS2 auf einem Schaukelschüttler aus, wie in Abbildung 5 gezeigt.
- Das erwärmte Gewebe wird in ein steriles Probenbecherglas mit 5 ml Konservierungslösung für die Gewebetransplantation gegeben, das für den Transport zur Transplantationsstelle bei 4 °C gehalten werden sollte.
HINWEIS: Alle oben beschriebenen Gewebekulturen sollten in einer Laminar-Flow-Haube der Klasse II durchgeführt werden. Reinigen Sie die Laminar-Flow-Bank mit einem Flächendesinfektionsmittel, während Sie Einweg-Laborhandschuhe tragen. Nicht gepuderte Handschuhe werden empfohlen.
8. Bestimmung der Follikelviabilität
- Bringen Sie Dimethylsulfoxid (DMSO) über Nacht auf Raumtemperatur, um einen flüssigen Zustand zu erhalten. Pipettieren Sie 100 μl DMSO in ein Fläschchen Calcein und resuspendieren Sie, um das Calcein aufzulösen. Pipettieren Sie 3 μl des gelösten Calceins in den Boden eines 1,5-ml-Röhrchens und lagern Sie die Fläschchen bei -20 °C.
- Geben Sie 0,007 g Kollagenase in ein 1,5-ml-Röhrchen und lagern Sie es bei -20 °C.
- Fügen Sie 997 μl DPBS zu den präaliquotierten und gefrorenen 3 μl Calcein in einem 1,5-ml-Röhrchen hinzu und resuspendieren Sie, um das Calcein aufzulösen. Fügen Sie 0,007 g Kollagenase hinzu, um eine Arbeitslösung von 1000 μl zu erhalten.
- Verwenden Sie 500 μl der Arbeitslösung, um zwei Stücke von 2 mm Fragmenten der Ovarialrinde 90 Minuten lang bei 37 °C lichtgeschützt in einer 4-Well-Schale zu verdauen. Nach 60 min und 70 min die Lösung wiederholt resuspendieren. Bestimmen Sie schließlich die follikuläre Viabilität mittels Fluoreszenzmikroskopie, wie in Abbildung 6 gezeigt.
Ergebnisse
Dieses Protokoll stellt die Verfahren für die Herstellung von Vitrifikationsmedien, Ladevorrichtungen, Vitrifikation, Herstellung von Schnellerwärmungsmedien, Schnellerwärmung und Bestimmung der Follikelviabilität vor. Ein direkter Vergleich der follikulären Viabilität und der angiogenen Faktoren zwischen langsamem Einfrieren und Vitrifikation wurde validiert und veröffentlicht31,32.
Der Gesamterfolg des beschriebenen Vitrifikationsprotokolls wurde durch den Vergleich der vitalen Follikelzahl vor und nach der Vitrifikation/schnellen Erwärmung bewertet. Der Versuchsaufbau ist in Abbildung 1 dargestellt, und die Ergebnisse sind in Abbildung 6 dargestellt. Bei 50 Patienten wurde eine mittlere Anzahl von 77,98 vitalen Follikeln vor der Vitrifikation und 62,99 nach der Vitrifikation/schnellen Erwärmung beobachtet, was einer Überlebensrate von 80,8 % entspricht. Dies war nach dem Wilcoxon-Test33 nicht signifikant anders.
Metallgitter werden individuell mit einer scharfen Schere auf eine Größe von 25 mm x 8 mm angepasst, die in die Kappen von 1,8 mL-Kryoröhrchen passt, wie in Abbildung 2A,C gezeigt. Nach der Sterilisation durch Dampfautoklavieren werden die Gitter und Kappen der 1,8-ml-Fläschchen unter einer Laminar-Flow-Bank zusammengebaut, wie in Abbildung 2B dargestellt. Dieser Aufbau sorgt für einen sicheren Halt in der Kappe, ohne dass zusätzliche Handgriffe erforderlich sind, und bietet ausreichend Platz für Gewebe unterschiedlicher Größe. Typischerweise werden Gewebestücke von 5 mm x 10 mm für die Transplantation und Stücke mit einem Durchmesser von 2 mm zur Beurteilung der vitalen Follikelzahl nach schnellem Auftauen vitrifiziert. Beide Größen passen perfekt auf die Metallgitter.
Die Äquilibrierung mit Vitrifikationslösungen (VS1, VS2 und VS3) wird in einer 6-Well-Platte auf einem Wippschüttler bei Raumtemperatur unter einer Laminar-Flow-Bank durchgeführt, wie in Abbildung 3 gezeigt. Die Zeitrahmen im Schema gewährleisten die effektive Aufnahme des Kryoprotektivums Ethylenglykol. Die Verwendung einer 6-Well-Platte über einzelnen Gefäßen wird empfohlen, da sie eine schnelle Bewegung des Gewebes zwischen den Lösungen ermöglicht und Verwechslungen verhindert.
Für eine schnelle vertikale Vitrifikation in flüssigem Stickstoff wird das Gewebe der Ovarialrinde in geeignete Stücke geschnitten (Abbildung 4A). Die Proben der Ovarialrinde werden auf Ladevorrichtungen gelegt (Abbildung 4B, C) und vertikal in flüssigen Stickstoff getaucht (Abbildung 4D), um durch Vitrifikation einen glasartigen Aggregationszustand zu erreichen. Die gewählten Metallgitter ermöglichen eine vertikale Handhabung des Gewebes, wie in Abbildung 4D gezeigt. Darüber hinaus sind die Metallgitter hochgradig wärmeleitfähig und sorgen für schnelle Abkühlraten von 22 °C bis -196 °C, was ein entscheidender Schritt im Vitrifikationsprozess ist.
Für eine schnelle Erwärmung wird RWS in einem sterilen Becher bei 37 °C zubereitet. ES, RS1 und RS2 werden in einer 6-Well-Platte auf einem Wippschüttler bei Raumtemperatur zubereitet, wie in Abbildung 5 gezeigt. Das hohe Volumen an vorgewärmtem RWS verhindert, dass die Lösung bei Zugabe des verglasten Gewebes übermäßig abkühlt, und sorgt für eine gleichbleibend warme Umgebung für das Gewebe während des gesamten schnellen Erwärmungsprozesses.
Um hohe Qualitätsstandards zu beurteilen und zu gewährleisten, werden 2 mm x 2 mm große Biopsiestanzen vor der Vitrifikation und nach der schnellen Erwärmung mit Calcein gefärbt, um die Follikelviabilität mittels Fluoreszenzmikroskopiezu bestimmen 34,35 (Abbildung 6). Lebensfähige Follikel emittieren nach der intrazellulären Aufnahme von Calcein eine grüne Fluoreszenz bei 495 nm. Alternativ kann die Follikelviabilität (Tabelle 3) mit neutralroten Farbstoffen36 bestimmt werden.
Durch die Befolgung der in diesem Protokoll beschriebenen Schritte wird das Eierstockgewebe in einen glasartigen Aggregatzustand überführt, der nach einer schnellen Erwärmung hohe Überlebensraten ermöglicht, wie die Fluoreszenzmikroskopie bestätigt.
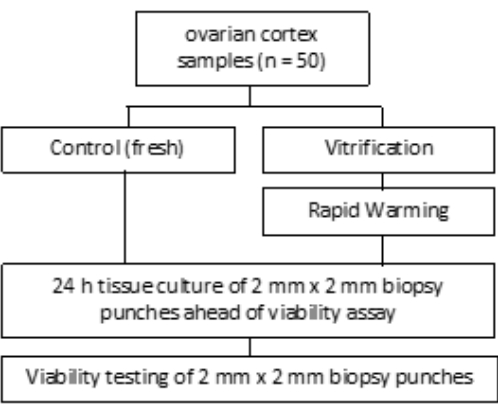
Abbildung 1: Studiendesign. Ovarialkortikale Proben von 50 Patientinnen wurden vor (frisch) und nach der Vitrifikation und der schnellen Erwärmung auf die Anzahl der lebensfähigen Follikel untersucht. Für jede Gruppe wurden zwei Gewebestücke mit einem Durchmesser von 2 mm 24 Stunden lang kultiviert, bevor die Follikelzahl beurteilt wurde. Das Gewebe wurde mit Kollagenase verdaut und mit Calcein gefärbt, um die Lebensfähigkeit zu beurteilen. Die Anzahl der lebensfähigen Follikel wurde mit Hilfe eines Mikroskops bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Vorbereitung der Ladevorrichtungen. Metallgitter wurden auf eine Größe von 8 mm x 25 mm (A) zugeschnitten. Die kundenspezifischen Metallgitter wurden durch Autoklavieren (B) sterilisiert. Die sterilisierten Metallgitter wurden dann in Verschlüsse mit 1,8-ml-Fläschchen eingesetzt, die gebrauchsfertig waren (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
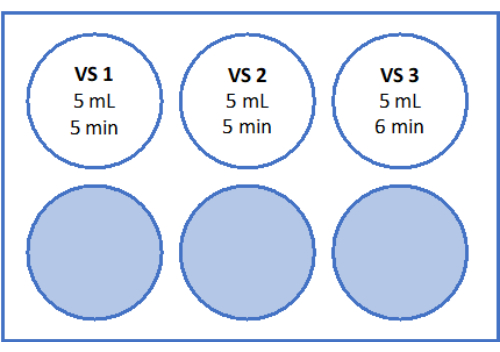
Abbildung 3: Aufbereitung von Vitrifikationslösungen. Vitrifikationslösungen (VS) wurden hergestellt und auf eine 6-Well-Platte übertragen. Die Vertiefungen zeigen das Volumen jeder Lösung und die einzelnen Inkubationszeiten, die im Vitrifikationsprotokoll verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Verarbeitung und Vitrifikation der Ovarialrinde. Das Gewebe der Ovarialrinde wurde für die Kryokonservierung aufbereitet, indem das Mark entfernt und das Gewebe in 5 mm x 10 mm große Stücke geschnitten wurde (A). Nach der Inkubation in den in Abbildung 3 gezeigten Vitrifikationslösungen wurde das Gewebe auf die Vitrifikationsladevorrichtung (B,C) geladen. Für eine schnelle vertikale Vitrifikation von Proben der Ovarialrinde wurden die Kappen mit dem geladenen Gewebe schnell in sterilisierten flüssigen Stickstoff (D) eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
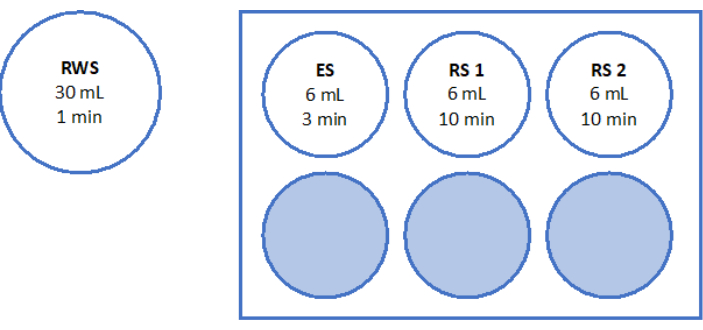
Abbildung 5: Herstellung von Lösungen für die schnelle Erwärmung. Die Schnellerwärmungslösung (RWS), die Äquilibrierungslösung (ES) und die Spüllösungen (RS) 1 und 2 wurden hergestellt und auf eine 6-Well-Platte überführt. Die Gefäße und Vertiefungen zeigen das Volumen jeder Lösung und die entsprechenden Inkubationszeiten an. Beachten Sie, dass RWS auf einer Heizplatte bei 37,2 °C gehalten wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
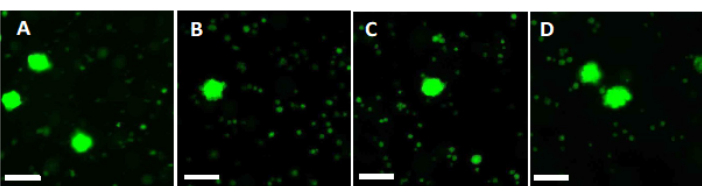
Abbildung 6: Anzahl der Lebensfähigkeiten. Um die Anzahl der lebensfähigen Follikel zu bestimmen, wurden Gewebestücke mit einem Durchmesser von 2 mm mit Kollagenase verdaut und mit Calcein gefärbt. Die repräsentativen Bilder zeigen (A) die Calcein-Färbung von 3 gewonnenen Follikeln vor der Vitrifikation. (B) Ein wiedergewonnener lebensfähiger Follikel nach Vitrifikation und rascher Erwärmung. (C) Ein wiedergewonnener lebensfähiger Follikel vor dem langsamen Einfrieren. (D) Wiedergewonnene lebensfähige Follikel nach langsamem Einfrieren und Auftauen. Die Follikelviabilität wird durch Calcein angezeigt, einen grün fluoreszierenden Farbstoff, der grüne Fluoreszenz emittiert, wenn er von lebensfähigen Zellen bei 495 nm enzymatisch umgewandelt wird. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| VS 1 (15 ml) | Ethylenglykol | 10% | 1,5 mL |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 12 mL | ||
| VS 2 (15 ml) | Ethylenglykol | 20% | 3 mL |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 10,5 mL | ||
| VS 3 (15 ml) | Ethylenglykol | 35% | 5,25 ml |
| SSS | 10% | 1,5 mL | |
| Saccharose | 0,5 mol/L | 2,57 Gramm | |
| PVP | 5 % (w/v) | 0,75 Gramm | |
| G-MOPS+ | ad 15 mL |
Tabelle 1: Zusammensetzung der Vitrifikationslösungen (VS).
| RWS (30 ml) | Saccharose | 0,8 mol/L | |
| 8,22 Gramm | |||
| SSS | 10% | 3 mL | |
| G-MOPS+ | ad 30 mL | ||
| ES (15 ml) | Saccharose | 0,4 mol/L | ca. 2,05 g |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | ad 15 mL | ||
| RS 1&2 (15 mL) | SSS | 10% | 1,5 mL |
| G-MOPS+ | ad 15 mL |
Tabelle 2: Zusammensetzung der Schnellerwärmungslösung (RWS), der Äquilibrierungslösung (ES) und der Spüllösung (RS). Diese Tabelle enthält die Komponenten und Konzentrationen für die Schnellerwärmungslösung (RWS), die Äquilibrierungslösung (ES) und die Spüllösungen (RS), die bei der Nachverglasung verwendet werden.
| Parameter | Frisch | Intervall | Schnelle Erwärmung nach der Vitrifikation | Intervall | n | *P-Wert |
| SD | SD | |||||
| Anzahl der follikulären Viabilität [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Wilcoxon-Test |
Tabelle 3: Repräsentative Ergebnisse der Follikelviabilität. Diese Tabelle zeigt die Ergebnisse der Bewertung der Follikelviabilität vor der Kryokonservierung und nach einer schnellen Erwärmung. Pro Patient wurden zwei Gewebestücke mit einem Durchmesser von 2 mm verwendet, um die Anzahl der lebensfähigen Follikel vor und nach der Vitrifikation/schnellen Erwärmung zu zählen. Gepaarte Gewebeproben von 50 Patienten wurden mit dem Wilcoxon-Test analysiert.
Diskussion
Hier wird ein Protokoll für die Hochdurchsatz-Vitrifikation von humanem Ovarialrindengewebe vorgestellt, das für die klinische Routine geeignet ist. Ähnlich wie bei der Vitrifikation von Eizellen oder Embryonen erfordert die erfolgreiche Anwendung des Verfahrens die detaillierte Einhaltung des Protokolls über die Temperatur der Vitrifikations- und Erwärmungslösungen sowie die Äquilibrierungsperiode. Die Einhaltung der EU-Geweberichtlinie37 in Bezug auf Luftqualität und Sterilität ist ebenfalls von entscheidender Bedeutung.
Das Vitrifikationsverfahren führt zu einem nichtkristallinen, amorphen oder glasartigen Zustand. Insgesamt ist die Vitrifikation ein vielseitiger Prozess mit erheblichen Auswirkungen auf verschiedene wissenschaftliche und technologische Bereiche. Der Hauptvorteil der Vitrifikation besteht in ihrer Fähigkeit, Gewebe in einen glasartigen Zustand umzuwandeln und dadurch die Bildung von Eiskristallen zu verhindern 38,39,40, die die Integrität des Gewebes und seine Bestandteile negativ beeinflussen können.
Die Supplementierung von kryoprotektiven Mitteln (CPAs) mit Polyvinylpyrrolidon (PVP) ermöglicht eine Verringerung der CPA-Konzentration, ohne die Qualität der Vitrifikationslösungen zu beeinträchtigen41,42. Darüber hinaus bietet die Verwendung von Metallgittern eine hohe Wärmeleitfähigkeit im Vergleich zu kunststoffbasierten Trägersystemen. Die Gitterstruktur erleichtert auch die Oberflächenhaftung und gewährleistet so die sichere Kryokonservierung von Gewebeproben und kleinen Kortex-Stanzen für Qualitätsmessungen. Wenn Kryogefäße anderer Hersteller verwendet werden, ist es wichtig, die Größe der Metallgitter vorher zu testen, um die Stabilität und den richtigen Halt im Kryogefäßdeckel sowie einen guten Sitz im Gefäß zu gewährleisten.
Zu den kritischen Schritten für eine erfolgreiche Vitrifikation gehören die schnelle Vitrifikation durch Eintauchen des Gewebes in sterilisierten flüssigen Stickstoff und die schnelle Erwärmung ohne Verzögerung, um nachteilige Ergebnisse zu vermeiden. In Bezug auf die Wirtschaftlichkeit ist die Gewebevitrifikation im Vergleich zum langsamen Einfrieren weniger anspruchsvoll, was die Personaleinsatzplanung beeinflussen kann. Darüber hinaus entfällt durch die Vitrifikation die Notwendigkeit, Geräte zu kaufen und zu warten, die für das langsame Einfrieren erforderlich sind.
Biologische Messungen und Metaanalysen haben die Vergleichbarkeit oder sogar Vorteile der Vitrifikation im Vergleich zum langsamen Einfrieren nachgewiesen43. Unterschiede in den Ergebnissen nach der Vitrifikation können jedoch auf die mangelnde Standardisierung sowohl des Vitrifikationsgeräts als auch des Protokolls zurückgeführt werden, einschließlich der verwendeten Lösungen, die von Studie zu Studie variieren. Zukünftige Forschungen sollten das Potenzial von Follikelkulturen aus vitrifiziertem/schnell erwärmtem Gewebe zur Überwachung des Wachstums in vitro untersuchen, wie es von mehreren Gruppen in Maus-Eierstockgewebe erfolgreich demonstriert wurde 44,45,46,47,48,49,50.
Zusammenfassend lässt sich sagen, dass die Vitrifizierung von Eierstockgewebe eine bedeutende Alternative zum weit verbreiteten Slow Freezing Protocol ist, unterstützt durch fünf erfolgreiche Geburten, die von Suzuki51 (Japan), Silber52 (USA) und Sänger53 (Deutschland) gemeldet wurden. Im Gegensatz zu kommerziell erhältlichen Vitrifikationsmedien und Kits für Zellen gibt es nur wenige FDA/CE-zugelassene Systeme für Eierstockgewebe, was ihre Anwendung im klinischen Umfeld einschränken kann. Daher wird die Entwicklung von FDA/CE-zugelassenen Kits und Medien für die Vitrifizierung und schnelle Erwärmung von Eierstockgewebe empfohlen30.
Offenlegungen
Nichts.
Danksagungen
Wir danken Cara Färber für das Korrekturlesen; Katharina Wollersheim, Martin Mahlberg, Lea Korte und Jasmin Rebholz für ihre technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Referenzen
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten