Method Article
Vitrificación del tejido de la corteza ovárica para lograr un estado vítreo de agregación
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta un protocolo para la vitrificación de tejido ovárico, como método de criopreservación alternativo al ampliamente utilizado protocolo de congelación lenta.
Resumen
La criopreservación de tejido ovárico (OTC, por sus siglas en inglés) es una opción importante para la preservación de la fertilidad. Para los pacientes cuyos tratamientos gonadotóxicos no se pueden posponer o para las niñas prepúberes, a menudo es la única opción para la protección de la fertilidad. La criopreservación se puede realizar mediante vitrificación o por congelación lenta. La congelación lenta es actualmente el enfoque estándar. Un número cada vez mayor de estudios indica que la vitrificación puede reemplazar la congelación lenta en los laboratorios de fertilización in vitro (FIV) de última generación, mejorando significativamente las tasas de supervivencia de descongelación y simplificando los aspectos técnicos de la criopreservación. Se describe un protocolo de alto rendimiento basado en rejillas metálicas para la vitrificación rápida del tejido de la corteza ovárica, adecuado para la rutina clínica. La esterilización de rejillas metálicas y nitrógeno líquido garantiza una alta calidad, cumpliendo con los estándares de buenas prácticas de fabricación (GMP). La vitrificación se llevó a cabo para garantizar velocidades de enfriamiento ultrarrápidas. En lugar de descongelarse lentamente, las muestras se calentaron rápidamente. Para evaluar la viabilidad folicular, se realizó una tinción con calceína tanto antes de la criopreservación como después de un calentamiento rápido. Se reporta la aplicación exitosa de la vitrificación y el calentamiento rápido utilizando rejillas metálicas. No se observaron diferencias significativas en la viabilidad folicular antes de la vitrificación y después del calentamiento rápido. Estos resultados confirman la alta capacidad de la vitrificación de tejidos para aplicaciones de rutina clínica como un posible sustituto del método de congelación lenta ampliamente utilizado.
Introducción
La criopreservación de tejido ovárico es una opción importante para la preservación de la fertilidad. El tejido explantado que contiene folículos ováricos, en los que se incrustan los ovocitos, se criopreserva. Después del almacenamiento, el tejido ovárico se puede descongelar, calentar y reimplantar en la paciente. En el caso de las células o tejidos viables, existen dos métodos de criopreservación: la congelación lenta y la vitrificación1.
La vitrificación se utiliza para preservar materiales biológicos, como embriones y ovocitos, con tasas de supervivencia superiores en comparación con el protocolo de congelación lenta 1,2,3,4. La congelación lenta tiene limitaciones, como la formación de cristales de hielo, que pueden dañar las estructuras celulares y tisulares. Sin embargo, la congelación lenta es un importante enfoque de criopreservación que facilita el almacenamiento a largo plazo de muestras biológicas, y la funcionalidad de este método ha sido ampliamente probada5. La vitrificación induce un estado vítreo de agregación, evitando la formación de cristales de hielo 6,7. A nivel técnico, la vitrificación simplifica significativamente el procedimiento de criopreservación al reducir el mantenimiento del equipo, disminuir la probabilidad de errores técnicos y acortar la duración del proceso de criopreservación 8,9. En la preservación de la fertilidad femenina, la criopreservación de tejido ovárico es un abordaje decisivo previo al tratamiento del cáncer10. Diferentes grupos han demostrado exitosamente el concepto de criopreservación, descongelación y trasplante de tejido basado en el protocolo de congelación lenta 11,12,13,14, que actualmente se considera el enfoque estándar 15.
La vitrificación del tejido ovárico se considera un método alternativo prometedor 16,17,18,19,20,21, en términos de ahorro de recursos22, tasas de supervivencia folicular, niveles de fragmentación del ADN y potencial angiogénico equilibrado 23,24,25,26,27. Así lo demuestran las entregas exitosas en Japón28, Estados Unidos29 y Alemania30.
La comparación de las dos opciones para la criopreservación de tejido ovárico (OTC)-vitrificación frente al procedimiento estándar de congelación lenta- los resultados son parcialmente contradictorios en los metaanálisis actuales16. Varios factores pueden haber contribuido a esto, ya que los protocolos de vitrificación actuales varían mucho. Estas diferencias incluyen la elección del crioprotector o la combinación de protectores, su concentración, la composición de los medios de venta libre, el tamaño de los fragmentos de tejido y el dispositivo utilizado como portador de tejido. En consecuencia, no existe un protocolo de calentamiento estandarizado.
Dado que los autores encontraron un método que arroja resultados convincentes en términos de manejo, viabilidad, inicio de la apoptosis, liberación de factores angiogénicos e incluso un reporte de un parto después del reimplante 9,27, se proporciona una descripción muy detallada del protocolo. El método descrito ofrece un protocolo válido y eficaz que puede contribuir a la estandarización de la vitrificación del tejido ovárico.
Protocolo
El estudio fue aprobado por el comité de ética del Hospital Universitario de Bonn (007/09). Se obtuvo el consentimiento informado por escrito de cada paciente. El grupo de estudio incluyó tejido ovárico humano de 50 pacientes con una edad media de 27,4 años antes de la criopreservación, como se indica en la Figura 1. Los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Preparación de los dispositivos de carga
- Prepare tijeras quirúrgicas y mallas metálicas para la personalización. Corte las mallas en tiras de 25 mm x 8 mm, como se indica en la Figura 2A.
- Coloque las mallas metálicas personalizadas en un recipiente de esterilización y autoclave durante 2 h (Figura 2B). Después de la esterilización en autoclave, coloque el recipiente de esterilización y los viales de 1,8 ml debajo del banco de flujo laminar.
- Encienda la irradiación ultravioleta (UV) del banco de flujo laminar durante 30 minutos para una esterilización adicional a una longitud de onda de 254 nm.
- Abra el recipiente de esterilización, retire las rejillas metálicas y colóquelas en las tapas de los viales de 1,8 mL, como se indica en la Figura 2C. Cierre los viales de 1,8 ml.
NOTA: Todos los trabajos de cultivo de tejidos descritos anteriormente deben realizarse en una campana de flujo laminar de Clase II. Limpie el banco de flujo laminar con un desinfectante de superficies mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
2. Preparación de los medios de vitrificación
- Prepare una pipeta serológica de 10 mL, una pipeta electrónica y tres tubos de 50 mL para la solución de vitrificación 1 (VS1), la solución de vitrificación 2 (VS2) y la solución de vitrificación 3 (VS3), así como para registrar la fecha de preparación. Encienda la radiación ultravioleta (UV) del banco de flujo laminar para una esterilización adicional.
- Para VS1 (15 mL), pipetear 12 mL de medio de manipulación de ovocitos (suplementado con albúmina sérica humana por el fabricante), 1,5 mL de SSS (Suero Sustitutivo de Suero) y 1,5 mL de etilenglicol en un tubo de 50 mL.
- Para VS2 (15 mL), pipetear 10,5 mL de medio de manipulación de ovocitos (suplementado con albúmina sérica humana por el fabricante), 3 mL de etilenglicol y 1,5 mL de SSS en un tubo de 50 mL.
- Para VS3, pipetear 8,5 mL de medio de manipulación de ovocitos (suplementado con albúmina sérica humana por el fabricante), 5,25 mL de etilenglicol y añadir 2,57 g de sacarosa y 0,75 g de polivinilpirrolidona (PVP) en un tubo de 50 mL. Consulte la Figura 3 para obtener más detalles. Mezcle todas las soluciones mediante vórtice a 3.000 rpm.
NOTA: Todos los trabajos de cultivo de tejidos descritos anteriormente deben realizarse en una campana de flujo laminar de Clase II. Limpie el banco de flujo laminar con un desinfectante mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
3. Preparación de la vitrificación
- Limpie el banco de flujo laminar con un desinfectante de superficies mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
- Prepare una placa de 6 pocillos, un colador de células, un bisturí, pinzas, un punzón de biopsia de 2 mm y dos platos de fondo redondo de 90 mm. Además, prepare los medios: solución de conservación para trasplante de tejidos y VS1-3. Pipetear 5 mL de cada solución enfriada (VS1-3) en pocillos separados y esperar 30 minutos para que las soluciones alcancen la temperatura ambiente.
- Esterilizar nitrógeno líquido con un sistema automatizado de irradiación UV; alternativamente, utilice la irradiación UV de la campana de flujo laminar durante 120 min.
4. Vitrificación de tejidos
- Prepara el tejido de la corteza ovárica mediante la extirpación de la médula. Dado que la corteza suele ser más dura que la médula, se pueden distinguir y separar fácilmente.
- Corte el tejido de la corteza ovárica en las formas deseadas (10 mm x 5 mm para el trasplante; punzones de 2 mm x 2 mm para el recuento de folículos viables antes y después de la vitrificación), como se indica en la Figura 4A.
NOTA: Evite dañar el tejido presionando demasiado fuerte y manéjelo con cuidado. Las muestras de tejido pueden variar de un paciente a otro.
- Corte el tejido de la corteza ovárica en las formas deseadas (10 mm x 5 mm para el trasplante; punzones de 2 mm x 2 mm para el recuento de folículos viables antes y después de la vitrificación), como se indica en la Figura 4A.
- Coloque un colador de células en el primer pocillo de la placa de 6 pocillos con VS1. Equilibre el tejido de la corteza ovárica durante 5 min en 5 mL de VS1 en el pocillo 1 de la placa de 6 pocillos utilizando el filtro de células.
- A continuación, mueva el filtro de células con el tejido de la corteza al pocillo 2 que contiene 5 mL de VS2 y equilibre durante 5 minutos. Finalmente, equilibrar durante 6 min en 5 mL de VS3, como se indica en la Figura 3 y la Tabla 1.
- Abra los crioviales preparados. Llene los viales con nitrógeno líquido esterilizado y colóquelos en el recipiente cryo dewar lleno de nitrógeno líquido. Cargue las muestras de tejido en la rejilla metálica del dispositivo de vitrificación en 1 minuto (Figura 4B, C).
- Inserte las muestras de tejido cargadas en la rejilla metálica en el nitrógeno líquido en los crioviales preparados basados en rejilla (Figura 4D).
NOTA: La congelación rápida del tejido cargado en la rejilla metálica es esencial para el éxito de este método. Todos los trabajos de cultivo de tejidos descritos anteriormente deben realizarse en una campana de flujo laminar de Clase II. Limpie el banco de flujo laminar con un desinfectante de superficies mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
- Inserte las muestras de tejido cargadas en la rejilla metálica en el nitrógeno líquido en los crioviales preparados basados en rejilla (Figura 4D).
5. Preparación de medios de calentamiento rápido
- Prepare las soluciones como se indica en la Figura 5 y la Tabla 2. Pesar la sacarosa para la solución de calentamiento rápido (RWS) y la solución de equilibrio (ES) y transferirla al tubo. Añada el medio de manipulación de ovocitos (suplementado con albúmina sérica humana por el fabricante) utilizando una pipeta serológica y un auxiliar de pipeteo. Agregue SSS y sacarosa como se indica en la Tabla 2.
- Cierre los tubos y déjelos agitar en una coctelera rodante hasta que se disuelvan por completo.
NOTA: Todos los trabajos de cultivo de tejidos descritos anteriormente deben realizarse en una campana de flujo laminar de Clase II. Limpie el banco de flujo laminar con un desinfectante de superficies mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
6. Preparación rápida para el calentamiento
- Un día antes del calentamiento rápido, prepare los consumibles y descontaminelos con luz ultravioleta en el banco de flujo laminar: Prepare el vaso de muestras para RWS, la placa de 6 pocillos para ES, RS1 y RS2, y el vaso de muestras para el transporte de tejidos después del calentamiento rápido. Coloque pinzas estériles y desechables, equipos de pipeteo y otros consumibles en el banco de flujo laminar.
- Precaliente una placa calefactora a 37,2 °C. Incubar RWS a 37 °C durante al menos 1 h.
- Prepare una placa estéril de 6 pocillos con 6 mL de ES, 6 mL de RS para "RS1" y otros 6 mL de RS para "RS2" en el banco de flujo laminar. Consulte la Figura 5 para obtener una ilustración esquemática de la placa de 6 pocillos. Deje que se incuben a temperatura ambiente durante 1 h antes de calentar el tejido.
- Transfiera el RWS a un vaso de precipitados de muestras estéril en condiciones estériles y colóquelo en la placa calefactora. El RWS debe mantenerse a 37 °C.
NOTA: El calentamiento rápido requiere una tasa de calentamiento rápida. Es crucial mantener el RWS a 37 °C para garantizar el éxito del primer paso.
7. Calentamiento rápido del tejido ovárico
- Transporte los viales criopreservados que contienen tejido cortical ovárico vitrificado en nitrógeno líquido al banco de flujo laminar. Abra los viales mientras estén parcialmente sumergidos bajo nitrógeno líquido. Sumerja rápidamente la malla con el tejido vitrificado en el RWS y deje reposar el tejido allí durante 1 minuto a 37 °C.
NOTA: Este es el paso más crítico durante el calentamiento rápido y debe llevarse a cabo sin demora. - Con pinzas estériles, transfiera el tejido al CE e incube durante 3 minutos mientras lo agita suavemente en un agitador oscilante.
- Enjuague el pañuelo a temperatura ambiente durante 10 minutos cada uno con RS1 y RS2 en un agitador oscilante, como se indica en la Figura 5.
- Transfiera el tejido calentado a un vaso de precipitados estéril que contenga 5 mL de solución de conservación para trasplante de tejidos, que debe mantenerse a 4 °C para su transporte al lugar del trasplante.
NOTA: Todos los trabajos de cultivo de tejidos descritos anteriormente deben realizarse en una campana de flujo laminar de Clase II. Limpie el banco de flujo laminar con un desinfectante de superficies mientras usa guantes de laboratorio desechables; Se recomiendan guantes sin polvo.
8. Determinación de la viabilidad folicular
- Lleve el dimetilsulfóxido (DMSO) a temperatura ambiente durante la noche para obtener un estado líquido. Pipetear 100 μL de DMSO en un vial de calceína y volver a suspender para disolver la calceína. Pipetear 3 μL de la calceína disuelta en el fondo de un tubo de 1,5 mL y almacenar los viales a -20 °C.
- Coloque 0,007 g de colagenasa en un tubo de 1,5 ml y guárdelo a -20 °C.
- Añada 997 μL de DPBS a los 3 μL de calceína prealicotizados y congelados en un tubo de 1,5 mL, y vuelva a suspender para disolver la calceína. Añadir 0,007 g de colagenasa para obtener 1000 μL de solución de trabajo.
- Utilice 500 μL de la solución de trabajo para digerir dos trozos de fragmentos de corteza ovárica de 2 mm durante 90 min a 37 °C, protegidos de la luz, en una placa de 4 pocillos. Después de 60 min y 70 min, vuelva a suspender la solución repetidamente. Finalmente, determinar la viabilidad folicular mediante microscopía de fluorescencia, como se muestra en la Figura 6.
Resultados
Este protocolo presenta los procedimientos para la preparación de medios de vitrificación, dispositivos de carga, vitrificación, preparación de medios de calentamiento rápido, calentamiento rápido y determinación de la viabilidad folicular. Se ha validado y publicado una comparación directa de la viabilidad folicular y los factores angiogénicos entre la congelación lenta y la vitrificación31,32.
El éxito general del protocolo de vitrificación descrito se evaluó comparando el recuento de folículos vitales antes y después de la vitrificación/calentamiento rápido. La configuración experimental se muestra en la Figura 1 y los resultados se presentan en la Figura 6. En 50 pacientes, se observó un recuento medio de 77,98 folículos vitales antes de la vitrificación y de 62,99 después de la vitrificación/calentamiento rápido, lo que refleja una tasa de supervivencia del 80,8%. Esto no fue significativamente diferente según la prueba de Wilcoxon33.
Las rejillas metálicas se personalizan individualmente con tijeras afiladas a un tamaño de 25 mm x 8 mm, que encaja en las tapas de los crioviales de 1,8 mL, como se muestra en la Figura 2A, C. Después de la esterilización mediante autoclave de vapor, las rejillas y tapas de los viales de 1,8 mL se ensamblan bajo un banco de flujo laminar, como se indica en la Figura 2B. Esta configuración proporciona una sujeción segura en la tapa sin necesidad de acciones adicionales y ofrece suficiente área para tejido de varios tamaños. Por lo general, se vitrifican piezas de tejido de 5 mm x 10 mm para el trasplante y piezas de 2 mm de diámetro para evaluar el recuento de folículos vitales después de una descongelación rápida. Ambos tamaños encajan perfectamente en las rejillas metálicas.
El equilibrio con soluciones de vitrificación (VS1, VS2 y VS3) se lleva a cabo en una placa de 6 pocillos en un agitador oscilante a temperatura ambiente debajo de un banco de flujo laminar, como se muestra en la Figura 3. Los plazos del plan garantizan la absorción efectiva del etilenglicol crioprotector. Se recomienda el uso de una placa de 6 pocillos sobre vasos individuales, ya que facilita el movimiento rápido del tejido entre soluciones y ayuda a prevenir confusiones.
Para una vitrificación vertical rápida en nitrógeno líquido, el tejido de la corteza ovárica se corta en trozos adecuados (Figura 4A). Las muestras de corteza ovárica se colocan en dispositivos de carga (Figura 4B, C) y se sumergen verticalmente en nitrógeno líquido (Figura 4D) para lograr un estado vítreo de agregación a través de la vitrificación. Las rejillas metálicas elegidas permiten la manipulación vertical del tejido, como se muestra en la Figura 4D. Además, las rejillas metálicas son altamente conductoras térmicamente, lo que garantiza velocidades de enfriamiento rápidas de 22 °C a -196 °C, lo cual es un paso de importancia crítica en el proceso de vitrificación.
Para un calentamiento rápido, RWS se prepara en un recipiente estéril a 37 °C. ES, RS1 y RS2 se preparan en una placa de 6 pocillos en un agitador oscilante a temperatura ambiente, como se muestra en la Figura 5. El alto volumen de RWS precalentado evita que la solución se enfríe excesivamente con la adición del tejido vitrificado y garantiza un ambiente constantemente cálido para el tejido durante todo el proceso de calentamiento rápido.
Para evaluar y asegurar altos estándares de calidad, los punzones de biopsia de 2 mm x 2 mm se tiñen con calceína antes de la vitrificación y después de un calentamiento rápido para determinar la viabilidad folicular mediante microscopía de fluorescencia34,35 (Figura 6). Los folículos viables emiten fluorescencia verde a 495 nm después de la absorción intracelular de calceína. Alternativamente, la viabilidad folicular (Tabla 3) puede evaluarse utilizando colorantes rojos neutros36.
Siguiendo los pasos descritos en este protocolo, el tejido ovárico se transforma en un estado vítreo de agregación, lo que facilita altas tasas de supervivencia después de un calentamiento rápido, como lo confirma la microscopía de fluorescencia.
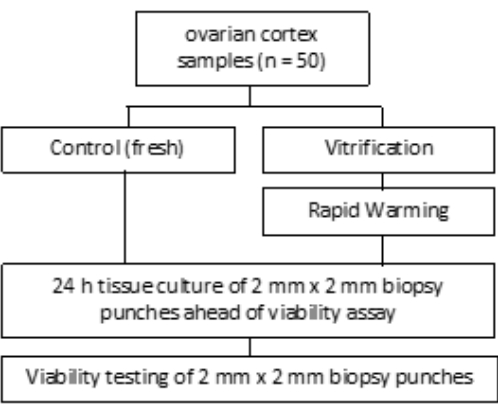
Figura 1: Diseño del estudio. Se examinaron muestras de la corteza ovárica de 50 pacientes antes (frescas) y después de la vitrificación y el calentamiento rápido para determinar el número de folículos viables. Para cada grupo, se cultivaron dos piezas de tejido de 2 mm de diámetro durante 24 h antes de la evaluación del recuento de folículos. El tejido se digirió con colagenasa y se tiñó con calceína para evaluar la viabilidad. El número de folículos viables se determinó mediante un microscopio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Preparación de los dispositivos de carga. Las rejillas metálicas se cortaron a un tamaño de 8 mm x 25 mm (A). Las rejillas metálicas personalizadas se esterilizaron en autoclave (B). A continuación, las rejillas metálicas esterilizadas se insertaron en tapones de viales de 1,8 ml, listos para su uso (C). Haga clic aquí para ver una versión más grande de esta figura.
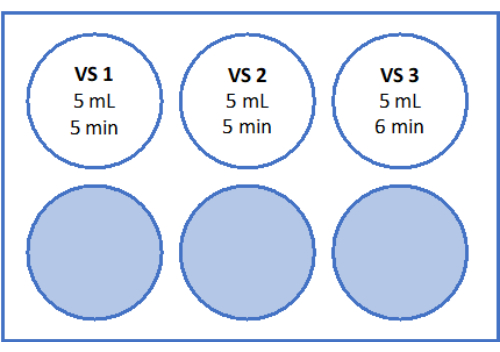
Figura 3: Preparación de soluciones de vitrificación. Se prepararon soluciones de vitrificación (VS) y se transfirieron a una placa de 6 pocillos. Los pocillos muestran el volumen de cada solución y los tiempos de incubación individuales utilizados en el protocolo de vitrificación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Procesamiento y vitrificación de la corteza ovárica. El tejido de la corteza ovárica se procesó para la criopreservación mediante la extracción de la médula y el corte del tejido en trozos de 5 mm x 10 mm (A). Después de la incubación en las soluciones de vitrificación que se muestran en la Figura 3, el tejido se cargó en el dispositivo de carga de vitrificación (B,C). Para la vitrificación vertical rápida de muestras de corteza ovárica, las tapas con el tejido cargado se insertaron rápidamente en nitrógeno líquido (D) esterilizado. Haga clic aquí para ver una versión más grande de esta figura.
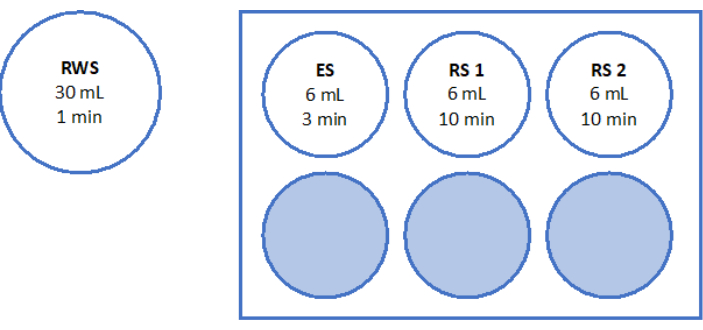
Figura 5: Preparación de soluciones de calentamiento rápido. Se prepararon y transfirieron la solución de calentamiento rápido (RWS), la solución de equilibrio (ES) y las soluciones de enjuague (RS) 1 y 2 a una placa de 6 pocillos. Los recipientes y pocillos muestran el volumen de cada solución y los tiempos de incubación correspondientes. Tenga en cuenta que el RWS se mantiene a 37,2 °C en una placa calefactora. Haga clic aquí para ver una versión más grande de esta figura.
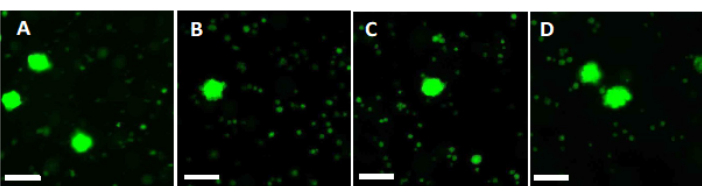
Figura 6: Recuento de viabilidad. Para evaluar el número de folículos viables, se digierieron trozos de tejido de 2 mm de diámetro con colagenasa y se tiñeron con calceína. Las imágenes representativas muestran (A) tinción con calceína de 3 folículos recuperados antes de la vitrificación. (B) Un folículo viable recuperado después de la vitrificación y el calentamiento rápido. (C) Un folículo viable recuperado antes de la congelación lenta. (D) Folículos viables recuperados después de la congelación y descongelación lentas. La viabilidad folicular está indicada por la calceína, un colorante verde fluorescente que emite fluorescencia verde cuando las células viables la convierten enzimáticamente a 495 nm. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
| VS 1 (15 mL) | Etilenglicol | 10% | 1,5 ml |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | 12 mL | ||
| VS 2 (15 mL) | Etilenglicol | 20% | 3 mL |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | 10,5 mL | ||
| VS 3 (15 mL) | Etilenglicol | 35% | 5.25 mL |
| SSS | 10% | 1,5 ml | |
| Sacarosa | 0,5 mol/L | 2,57 g | |
| PVP | 5 % (p/v) | 0,75 g | |
| G-MOPS+ | ad 15 mL |
Tabla 1: Composición de las soluciones de vitrificación (VS).
| RWS (30 mL) | Sacarosa | 0,8 mol/L | |
| 8,22 g | |||
| SSS | 10% | 3 mL | |
| G-MOPS+ | ad 30 mL | ||
| ES (15 mL) | Sacarosa | 0,4 mol/L | 2,05 g |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | ad 15 mL | ||
| RS 1 y 2 (15 mL) | SSS | 10% | 1,5 ml |
| G-MOPS+ | ad 15 mL |
Tabla 2: Composición de la solución de calentamiento rápido (RWS), la solución de equilibrio (ES) y las soluciones de enjuague (RS). Esta tabla proporciona los componentes y las concentraciones para la solución de calentamiento rápido (RWS), la solución de equilibrio (ES) y las soluciones de enjuague (RS) utilizadas en el procesamiento posterior a la vitrificación.
| Parámetro | Fresco | Intervalo | Calentamiento rápido después de la vitrificación | Intervalo | n | *Valor P |
| SD | SD | |||||
| Recuento de viabilidad folicular [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Prueba de Wilcoxon |
Tabla 3: Resultados representativos de la viabilidad folicular. Esta tabla presenta los resultados de las evaluaciones de viabilidad folicular antes de la criopreservación y después del calentamiento rápido. Se utilizaron dos piezas de tejido de 2 mm de diámetro por paciente para contar el número de folículos viables antes y después de la vitrificación/calentamiento rápido. Se analizaron muestras de tejido pareado de 50 pacientes mediante la prueba de Wilcoxon.
Discusión
En este trabajo se presenta un protocolo para la vitrificación de alto rendimiento de tejido de corteza ovárica humana, adecuado para la rutina clínica. Al igual que en la vitrificación de ovocitos o embriones, la aplicación exitosa del procedimiento requiere un cumplimiento detallado del protocolo relativo a la temperatura de las soluciones de vitrificación y calentamiento, así como al período de equilibrio. También es esencial el cumplimiento de las directivas de tejidos de la UE37 relativas a la calidad del aire y la esterilidad.
El procedimiento de vitrificación da como resultado un estado no cristalino, amorfo o vítreo. En general, la vitrificación es un proceso versátil con implicaciones significativas en varios dominios científicos y tecnológicos. El principal beneficio de la vitrificación es su capacidad para convertir el tejido en un estado vítreo, evitando así la formación de cristales de hielo 38,39,40, que pueden afectar negativamente la integridad del tejido y sus componentes.
La suplementación de agentes crioprotectores (CPA) con polivinilpirrolidona (PVP) permite una reducción de la concentración de CPA sin comprometer la calidad de las soluciones de vitrificación41,42. Además, el uso de rejillas metálicas proporciona una alta conductividad térmica en comparación con los sistemas portadores basados en plástico. La estructura de rejilla también facilita la adhesión a la superficie, lo que garantiza la criopreservación segura de muestras de tejido y pequeños punzones de corteza para medir la calidad. Si se utilizan criovasos de otros fabricantes, es importante probar previamente el tamaño de las rejillas metálicas para garantizar la estabilidad y el agarre adecuado dentro de la tapa del criorecipiente, así como un buen ajuste en el recipiente.
Los pasos críticos para garantizar el éxito de la vitrificación incluyen la vitrificación rápida mediante la inmersión del tejido en nitrógeno líquido esterilizado y la realización de un calentamiento rápido sin demora para evitar resultados adversos. En términos de rentabilidad, la vitrificación de tejidos es menos exigente en comparación con el procedimiento de congelación lenta, lo que puede influir en la planificación del despliegue del personal. Además, la vitrificación elimina la necesidad de comprar y reparar el equipo necesario para la congelación lenta.
Las medidas biológicas y los metaanálisis han demostrado la comparabilidad o incluso las ventajas de la vitrificación en comparación con la congelación lenta43. Sin embargo, las diferencias en los resultados después de la vitrificación pueden atribuirse a la falta de estandarización tanto en el dispositivo de vitrificación como en el protocolo, incluidas las soluciones utilizadas, que varían según los estudios. Las investigaciones futuras deben explorar el potencial del cultivo de folículos a partir de tejido vitrificado/calentado rápidamente para monitorear el crecimiento in vitro, como se ha demostrado con éxito en tejido ovárico de ratón por varios grupos 44,45,46,47,48,49,50.
En resumen, la vitrificación del tejido ovárico es una alternativa significativa al protocolo de congelación lenta ampliamente utilizado, respaldada por cinco partos exitosos reportados por Suzuki51 (Japón), Silber52 (EE. UU.) y Sänger53 (Alemania). A diferencia de los medios y kits de vitrificación para células disponibles en el mercado, existen pocos sistemas aprobados por la FDA/CE para el tejido ovárico, lo que puede limitar su aplicación en entornos clínicos. Por lo tanto, se recomienda el desarrollo de kits y medios aprobados por la FDA/CE para la vitrificación y el calentamiento rápido del tejido ovárico30.
Divulgaciones
Ninguno.
Agradecimientos
Agradecemos a Cara Färber por la corrección; Katharina Wollersheim, Martin Mahlberg, Lea Korte y Jasmin Rebholz por su asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Referencias
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados