Method Article
난소 피질 조직의 유리화(vitrification of the glassy state of aggation)
요약
널리 사용되는 느린 동결 프로토콜에 대한 대안적인 냉동 보존 방법으로서 난소 조직의 유리화를 위한 프로토콜이 제시됩니다.
초록
난소 조직 동결 보존(OTC)은 가임력 보존을 위한 중요한 옵션입니다. 성선독성 치료를 연기할 수 없는 환자나 사춘기 이전의 소녀들에게는 생식력 보호를 위한 유일한 선택인 경우가 많습니다. 냉동 보존은 유리화 또는 서서히 동결하여 수행할 수 있습니다. 서서히 동결하는 것이 현재 표준 접근 방식입니다. 점점 더 많은 연구에 따르면 유리화는 최첨단 체외 수정(IVF) 실험실에서 느린 동결을 대체하여 해동 생존율을 크게 개선하고 동결 보존의 기술적 측면을 단순화할 수 있습니다. 임상 루틴에 적합한 난소 피질 조직의 신속한 유리화를 위한 금속 그리드 기반의 고처리량 프로토콜에 대해 설명합니다. 금속 그리드 및 액체 질소의 멸균은 GMP(Good Manufacturing Practice) 표준을 충족하는 고품질을 보장합니다. 초고속 냉각 속도를 보장하기 위해 유리화(vitrification)가 수행되었습니다. 천천히 해동하는 대신, 샘플을 빠르게 데우십시오. 여포 생존율을 평가하기 위해 칼세인 염색은 냉동 보존 전과 급속 온난화 후에 모두 수행되었습니다. 금속 그리드를 사용한 유리화 및 급속 온난화의 성공적인 적용이 보고되었습니다. 소낭선 생존력의 유의미한 차이는 유리화 이전과 급속한 온난화 후에 관찰되지 않았다. 이러한 결과는 널리 사용되는 완속 동결 방법의 잠재적 대체품으로서 임상 일상 응용 분야를 위한 조직 유리화의 고용량을 입증합니다.
서문
난소 조직의 냉동 보존은 가임력 보존을 위한 중요한 옵션입니다. 난모세포가 박혀 있는 난소 난포가 포함된 이식된 조직은 동결 보존됩니다. 보관 후 난소 조직을 해동하고 따뜻하게 하여 환자에게 다시 이식할 수 있습니다. 생존 가능한 세포 또는 조직의 경우 느린 동결 및 유리화의 두 가지 동결 보존 방법을 사용할 수 있습니다1.
유리화는 배아 및 난모세포와 같은 생물학적 물질을 보존하는 데 사용되며, 느린 동결 프로토콜 1,2,3,4에 비해 생존율이 우수합니다. 천천히 얼면 얼음 결정 형성과 같은 제한 사항이 있어 잠재적으로 세포 및 조직 구조를 손상시킬 수 있습니다. 그러나 서서히 동결하는 것은 생물학적 샘플의 장기 보관을 용이하게 하는 중요한 동결 보존 접근 방식이며 이 방법의 기능은 널리 입증되었습니다5. 유리화는 유리 같은 응집 상태를 유도하여 얼음 결정 형성을 방지합니다 6,7. 기술적 수준에서 유리화는 장비 유지 보수를 줄이고 기술적 오류 가능성을 줄이며 동결보존 프로세스 8,9의 기간을 단축하여 동결 보존 절차를 크게 단순화합니다. 여성의 가임력 보존에서 난소 조직 동결보존은 암 치료 전에 결정적인 접근법이다10. 다양한 그룹들이 현재 표준 접근법15로 간주되는 느린 냉동 프로토콜 11,12,13,14를 기반으로 조직의 동결 보존, 해동 및 이식의 개념을 성공적으로 입증했다.
난소 조직의 유리화는 자원 절약22, 여포 생존율, DNA 단편화 수준 및 균형 잡힌 혈관 형성 전위 23,24,25,26,27 측면에서 유망한 대체 방법으로 간주됩니다 16,17,18,19,20,21. 이는 일본28, 미국29, 독일30에서 성공적인 납품으로 입증되었습니다.
난소 조직 동결보존(OTC)-유리체화-유리화-와 느린 동결-결과의 표준 절차를 비교하는 것은 현재의 메타 분석에서 부분적으로 상충되는 결과를 보인다16. 여기에는 몇 가지 요인이 기여했을 수 있는데, 현재의 유리화 프로토콜은 매우 다양하기 때문입니다. 이러한 차이점에는 동결 보호제의 선택 또는 보호제의 조합, 농도, OTC 배지의 구성, 조직 조각의 크기 및 조직 담체로 사용되는 장치가 포함됩니다. 따라서 표준화된 온난화 프로토콜은 없습니다.
저자는 처리, 생존 가능성, 세포 사멸 시작, 혈관 생성 인자의 방출 및 재착상 후 출산 보고서 측면에서 설득력 있는 결과를 산출하는 방법을 찾았으므로 9,27 프로토콜에 대한 매우 자세한 설명이 제공됩니다. 설명된 방법은 난소 조직의 유리화의 표준화에 기여할 수 있는 유효하고 효과적인 프로토콜을 제공합니다.
프로토콜
이 연구는 본 대학병원의 윤리 위원회에 의해 승인되었다(007/09). 각 환자로부터 서면 동의서를 받았습니다. 연구 그룹에는 그림 1에서 알 수 있듯이 냉동 보존 전 평균 연령이 27.4세인 환자 50명의 인간 난소 조직이 포함되었습니다. 이 연구에 사용된 시약 및 장비는 재료 표에 나열되어 있습니다.
1. 적재 장치의 준비
- 사용자 정의를 위해 수술용 가위와 금속 메쉬를 준비합니다. 그림 25A와 같이 메쉬를 8mm x 2mm 크기의 스트립으로 자릅니다.
- 맞춤형 금속 메쉬를 멸균 용기에 넣고 2시간 동안 오토클레이브합니다(그림 2B). 고압멸균 후 멸균 용기와 1.8mL 바이알을 층류 벤치 아래에 놓습니다.
- 30nm 파장에서 추가 살균을 위해 254분 동안 층류 벤치의 자외선(UV) 조사를 켭니다.
- 멸균 용기를 열고 금속 그리드를 제거한 다음 그림 2C와 같이 1.8mL 바이알의 캡에 끼웁니다. 1.8mL 바이알을 닫습니다.
참고: 위에서 설명한 모든 조직 배양 작업은 Class II 층류 후드에서 수행해야 합니다. 일회용 실험실 장갑을 착용하는 동안 표면 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
2. 유리화 매체의 준비
- 유리화 용액 1(VS1), 유리화 용액 2(VS2) 및 유리화 용액 3(VS3)을 위한 혈청학적 10mL 피펫 1개, 전동 피펫 보조제 1개, 50mL 튜브 3개를 준비하고 준비 날짜를 기록합니다. 추가 살균을 위해 층류 벤치의 자외선(UV) 방사선을 켭니다.
- VS1(15mL)의 경우, 난모세포 처리 배지 12mL(제조업체에서 인간 혈청 알부민으로 보충), SSS(Serum Substitute Supplement) 1.5mL, 에틸렌 글리콜 1.5mL를 50mL 튜브 1개에 피펫팅합니다.
- VS2(15mL)의 경우, 10.5mL의 난모세포 처리 배지(제조업체에서 인간 혈청 알부민으로 보충), 에틸렌 글리콜 3mL 및 SSS 1.5mL를 하나의 50mL 튜브에 피펫합니다.
- VS3의 경우 8.5mL의 난모세포 처리 배지(제조업체에서 인간 혈청 알부민으로 보충), 5.25mL의 에틸렌 글리콜을 피펫팅하고 2.57g의 자당과 0.75g의 폴리비닐피롤리돈(PVP)을 하나의 50mL 튜브에 추가합니다. 자세한 내용은 그림 3 을 참조하십시오. 3,000rpm에서 볼텍싱하여 모든 용액을 혼합합니다.
참고: 위에서 설명한 모든 조직 배양 작업은 Class II 층류 후드에서 수행해야 합니다. 일회용 실험실 장갑을 착용하는 동안 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
3. 유리화 준비
- 일회용 실험실 장갑을 착용하는 동안 표면 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
- 6웰 플레이트 1개, 세포 여과기, 메스, 핀셋, 2mm 생검 펀치 1개, 90mm 둥근 바닥 접시 2개를 준비합니다. 또한 조직 이식 및 VS1-3을 위한 보존 용액을 준비합니다. 각 냉각 용액(VS1-3) 5mL를 별도의 웰에 피펫팅하고 용액이 실온에 도달할 때까지 30분 동안 기다립니다.
- 자동 UV 조사 시스템으로 액체 질소를 살균합니다. 또는 층류 후드의 UV 조사를 120분 동안 사용하십시오.
4. 조직의 유리화
- 수질을 제거하여 난소 피질 조직을 준비합니다. 대뇌 피질은 일반적으로 수질보다 단단하기 때문에 쉽게 구별하고 분리할 수 있습니다.
- 그림 4A와 같이 난소 피질 조직을 원하는 모양(이식의 경우 10mm x 5mm, 유리화 전후의 생존 가능한 난포 계수를 위한 2mm x 2mm 펀치)으로 자릅니다.
알림: 너무 세게 눌러 티슈를 손상시키지 않도록 주의하고 조심스럽게 다루십시오. 조직 샘플은 환자마다 다를 수 있습니다.
- 그림 4A와 같이 난소 피질 조직을 원하는 모양(이식의 경우 10mm x 5mm, 유리화 전후의 생존 가능한 난포 계수를 위한 2mm x 2mm 펀치)으로 자릅니다.
- 셀 스트레이너를 VS6이 있는 1웰 플레이트의 첫 번째 웰에 놓습니다. 세포 스트레이너를 사용하여 6웰 플레이트의 웰 1에 있는 5mL의 VS1에서 난소 피질 조직을 5분 동안 평형화합니다.
- 그런 다음 피질 조직이 있는 세포 여과기를 5mL의 VS2가 포함된 웰 2로 이동시키고 5분 동안 평형을 유지합니다. 마지막으로, 그림 3 및 표 1에 표시된 대로 5mL의 VS3에서 6분 동안 평형을 유지합니다.
- 준비된 극저온을 엽니다. 바이알에 멸균된 액체 질소를 채우고 액체 질소로 채워진 극저온 듀어 용기에 넣습니다. 조직 샘플을 1분 이내에 유리화 장치의 금속 그리드에 로드합니다(그림 4B,C).
- 금속 그리드에 로드된 조직 샘플을 준비된 그리드 기반 극저온의 액체 질소에 삽입합니다(그림 4D).
알림: 금속 그리드에 로드된 조직을 빠르게 동결하는 것은 이 방법의 성공에 필수적입니다. 위에서 설명한 모든 조직 배양 작업은 Class II 층류 후드에서 수행해야 합니다. 일회용 실험실 장갑을 착용하는 동안 표면 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
- 금속 그리드에 로드된 조직 샘플을 준비된 그리드 기반 극저온의 액체 질소에 삽입합니다(그림 4D).
5. 급속 온난화 매체의 준비
- 그림 5 및 표 2에 표시된 대로 솔루션을 준비합니다. 급속 온난화 용액(RWS)과 평형 용액(ES)에 대한 자당의 무게를 측정하고 튜브로 옮깁니다. 혈청학적 피펫과 피펫팅 보조제를 사용하여 난모세포 처리 배지(제조업체에서 인간 혈청 알부민으로 보충)를 추가합니다. 표 2에 나열된 대로 SSS 및 자당을 추가합니다.
- 튜브를 닫고 완전히 녹을 때까지 롤링 셰이커에서 교반합니다.
참고: 위에서 설명한 모든 조직 배양 작업은 Class II 층류 후드에서 수행해야 합니다. 일회용 실험실 장갑을 착용하는 동안 표면 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
6. 급속 온난화 준비
- 급속 온난화 하루 전, 소모품을 준비하고 층류 벤치에서 UV 광선을 사용하여 오염을 제거합니다: RWS용 샘플 비커, ES, RS1 및 RS2용 6웰 플레이트, 급속 가열 후 조직 운송을 위한 샘플 비커를 준비합니다. 멸균 가능한 일회용 핀셋, 피펫팅 장비 및 기타 소모품을 층류 벤치에 놓습니다.
- 가열판을 37.2°C로 예열합니다. RWS를 37°C에서 1시간 이상 배양합니다.
- 층류 벤치에서 ES 6mL, "RS1"에 대해 6mL, "RS2"에 대해 6mL의 RS가 있는 멸균 6웰 플레이트를 준비합니다. 그림 5 를 참조하여 6-well plate의 개략도를 확인하십시오. 조직을 데우기 전에 실온에서 1시간 동안 배양하십시오.
- 멸균 상태에서 RWS를 멸균 샘플 비커로 옮기고 가열판에 놓습니다. RWS는 37°C에서 유지해야 합니다.
알림: 급격한 온난화에는 빠른 온난화 속도가 필요합니다. 첫 번째 단계의 성공을 보장하기 위해 RWS를 37°C로 유지하는 것이 중요합니다.
7. 난소 조직의 급속한 데우기
- 액체 질소의 유리화된 난소 피질 조직이 포함된 냉동 보존된 바이알을 층류 벤치로 운반합니다. 바이알이 액체 질소에 부분적으로 잠긴 상태에서 바이알을 엽니다. 유리화 조직이 있는 메쉬를 RWS에 빠르게 담그고 조직을 37°C에서 1분 동안 그대로 둡니다.
알림: 이것은 급격한 온난화 중에 가장 중요한 단계이며 지체 없이 수행해야 합니다. - 멸균 겸자를 사용하여 조직을 ES로 옮기고 흔들리는 셰이커에 부드럽게 흔들면서 3분 동안 배양합니다.
- 그림 10과 같이 흔들리는 셰이커에서 RS1 및 RS2로 각각 5분 동안 실온에서 조직을 헹굽니다.
- 따뜻해진 조직을 조직 이식을 위한 보존 용액 5mL가 들어 있는 멸균 샘플 비커로 옮기고, 이식 부위로 운반하기 위해 4°C에서 보관해야 합니다.
참고: 위에서 설명한 모든 조직 배양 작업은 Class II 층류 후드에서 수행해야 합니다. 일회용 실험실 장갑을 착용하는 동안 표면 소독제로 층류 벤치를 청소하십시오. 가루가 아닌 장갑을 착용하는 것이 좋습니다.
8. 여포 생존력의 결정
- 디메틸 설폭사이드(DMSO)를 밤새 실온에 두어 액체 상태를 얻습니다. 100 μL의 DMSO를 칼세인 바이알 1개에 피펫팅하고 재현탁하여 칼세인을 용해시킵니다. 용해된 칼세인 3μL를 1.5mL 튜브 1개의 바닥에 피펫팅하고 바이알을 -20°C에서 보관합니다.
- 1.5mL 튜브 1개에 콜라겐분해효소 0.007g을 넣고 -20°C에서 보관합니다.
- 1.5mL 튜브 1개에 사전 분주 및 냉동된 3μL의 칼세인에 997μL의 DPBS를 첨가하고 재현탁하여 칼세인을 용해시킵니다. 0.007g의 콜라겐 분해 효소를 첨가하여 1000 μL의 작업 용액을 얻습니다.
- 500 μL의 작업 용액을 사용하여 4-웰 접시에서 빛으로부터 차폐된 37°C에서 90분 동안 2mm 난소 피질 단편 두 조각을 소화합니다. 60분 및 70분 후에 용액을 반복적으로 재현탁합니다. 마지막으로, 그림 6과 같이 형광 현미경을 통해 소낭선 생존율을 결정합니다.
결과
이 프로토콜은 유리화 매체의 준비, 로딩 장치, 유리화, 급속 온난화 매체의 준비, 급속 온난화 및 소낭선 생존율 결정을 위한 절차를 제시합니다. 느린 동결과 유리화 사이의 여포 생존력과 혈관 형성 요인의 직접적인 비교가 검증되고 발표되었습니다31,32.
설명된 유리화 프로토콜의 전반적인 성공은 유리화/급속 온난화 전후의 활력 소낭선 수를 비교하여 평가되었습니다. 실험 설정은 그림 1에 나와 있으며 결과는 그림 6에 나와 있습니다. 50명의 환자에서 유리화 전 평균 77.98개, 유리화/급속온난화 후 62.99개의 생명여포가 관찰되어 80.8%의 생존율을 보였다. 이것은 Wilcoxon 테스트33에 따르면 크게 다르지 않았습니다.
금속 그리드는 그림 2A,C와 같이 1.8mL 극저온 디스크의 캡에 맞는 25mm x 8mm 크기의 날카로운 가위로 개별적으로 맞춤화됩니다. 증기 오토클레이브를 사용한 멸균 후 1.8mL 바이알의 그리드와 캡은 그림 2B와 같이 층류 벤치 아래에 조립됩니다. 이 설정은 추가 조치가 필요 없이 캡을 안전하게 고정하고 다양한 크기의 조직을 위한 충분한 영역을 제공합니다. 일반적으로 이식을 위한 5mm x 10mm의 조직 조각과 급속 해동 후 생명 난포 수를 평가하기 위한 2mm 직경의 조직 조각이 유리화됩니다. 두 크기 모두 금속 그리드에 완벽하게 맞습니다.
유리화 용액(VS1, VS2 및 VS3)을 사용한 평형은 그림 3과 같이 층류 벤치 아래의 실온에서 로킹 셰이커의 6웰 플레이트에서 수행됩니다. 계획의 시간 프레임은 동결 보호제 에틸렌 글리콜의 효과적인 흡수를 보장합니다. 단일 용기 위에 6웰 플레이트를 사용하는 것은 용액 간 조직의 빠른 이동을 용이하게 하고 혼합을 방지하는 데 도움이 되므로 권장됩니다.
액체 질소에서 빠른 수직 유리화를 위해 난소 피질 조직을 적절한 조각으로 절단합니다(그림 4A). 난소 피질 샘플은 로딩 장치(그림 4B, C)에 놓고 액체 질소(그림 4D)에 수직으로 담가 유리화를 통해 유리 응집 상태를 달성합니다. 선택된 금속 그리드는 그림 4D와 같이 조직의 수직 처리를 허용합니다. 또한 금속 그리드는 열 전도성이 높아 22°C에서 -196°C까지의 빠른 냉각 속도를 보장하며, 이는 유리화 공정에서 매우 중요한 단계입니다.
빠른 온난화를 위해 RWS는 그림 5와 같이 37°C의 멸균 컵에 담아 준비되며, ES, RS1 및 RS2는 실온에서 로킹 셰이커의 6웰 플레이트에 준비됩니다. 많은 양의 사전 예열된 RWS는 유리화 조직을 추가할 때 용액이 과도하게 냉각되는 것을 방지하고 급속 예열 과정 전반에 걸쳐 조직을 위한 일관된 따뜻한 환경을 보장합니다.
고품질 표준물질을 평가하고 보장하기 위해 2mm x 2mm 생검 펀치를 유리화 전과 급속 가열 후에 칼세인으로 염색하여 형광 현미경을 사용하여 여포 생존율을 결정합니다34,35(그림 6). 생존 가능한 난포는 칼세인의 세포 내 흡수 후 495nm에서 녹색 형광을 방출합니다. 대안적으로, 소낭선 생존력(표 3)은 중성 적색 염료(36)를 사용하여 평가할 수 있다.
이 프로토콜에 설명된 단계를 따르면 난소 조직은 유리 같은 응집 상태로 변형되어 형광 현미경으로 확인된 바와 같이 급격한 온난화 후 높은 생존율을 촉진합니다.
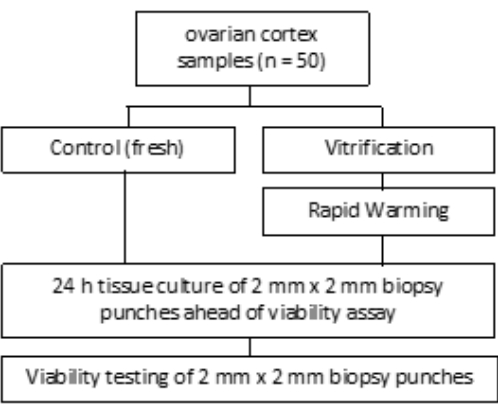
그림 1: 스터디 설계. 50명의 환자로부터 채취한 난소 피질 샘플을 유리화와 급속 온난화 전(신선) 및 후로 생존 가능한 난포의 수에 대해 검사했습니다. 각 그룹에 대해 직경이 2mm인 조직 조각 2개를 소낭선 수 평가 전에 24시간 동안 배양했습니다. 조직을 콜라겐분해효소로 소화하고 칼세인으로 염색하여 생존율을 평가했습니다. 생존 가능한 난포의 수는 현미경을 사용하여 측정했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 로딩 장치 준비. 금속 그리드는 8mm x 25mm(A) 크기로 절단되었습니다. 맞춤형 금속 그리드는 오토클레이브(B)에 의해 멸균되었습니다. 그런 다음 멸균된 금속 그리드를 1.8mL 바이알의 캡에 삽입하여 바로 사용할 수 있도록 했습니다(C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
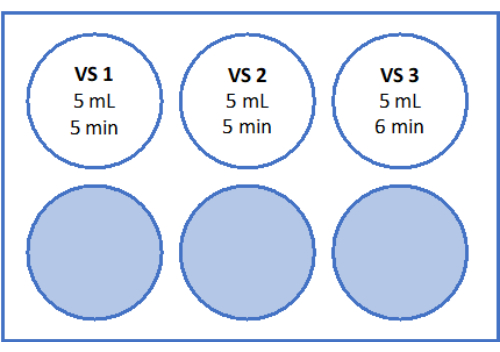
그림 3: 유리화 용액의 준비. 유리화 용액(VS)을 준비하여 6-웰 플레이트로 옮겼습니다. 웰은 각 용액의 부피와 유리화 프로토콜에 사용된 개별 배양 시간을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 난소 피질 처리 및 유리화. 난소 피질 조직은 수질을 제거하고 조직을 5mm x 10mm 조각(A)으로 절단하여 동결 보존을 위해 처리되었습니다. 도 3에 도시된 유리화 용액에서 배양한 후, 조직을 유리화 로딩 장치(B,C)에 로드하였다. 난소 피질 샘플의 신속한 수직 유리화를 위해 하중이 가해진 조직이 있는 캡을 멸균된 액체 질소(D)에 빠르게 삽입했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
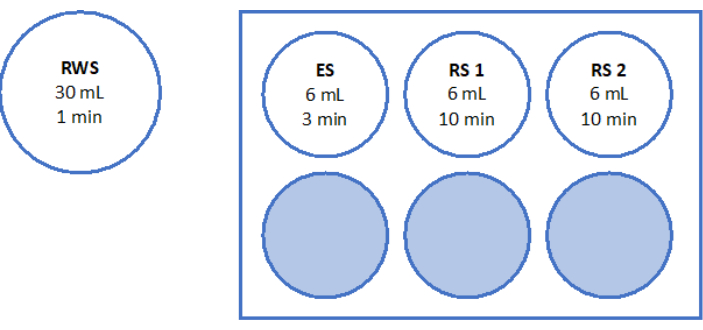
그림 5 : 급속 온난화 용액의 준비. 급속 온난화 용액(RWS), 평형 용액(ES) 및 헹굼 용액(RS) 1 및 2를 제조하여 6-웰 플레이트로 옮겼습니다. vessel과 well은 각 용액의 부피와 해당 배양 시간을 보여줍니다. RWS는 가열판에서 37.2°C로 유지됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 6: 생존 가능성 수. 생존 가능한 난포의 수를 평가하기 위해 직경 2mm의 조직 조각을 콜라겐분해효소로 절단하고 칼세인으로 염색했습니다. 대표적인 이미지는 (A) 유리화(vitrification) 전에 회수된 3개의 난포에 대한 칼세인 염색을 보여줍니다. (B) 유리화 및 급격한 온난화 후 회복된 생존 가능한 난포. (C) 천천히 얼기 전에 회복된 생존 가능한 난포. (D) 천천히 동결 및 해동 후 생존 가능한 난포가 회복되었습니다. 소낭선 생존율은 495nm에서 생존 가능한 세포에 의해 효소로 전환될 때 녹색 형광을 방출하는 녹색 형광 염료인 칼세인(calcein)으로 표시됩니다. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| VS 1 (15mL) | 에틸렌 글리콜 | 10% | 1.5 mL |
| SSS (SSS) | 10% | 1.5 mL | |
| G-걸레+ | 12mL | ||
| VS 2 (15mL) | 에틸렌 글리콜 | 20% | 3mL |
| SSS (SSS) | 10% | 1.5 mL | |
| G-걸레+ | 10.5mL | ||
| VS 3 (15mL) | 에틸렌 글리콜 | 35% | 5.25 mL |
| SSS (SSS) | 10% | 1.5 mL | |
| 자당 | 0.5 몰 / L | 2.57 지 | |
| PVP (폴리벤트) | 5 % (w/v) | 0.75 지 | |
| G-걸레+ | 광고 15mL |
표 1: 유리화 용액(VS)의 조성.
| RWS (30mL) | 자당 | 0.8 몰 / L | |
| 8.22 지 | |||
| SSS (SSS) | 10% | 3mL | |
| G-걸레+ | 광고 30mL | ||
| ES (15mL) | 자당 | 0.4 몰 / L | 2.05 지 |
| SSS (SSS) | 10% | 1.5 mL | |
| G-걸레+ | 광고 15mL | ||
| RS 1&2 (15 mL) | SSS (SSS) | 10% | 1.5 mL |
| G-걸레+ | 광고 15mL |
표 2: 급속 온난화 용액(RWS), 평형 용액(ES) 및 헹굼 용액(RS)의 구성. 이 표는 유리화 후 처리에 사용되는 급속 온난화 용액(RWS), 평형 용액(ES) 및 헹굼 용액(RS)에 대한 성분 및 농도를 제공합니다.
| 매개 변수 | 신선한 | 간 | 유리화 후 급속 가열 | 간 | n | *p-값 |
| SD | SD | |||||
| 소낭선 생존력 수 [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Wilcoxon 테스트 |
표 3: 여포 생존력의 대표적인 결과. 이 표는 동결 보존 전과 급속 온난화 후의 여포 생존력 평가 결과를 나타냅니다. 환자당 직경이 2mm인 조직 조각 2개를 사용하여 유리화/급속 온난화 전후에 생존 가능한 난포의 수를 계산했습니다. 50명의 환자로부터 채취한 쌍을 이루는 조직 샘플은 Wilcoxon 테스트를 사용하여 분석되었습니다.
토론
여기에서는 임상 루틴에 적합한 인간 난소 피질 조직의 고처리량 유리화를 위한 프로토콜을 제시합니다. 난모세포 또는 배아의 유리화와 유사하게, 이 절차를 성공적으로 적용하려면 유리화 및 온난화 용액의 온도와 평형 기간에 관한 프로토콜을 자세히 준수해야 합니다. 공기 질 및 멸균에 관한 EU 조직 지침37 을 준수하는 것도 필수적입니다.
유리화 절차는 비결정질, 비정질 또는 유리 상태를 초래합니다. 전반적으로 유리화는 다양한 과학 및 기술 영역에서 중요한 의미를 지닌 다재다능한 공정입니다. 유리화의 주요 이점은 조직을 유리 상태로 변환하는 능력이며, 이로 인해 조직 무결성 및 그 구성 요소에 부정적인 영향을 미칠 수 있는 얼음 결정 형성 38,39,40을 방지합니다.
폴리비닐피롤리돈(PVP)으로 동결보호제(CPA)를 보충하면 유리화 용액의 품질을 손상시키지 않으면서 CPA 농도를 감소시킬 수 있습니다(41,42). 또한 금속 그리드를 사용하면 플라스틱 기반 캐리어 시스템에 비해 높은 열전도율을 제공합니다. 그리드 구조는 또한 표면 접착을 용이하게 하여 조직 샘플과 품질 측정을 위한 작은 피질 펀치의 안전하고 확실한 냉동 보존을 보장합니다. 다른 제조업체의 cryovessel을 사용하는 경우 cryovessel 뚜껑 내부의 안정성과 적절한 그립은 물론 vessel에 잘 맞는지 확인하기 위해 사전에 금속 그리드의 크기를 테스트하는 것이 중요합니다.
성공적인 유리화를 보장하기 위한 중요한 단계에는 조직을 멸균된 액체 질소에 담그는 신속한 유리화와 부작용을 피하기 위해 지체 없이 급속 가열을 수행하는 것이 포함됩니다. 비용 효율성 측면에서, 조직 유리화는 인력 배치 계획에 영향을 미칠 수 있는 느린 동결 절차에 비해 덜 까다롭습니다. 또한 유리화는 느린 동결에 필요한 장비를 구입하고 서비스할 필요성을 제거합니다.
생물학적 측정 및 메타 분석은 천천히 얼리는 것과 비교하여 유리화의 비교 가능성 또는 이점을 입증했습니다43. 그러나 유리화 후 결과의 차이는 유리화 장치와 사용된 용액을 포함한 프로토콜 모두에서 표준화가 부족하기 때문일 수 있으며, 이는 연구마다 다릅니다. 향후 연구는 여러 그룹 44,45,46,47,48,49,50에 의해 마우스 난소 조직에서 성공적으로 입증 된 바와 같이 유리화 / 급속 온난화 조직에서 난포 배양이 시험관 내 성장을 모니터링 할 수있는 가능성을 탐구해야합니다.
요약하면, 난소 조직의 유리화는 널리 사용되는 느린 동결 프로토콜에 대한 중요한 대안이며, Suzuki51 (일본), Silber52 (미국) 및 Sänger53 (독일)에서 보고한 5건의 성공적인 출산이 이를 뒷받침합니다. 상업적으로 이용 가능한 세포용 유리화 배지 및 키트와 달리, 난소 조직에 대한 FDA/CE 승인 시스템은 거의 없어 임상 환경에서의 적용이 제한될 수 있습니다. 따라서 난소 조직의 유리화 및 빠른 온난화를 위한 FDA/CE 승인 키트 및 배지의 개발이 권장됩니다30.
공개
없음.
감사의 말
교정을 해주신 Cara Färber에게 감사드립니다. 기술 지원을 아끼지 않은 Katharina Wollersheim, Martin Mahlberg, Lea Korte, Jasmin Rebholz.
자료
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
참고문헌
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047 (2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885 (2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052 (2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537 (2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65 (2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346 (2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940 (2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M., Meryman, H. T. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. , 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4 (2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38 (2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유