Method Article
卵巢皮层组织的玻璃化以达到玻璃状聚集状态
摘要
提出了一种卵巢组织玻璃化的方案,作为广泛使用的慢速冷冻方案的替代冷冻保存方法。
摘要
卵巢组织冷冻保存 (OTC) 是保留生育能力的重要选择。对于不能推迟性腺毒性治疗的患者或青春期前的女孩来说,这通常是保护生育能力的唯一选择。冷冻保存可以通过玻璃化或缓慢冷冻进行。缓慢冻结是目前的标准方法。越来越多的研究表明,玻璃化可以取代最先进的 体外 受精 (IVF) 实验室中的缓慢冷冻,显著提高解冻存活率并简化冷冻保存的技术方面。描述了一种基于金属网格的高通量方案,用于卵巢皮质组织的快速玻璃化,适用于临床常规。金属网格和液氮的灭菌可确保高质量,符合良好生产规范 (GMP) 标准。进行玻璃化处理以确保超快的冷却速率。样品不是缓慢解冻,而是快速加热。为了评估滤泡活力,在冷冻保存之前和快速升温后进行钙黄绿素染色。据报道,使用金属网格玻璃化和快速加热的成功应用。在玻璃化之前和快速升温后未观察到滤泡活力的显着差异。这些结果证实了组织玻璃化在临床常规应用中的高容量,作为广泛使用的慢速冷冻方法的潜在替代品。
引言
卵巢组织的冷冻保存是保留生育能力的重要选择。含有卵巢卵泡的外植组织(其中嵌入了卵母细胞)被冷冻保存。储存后,卵巢组织可以解冻、加热并重新植入患者体内。对于活细胞或组织,有两种冷冻保存方法可用:慢速冷冻和玻璃化1。
玻璃化用于保存生物材料,例如胚胎和卵母细胞,与缓慢冷冻方案相比,存活率更高 1,2,3,4。缓慢冷冻有局限性,例如冰晶形成,这可能会损害细胞和组织结构。然而,缓慢冷冻是一种重要的冷冻保存方法,有助于生物样品的长期储存,这种方法的功能已得到广泛证明5。玻璃化反应会诱导玻璃状聚集状态,从而阻止冰晶形成 6,7。在技术层面上,玻璃化冷冻通过减少设备维护、降低技术错误的可能性和缩短冷冻保存过程的持续时间,显著简化了冷冻保存程序 8,9。在女性生育力保存中,卵巢组织冷冻保存是癌症治疗前的决定性方法10。不同的小组已经成功地展示了基于慢速冷冻方案11、12、13、14 的组织冷冻保存、解冻和移植的概念,该方案目前被认为是标准方法15。
卵巢组织玻璃化冷冻被认为是一种很有前途的替代方法 16,17,18,19,20,21,在节省资源22、卵泡存活率、DNA 片段化水平和平衡血管生成潜力 23,24,25,26,27 方面。日本28、美国29 和德国30 的成功交付证明了这一点。
在当前的荟萃分析中,比较卵巢组织冷冻保存 (OTC) 玻璃化术与缓慢冷冻结果的标准程序的两种选择是部分冲突的 16。有几个因素可能促成了这一点,因为目前的玻璃化实验方案差异很大。这些差异包括冷冻保护剂或保护剂组合的选择、它们的浓度、OTC 培养基的组成、组织碎片的大小以及用作组织载体的设备。因此,没有标准化的加热协议。
由于作者发现了一种在处理、活力、细胞凋亡发生、血管生成因子释放,甚至再植入后出生报告方面产生令人信服结果的方法 9,27,因此提供了该方案的非常详细的描述。所描述的方法提供了一种有效且有效的方案,可能有助于卵巢组织玻璃化的标准化。
研究方案
该研究得到了波恩大学医院伦理委员会 (007/09) 的批准。获得每位患者的书面知情同意书。研究组包括 50 名患者的人卵巢组织,冻存前平均年龄为 27.4 岁,如图 1 所示。本研究中使用的试剂和设备列在 材料表中。
1. 装载装置的准备
- 准备手术剪刀和金属网进行定制。将网片切成 25 mm x 8 mm 的条带,如图 2A 所示。
- 将定制的金属网放入灭菌容器中并高压灭菌 2 小时(图 2B)。高压灭菌后,将灭菌容器和 1.8 mL 样品瓶置于层流工作台下。
- 打开层流工作台的紫外线 (UV) 照射 30 分钟,以便在 254 nm 波长处进行额外灭菌。
- 打开灭菌容器,取下金属网格,然后将它们装入 1.8 mL 样品瓶的瓶盖中,如图 2C 所示。关闭 1.8 mL 样品瓶。
注:上述所有组织培养工作均应在 II 类层流罩中进行。戴上一次性实验室手套,用表面消毒剂清洁层流工作台;建议使用无粉手套。
2. 玻璃化介质的制备
- 准备一个血清学 10 mL 移液器、一个电动移液器辅助器和三个 50 mL 试管,用于玻璃化溶液 1 (VS1)、玻璃化溶液 2 (VS2) 和玻璃化溶液 3 (VS3),以及记录制备日期。打开层流工作台的紫外线 (UV) 辐射以进行额外灭菌。
- 对于 VS1 (15 mL),将 12 mL 卵母细胞处理培养基(由制造商补充人血清白蛋白)、1.5 mL SSS(血清替代补充剂)和 1.5 mL 乙二醇移液到一个 50 mL 试管中。
- 对于 VS2 (15 mL),将 10.5 mL 卵母细胞处理培养基(由制造商补充人血清白蛋白)、3 mL 乙二醇和 1.5 mL SSS 移液到一个 50 mL 试管中。
- 对于 VS3,吸取 8.5 mL 卵母细胞处理培养基(由制造商补充人血清白蛋白)、5.25 mL 乙二醇,并将 2.57 g 蔗糖和 0.75 g 聚乙烯吡咯烷酮 (PVP) 加入一个 50 mL 试管中。有关详细信息,请参见 图 3 。通过以 3,000 rpm 涡旋混合所有溶液。
注:上述所有组织培养工作均应在 II 类层流罩中进行。戴上一次性实验室手套,用消毒剂清洁层流工作台;建议使用无粉手套。
3. 玻璃化制备
- 戴上一次性实验室手套,用表面消毒剂清洁层流工作台;建议使用无粉手套。
- 准备一个 6 孔板、一个细胞过滤器、一把手术刀、镊子、一个 2 毫米活检打孔器和两个 90 毫米圆底培养皿。另外,准备培养基:用于组织移植的保存溶液和 VS1-3。将 5 mL 的每种冷冻溶液 (VS1-3) 移液到单独的孔中,等待 30 分钟,让溶液达到室温。
- 使用自动紫外线照射系统对液氮进行灭菌;或者,使用层流罩的紫外线照射 120 分钟。
4. 组织玻璃化
- 通过去除髓质来准备卵巢皮质组织。由于皮层通常比延髓更硬,因此很容易区分和分离它们。
- 将卵巢皮质组织切成所需的形状(10 毫米 x 5 毫米用于移植;2 毫米 x 2 毫米打孔,用于玻璃化前后的活卵泡计数),如图 4A 所示。
注意:避免用力按压损坏组织,并小心处理。组织样本可能因患者而异。
- 将卵巢皮质组织切成所需的形状(10 毫米 x 5 毫米用于移植;2 毫米 x 2 毫米打孔,用于玻璃化前后的活卵泡计数),如图 4A 所示。
- 将细胞过滤器放入含有 VS1 的 6 孔板的第一个孔中。使用细胞过滤器在 6 孔板的 1 孔中的 5 mL VS1 中平衡卵巢皮质组织 5 分钟。
- 然后,将带有皮层组织的细胞过滤器移动到含有 5 mL VS2 的 2 孔中,并平衡 5 分钟。最后,在 5 mL VS3 中平衡 6 分钟,如图 3 和表 1 所示。
- 打开准备好的冻存管。用消毒液氮填充小瓶,然后将其放入装满液氮的低温杜瓦瓶中。在 1 分钟内将组织样品加载到玻璃化装置的金属网格上(图 4B、C)。
- 将装载在金属网格上的组织样品插入准备好的基于网格的冷冻管中的液氮中(图 4D)。
注意:快速冷冻加载在金属网格上的组织对于该方法的成功至关重要。上述所有组织培养工作均应在 II 类层流罩中进行。戴上一次性实验室手套,用表面消毒剂清洁层流工作台;建议使用无粉手套。
- 将装载在金属网格上的组织样品插入准备好的基于网格的冷冻管中的液氮中(图 4D)。
5. 快速升温培养基的制备
- 如图 5 和 表 2 所示准备溶液。称量用于快速升温溶液 (RWS) 和平衡溶液 (ES) 的蔗糖,并将其转移到试管中。使用血清移液管和移液辅助工具添加卵母细胞处理培养基(由制造商补充人血清白蛋白)。添加 SSS 和蔗糖,如 表 2 所示。
- 关闭试管,让它们在滚动摇床上搅拌直至完全溶解。
注:上述所有组织培养工作均应在 II 类层流罩中进行。戴上一次性实验室手套,用表面消毒剂清洁层流工作台;建议使用无粉手套。
6. 快速升温准备
- 快速升温前一天,准备耗材并在层流工作台中使用紫外光对其进行去污:准备用于 RWS 的样品烧杯、用于 ES、RS1 和 RS2 的 6 孔板以及用于快速升温后组织运输的样品烧杯。将无菌、一次性镊子、移液设备和其他耗材放在层流工作台中。
- 将加热板预热至 37.2 °C。 将 RWS 在 37 °C 孵育至少 1 小时。
- 在层流工作台中准备一个无菌 6 孔板,其中含有 6 mL ES、6 mL RS 用于“RS1”和另外 6 mL RS 用于“RS2”。请参阅 图 5 以获取 6 孔板的示意图。让它们在室温下孵育 1 小时,然后再加热组织。
- 在无菌条件下将 RWS 转移到无菌样品杯中,并将其放在加热板上。RWS 应保持在 37 °C。
注意:快速升温需要快速升温速率。将 RWS 保持在 37 °C 以确保第一步的成功至关重要。
7. 卵巢组织快速升温
- 将含有液氮中玻璃化卵巢皮质组织的冻存小瓶运输到层流工作台。当样品瓶部分浸没在液氮下时,打开样品瓶。将带有玻璃化组织的网片快速浸入 RWS 中,让组织在 37 °C 下放置 1 分钟。
注意:这是快速变暖期间最关键的步骤,必须立即进行。 - 使用无菌镊子,将组织转移到 ES 中并孵育 3 分钟,同时在摇床上轻轻摇动。
- 在室温下用 RS1 和 RS2 在摇床上冲洗组织 10 分钟,如图 5 所示。
- 将加热的组织转移到含有 5 mL 组织移植保存液的无菌样品烧杯中,该烧杯应保持在 4 °C 以运输到移植部位。
注:上述所有组织培养工作均应在 II 类层流罩中进行。戴上一次性实验室手套,用表面消毒剂清洁层流工作台;建议使用无粉手套。
8. 滤泡活力的测定
- 将二甲基亚砜 (DMSO) 置于室温下过夜,以获得液态。将 100 μL DMSO 移液到一小瓶钙黄绿素中,然后重悬以溶解钙黄绿素。将 3 μL 溶解的钙黄绿素移液到一根 1.5 mL 试管的底部,并将样品瓶储存在 -20 °C。
- 将 0.007 g 胶原酶放入一个 1.5 mL 试管中,并储存在 -20 °C。
- 将 997 μL DPBS 添加到预先分装并冷冻的 3 μL 钙黄绿素中,装在一个 1.5 mL 试管中,然后重悬以溶解钙黄绿素。加入 0.007 g 胶原酶以获得 1000 μL 的工作溶液。
- 使用 500 μL 工作溶液在 4 孔培养皿中避光,在 37 °C 下消化两片 2 mm 卵巢皮质碎片 90 分钟。60 分钟和 70 分钟后,重复重悬溶液。最后, 通过 荧光显微镜确定滤泡活力,如图 6 所示。
结果
该方案介绍了玻璃化培养基的制备、加载装置、玻璃化、快速升温培养基的制备、快速升温和卵泡活力测定的程序。缓慢冷冻和玻璃化之间滤泡活力和血管生成因子的直接比较已得到验证并发表31,32。
通过比较玻璃化/快速升温前后的重要卵泡计数来评估所描述的玻璃化方案的总体成功。实验装置如图 1 所示,结果如图 6 所示。在 50 例患者中,玻璃化冷冻前观察到的平均计数为 77.98 个重要卵泡,玻璃化冷冻/快速升温后观察到 62.99 个,生存率为 80.8%。根据 Wilcoxon 检验33,这没有显著差异。
金属网格用锋利的剪刀单独定制,尺寸为 25 mm x 8 mm,适合 1.8 mL 冻存管的瓶盖,如图 2A、C 所示。使用蒸汽高压灭菌后,将 1.8 mL 样品瓶的网格和瓶盖组装在层流工作台下,如图 2B 所示。这种设置无需额外操作即可牢固地固定在瓶盖中,并为各种大小的组织提供足够的区域。通常,用于移植的 5 mm x 10 mm 的组织块和用于快速解冻后重要卵泡计数的 2 mm 直径的组织块被玻璃化。两种尺寸都非常适合金属网格。
如图 3 所示,在室温下,在层流工作台下,在摇床上的 6 孔板上用玻璃化溶液(VS1、VS2 和 VS3)进行平衡。该计划中的时间框架可确保冷冻保护剂乙二醇的有效吸收。建议在单个容器上使用 6 孔板,因为它有助于组织在溶液之间快速移动,并有助于防止混淆。
为了在液氮中快速垂直玻璃化,将卵巢皮质组织切成合适的块(图 4A)。将卵巢皮质样品放置在加载装置上(图 4B、C)并垂直浸入液氮中(图 4D),以通过玻璃化实现玻璃状聚集状态。所选的金属网格允许垂直处理组织,如图 4D 所示。此外,金属板栅具有高度导热性,可确保从 22 °C 到 -196 °C 的快速冷却速率,这是玻璃化过程中至关重要的步骤。
为了快速加热,RWS 在 37 °C 的无菌杯中制备。ES、RS1 和 RS2 在室温下在摇床上的 6 孔板中制备,如图 5 所示。大量预热的 RWS 可防止溶液在加入玻璃化组织时过度冷却,并确保在整个快速加热过程中为组织提供始终温暖的环境。
为了评估和确保高质量标准,在玻璃化之前和快速升温后用钙黄绿素对 2 mm x 2 mm 活检打孔器进行染色,以使用荧光显微镜确定滤泡活力34,35(图 6)。活的卵泡在细胞内摄取钙黄绿素后在 495 nm 处发出绿色荧光。或者,可以使用中性红染料36 评估滤泡活力(表 3)。
按照本协议中描述的步骤,卵巢组织转化为玻璃状聚集状态,这有助于在快速变暖后实现高存活率,如荧光显微镜所证实的那样。
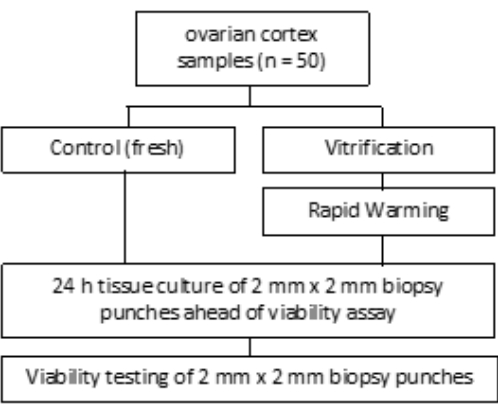
图 1:研究设计。 在 (新鲜) 和玻璃化和快速升温之前 (新鲜) 检查来自 50 名患者的卵巢皮质样本,以确定活卵泡的数量。对于每组,在评估卵泡计数之前,将两个直径为 2 mm 的组织块培养 24 小时。用胶原酶消化组织并用钙黄绿素染色以评估活力。使用显微镜测定活卵泡的数量。 请单击此处查看此图的较大版本。

图 2:加载装置的准备。 金属网格被切割成 8 mm x 25 mm (A) 的尺寸。定制的金属网格通过高压灭菌 (B) 灭菌。然后将灭菌后的金属网格插入 1.8 mL 样品瓶的瓶盖中,即用型 (C)。 请单击此处查看此图的较大版本。
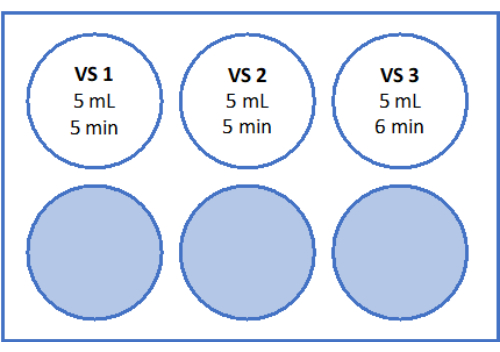
图 3:玻璃化溶液的制备。 制备玻璃化溶液 (VS) 并转移至 6 孔板中。孔显示每种溶液的体积和玻璃化方案中使用的单个孵育时间。 请单击此处查看此图的较大版本。

图 4:卵巢皮层处理和玻璃化。 通过去除髓质并将组织切成 5 mm x 10 mm 的小块 (A) 来处理卵巢皮质组织以进行冷冻保存。在 图 3 所示的玻璃化溶液中孵育后,将组织加载到玻璃化加载装置 (B,C) 上。为了快速垂直玻璃化卵巢皮质样品,将带有负载组织的帽快速插入灭菌的液氮 (D) 中。 请单击此处查看此图的较大版本。
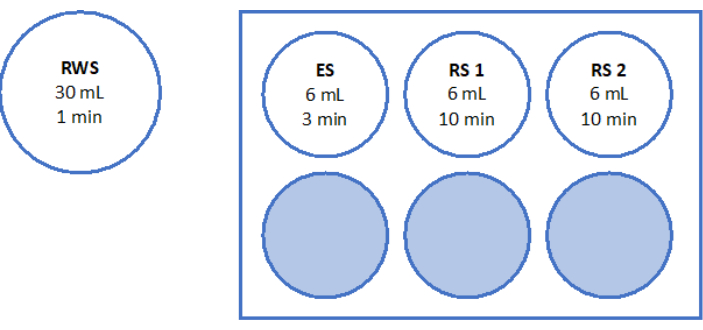
图 5:快速升温溶液的制备。 制备快速升温溶液 (RWS)、平衡溶液 (ES) 和冲洗溶液 (RS) 1 和 2 并转移至 6 孔板中。容器和孔显示每种溶液的体积和相应的孵育时间。请注意,RWS 在加热板上保持在 37.2 °C。 请单击此处查看此图的较大版本。
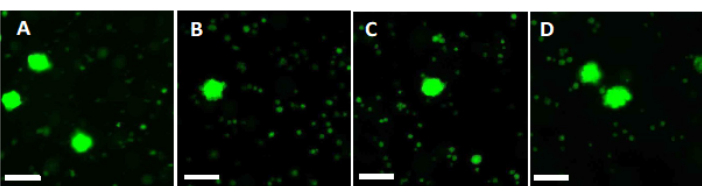
图 6:活力计数。 为了评估活卵泡的数量,用胶原酶消化直径为 2 mm 的组织块并用钙黄绿素染色。代表性图像显示 (A) 玻璃化前对 3 个回收的卵泡进行钙黄绿素染色。(B) 玻璃化和快速变暖后恢复的活卵泡。(C) 缓慢冷冻前恢复的活卵泡。(D) 缓慢冷冻和解冻后恢复的活卵泡。卵泡活力由钙黄绿素指示,钙黄绿素是一种绿色荧光染料,当在 495 nm 处被活细胞酶促转化时会发出绿色荧光。比例尺 = 100 μm。 请点击此处查看此图的较大版本。
| VS 1 (15 毫升) | 乙二醇 | 10% | 1.5 毫升 |
| SSS | 10% | 1.5 毫升 | |
| G-MOPS+ | 12 毫升 | ||
| VS 2 (15 毫升) | 乙二醇 | 20% | 3 毫升 |
| SSS | 10% | 1.5 毫升 | |
| G-MOPS+ | 10.5 毫升 | ||
| VS 3 (15 毫升) | 乙二醇 | 35% | 5.25 毫升 |
| SSS | 10% | 1.5 毫升 | |
| 蔗糖 | 0.5 mol/L | 2.57 克 | |
| PVP | 5 % (w/v) | 0.75 克 | |
| G-MOPS+ | ad 15 mL |
表 1:玻璃化溶液 (VS) 的组成。
| RWS (30 毫升) | 蔗糖 | 0.8 mol/L | |
| 8.22 克 | |||
| SSS | 10% | 3 毫升 | |
| G-MOPS+ | ad 30 毫升 | ||
| ES (15 毫升) | 蔗糖 | 0.4 mol/L | 2.05 克 |
| SSS | 10% | 1.5 毫升 | |
| G-MOPS+ | ad 15 mL | ||
| RS 1&2 (15 毫升) | SSS | 10% | 1.5 毫升 |
| G-MOPS+ | ad 15 mL |
表 2:快速升温溶液 (RWS)、平衡溶液 (ES) 和冲洗溶液 (RS) 的成分。 下表提供了玻璃化后处理中使用的快速升温溶液 (RWS)、平衡溶液 (ES) 和漂洗溶液 (RS) 的成分和浓度。
| 参数 | 新鲜 | 间隔 | 玻璃化后快速升温 | 间隔 | n | *P 值 |
| 标清 | 标清 | |||||
| 滤泡活力计数 [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Wilcoxon 试验 |
表 3:滤泡活力的代表性结果。 下表显示了冷冻保存前和快速升温后的滤泡活力评估结果。每位患者使用两块直径为 2 mm 的组织块来计算玻璃化/快速升温前后活卵泡的数量。使用 Wilcoxon 检验分析来自 50 名患者的配对组织样本。
讨论
在这里,提出了一种适用于临床常规的人卵巢皮质组织高通量玻璃化的方案。与卵母细胞或胚胎的玻璃化类似,该程序的成功应用需要详细遵守有关玻璃化和加热溶液温度以及平衡期的方案。遵守欧盟组织指令37 关于空气质量和无菌性的规定也很重要。
玻璃化程序导致非结晶、无定形或玻璃状状态。总体而言,玻璃化是一个多功能的过程,在各个科学和技术领域具有重大意义。玻璃化冷冻的主要好处是它能够将组织转化为玻璃状,从而防止冰晶形成 38,39,40,这会对组织完整性及其成分产生负面影响。
用聚乙烯吡咯烷酮 (PVP) 补充冷冻保护剂 (CPA) 可以降低 CPA 浓度,而不会影响玻璃化溶液的质量41,42。此外,与塑料基载体系统相比,使用金属格栅可提供高导热性。网格结构还有助于表面粘附,确保组织样品和用于质量测量的小皮层冲头的安全冷冻保存。如果使用其他制造商的冻存罐,请务必事先测试金属格栅的尺寸,以确保冻存罐盖内的稳定性和正确抓握,以及与冻存罐的良好配合。
确保成功玻璃化的关键步骤包括通过将组织浸入灭菌液氮中来快速玻璃化,并立即进行快速加热以避免不良结果。在成本效益方面,与缓慢冷冻程序相比,组织玻璃化的要求较低,这可能会影响人员部署计划。此外,玻璃化冷冻消除了购买和维护缓慢冷冻所需的设备的需要。
生物学测量和荟萃分析表明,与缓慢冷冻相比,玻璃化冷冻具有可比性甚至优势43。然而,玻璃化后结果的差异可能归因于玻璃化装置和方案(包括使用的解决方案)缺乏标准化,这因研究而异。未来的研究应探索从玻璃化/快速加热组织中培养卵泡以监测体外生长的潜力,正如几组在小鼠卵巢组织中成功证明的那样44、45、46、47、48、49、50。
总之,卵巢组织玻璃化冷冻是广泛使用的缓慢冷冻方案的重要替代方案,Suzuki51 (日本)、Silber52 (美国)和 Sänger53 (德国)报告了五次成功分娩。与市售的细胞玻璃化培养基和试剂盒相比,FDA / CE批准的卵巢组织系统很少,这可能会限制它们在临床环境中的应用。因此,建议开发 FDA/CE 批准的试剂盒和培养基,用于卵巢组织的玻璃化和快速加热30。
披露声明
没有。
致谢
我们感谢 Cara Färber 的校对;Katharina Wollersheim、Martin Mahlberg、Lea Korte 和 Jasmin Rebholz 的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
参考文献
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。