Method Article
Витрификация ткани коры яичников для достижения стеклообразного состояния агрегации
В этой статье
Резюме
Представлен протокол витрификации ткани яичника, как альтернативный метод криоконсервации широко используемому протоколу медленной заморозки.
Аннотация
Криоконсервация ткани яичников (ОТК) является важным вариантом сохранения фертильности. Для пациенток, чье гонадотоксическое лечение не может быть отложено, или для девочек препубертатного возраста, это часто является единственным вариантом защиты фертильности. Криоконсервация может быть выполнена как методом витрификации, так и методом медленной заморозки. Медленная заморозка в настоящее время является стандартным подходом. Все большее число исследований указывает на то, что витрификация может заменить медленное замораживание в современных лабораториях экстракорпорального оплодотворения (ЭКО), значительно улучшая показатели выживаемости при размораживании и упрощая технические аспекты криоконсервации. Описан протокол на основе металлической сетки с высокой пропускной способностью для быстрой витрификации ткани коры яичников, подходящий для клинической рутины. Стерилизация металлических решеток и жидкий азот обеспечивают высокое качество, соответствующее стандартам надлежащей производственной практики (GMP). Витрификация была проведена для обеспечения сверхбыстрой скорости охлаждения. Вместо медленного размораживания образцы быстро нагревались. Для оценки жизнеспособности фолликулов окрашивание кальцеином проводили как до криоконсервации, так и после быстрого прогревания. Сообщается об успешном применении остекловывания и быстром прогревании с использованием металлических сеток. До витрификации и после быстрого потепления не наблюдалось существенных различий в жизнеспособности фолликулов. Эти результаты обосновывают высокую способность витрификации тканей для клинического рутинного применения в качестве потенциальной замены широко используемого метода медленной заморозки.
Введение
Криоконсервация ткани яичников является важным вариантом сохранения фертильности. Эксплантированная ткань, содержащая фолликулы яичников, в которые встроены ооциты, криоконсервируется. После хранения ткань яичника может быть разморожена, согрета и реимплантирована пациентке. Для жизнеспособных клеток или тканей доступны два метода криоконсервации: медленная заморозка и витрификация1.
Витрификация используется для сохранения биологических материалов, таких как эмбрионы и ооциты, с более высокими показателями выживаемости по сравнению с протоколом медленной заморозки 1,2,3,4. Медленное замораживание имеет ограничения, такие как образование кристаллов льда, которые потенциально могут повредить клеточные и тканевые структуры. Тем не менее, медленная заморозка является важным подходом к криоконсервации, который способствует долгосрочному хранению биологических образцов, и функциональность этого методашироко доказана5. Витрификация вызывает стеклообразное состояние агрегата, предотвращая образование кристаллов льда 6,7. На техническом уровне витрификация значительно упрощает процедуру криоконсервации за счет сокращения технического обслуживания оборудования, снижения вероятности технических ошибок и сокращения продолжительностипроцесса криоконсервации8,9. В деле сохранения женской фертильности криоконсервация ткани яичников является решающим подходом перед лечением рака10. В различных группах была успешно продемонстрирована концепция криоконсервации, размораживания и трансплантации тканей на основе протокола медленного замораживания 11,12,13,14, который в настоящее время рассматривается как стандартный подход15.
Витрификация ткани яичников рассматривается как перспективный альтернативный метод 16,17,18,19,20,21, с точки зрения ресурсосберегаемости22, выживаемости фолликулов, уровней фрагментации ДНК и сбалансированного ангиогенного потенциала 23,24,25,26,27. Это подтверждается успешными поставками вЯпонию 28, США29,Германию 30.
Сравнение двух вариантов криоконсервации ткани яичников (ОТС)-витрификации со стандартной процедурой медленной заморозки частично противоречат друг другу в современных мета-анализах16. Этому могли способствовать несколько факторов, поскольку современные протоколы витрификации сильно различаются. К таким различиям относятся выбор криопротектора или комбинации протекторов, их концентрация, состав безрецептурных сред, размер фрагментов тканей, а также устройство, используемое в качестве тканевого носителя. Соответственно, нет и стандартизированного протокола потепления.
Поскольку авторы нашли метод, который дает убедительные результаты с точки зрения обработки, жизнеспособности, начала апоптоза, высвобождения ангиогенных факторов и даже сообщения о рождении после реимплантации, приводится очень подробное описание протокола. Описанный метод предлагает действенный и эффективный протокол, который может способствовать стандартизации витрификации ткани яичников.
протокол
Исследование было одобрено комитетом по этике Университетской клиники Бонна (007/09). От каждого пациента было получено письменное информированное согласие. В исследуемую группу была включена ткань яичников человека от 50 пациенток, средний возраст которых до криоконсервации составлял 27,4 года, как показано на рисунке 1. Реагенты и оборудование, использованные в данном исследовании, перечислены в Таблице материалов.
1. Подготовка загрузочных устройств
- Подготовьте хирургические ножницы и металлические сетки для персонализации. Разрежьте сетки на полосы размером 25 мм х 8 мм, как показано на рисунке 2А.
- Поместите изготовленные по индивидуальному заказу металлические сетки в контейнер для стерилизации и автоклав на 2 ч (Рисунок 2B). После автоклавирования поместите стерилизационный контейнер и флаконы объемом 1,8 мл под стенд ламинарного потока.
- Включите ультрафиолетовое (УФ) облучение стенда ламинарного потока на 30 мин для дополнительной стерилизации на длине волны 254 нм.
- Откройте контейнер для стерилизации, снимите металлические решетки и вставьте их в крышки флаконов объемом 1,8 мл, как показано на рисунке 2В. Закройте флаконы объемом 1,8 мл.
ПРИМЕЧАНИЕ: Все описанные выше работы по культивированию тканей должны выполняться в колпаке класса II с ламинарным потоком. Очистите стенд ламинарного потока дезинфицирующим средством для поверхности, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
2. Подготовка сред для остекловывания
- Подготовьте одну серологическую пипетку объемом 10 мл, одну электронную дозатор и три пробирки по 50 мл для витрификации раствора 1 (VS1), витрификационного раствора 2 (VS2) и витрификационного раствора 3 (VS3), а также для записи даты приготовления. Включите ультрафиолетовое (УФ) излучение стенда ламинарного потока для дополнительной стерилизации.
- Для VS1 (15 мл) пипетку 12 мл среды для работы с ооцитами (с добавлением сывороточного альбумина от производителя), 1,5 мл SSS (Serum Replacement Supplement) и 1,5 мл этиленгликоля в одну пробирку объемом 50 мл.
- Для VS2 (15 мл) пипетку 10,5 мл среды для работы с ооцитами (с добавлением сывороточного альбумина человека производителем), 3 мл этиленгликоля и 1,5 мл ССС в одну пробирку объемом 50 мл.
- Для VS3 пипетку пипетку 8,5 мл среды для работы с ооцитами (с добавлением сывороточного альбумина человека от производителя), 5,25 мл этиленгликоля и добавьте 2,57 г сахарозы и 0,75 г поливинилпирролидона (ПВП) в одну 50 мл пробирки. Подробности см. на рисунке 3 . Смешайте все растворы с помощью вортекса со скоростью 3 000 об/мин.
ПРИМЕЧАНИЕ: Все описанные выше работы по культивированию тканей должны выполняться в колпаке класса II с ламинарным потоком. Очистите стенд ламинарного потока дезинфицирующим средством, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
3. Подготовка к остекловыванию
- Очистите стенд ламинарного потока дезинфицирующим средством для поверхности, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
- Приготовьте одну 6-луночную пластину, клеточное ситечко, скальпель, пинцет, один 2-миллиметровый биопсийный пробойник и две 90-миллиметровые чашки с круглым дном. Также приготовьте среды: консервирующий раствор для трансплантации тканей и ВС1-3. Пипетку по 5 мл каждого охлажденного раствора (VS1-3) в отдельные лунки и подождите 30 мин, пока растворы нагреются до комнатной температуры.
- Стерилизовать жидкий азот с помощью автоматизированной системы ультрафиолетового облучения; в качестве альтернативы используйте УФ-излучение ламинарного колпака в течение 120 минут.
4. Витрификация тканей
- Подготовьте ткань коры яичников путем удаления мозгового вещества. Поскольку кора обычно тверже, чем мозговое вещество, их можно легко различить и разделить.
- Разрежьте ткань коры яичника до желаемой формы (10 мм x 5 мм для трансплантации; перфораторы 2 мм x 2 мм для подсчета жизнеспособных фолликулов до и после витрификации), как показано на рисунке 4A.
ПРИМЕЧАНИЕ: Не повреждайте ткань слишком сильным нажатием и обращайтесь с ней осторожно. Образцы тканей могут различаться у разных пациентов.
- Разрежьте ткань коры яичника до желаемой формы (10 мм x 5 мм для трансплантации; перфораторы 2 мм x 2 мм для подсчета жизнеспособных фолликулов до и после витрификации), как показано на рисунке 4A.
- Поместите сетчатое фильтр в первую лунку 6-луночного планшета с помощью VS1. Уравновесьте ткань коры яичников в течение 5 мин в 5 мл VS1 в лунке 1 6-луночного планшета с помощью клеточного фильтра.
- Затем переместите клеточный фильтр с тканью коры в лунку 2, содержащую 5 мл VS2, и уравновесьте в течение 5 минут. Наконец, уравновесьте в течение 6 мин 5 мл VS3, как показано на рисунке 3 и в таблице 1.
- Откройте подготовленные криовиалы. Наполните флаконы стерилизованным жидким азотом и поместите их в сосуд Дьюара, наполненный жидким азотом. Загрузите образцы тканей на металлическую сетку витрификационного устройства в течение 1 минуты (рис. 4B, C).
- Вставьте образцы тканей, загруженные на металлическую сетку, в жидкий азот в подготовленных криовиалах на основе сетки (рис. 4D).
ПРИМЕЧАНИЕ: Быстрое замораживание ткани, нагруженной на металлическую сетку, имеет важное значение для успеха этого метода. Все описанные выше работы по культивированию тканей должны выполняться в колпаке класса II с ламинарным потоком. Очистите стенд ламинарного потока дезинфицирующим средством для поверхности, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
- Вставьте образцы тканей, загруженные на металлическую сетку, в жидкий азот в подготовленных криовиалах на основе сетки (рис. 4D).
5. Приготовление быстросогревающих сред
- Приготовьте растворы, как показано на рисунке 5 и в таблице 2. Взвесьте сахарозу для раствора для быстрого нагрева (RWS) и уравновешивающего раствора (ES) и переложите его в пробирку. Добавьте среду для работы с ооцитами (дополненную сывороточным альбумином от производителя) с помощью серологической пипетки и пипетирования. Добавьте SSS и сахарозу, как указано в таблице 2.
- Закройте трубки и дайте им помешать на вращающемся шейкере до полного растворения.
ПРИМЕЧАНИЕ: Все описанные выше работы по культивированию тканей должны выполняться в колпаке класса II с ламинарным потоком. Очистите стенд ламинарного потока дезинфицирующим средством для поверхности, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
6. Быстрая подготовка к разогреванию
- За день до быстрого потепления подготовьте расходные материалы и обеззаритите их с помощью ультрафиолетового излучения на стенде для ламинарного потока: подготовьте стакан для образца для RWS, планшет с 6 лунками для ES, RS1 и RS2 и стакан для образца для транспортировки тканей после быстрого нагрева. Поместите стерильные одноразовые пинцеты, оборудование для пипетирования и другие расходные материалы на стол для ламинарного потока.
- Разогрейте нагревательную пластину до 37,2 °C. Инкубируйте RWS при 37 °C в течение не менее 1 ч.
- Приготовьте стерильный 6-луночный планшет с 6 мл ES, 6 мл RS для "RS1" и еще 6 мл RS для "RS2" на стенде ламинарного потока. На рисунке 5 приведена схематическая иллюстрация 6-луночного планшета. Дайте им поинкубироваться при комнатной температуре в течение 1 часа перед прогреванием тканей.
- Перенесите RWS в стерильный стакан для образцов в стерильных условиях и поместите его на нагревательную пластину. RWS следует поддерживать на уровне 37 °C.
ПРИМЕЧАНИЕ: Быстрое потепление требует быстрой скорости прогревания. Крайне важно поддерживать RWS на уровне 37 °C, чтобы обеспечить успех первого этапа.
7. Быстрое прогревание тканей яичников
- Транспортируйте криоконсервированные флаконы, содержащие витрифицированную ткань коры яичников в жидком азоте, на стенд ламинарного потока. Открывайте флаконы, пока они частично погружены в жидкий азот. Быстро погрузите сетку с витрифицированной тканью в RWS и оставьте ткань на 1 минуту при температуре 37 °C.
ПРИМЕЧАНИЕ: Это самый важный шаг во время быстрого потепления, и он должен быть проведен без промедления. - С помощью стерильных щипцов перенесите ткань в ЭС и инкубируйте ее в течение 3 минут, осторожно встряхивая на качающемся шейкере.
- Промойте салфетку при комнатной температуре в течение 10 минут с RS1 и RS2 на качающемся шейкере, как показано на рисунке 5.
- Перенесите нагретую ткань в стерильный стакан для образцов, содержащий 5 мл консервационного раствора для трансплантации ткани, который следует держать при температуре 4 °C для транспортировки к месту трансплантации.
ПРИМЕЧАНИЕ: Все описанные выше работы по культивированию тканей должны выполняться в колпаке класса II с ламинарным потоком. Очистите стенд ламинарного потока дезинфицирующим средством для поверхности, надев одноразовые лабораторные перчатки; Рекомендуется использовать неопудренные перчатки.
8. Определение жизнеспособности фолликулов
- Доведите диметилсульфоксид (ДМСО) до комнатной температуры на ночь, чтобы получить жидкое состояние. Пипетку 100 мкл ДМСО в один флакон кальцеина и повторно суспендировать для растворения кальцеина. Пипеткой нанесите 3 мкл растворенного кальцеина на дно одной пробирки объемом 1,5 мл и храните флаконы при температуре -20 °C.
- Поместите 0,007 г коллагеназы в одну пробирку объемом 1,5 мл и храните при температуре -20 °C.
- Добавьте 997 мкл DPBS к предварительно аликвотированным и замороженным 3 мкл кальцеина в одной пробирке объемом 1,5 мл и повторно суспендируйте для растворения кальцеина. Добавьте 0,007 г коллагеназы для получения 1000 мкл рабочего раствора.
- Используйте 500 мкл рабочего раствора для переваривания двух фрагментов коры яичников диаметром 2 мм в течение 90 мин при 37 °С, защищенных от света, в 4-луночной чашке. Через 60 мин и 70 мин повторно суспендируйте раствор. Наконец, определите жизнеспособность фолликулов с помощью флуоресцентной микроскопии, как показано на рисунке 6.
Результаты
В этом протоколе представлены процедуры приготовления витрификационных сред, нагрузочных устройств, витрификации, приготовления быстрых согревающих сред, быстрого согревания и определения жизнеспособности фолликулов. Прямое сравнение жизнеспособности фолликулов и ангиогенных факторов между медленным замораживанием и витрификацией было валидировано и опубликовано31,32.
Общий успех описанного протокола витрификации оценивали путем сравнения количества жизненно важных фолликулов до и после витрификации/быстрого потепления. Экспериментальная установка показана на рисунке 1, а результаты представлены на рисунке 6. У 50 пациентов среднее количество жизненно важных фолликулов составляло 77,98 до витрификации и 62,99 после витрификации/быстрого нагревания, что соответствует выживаемости 80,8%. Это существенно не отличалось по сравнению с тестом Вилкоксона33.
Металлические сетки индивидуально подгоняются острыми ножницами до размера 25 мм х 8 мм, который помещается в колпачки криовиалов объемом 1,8 мл, как показано на рисунке 2A, C. После стерилизации с помощью парового автоклавирования решетки и колпачки флаконов объемом 1,8 мл собираются под стендом ламинарного потока, как показано на рисунке 2В. Такая установка обеспечивает надежную фиксацию в колпачке без необходимости дополнительных действий и предлагает достаточную площадь для тканей различных размеров. Как правило, витрифицируются кусочки ткани размером 5 мм x 10 мм для трансплантации и кусочки диаметром 2 мм для оценки жизненно важного количества фолликулов после быстрого размораживания. Оба размера идеально ложатся на металлические решетки.
Уравновешивание с помощью растворов для витрификации (VS1, VS2 и VS3) проводится в 6-луночном планшете на качающемся вибростенде при комнатной температуре под ламинарным проточным стендом, как показано на рисунке 3. Временные рамки в схеме обеспечивают эффективное поглощение криопротектора этиленгликоля. Рекомендуется использовать 6-луночный планшет над отдельными сосудами, так как это способствует быстрому перемещению ткани между растворами и помогает предотвратить путаницу.
Для быстрой вертикальной витрификации в жидком азоте ткань коры яичников разрезается на подходящие куски (рисунок 4А). Образцы коры яичников помещают на загрузочные устройства (рис. 4B, C) и погружают вертикально в жидкий азот (рис. 4D) для достижения стеклообразного агрегатного состояния путем витрификации. Выбранные металлические сетки позволяют осуществлять вертикальную обработку ткани, как показано на рисунке 4D. Кроме того, металлические решетки обладают высокой теплопроводностью, что обеспечивает быструю скорость охлаждения от 22 °C до -196 °C, что является критически важным этапом в процессе остеклования.
Для быстрого прогрева RWS готовят в стерильной чашке при 37 °C. ES, RS1 и RS2 готовят в 6-луночном планшете на качающемся шейкере при комнатной температуре, как показано на рисунке 5. Большой объем предварительно нагретой RWS предотвращает чрезмерное охлаждение раствора при добавлении витрифицированной ткани и обеспечивает постоянно теплую среду для ткани на протяжении всего процесса быстрого нагрева.
Для оценки и обеспечения высоких стандартов качества биопсийные пункции размером 2 мм x 2 мм окрашивают кальцеином перед витрификацией и после быстрого нагревания для определения жизнеспособности фолликулов с помощью флуоресцентной микроскопии34,35 (Рисунок 6). Жизнеспособные фолликулы излучают зеленую флуоресценцию на длине волны 495 нм после внутриклеточного поглощения кальцеина. В качестве альтернативы жизнеспособность фолликулов (Таблица 3) может быть оценена с использованием нейтральных красных красителей36.
Следуя описанным шагам в этом протоколе, ткань яичников преобразуется в стеклообразное агрегатное состояние, что способствует высоким показателям выживаемости после быстрого нагревания, что подтверждено флуоресцентной микроскопией.
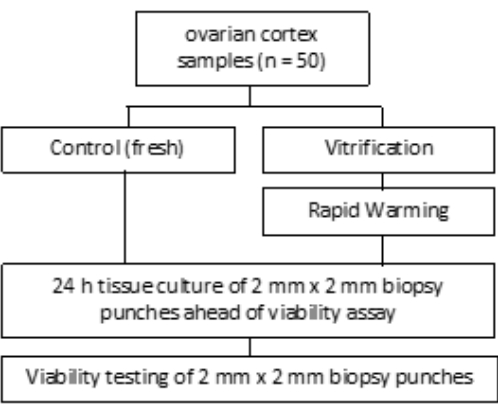
Рисунок 1: Дизайн исследования. Образцы коры яичников у 50 пациенток исследовали до (свежие) и после витрификации и быстрого прогревания на количество жизнеспособных фолликулов. Для каждой группы в течение 24 ч до оценки количества фолликулов культивировали два кусочка ткани диаметром 2 мм. Ткань расщепляли коллагеназой и окрашивали кальцеином для оценки жизнеспособности. Количество жизнеспособных фолликулов определяли с помощью микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Подготовка загрузочных устройств. Металлические сетки были нарезаны до размера 8 мм х 25 мм (А). Изготовленные по индивидуальному заказу металлические сетки были стерилизованы автоклавированием (В). Затем стерилизованные металлические сетки помещали в колпачки объемом 1,8 мл, готовые к использованию (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
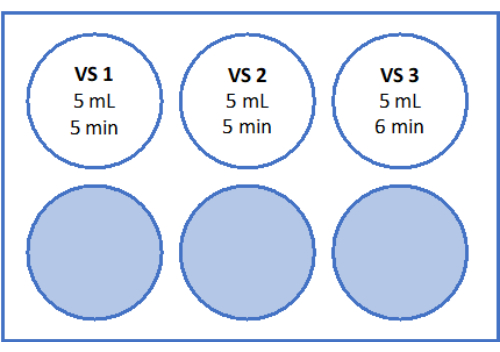
Рисунок 3: Приготовление растворов для остекловывания. Готовили растворы для витрификации (ВС) и переносили их в 6-луночный планшет. Лунки показывают объем каждого раствора и индивидуальное время инкубации, используемое в протоколе витрификации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Обработка коры яичников и витрификация. Ткань коры яичников обрабатывали для криоконсервации путем удаления мозгового вещества и разрезания ткани на кусочки размером 5 мм х 10 мм (А). После инкубации в растворах для витрификации, показанных на рисунке 3, ткань загружали в загрузочное устройство витрификации (B,C). Для быстрой вертикальной витрификации образцов коры яичников колпачки с загруженной тканью быстро вводили в стерилизованный жидкий азот (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
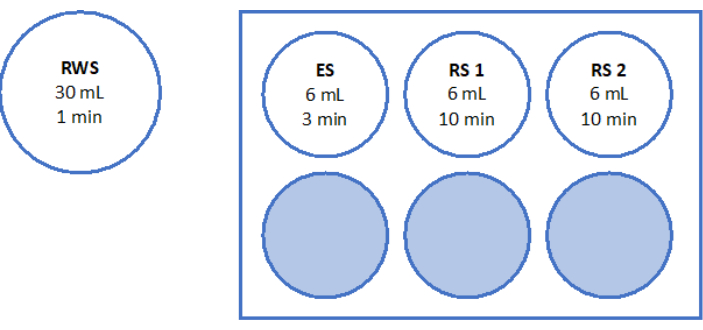
Рисунок 5: Приготовление растворов для быстрого прогревания. Быстро нагревающий раствор (RWS), уравновешивающий раствор (ES) и промывочные растворы (RS) 1 и 2 готовили и переносили на 6-луночный планшет. На сосудах и лунках отображается объем каждого раствора и соответствующее время инкубации. Обратите внимание, что RWS поддерживается на уровне 37,2 °C на нагревательной пластине. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
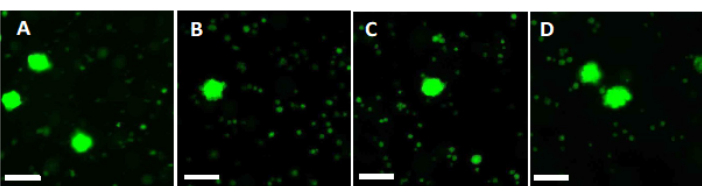
Рисунок 6: Подсчет жизнеспособности. Для оценки количества жизнеспособных фолликулов кусочки ткани диаметром 2 мм расщепляли коллагеназой и окрашивали кальцеином. Репрезентативные изображения показывают (А) окрашивание кальцеином 3 восстановленных фолликулов до витрификации. (B) Восстановленный жизнеспособный фолликул после витрификации и быстрого нагревания. (C) Восстановленный жизнеспособный фолликул до медленной заморозки. (D) Восстановленные жизнеспособные фолликулы после медленного замораживания и оттаивания. На жизнеспособность фолликулов указывает кальцеин, зеленый флуоресцентный краситель, который излучает зеленую флуоресценцию при ферментативном преобразовании жизнеспособными клетками при длине волны 495 нм. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| VS 1 (15 мл) | Этиленгликоль | 10% | 1,5 мл |
| СНО | 10% | 1,5 мл | |
| G-MOPS+ | 12 мл | ||
| VS 2 (15 мл) | Этиленгликоль | 20% | 3 мл |
| СНО | 10% | 1,5 мл | |
| G-MOPS+ | 10,5 мл | ||
| VS 3 (15 мл) | Этиленгликоль | 35% | 5,25 мл |
| СНО | 10% | 1,5 мл | |
| Сахароза | 0,5 моль/л | 2,57 г | |
| ПВП | 5 % (по объему) | 0,75 г | |
| G-MOPS+ | ад 15 мл |
Таблица 1: Состав растворов для витрификации (ВС).
| RWS (30 мл) | Сахароза | 0,8 моль/л | |
| 8,22 г | |||
| СНО | 10% | 3 мл | |
| G-MOPS+ | около 30 мл | ||
| ES (15 мл) | Сахароза | 0,4 моль/л | 2,05 г |
| СНО | 10% | 1,5 мл | |
| G-MOPS+ | ад 15 мл | ||
| RS 1 и 2 (15 мл) | СНО | 10% | 1,5 мл |
| G-MOPS+ | ад 15 мл |
Таблица 2: Состав раствора для быстрого нагрева (RWS), уравновешивающего раствора (ES) и промывочных растворов (RS). В этой таблице приведены компоненты и концентрации раствора для быстрого нагрева (RWS), уравновешивающего раствора (ES) и промывочных растворов (RS), используемых при обработке после остеклования.
| Параметр | Свежий | Интервал | Быстрый прогрев после остеклования | Интервал | n | *P-значение |
| СД | СД | |||||
| Количество жизнеспособности фолликулов [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Тест Вилкоксона |
Таблица 3: Репрезентативные результаты жизнеспособности фолликулов. В данной таблице представлены результаты оценки жизнеспособности фолликулов до криоконсервации и после быстрого нагревания. С помощью двух кусочков ткани диаметром 2 мм на пациента подсчитывали количество жизнеспособных фолликулов до и после витрификации/быстрого нагревания. Парные образцы тканей 50 пациентов были проанализированы с помощью теста Вилкоксона.
Обсуждение
Здесь представлен протокол высокопроизводительной витрификации ткани коры яичников человека, подходящий для клинической рутины. Подобно витрификации ооцитов или эмбрионов, успешное применение процедуры требует тщательного соблюдения протокола, касающегося температуры витрификационных и согревающих растворов, а также периода равновесия. Соблюдение Директивы ЕС37 по качеству воздуха и стерильности также имеет важное значение.
Процедура витрификации приводит к некристаллическому, аморфному или стекловидному состоянию. В целом, витрификация является универсальным процессом, имеющим значительные последствия в различных научных и технологических областях. Основным преимуществом витрификации является ее способность переводить ткань в стеклообразное состояние, тем самым предотвращая образование кристаллов льда 38,39,40, которые могут негативно повлиять на целостность ткани и ее компонентов.
Добавление криопротекторов (КИП) поливинилпирролидоном (ПВП) позволяет снизить концентрацию ХПА без ущерба для качества растворов для витрификации41,42. Кроме того, использование металлических решеток обеспечивает высокую теплопроводность по сравнению с несущими системами на основе пластика. Сетчатая структура также облегчает адгезию поверхности, обеспечивая безопасную и надежную криоконсервацию образцов тканей и небольшие отверстия в коре головного мозга для измерения качества. Если используются криогенные сосуды других производителей, важно предварительно проверить размер металлических решеток, чтобы обеспечить устойчивость и правильное сцепление внутри крышки криососуда, а также хорошую посадку в сосуд.
Важнейшие шаги для обеспечения успешной витрификации включают быструю витрификацию путем погружения ткани в стерилизованный жидкий азот и выполнение быстрого нагревания без промедления во избежание неблагоприятных результатов. С точки зрения экономической эффективности, витрификация тканей менее требовательна по сравнению с процедурой медленной заморозки, что может повлиять на планирование распределения персонала. Кроме того, остеклование избавляет от необходимости приобретать и обслуживать оборудование, необходимое для медленной заморозки.
Биологические измерения и метаанализы продемонстрировали сопоставимость или даже преимущества витрификации по сравнению с медленным замораживанием43. Тем не менее, различия в результатах после витрификации могут быть связаны с отсутствием стандартизации как в устройстве для витрификации, так и в протоколе, включая используемые решения, которые варьируются в разных исследованиях. Будущие исследования должны изучить потенциал культивирования фолликулов из витрифицированной/быстро разогретой ткани для мониторинга роста in vitro, что было успешно продемонстрировано в ткани яичников мышей несколькими группами 44,45,46,47,48,49,50.
Таким образом, витрификация ткани яичников является важной альтернативой широко используемому протоколу медленной заморозки, чему способствовали пять успешных доставок, о которых сообщили Suzuki51 (Япония), Silber52 (США) и Sänger53 (Германия). В отличие от коммерчески доступных сред для витрификации и наборов для клеток, существует мало одобренных FDA/CE систем для ткани яичников, что может ограничивать их применение в клинических условиях. Поэтому рекомендуется разработка одобренных FDA/CE наборов и сред для витрификации и быстрого нагрева ткани яичников30.
Раскрытие информации
Никакой.
Благодарности
Мы благодарим Кару Фербер за корректуру; Катарине Воллершайм, Мартину Мальбергу, Леа Корте и Ясмин Ребхольц за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Ссылки
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены