Method Article
Vitrificazione del tessuto della corteccia ovarica per raggiungere uno stato vetroso di aggregazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Viene presentato un protocollo per la vitrificazione del tessuto ovarico, come metodo di crioconservazione alternativo al protocollo di congelamento lento ampiamente utilizzato.
Abstract
La crioconservazione del tessuto ovarico (OTC) è un'opzione importante per la conservazione della fertilità. Per i pazienti i cui trattamenti gonadotossici non possono essere posticipati o per le ragazze in età pre-puberale, è spesso l'unica opzione per la protezione della fertilità. La crioconservazione può essere eseguita sia mediante vetrificazione che mediante congelamento lento. Il congelamento lento è attualmente l'approccio standard. Un numero crescente di studi indica che la vitrificazione può sostituire il congelamento lento nei laboratori di fecondazione in vitro (IVF) all'avanguardia, migliorando significativamente i tassi di sopravvivenza allo scongelamento e semplificando gli aspetti tecnici della crioconservazione. Viene descritto un protocollo ad alto rendimento basato su griglia metallica per la vetrificazione rapida del tessuto della corteccia ovarica, adatto per la routine clinica. La sterilizzazione delle griglie metalliche e dell'azoto liquido garantisce un'elevata qualità, soddisfacendo gli standard delle buone pratiche di fabbricazione (GMP). La vetrificazione è stata condotta per garantire velocità di raffreddamento ultrarapide. Invece di scongelarsi lentamente, i campioni sono stati riscaldati rapidamente. Per valutare la vitalità follicolare, la colorazione con calceina è stata eseguita sia prima della crioconservazione che dopo un rapido riscaldamento. Viene segnalata l'applicazione riuscita della vetrificazione e del riscaldamento rapido utilizzando griglie metalliche. Non sono state osservate differenze significative nella vitalità follicolare prima della vetrificazione e dopo un rapido riscaldamento. Questi risultati confermano l'elevata capacità della vitrificazione dei tessuti per le applicazioni cliniche di routine come potenziale sostituto del metodo di congelamento lento ampiamente utilizzato.
Introduzione
La crioconservazione del tessuto ovarico è un'opzione importante per la conservazione della fertilità. Il tessuto espiantato contenente follicoli ovarici, in cui sono incorporati gli ovociti, viene crioconservato. Dopo la conservazione, il tessuto ovarico può essere scongelato, riscaldato e reimpiantato nella paziente. Per le cellule o i tessuti vitali, sono disponibili due metodi di crioconservazione: congelamento lento e vitrificazione1.
La vitrificazione viene utilizzata per conservare materiali biologici, come embrioni e ovociti, con tassi di sopravvivenza superiori rispetto al protocollo di congelamento lento 1,2,3,4. Il congelamento lento ha dei limiti, come la formazione di cristalli di ghiaccio, che possono potenzialmente danneggiare le strutture cellulari e tissutali. Tuttavia, il congelamento lento è un importante approccio di crioconservazione che facilita la conservazione a lungo termine di campioni biologici e la funzionalità di questo metodo è stata ampiamente dimostrata5. La vetrificazione induce uno stato vetroso di aggregazione, impedendo la formazione di cristalli di ghiaccio 6,7. A livello tecnico, la vetrificazione semplifica notevolmente la procedura di crioconservazione riducendo la manutenzione delle apparecchiature, diminuendo la probabilità di errori tecnici e accorciando la durata del processo di crioconservazione 8,9. Nella preservazione della fertilità femminile, la crioconservazione del tessuto ovarico è un approccio decisivo prima del trattamento del cancro10. Diversi gruppi hanno dimostrato con successo il concetto di crioconservazione, scongelamento e trapianto di tessuto basato sul protocollo di congelamento lento 11,12,13,14, che è attualmente considerato l'approccio standard15.
La vitrificazione del tessuto ovarico è considerata un promettente metodo alternativo 16,17,18,19,20,21, in termini di risparmio di risorse22, tassi di sopravvivenza follicolare, livelli di frammentazione del DNA e potenziale angiogenico bilanciato 23,24,25,26,27. Ciò è confermato dal successo delle consegne in Giappone28, negli Stati Uniti29 e in Germania30.
Il confronto tra le due opzioni per la crioconservazione del tessuto ovarico (OTC)-vitrificazione rispetto alla procedura standard di congelamento lento dei risultati è parzialmente in conflitto nelle attuali meta-analisi16. Diversi fattori possono aver contribuito a questo, poiché gli attuali protocolli di vitrificazione variano notevolmente. Queste differenze includono la scelta del crioprotettore o della combinazione di protettivi, la loro concentrazione, la composizione dei mezzi OTC, la dimensione dei frammenti di tessuto e il dispositivo utilizzato come vettore tissutale. Di conseguenza, non esiste un protocollo di riscaldamento standardizzato.
Poiché gli autori hanno trovato un metodo che produce risultati convincenti in termini di manipolazione, vitalità, insorgenza dell'apoptosi, rilascio di fattori angiogenici e persino un rapporto di una nascita dopo il reimpianto 9,27, viene fornita una descrizione molto dettagliata del protocollo. Il metodo descritto offre un protocollo valido ed efficace che può contribuire alla standardizzazione della vitrificazione del tessuto ovarico.
Protocollo
Lo studio è stato approvato dal comitato etico dell'Ospedale universitario di Bonn (007/09). Il consenso informato scritto è stato ottenuto da ciascun paziente. Il gruppo di studio ha incluso tessuto ovarico umano proveniente da 50 pazienti con un'età media di 27,4 anni prima della crioconservazione, come indicato nella Figura 1. I reagenti e le attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Preparazione dei dispositivi di carico
- Prepara forbici chirurgiche e reti metalliche per la personalizzazione. Tagliare le maglie in strisce di 25 mm x 8 mm, come indicato nella Figura 2A.
- Posizionare le reti metalliche personalizzate in un contenitore di sterilizzazione e in autoclave per 2 ore (Figura 2B). Dopo la sterilizzazione in autoclave, posizionare il contenitore di sterilizzazione e le fiale da 1,8 ml sotto il banco a flusso laminare.
- Attivare l'irradiazione ultravioletta (UV) del banco a flusso laminare per 30 minuti per un'ulteriore sterilizzazione a 254 nm di lunghezza d'onda.
- Aprire il contenitore di sterilizzazione, rimuovere le griglie metalliche e inserirle nei tappi delle fiale da 1,8 ml, come indicato nella Figura 2C. Chiudere i flaconcini da 1,8 mL.
NOTA: Tutti i lavori di coltura tissutale sopra descritti devono essere eseguiti in una cappa a flusso laminare di Classe II. Pulire il banco a flusso laminare con un disinfettante per superfici indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
2. Preparazione dei terreni di vetrificazione
- Preparare una pipetta sierologica da 10 ml, un coadiuvante elettronico per pipette e tre provette da 50 ml per la soluzione di vitrificazione 1 (VS1), la soluzione di vitrificazione 2 (VS2) e la soluzione di vitrificazione 3 (VS3), nonché per registrare la data di preparazione. Attivare la radiazione ultravioletta (UV) del banco a flusso laminare per un'ulteriore sterilizzazione.
- Per VS1 (15 mL), pipettare 12 mL di terreno per la manipolazione degli ovociti (integrato con albumina sierica umana dal produttore), 1,5 mL di SSS (Serum Substitute Supplement) e 1,5 mL di glicole etilenico in una provetta da 50 mL.
- Per VS2 (15 mL), pipettare 10,5 mL di terreno per la manipolazione degli ovociti (integrato con albumina sierica umana dal produttore), 3 mL di glicole etilenico e 1,5 mL di SSS in una provetta da 50 mL.
- Per VS3, pipettare 8,5 ml di terreno per la manipolazione degli ovociti (integrato con albumina sierica umana dal produttore), 5,25 ml di glicole etilenico e aggiungere 2,57 g di saccarosio e 0,75 g di polivinilpirrolidone (PVP) in una provetta da 50 ml. Per ulteriori informazioni, vedere la Figura 3 . Miscelare tutte le soluzioni agitando a 3.000 giri/min.
NOTA: Tutti i lavori di coltura tissutale sopra descritti devono essere eseguiti in una cappa a flusso laminare di Classe II. Pulire il banco a flusso laminare con un disinfettante indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
3. Preparazione alla vetrificazione
- Pulire il banco a flusso laminare con un disinfettante per superfici indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
- Preparare una piastra a 6 pozzetti, un colino cellulare, un bisturi, una pinzetta, un punzone per biopsia da 2 mm e due piastre a fondo tondo da 90 mm. Inoltre, preparare i terreni: soluzione di conservazione per il trapianto di tessuti e VS1-3. Pipettare 5 mL di ciascuna soluzione refrigerata (VS1-3) in pozzetti separati e attendere 30 minuti affinché le soluzioni raggiungano la temperatura ambiente.
- Sterilizzare l'azoto liquido con un sistema automatizzato di irradiazione UV; in alternativa, utilizzare l'irraggiamento UV della cappa a flusso laminare per 120 min.
4. Vitrificazione dei tessuti
- Preparare il tessuto della corteccia ovarica rimuovendo il midollo. Poiché la corteccia è solitamente più dura del midollo, possono essere facilmente distinti e separati.
- Tagliare il tessuto della corteccia ovarica nelle forme desiderate (10 mm x 5 mm per il trapianto; punzoni da 2 mm x 2 mm per il conteggio dei follicoli vitali prima e dopo la vitrificazione), come indicato nella Figura 4A.
NOTA: Evitare di danneggiare il fazzoletto premendo troppo forte e maneggiarlo con cura. I campioni di tessuto possono variare da un paziente all'altro.
- Tagliare il tessuto della corteccia ovarica nelle forme desiderate (10 mm x 5 mm per il trapianto; punzoni da 2 mm x 2 mm per il conteggio dei follicoli vitali prima e dopo la vitrificazione), come indicato nella Figura 4A.
- Posizionare un colino a celle nel primo pozzetto della piastra a 6 pozzetti con VS1. Equilibrare il tessuto della corteccia ovarica per 5 minuti in 5 mL di VS1 nel pozzetto 1 della piastra a 6 pozzetti utilizzando il colino cellulare.
- Quindi, spostare il colino cellulare con il tessuto della corteccia sul pozzetto 2 contenente 5 mL di VS2 ed equilibrare per 5 minuti. Infine, equilibrare per 6 minuti in 5 mL di VS3, come indicato nella Figura 3 e nella Tabella 1.
- Aprire i crioviali preparati. Riempi le fiale con azoto liquido sterilizzato e mettile nel recipiente cryo dewar riempito con azoto liquido. Caricare i campioni di tessuto sulla griglia metallica del dispositivo di vetrificazione entro 1 minuto (Figura 4B, C).
- Inserire i campioni di tessuto caricati sulla griglia metallica nell'azoto liquido nei crioviali preparati a griglia (Figura 4D).
NOTA: Il congelamento rapido del tessuto caricato sulla griglia metallica è essenziale per il successo di questo metodo. Tutti i lavori di coltura tissutale sopra descritti devono essere eseguiti in una cappa a flusso laminare di Classe II. Pulire il banco a flusso laminare con un disinfettante per superfici indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
- Inserire i campioni di tessuto caricati sulla griglia metallica nell'azoto liquido nei crioviali preparati a griglia (Figura 4D).
5. Preparazione di mezzi di riscaldamento rapido
- Preparare le soluzioni come indicato nella Figura 5 e nella Tabella 2. Pesare il saccarosio per la soluzione di riscaldamento rapido (RWS) e la soluzione di equilibrio (ES) e trasferirlo nella provetta. Aggiungere il terreno di manipolazione degli ovociti (integrato con albumina sierica umana dal produttore) utilizzando una pipetta sierologica e un coadiuvante per il pipettaggio. Aggiungere SSS e saccarosio come elencato nella Tabella 2.
- Chiudere i tubi e lasciarli agitare su uno shaker rotante fino a completo scioglimento.
NOTA: Tutti i lavori di coltura tissutale sopra descritti devono essere eseguiti in una cappa a flusso laminare di Classe II. Pulire il banco a flusso laminare con un disinfettante per superfici indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
6. Preparazione rapida del riscaldamento
- Un giorno prima del riscaldamento rapido, preparare i materiali di consumo e decontaminarli con la luce UV nel banco a flusso laminare: preparare il becher per campioni per RWS, la piastra a 6 pozzetti per ES, RS1 e RS2 e il becher per il trasporto dei tessuti dopo un rapido riscaldamento. Posizionare le pinzette sterili e monouso, le apparecchiature di pipettaggio e altri materiali di consumo nel banco a flusso laminare.
- Preriscaldare una piastra riscaldante a 37,2 °C. Incubare RWS a 37 °C per almeno 1 ora.
- Preparare una piastra sterile a 6 pozzetti con 6 mL di ES, 6 mL di RS per "RS1" e altri 6 mL di RS per "RS2" nel banco a flusso laminare. Fare riferimento alla Figura 5 per un'illustrazione schematica della piastra a 6 pozzetti. Lasciarli incubare a temperatura ambiente per 1 ora prima di riscaldare il fazzoletto.
- Trasferire RWS in un becher per campioni sterile in condizioni sterili e posizionarlo sulla piastra riscaldante. L'RWS deve essere mantenuto a 37 °C.
NOTA: Il riscaldamento rapido richiede una velocità di riscaldamento rapida. È fondamentale mantenere l'RWS a 37 °C per garantire il successo del primo passaggio.
7. Rapido riscaldamento del tessuto ovarico
- Trasportare le fiale crioconservate contenenti tessuto corticale ovarico vetrificato in azoto liquido al banco a flusso laminare. Aprire i flaconcini mentre sono parzialmente immersi nell'azoto liquido. Immergere rapidamente la rete con il tessuto vetrificato nell'RWS e lasciare riposare il tessuto per 1 minuto a 37 °C.
NOTA: Questo è il passaggio più critico durante il riscaldamento rapido e deve essere eseguito senza alcun ritardo. - Utilizzando una pinza sterile, trasferire il tessuto nell'ES e incubarlo per 3 minuti agitandolo delicatamente su uno shaker a dondolo.
- Sciacquare il fazzoletto a temperatura ambiente per 10 minuti ciascuno con RS1 e RS2 su uno shaker a dondolo, come indicato nella Figura 5.
- Trasferire il tessuto riscaldato in un becher sterile contenente 5 mL di soluzione di conservazione per il trapianto di tessuti, che deve essere mantenuto a 4 °C per il trasporto al sito di trapianto.
NOTA: Tutti i lavori di coltura tissutale sopra descritti devono essere eseguiti in una cappa a flusso laminare di Classe II. Pulire il banco a flusso laminare con un disinfettante per superfici indossando guanti da laboratorio monouso; Si consigliano guanti senza polvere.
8. Determinazione della vitalità follicolare
- Portare il dimetilsolfossido (DMSO) a temperatura ambiente per una notte per ottenere uno stato liquido. Pipettare 100 μl di DMSO in una fiala di calceina e risospendere per sciogliere la calceina. Pipettare 3 μL di calceina disciolta sul fondo di una provetta da 1,5 mL e conservare i flaconcini a -20 °C.
- Mettere 0,007 g di collagenasi in una provetta da 1,5 mL e conservarla a -20 °C.
- Aggiungere 997 μL di DPBS ai 3 μL di calceina prealiquotati e congelati in una provetta da 1,5 mL e risospendere per sciogliere la calceina. Aggiungere 0,007 g di collagenasi per ottenere 1000 μL di soluzione di lavoro.
- Utilizzare 500 μl della soluzione di lavoro per digerire due pezzi di frammenti di corteccia ovarica da 2 mm per 90 minuti a 37 °C, al riparo dalla luce, in un piatto a 4 pozzetti. Dopo 60 minuti e 70 minuti, risospendere ripetutamente la soluzione. Infine, determinare la vitalità follicolare tramite microscopia a fluorescenza, come mostrato nella Figura 6.
Risultati
Questo protocollo presenta le procedure per la preparazione dei terreni di vetrificazione, i dispositivi di caricamento, la vetrificazione, la preparazione dei terreni di riscaldamento rapido, il riscaldamento rapido e la determinazione della vitalità follicolare. Un confronto diretto della vitalità follicolare e dei fattori angiogenici tra congelamento lento e vitrificazione è stato convalidato e pubblicato31,32.
Il successo complessivo del protocollo di vitrificazione descritto è stato valutato confrontando la conta dei follicoli vitali prima e dopo la vitrificazione/riscaldamento rapido. La configurazione sperimentale è mostrata nella Figura 1 e i risultati sono presentati nella Figura 6. In 50 pazienti, è stata osservata una conta media di 77,98 follicoli vitali prima della vitrificazione e di 62,99 dopo la vitrificazione/riscaldamento rapido, che riflette un tasso di sopravvivenza dell'80,8%. Questo non era significativamente diverso secondo il test di Wilcoxon33.
Le griglie metalliche sono personalizzate individualmente con forbici affilate di dimensioni 25 mm x 8 mm, che si inseriscono nei cappucci dei crioviali da 1,8 mL, come mostrato nella Figura 2A, C. Dopo la sterilizzazione con autoclave a vapore, le griglie e i tappi delle fiale da 1,8 mL vengono assemblati sotto un banco a flusso laminare, come indicato nella Figura 2B. Questa configurazione fornisce una presa sicura nel tappo senza la necessità di ulteriori azioni e offre un'area sufficiente per tessuti di varie dimensioni. In genere, vengono vitrificati pezzi di tessuto di 5 mm x 10 mm per il trapianto e pezzi di 2 mm di diametro per la valutazione della conta dei follicoli vitali dopo un rapido scongelamento. Entrambe le dimensioni si adattano perfettamente alle griglie metalliche.
L'equilibratura con soluzioni di vetrificazione (VS1, VS2 e VS3) viene condotta in una piastra a 6 pozzetti su un agitatore oscillante a temperatura ambiente sotto un banco a flusso laminare, come mostrato nella Figura 3. I tempi previsti dallo schema garantiscono l'efficace assorbimento del glicole etilenico crioprotettore. Si consiglia l'uso di una piastra a 6 pozzetti su singoli recipienti in quanto facilita il rapido movimento del tessuto tra le soluzioni e aiuta a prevenire gli scambi.
Per una rapida vetrificazione verticale in azoto liquido, il tessuto della corteccia ovarica viene tagliato in pezzi adatti (Figura 4A). I campioni di corteccia ovarica vengono posti su dispositivi di carico (Figura 4B, C) e immersi verticalmente in azoto liquido (Figura 4D) per ottenere uno stato vetroso di aggregazione attraverso la vetrificazione. Le griglie metalliche scelte consentono la movimentazione verticale del tessuto, come mostrato nella Figura 4D. Inoltre, le griglie metalliche sono altamente conduttive termicamente e garantiscono velocità di raffreddamento rapide da 22 °C a -196 °C, un passaggio di fondamentale importanza nel processo di vetrificazione.
Per un riscaldamento rapido, l'RWS viene preparato in una tazza sterile a 37 °C. ES, RS1 e RS2 vengono preparati in una piastra a 6 pozzetti su un agitatore a oscillazione a temperatura ambiente, come mostrato nella Figura 5. L'elevato volume di RWS preriscaldato impedisce che la soluzione si raffreddi eccessivamente dopo l'aggiunta del tessuto vetrificato e garantisce un ambiente costantemente caldo per il tessuto durante tutto il processo di riscaldamento rapido.
Per valutare e garantire elevati standard di qualità, i punzoni per biopsia da 2 mm x 2 mm vengono colorati con calceina prima della vetrificazione e dopo un rapido riscaldamento per determinare la vitalità follicolare utilizzando la microscopia a fluorescenza34,35 (Figura 6). I follicoli vitali emettono fluorescenza verde a 495 nm dopo l'assorbimento intracellulare della calceina. In alternativa, la vitalità follicolare (Tabella 3) può essere valutata utilizzando coloranti rossi neutri36.
Seguendo i passaggi descritti in questo protocollo, il tessuto ovarico viene trasformato in uno stato vetroso di aggregazione, che facilita alti tassi di sopravvivenza dopo un rapido riscaldamento, come confermato dalla microscopia a fluorescenza.
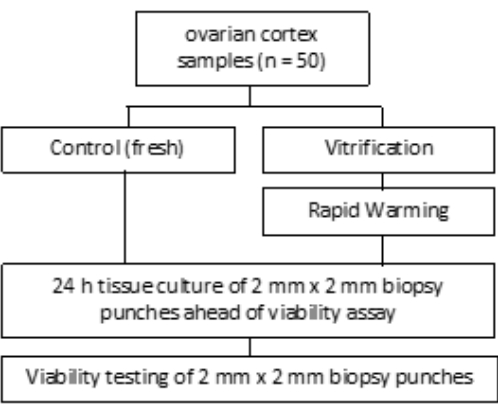
Figura 1: Disegno dello studio. I campioni corticali ovarici di 50 pazienti sono stati esaminati prima (fresco) e dopo la vitrificazione e il riscaldamento rapido per il numero di follicoli vitali. Per ogni gruppo, due pezzi di tessuto di 2 mm di diametro sono stati coltivati per 24 ore prima della valutazione della conta dei follicoli. Il tessuto è stato digerito con collagenasi e colorato con calceina per valutarne la vitalità. Il numero di follicoli vitali è stato determinato utilizzando un microscopio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione dei dispositivi di carico. Le griglie metalliche sono state tagliate a una dimensione di 8 mm x 25 mm (A). Le griglie metalliche personalizzate sono state sterilizzate in autoclave (B). Le griglie metalliche sterilizzate sono state quindi inserite in tappi da flaconcini da 1,8 mL, pronti per l'uso (C). Clicca qui per visualizzare una versione più grande di questa figura.
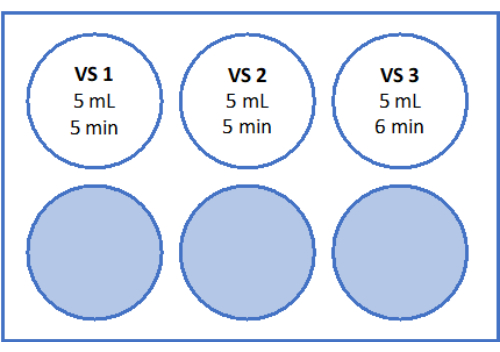
Figura 3: Preparazione di soluzioni di vitrificazione. Le soluzioni di vetrificazione (VS) sono state preparate e trasferite su una piastra a 6 pozzetti. I pozzetti mostrano il volume di ciascuna soluzione e i tempi di incubazione individuali utilizzati nel protocollo di vetrificazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Processamento e vitrificazione della corteccia ovarica. Il tessuto della corteccia ovarica è stato processato per la crioconservazione rimuovendo il midollo e tagliando il tessuto in pezzi di 5 mm x 10 mm (A). Dopo l'incubazione nelle soluzioni di vitrificazione mostrate nella Figura 3, il tessuto è stato caricato sul dispositivo di carico di vitrificazione (B,C). Per una rapida vitrificazione verticale di campioni di corteccia ovarica, i tappi con il tessuto caricato sono stati rapidamente inseriti in azoto liquido sterilizzato (D). Clicca qui per visualizzare una versione più grande di questa figura.
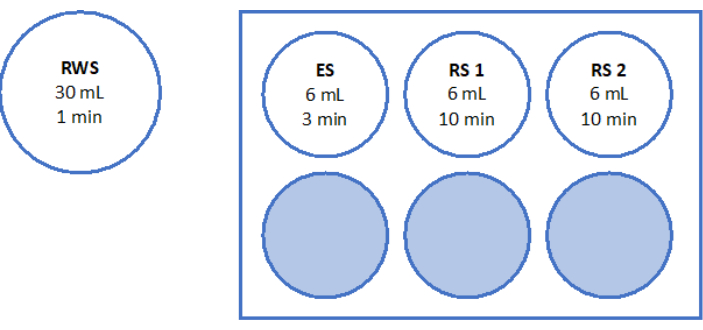
Figura 5: Preparazione di soluzioni di riscaldamento rapido. La soluzione di riscaldamento rapido (RWS), la soluzione di equilibrio (ES) e le soluzioni di risciacquo (RS) 1 e 2 sono state preparate e trasferite in una piastra a 6 pozzetti. I recipienti e i pozzetti mostrano il volume di ciascuna soluzione e i corrispondenti tempi di incubazione. Si noti che l'RWS viene mantenuto a 37,2 °C su una piastra riscaldante. Clicca qui per visualizzare una versione più grande di questa figura.
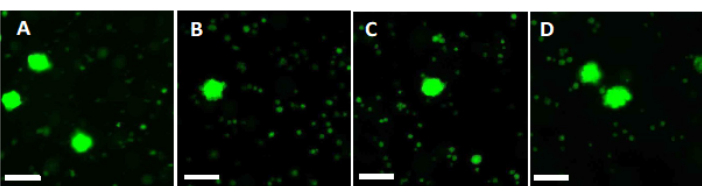
Figura 6: Conteggio della vitalità. Per valutare il numero di follicoli vitali, pezzi di tessuto di 2 mm di diametro sono stati digeriti con collagenasi e colorati con calceina. Le immagini rappresentative mostrano (A) la colorazione con calceina di 3 follicoli recuperati prima della vitrificazione. (B) Un follicolo vitale recuperato dopo vetrificazione e riscaldamento rapido. (C) Un follicolo vitale recuperato prima del congelamento lento. (D) Recupero di follicoli vitali dopo il congelamento lento e lo scongelamento. La vitalità follicolare è indicata dalla calceina, un colorante fluorescente verde che emette fluorescenza verde quando viene convertito enzimaticamente da cellule vitali a 495 nm. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| VS 1 (15 mL) | Glicole etilenico | 10% | 1,5 ml |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | 12 ml | ||
| VS 2 (15 mL) | Glicole etilenico | 20% | 3 ml |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | 10,5 ml | ||
| VS 3 (15 mL) | Glicole etilenico | 35% | 5,25 ml |
| SSS | 10% | 1,5 ml | |
| Saccarosio | 0,5 mol/L | 2,57 g | |
| PVP | 5 % (p/v) | 0,75 g | |
| G-MOPS+ | ad 15 ml |
Tabella 1: Composizione delle soluzioni di vitrificazione (VS).
| RWS (30 mL) | Saccarosio | 0,8 mol/L | |
| 8,22 grammi | |||
| SSS | 10% | 3 ml | |
| G-MOPS+ | ad 30 ml | ||
| ES (15 ml) | Saccarosio | 0,4 mol/L | 2,05 g |
| SSS | 10% | 1,5 ml | |
| G-MOPS+ | ad 15 ml | ||
| RS 1&2 (15 mL) | SSS | 10% | 1,5 ml |
| G-MOPS+ | ad 15 ml |
Tabella 2: Composizione della soluzione di riscaldamento rapido (RWS), della soluzione di equilibrio (ES) e delle soluzioni di risciacquo (RS). Questa tabella fornisce i componenti e le concentrazioni per la soluzione di riscaldamento rapido (RWS), la soluzione di equilibrio (ES) e le soluzioni di risciacquo (RS) utilizzate nel processo post-vetrificazione.
| Parametro | Fresco | Intervallo | Riscaldamento rapido dopo la vetrificazione | Intervallo | n | *Valore P |
| SD | SD | |||||
| Conta della vitalità follicolare [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Test di Wilcoxon |
Tabella 3: Risultati rappresentativi della vitalità follicolare. Questa tabella presenta i risultati delle valutazioni della vitalità follicolare prima della crioconservazione e dopo un rapido riscaldamento. Due pezzi di tessuto di 2 mm di diametro per paziente sono stati utilizzati per contare il numero di follicoli vitali prima e dopo la vitrificazione/riscaldamento rapido. I campioni di tessuto accoppiati di 50 pazienti sono stati analizzati utilizzando il test di Wilcoxon.
Discussione
Qui viene presentato un protocollo per la vitrificazione ad alto rendimento del tessuto della corteccia ovarica umana, adatto alla routine clinica. Analogamente alla vitrificazione di ovociti o embrioni, l'applicazione efficace della procedura richiede il rispetto dettagliato del protocollo relativo alla temperatura delle soluzioni di vitrificazione e riscaldamento, nonché al periodo di equilibrio. Anche la conformità alle direttive UEsui tessuti 37 relative alla qualità dell'aria e alla sterilità è essenziale.
La procedura di vetrificazione si traduce in uno stato non cristallino, amorfo o vetroso. Nel complesso, la vetrificazione è un processo versatile con implicazioni significative in vari domini scientifici e tecnologici. Il vantaggio principale della vitrificazione è la sua capacità di convertire il tessuto in uno stato vetroso, prevenendo così la formazione di cristalli di ghiaccio 38,39,40, che può influire negativamente sull'integrità del tessuto e dei suoi componenti.
L'integrazione di agenti crioprotettivi (CPA) con polivinilpirrolidone (PVP) consente una riduzione della concentrazione di CPA senza compromettere la qualità delle soluzioni di vetrificazione 41,42. Inoltre, l'uso di griglie metalliche fornisce un'elevata conduttività termica rispetto ai sistemi di supporto a base di plastica. La struttura a griglia facilita anche l'adesione della superficie, garantendo la crioconservazione sicura di campioni di tessuto e piccoli punzoni di corteccia per misure di qualità. Se si utilizzano recipienti criogenici di altri produttori, è importante testare preventivamente le dimensioni delle griglie metalliche per garantire stabilità e presa adeguata all'interno del coperchio del criorecipiente, nonché una buona vestibilità nel recipiente.
I passaggi critici per garantire il successo della vetrificazione includono la vetrificazione rapida immergendo il tessuto in azoto liquido sterilizzato e l'esecuzione di un riscaldamento rapido senza indugio per evitare risultati avversi. In termini di rapporto costo-efficacia, la vitrificazione dei tessuti è meno impegnativa rispetto alla procedura di congelamento lento, che può influenzare la pianificazione dell'impiego del personale. Inoltre, la vetrificazione elimina la necessità di acquistare e riparare le apparecchiature necessarie per il congelamento lento.
Le misure biologiche e le meta-analisi hanno dimostrato la comparabilità o addirittura i vantaggi della vitrificazione rispetto al congelamento lento43. Tuttavia, le differenze nei risultati dopo la vitrificazione possono essere attribuite alla mancanza di standardizzazione sia nel dispositivo di vitrificazione che nel protocollo, comprese le soluzioni utilizzate, che variano da uno studio all'altro. La ricerca futura dovrebbe esplorare il potenziale della coltura dei follicoli da tessuto vitrificato/riscaldato rapidamente per monitorare la crescita in vitro, come dimostrato con successo nel tessuto ovarico di topo da diversi gruppi 44,45,46,47,48,49,50.
In sintesi, la vitrificazione del tessuto ovarico è un'alternativa significativa al protocollo di congelamento lento ampiamente utilizzato, supportato da cinque parti di successo riportati da Suzuki51 (Giappone), Silber52 (USA) e Sänger53 (Germania). A differenza dei terreni di vetrificazione e dei kit per cellule disponibili in commercio, esistono pochi sistemi approvati dalla FDA/CE per il tessuto ovarico, il che può limitarne l'applicazione in ambito clinico. Pertanto, si raccomanda lo sviluppo di kit e terreni approvati dalla FDA/CE per la vetrificazione e il riscaldamento rapido del tessuto ovarico30.
Divulgazioni
Nessuno.
Riconoscimenti
Ringraziamo Cara Färber per la correzione delle bozze; Katharina Wollersheim, Martin Mahlberg, Lea Korte e Jasmin Rebholz per la loro assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Riferimenti
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon