Method Article
ガラス質の凝集状態を達成するための卵巣皮質組織のガラス化
要約
卵巣組織のガラス化のためのプロトコルは、広く使用されているゆっくりと凍結プロトコルに代わる凍結保存方法として、提示されます。
要約
卵巣組織凍結保存(OTC)は、受胎能保存のための重要な選択肢です。性腺毒性治療を延期できない患者や思春期前の少女にとって、それが不妊治療の唯一の選択肢であることがよくあります。凍結保存は、ガラス固化または徐凍結のいずれかによって行うことができます。現在、ゆっくりと凍結することが標準的なアプローチです。ますます多くの研究が、ガラス化が最先端の 体外 受精(IVF)研究所でのゆっくりとした凍結に取って代わることができ、解凍生存率を大幅に改善し、凍結保存の技術的側面を簡素化できることを示しています。臨床ルーチンに適した、卵巣皮質組織の迅速なガラス化のための金属グリッドベースのハイスループットプロトコルについて説明します。金属グリッドと液体窒素の滅菌により、GMP(Good Manufacturing Practice)基準を満たした高品質が保証されます。ガラス固化は、超急速冷却速度を確保するために行われました。ゆっくりと解凍する代わりに、サンプルは急速に温められました。卵胞の生存率を評価するために、カルセイン染色を凍結保存前と急速加温後の両方で行いました。金属グリッドを使用したガラス化と急速な温暖化の成功した適用が報告されています。ガラス固化前と急激な温暖化後に、卵胞の生存率に有意差は観察されませんでした。これらの結果は、広く使用されている低速凍結法の潜在的な代替品として、臨床ルーチンアプリケーションのための組織ガラス化の高能力を実証しています。
概要
卵巣組織の凍結保存は、受胎能の保存にとって重要な選択肢です。卵子が埋め込まれている卵巣卵胞を含む外植組織は凍結保存されます。保管後、卵巣組織を解凍し、温め、患者に再移植することができます。生細胞または生組織には、徐放尿とガラス化の2つの凍結保存方法があります1。
ガラス化は、胚や卵子などの生物学的物質を、緩慢凍結プロトコル1,2,3,4と比較して優れた生存率で保存するために使用されます。ゆっくりと凍結すると、氷の結晶が形成されるなどの制限があり、細胞や組織の構造に損傷を与える可能性があります。しかし、徐放法は生体試料の長期保存を容易にする重要な凍結保存法であり、その機能性は広く証明されています5。ガラス化はガラス状の凝集状態を誘発し、氷の結晶形成を防ぎます6,7。技術レベルでは、ガラス化は、機器のメンテナンスを減らし、技術的なエラーの可能性を減らし、凍結保存プロセスの期間を短縮することにより、凍結保存手順を大幅に簡素化します8,9。女性の生殖能力の保存では、卵巣組織の凍結保存が癌治療前の決定的なアプローチです10。さまざまなグループが、現在標準的なアプローチ15と見なされている緩慢凍結プロトコル11,12,13,14に基づいて、組織の凍結保存、融解、および移植の概念を成功裏に実証しました。
卵巣組織のガラス化は、資源節約22、卵胞生存率、DNA断片化レベル、およびバランスの取れた血管新生能23,24,25,26,27の観点から、有望な代替方法16,17,18,19,20,21と見なされている。これは、日本での納入実績が28件、米国で29件、ドイツでの成功実績が証明しています。
卵巣組織凍結保存(OTC)ガラス化の2つのオプションと、ゆっくりと凍結する標準的な手順を比較することは、現在のメタアナリシス16で部分的に矛盾しています。現在のガラス化プロトコルは大きく異なるため、これにはいくつかの要因が寄与している可能性があります。これらの違いには、凍結保護剤または保護剤の組み合わせの選択、それらの濃度、OTC培地の組成、組織片のサイズ、および組織担体として使用されるデバイスが含まれます。したがって、標準化された温暖化プロトコルはありません。
著者らは、取り扱い、生存率、アポトーシスの開始、血管新生因子の放出、さらには再移植後の出生の報告に関して説得力のある結果をもたらす方法を見つけたため9,27、プロトコルの非常に詳細な説明が提供されます。記載された方法は、卵巣組織のガラス化の標準化に貢献し得る有効かつ効果的なプロトコルを提供する。
プロトコル
この研究は、ボン大学病院の倫理委員会によって承認されました(007/09)。書面によるインフォームドコンセントは、各患者から得られました。この研究グループには、 図1に示すように、凍結保存前の平均年齢が27.4歳の50人の患者からのヒト卵巣組織が含まれていました。この研究で使用した試薬と機器は、 材料表に記載されています。
1. ローディング装置の準備
- カスタマイズ用の手術用ハサミと金属メッシュを準備します。 図 2A に示すように、メッシュを 25 mm x 8 mm のストリップにカットします。
- カスタマイズした金属メッシュを滅菌容器とオートクレーブに2時間入れます(図2B)。オートクレーブ後、滅菌容器と1.8 mLバイアルを層流ベンチの下に置きます。
- 層流ベンチの紫外線(UV)照射を30分間オンにして、254nmの波長で追加の滅菌を行います。
- 滅菌容器を開け、金属製のグリッドを取り外し、 図2Cに示すように、1.8mLバイアルのキャップに取り付けます。1.8 mLバイアルを閉じます。.
注:上記のすべての組織培養作業は、クラスII層流フードで行う必要があります。使い捨ての実験用手袋を着用しながら、表面消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
2. ガラス固化媒体の調製
- ガラス固化液1(VS1)、ガラス固化液2(VS2)、ガラス固化液3(VS3)用の血清学的10 mLピペット1本、電動ピペット補助具1本、50 mLチューブ3本を準備し、調製日を記録します。層流ベンチの紫外線(UV)放射をオンにして、追加の滅菌を行います。
- VS1(15 mL)の場合、卵子処理培地12 mL(メーカーがヒト血清アルブミンを添加)、SSS(Serum Substitute Supplement)1.5 mL、およびエチレングリコール1.5 mLを50 mLチューブ1本にピペットで挿入します。
- VS2(15 mL)の場合、卵子処理培地10.5 mL(メーカーがヒト血清アルブミンを添加)、エチレングリコール3 mL、SSS1.5 mLを50 mLチューブ1本にピペットで移します。
- VS3の場合、8.5 mLの卵母細胞処理培地(メーカーがヒト血清アルブミンを添加)、5.25 mLのエチレングリコールをピペットで移し、2.57 gのスクロースと0.75 gのポリビニルピロリドン(PVP)を1本の50 mLチューブに加えます。詳細については、 図 3 を参照してください。すべての溶液を3,000rpmでボルテックスして混合します。
注:上記のすべての組織培養作業は、クラスII層流フードで行う必要があります。使い捨ての実験用手袋を着用しながら、消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
3. ガラス化の準備
- 使い捨ての実験用手袋を着用しながら、表面消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
- 6ウェルプレート1枚、細胞ストレーナー、メス、ピンセット、2mm生検パンチ1個、90mm丸底皿2枚を用意します。また、組織移植用の保存液とVS1-3の培地を調製します。各冷やした溶液(VS1-3)の5 mLを別々のウェルにピペットで移し、溶液が室温に達するまで30分間待ちます。
- 自動UV照射システムで液体窒素を滅菌します。または、層流フードのUV照射を120分間使用します。
4. 組織のガラス化
- 髄質を切除して卵巣皮質組織を準備します。通常、皮質は髄質よりも硬いため、簡単に区別して分離できます。
- 図4Aに示すように、卵巣皮質組織を目的の形状に切断します(移植の場合は10 mm x 5 mm、ガラス化の前後に生存可能な卵胞をカウントする場合は2 mm x 2 mmパンチ)。
注意: 強く押しすぎてティッシュを傷つけないようにし、取り扱いには注意してください。組織サンプルは患者によって異なる場合があります。
- 図4Aに示すように、卵巣皮質組織を目的の形状に切断します(移植の場合は10 mm x 5 mm、ガラス化の前後に生存可能な卵胞をカウントする場合は2 mm x 2 mmパンチ)。
- VS1を入れた6ウェルプレートの最初のウェルにセルストレーナーを置きます。細胞ストレーナーを使用して、6ウェルプレートのウェル1のVS1 5 mLで卵巣皮質組織を5分間平衡化します。
- 次に、皮質組織と共に細胞ストレーナーを5mLのVS2を含むウェル2に移し、5分間平衡化します。最後に、 図3 および表1に示すように、VS3の5 mLで6分間平衡化します。
- 準備したクライオバイアルを開きます。バイアルに滅菌した液体窒素を入れ、液体窒素で満たされたクライオデュワー容器に入れます。組織サンプルをガラス化装置の金属グリッドに1分以内にロードします(図4B、C)。
- 金属グリッドにロードした組織サンプルを、調製したグリッドベースのクライオバイアルの液体窒素に挿入します(図4D)。
注:この方法を成功させるには、金属グリッドにロードされた組織の急速凍結が不可欠です。上記のすべての組織培養作業は、クラスII層流フードで行う必要があります。使い捨ての実験用手袋を着用しながら、表面消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
- 金属グリッドにロードした組織サンプルを、調製したグリッドベースのクライオバイアルの液体窒素に挿入します(図4D)。
5.急速温暖化媒体の調製
- 図 5 および表 2 に示されているように溶液を準備します。スクロースを急速加温液(RWS)と平衡液(ES)の秤量し、チューブに移します。卵子処理培地(メーカーがヒト血清アルブミンを添加)を血清ピペットとピペッティング補助具を使用して追加します。表2に示すように、SSSとスクロースを追加します。
- チューブを閉じ、完全に溶解するまでローリングシェーカーで攪拌します。
注:上記のすべての組織培養作業は、クラスII層流フードで行う必要があります。使い捨ての実験用手袋を着用しながら、表面消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
6.急速な温暖化の準備
- 急速加温の1日前に、消耗品を準備し、層流ベンチでUV光を使用して除染します:RWS用のサンプルビーカー、ES、RS1、およびRS2用の6ウェルプレート、および急速加温後の組織輸送用のサンプルビーカーを準備します。滅菌済みの使い捨てピンセット、ピペッティング装置、およびその他の消耗品を層流ベンチに置きます。
- 加熱プレートを37.2°Cに予熱します。 RWSを37°Cで少なくとも1時間インキュベートします。
- 6 mLのES、「RS1」用の6 mLのRS、および「RS2」用のRSの6 mLを入した滅菌6ウェルプレートを層流ベンチで調製します。6ウェルプレートの概略図については、 図5 を参照してください。これらを室温で1時間インキュベートしてから、組織を温めます。
- 無菌条件下でRWSを滅菌サンプルビーカーに移し、加熱プレートの上に置きます。RWSは37°Cに維持する必要があります。
注:急速な温暖化には、速い温暖化速度が必要です。最初のステップを成功させるためには、RWSを37°Cに保持することが重要です。
7. 卵巣組織の急速な温暖化
- 凍結保存されたバイアルを、液体窒素中のガラス化卵巣皮質組織を層流ベンチに輸送します。バイアルを部分的に液体窒素に浸した状態で開きます。ガラス化組織を含むメッシュをRWSに急速に沈め、組織を37°Cで1分間放置します。
注:これは急激な温暖化の際に最も重要なステップであり、遅滞なく実施する必要があります。 - 滅菌鉗子を使用して、組織をESに移し、ロッキングシェーカーで静かに振とうしながら3分間インキュベートします。
- 図5に示すように、ロッキングシェーカーでRS1とRS2をそれぞれ室温で10分間すすぎます。
- 温めた組織を、組織移植用の保存液5 mLを含む滅菌サンプルビーカーに移し、移植部位に輸送するために4°Cに保持する必要があります。
注:上記のすべての組織培養作業は、クラスII層流フードで行う必要があります。使い捨ての実験用手袋を着用しながら、表面消毒剤で層流ベンチを清掃します。パウダーを塗っていない手袋をお勧めします。
8. 卵胞生存率の決定
- ジメチルスルホキシド(DMSO)を室温で一晩中室温に戻して、液体状態にします。100 μLのDMSOをカルセインのバイアル1本にピペットで移し、再懸濁してカルセインを溶解します。溶解したカルセイン3μLを1.5 mLチューブ1本の底にピペットで移し、バイアルを-20°Cで保存します。
- 1.5 mLチューブ1本に0.007 gのコラゲナーゼを入れ、-20°Cで保存します。
- 1.5 mLチューブ1本にあらかじめ分注して凍結した3 μLのカルセインに997 μLのDPBSを加え、再懸濁してカルセインを溶解します。0.007 gのコラゲナーゼを添加して、1000 μLの作業溶液を得ます。
- 500 μLのワーキングソリューションを使用して、2 mmの卵巣皮質フラグメント2個を37°Cで90分間、光から遮蔽した状態で4ウェルディッシュで消化します。60分後および70分後、溶液を繰り返し再懸濁します。最後に、図6に示すように、蛍光顕微鏡法で卵胞の生存率を決定します。
結果
このプロトコルは、ガラス化媒体の調製、ローディングデバイス、ガラス化、急速加温媒体の調製、急速加温、および卵胞生存率の決定の手順を示しています。ゆっくりと凍結とガラス化の間の卵胞生存率と血管新生因子の直接比較が検証され、発表されています31,32。
記載されているガラス化プロトコルの全体的な成功は、ガラス化/急速な温暖化の前後のバイタル卵胞数を比較することによって評価されました。実験のセットアップを 図1に、結果を 図6に示します。50人の患者では、ガラス化前に77.98個、ガラス化/急温化後に62.99個の重要な卵胞の平均数が観察され、80.8%の生存率を反映しています。これは、Wilcoxonテスト33によれば有意差はなかった。
金属製のグリッドは、 図 2A、C に示すように、鋭利なハサミで 25 mm x 8 mm のサイズに個別にカスタマイズでき、1.8 mL クライオバイアルのキャップに収まります。蒸気オートクレーブを使用して滅菌した後、 図2Bに示すように、1.8 mLバイアルのグリッドとキャップを層流ベンチの下に組み立てます。このセットアップにより、追加の操作を必要とせずにキャップをしっかりと保持でき、さまざまなサイズの組織に十分な面積を提供します。通常、移植用の5 mm x 10 mmの組織片と、急速な融解後の重要な卵胞数を評価するための直径2 mmの組織片がガラス化されます。どちらのサイズも金属グリッドにぴったりとフィットします。
ガラス固化溶液(VS1、VS2、およびVS3)による平衡化は、 図3に示すように、ロッキングシェーカー上の6ウェルプレートで、室温の層流ベンチの下で行われます。このスキームの時間枠により、凍結保護剤エチレングリコールの効果的な取り込みが保証されます。1つの血管に6ウェルプレートを使用すると、溶液間の組織の迅速な移動が容易になり、取り違えを防ぐことができるため、推奨されます。
液体窒素中での迅速な垂直ガラス化のために、卵巣皮質組織を適切な断片に切断します(図4A)。卵巣皮質サンプルをローディングデバイス(図4B、C)に置き、液体窒素に垂直に沈め(図4D)、ガラス化によるガラス状凝集状態を実現します。選択された金属グリッドは、 図4Dに示すように、組織を垂直に取り扱うことができます。さらに、金属グリッドは熱伝導性が高く、ガラス固化プロセスにおいて非常に重要なステップである22°Cから-196°Cまでの急速な冷却速度を確保します。
急速加温のために、RWSは37°Cの滅菌カップで調製され、ES、RS1、およびRS2は、 図5に示すように、室温でロッキングシェーカー上の6ウェルプレートで調製されます。予め温められたRWSの量が多いため、ガラス化組織を添加したときに溶液が過度に冷却されるのを防ぎ、急速な加温プロセス全体を通じて組織に一貫した温熱環境を確保します。
高い品質基準を評価し、確保するために、2 mm x 2 mmの生検パンチをガラス化前および急速加温後にカルセインで染色し、蛍光顕微鏡34,35を使用して卵胞の生存率を決定します(図6)。生存可能な卵胞は、カルセインの細胞内取り込み後、495 nmで緑色の蛍光を発します。あるいは、卵胞生存率(表3)は、中性赤色染料36を用いて評価することができる。
このプロトコルに記載されている手順に従うことにより、卵巣組織はガラス状の凝集状態に変換され、蛍光顕微鏡で確認されたように、急速な温暖化後の高い生存率を促進します。
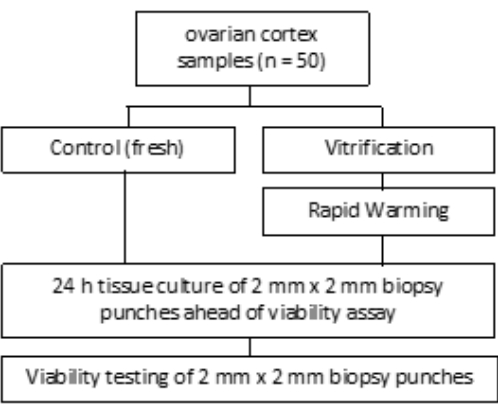
図1:試験デザイン。 50人の患者からの卵巣皮質サンプルを、ガラス化前(新鮮)とガラス化および急速な加温後、生存可能な卵胞の数について調べました。各グループについて、直径2mmの組織片2個を卵胞数評価の前に24時間培養しました。組織をコラゲナーゼで消化し、カルセインで染色して生存率を評価しました。生存可能な卵胞の数は、顕微鏡を用いて決定した。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ローディングデバイスの準備。 金属製のグリッドを8 mm x 25 mm(A)のサイズにカットしました。カスタマイズされた金属グリッドは、オートクレーブ(B)によって滅菌されました。次に、滅菌した金属グリッドを1.8mLバイアルのキャップに挿入し、すぐに使用できます(C)。 この図の拡大版を表示するには、ここをクリックしてください。
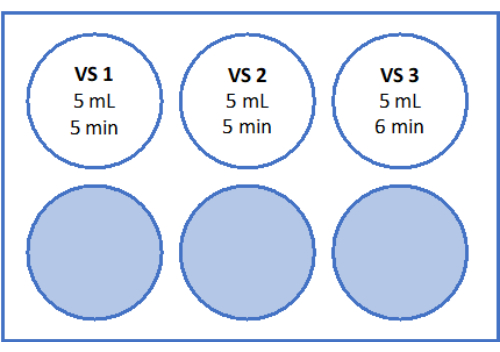
図3:ガラス固化溶液の調製。 ガラス固化溶液(VS)を調製し、6ウェルプレートに移しました。ウェルには、各溶液の量と、ガラス固化プロトコルで使用される個々のインキュベーション時間が表示されます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:卵巣皮質の処理とガラス化。 卵巣皮質組織は、髄質を切除し、組織を5mm×10mmの小片に切断することにより、凍結保存のために処理した(A)。 図3に示すガラス固化溶液中でインキュベートした後、組織をガラス化ローディング装置(B,C)にロードしました。卵巣皮質サンプルの迅速な垂直ガラス化のために、ロードされた組織のキャップを滅菌した液体窒素(D)に迅速に挿入しました。 この図の拡大版を表示するには、ここをクリックしてください。
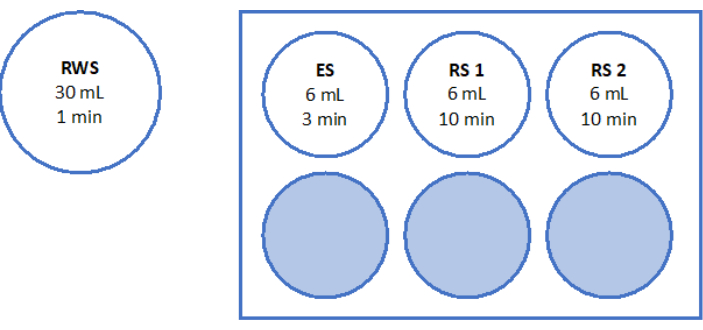
図5:急速温暖化溶液の調製。 急速加温溶液(RWS)、平衡化溶液(ES)、リンス溶液(RS)1および2を調製し、6ウェルプレートに移しました。容器とウェルには、各溶液の量と対応するインキュベーション時間が表示されます。RWSは加熱プレート上で37.2°Cに維持されることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
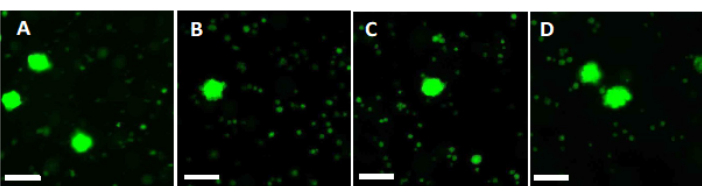
図6:生存率の数。 生存可能な卵胞の数を評価するために、直径2 mmの組織片をコラゲナーゼで消化し、カルセインで染色しました。代表的な画像は、(A)ガラス化前の回収された3つの卵胞のカルセイン染色を示しています。(B)ガラス化および急速な温暖化後に回復した生存可能な卵胞。(C)ゆっくりと凍結する前に回復した生存可能な卵胞。(D)ゆっくりと凍結および融解した後、生存可能な卵胞を回復しました。卵胞の生存率は、495 nmの生細胞によって酵素的に変換されると緑色の蛍光を発する緑色の蛍光色素であるカルセインによって示されます。スケールバー = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。
| VS 1(15 mL) | エチレング リコール | 10% | 1.5ミリリットル |
| SSSの | 10% | 1.5ミリリットル | |
| G-MOPS+(ジーモップスプラス) | 12ミリリットル | ||
| VS 2 (15 mL) | エチレング リコール | 20% | 3ミリリットル |
| SSSの | 10% | 1.5ミリリットル | |
| G-MOPS+(ジーモップスプラス) | 10.5ミリリットル | ||
| VS 3 (15 mL) | エチレング リコール | 35% | 5.25ミリリットル |
| SSSの | 10% | 1.5ミリリットル | |
| 蔗糖 | 0.5モル/L | 2.57グラム | |
| PVPの | 5 % (w/v) | 0.75グラム | |
| G-MOPS+(ジーモップスプラス) | 広告 15 mL |
表1:ガラス固化液(VS)の組成。
| RWS(30 mL) | 蔗糖 | 0.8モル/L | |
| 8.22 グラム | |||
| SSSの | 10% | 3ミリリットル | |
| G-MOPS+(ジーモップスプラス) | 広告 30 mL | ||
| ES(15 mL) | 蔗糖 | 0.4モル/L | 2.05 グラム |
| SSSの | 10% | 1.5ミリリットル | |
| G-MOPS+(ジーモップスプラス) | 広告 15 mL | ||
| RS 1&2 (15 mL) | SSSの | 10% | 1.5ミリリットル |
| G-MOPS+(ジーモップスプラス) | 広告 15 mL |
表2:急速加温液(RWS)、平衡化液(ES)、リンス液(RS)の組成。 この表は、ガラス固化後の処理で使用される急速加温溶液(RWS)、平衡化溶液(ES)、およびすすぎ溶液(RS)の成分と濃度を示しています。
| パラメーター | 新鮮 | 間 | ガラス化後の急速な温暖化 | 間 | n | *P値 |
| SDの | SDの | |||||
| 卵胞生存率カウント [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *ウィルコクソン試験 |
表3:卵胞生存率の代表的な結果。 この表は、凍結保存前と急温後の卵胞生存率評価の結果を示しています。患者1人あたり直径2mmの組織片2枚を使用して、ガラス化/急速加温の前後の生存可能な卵胞の数を数えました。50人の患者からのペア組織サンプルをWilcoxonテストを使用して分析しました。
ディスカッション
ここでは、臨床ルーチンに適したヒト卵巣皮質組織のハイスループットガラス化のためのプロトコルが提示されます。卵母細胞や胚のガラス化と同様に、この手順を成功裏に適用するには、ガラス化溶液と加温溶液の温度、および平衡化期間に関するプロトコルを詳細に遵守する必要があります。空気の質と無菌性に関するEU組織指令37 への準拠も不可欠です。
ガラス化手順は、非結晶性、非晶質、またはガラス状の状態をもたらします。全体として、ガラス化は、さまざまな科学技術領域に大きな影響を与える汎用性の高いプロセスです。ガラス化の主な利点は、組織をガラス状状態に変換する能力であり、それによって氷の結晶形成38,39,40を防ぎ、これは組織の完全性とその成分に悪影響を及ぼす可能性がある。
凍結保護剤(CPA)にポリビニルピロリドン(PVP)を補給すると、ガラス固化溶液の品質を損なうことなくCPA濃度を下げることができる41,42。さらに、金属グリッドの使用は、プラスチックベースのキャリアシステムと比較して高い熱伝導率を提供します。また、グリッド構造により表面の接着が容易になり、組織サンプルや品質測定のための小さなコルテックスパンチの安全で確実な凍結保存が保証されます。他のメーカーのクライオ容器を使用する場合は、事前に金属グリッドのサイズをテストして、クライオ容器の蓋内の安定性と適切なグリップ、および容器への適切なフィット感を確認することが重要です。
ガラス化を成功させるための重要なステップには、滅菌した液体窒素に組織を浸すことによる迅速なガラス化と、悪影響を避けるために遅滞なく急速な加温を行うことが含まれます。費用対効果の面では、組織ガラス化はゆっくりと凍結する手順に比べて要求が少なく、人員の配置計画に影響を与える可能性があります。さらに、ガラス固化により、ゆっくりと凍結するために必要な機器を購入して保守する必要がなくなります。
生物学的測定とメタアナリシスは、ゆっくりと凍結することと比較したガラス化の比較可能性または利点さえも実証しています43。ただし、ガラス化後の結果の違いは、ガラス化デバイスとプロトコルの両方(使用される溶液を含む)が標準化されていないことに起因する可能性があります。将来の研究では、いくつかのグループ44,45,46,47,48,49,50によってマウス卵巣組織で成功裏に実証されたように、ビトリファイド/急速温化組織からの卵胞培養の可能性を探る必要があります。
要約すると、卵巣組織のガラス化は、広く使用されている緩徐凍結プロトコルの重要な代替手段であり、Suzuki51 (日本)、Silber52 (米国)、およびSänger53 (ドイツ)によって報告された5つの成功した送達によってサポートされています。市販のガラス固化培地や細胞用キットとは対照的に、卵巣組織用のFDA/CE承認システムはほとんどなく、臨床現場での応用が制限される可能性があります。したがって、卵巣組織のガラス化と急速な加温のためのFDA/CE承認のキットと培地の開発が推奨されます30。
開示事項
何一つ。
謝辞
校正してくれたCara Färberに感謝します。Katharina Wollersheim氏、Martin Mahlberg氏、Lea Korte氏、Jasmin Rebholz氏の技術協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
参考文献
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047 (2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885 (2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052 (2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537 (2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65 (2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346 (2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940 (2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M., Meryman, H. T. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. , 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4 (2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38 (2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved