Method Article
Vitrification du tissu du cortex ovarien pour obtenir un état vitreux d’agrégation
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole de vitrification du tissu ovarien, en tant que méthode de cryoconservation alternative au protocole de congélation lente largement utilisé, est présenté.
Résumé
La cryoconservation du tissu ovarien (OTC) est une option importante pour la préservation de la fertilité. Pour les patientes dont les traitements gonadotoxiques ne peuvent pas être reportés ou pour les filles prépubères, c’est souvent la seule option pour protéger la fertilité. La cryoconservation peut être réalisée soit par vitrification, soit par congélation lente. La congélation lente est actuellement l’approche standard. De plus en plus d’études indiquent que la vitrification peut remplacer la congélation lente dans les laboratoires de fécondation in vitro (FIV) de pointe, améliorant considérablement les taux de survie à la décongélation et simplifiant les aspects techniques de la cryoconservation. Un protocole à haut débit basé sur une grille métallique pour la vitrification rapide du tissu du cortex ovarien, adapté à la routine clinique, est décrit. La stérilisation des grilles métalliques et de l’azote liquide garantit une qualité élevée, répondant aux normes de bonnes pratiques de fabrication (BPF). Une vitrification a été réalisée pour assurer des vitesses de refroidissement ultra-rapides. Au lieu de décongeler lentement, les échantillons ont été rapidement réchauffés. Pour évaluer la viabilité folliculaire, la coloration à la calcéine a été réalisée à la fois avant la cryoconservation et après un réchauffement rapide. L’application réussie de la vitrification et du réchauffement rapide à l’aide de grilles métalliques est rapportée. Aucune différence significative dans la viabilité folliculaire n’a été observée avant la vitrification et après un réchauffement rapide. Ces résultats confirment la grande capacité de la vitrification tissulaire pour les applications de routine clinique en tant que substitut potentiel à la méthode de congélation lente largement utilisée.
Introduction
La cryoconservation du tissu ovarien est une option importante pour la préservation de la fertilité. Le tissu explanté contenant des follicules ovariens, dans lesquels les ovocytes sont intégrés, est cryoconservé. Après stockage, le tissu ovarien peut être décongelé, réchauffé et réimplanté chez la patiente. Pour les cellules ou tissus viables, deux méthodes de cryoconservation sont disponibles : la congélation lente et la vitrification1.
La vitrification est utilisée pour préserver le matériel biologique, tel que les embryons et les ovocytes, avec des taux de survie supérieurs à ceux du protocole de congélation lente 1,2,3,4. La congélation lente a des limites, telles que la formation de cristaux de glace, qui peuvent potentiellement endommager les structures cellulaires et tissulaires. Cependant, la congélation lente est une approche de cryoconservation importante qui facilite le stockage à long terme des échantillons biologiques, et la fonctionnalité de cette méthode a été largementprouvée 5. La vitrification induit un état vitreux d’agrégation, empêchant la formation de cristaux de glace 6,7. Sur le plan technique, la vitrification simplifie considérablement la procédure de cryoconservationen réduisant la maintenance de l’équipement, en diminuant la probabilité d’erreurs techniques et en raccourcissant la durée du processus de cryoconservation 8,9. Dans la préservation de la fertilité féminine, la cryoconservation du tissu ovarien est une approche décisive avant le traitement du cancer10. Différents groupes ont démontré avec succès le concept de cryoconservation, de décongélation et de transplantation de tissus basé sur le protocole de congélation lente 11,12,13,14, qui est actuellement considéré comme l’approche standard 15.
La vitrification du tissu ovarien est considérée comme une méthode alternative prometteuse 16,17,18,19,20,21, en termes d’économie de ressources22, de taux de survie folliculaire, de niveaux de fragmentation de l’ADN et de potentiel angiogénique équilibré 23,24,25,26,27. En témoignent les livraisons réussies au Japon28, aux États-Unis29 et en Allemagne30.
La comparaison des deux options de cryoconservation du tissu ovarien-vitrification (OTC) par rapport à la procédure standard de congélation lente donne des résultats partiellement contradictoires dans les méta-analyses actuelles16. Plusieurs facteurs peuvent y avoir contribué, car les protocoles de vitrification actuels varient considérablement. Ces différences comprennent le choix du cryoprotecteur ou de la combinaison de protecteurs, leur concentration, la composition du milieu en vente libre, la taille des fragments de tissu et le dispositif utilisé comme support de tissu. Par conséquent, il n’existe pas de protocole de réchauffement normalisé.
Comme les auteurs ont trouvé une méthode qui donne des résultats convaincants en termes de manipulation, de viabilité, d’apparition de l’apoptose, de libération de facteurs angiogéniques, et même un rapport d’une naissance après réimplantation 9,27, une description très détaillée du protocole est fournie. La méthode décrite offre un protocole valide et efficace qui peut contribuer à la normalisation de la vitrification du tissu ovarien.
Protocole
L’étude a été approuvée par le comité d’éthique de l’hôpital universitaire de Bonn (007/09). Un consentement éclairé écrit a été obtenu de chaque patient. Le groupe d’étude comprenait du tissu ovarien humain de 50 patientes dont l’âge moyen était de 27,4 ans avant la cryoconservation, comme indiqué sur la figure 1. Les réactifs et l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Préparation des dispositifs de chargement
- Préparez des ciseaux chirurgicaux et des treillis métalliques pour la personnalisation. Coupez les mailles en bandes de 25 mm x 8 mm, comme indiqué sur la figure 2A.
- Placez les treillis métalliques personnalisés dans un récipient de stérilisation et un autoclave pendant 2 h (figure 2B). Après l’autoclavage, placez le récipient de stérilisation et les flacons de 1,8 mL sous le banc à flux laminaire.
- Activez l’irradiation ultraviolette (UV) du banc à flux laminaire pendant 30 min pour une stérilisation supplémentaire à une longueur d’onde de 254 nm.
- Ouvrez le contenant de stérilisation, retirez les grilles métalliques et insérez-les dans les bouchons des fioles de 1,8 ml, comme indiqué à la figure 2C. Fermez les flacons de 1,8 ml.
REMARQUE : Tous les travaux de culture tissulaire décrits ci-dessus doivent être effectués dans une hotte à flux laminaire de classe II. Nettoyez la paillasse à flux laminaire avec un désinfectant de surface tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
2. Préparation des milieux de vitrification
- Préparez une pipette sérologique de 10 ml, un aide-pipette électronique et trois tubes de 50 ml pour la solution de vitrification 1 (VS1), la solution de vitrification 2 (VS2) et la solution de vitrification 3 (VS3), ainsi que pour enregistrer la date de préparation. Activez le rayonnement ultraviolet (UV) du banc à flux laminaire pour une stérilisation supplémentaire.
- Pour VS1 (15 ml), pipetez 12 ml de milieu de manipulation d’ovocytes (complété par de l’albumine sérique humaine par le fabricant), 1,5 ml de SSS (supplément de substitution sérique) et 1,5 ml d’éthylène glycol dans un tube de 50 ml.
- Pour VS2 (15 ml), pipetez 10,5 ml de milieu de manipulation d’ovocytes (complété par l’albumine sérique humaine par le fabricant), 3 ml d’éthylène glycol et 1,5 ml de SSS dans un tube de 50 ml.
- Pour VS3, pipeter 8,5 ml de milieu de manipulation des ovocytes (complété par de l’albumine sérique humaine par le fabricant), 5,25 ml d’éthylène glycol, et ajouter 2,57 g de saccharose et 0,75 g de polyvinylpyrrolidone (PVP) dans un tube de 50 mL. Pour plus d’informations, reportez-vous à la figure 3 . Mélanger toutes les solutions par vortex à 3 000 tr/min.
REMARQUE : Tous les travaux de culture tissulaire décrits ci-dessus doivent être effectués dans une hotte à flux laminaire de classe II. Nettoyer la paillasse à flux laminaire avec un désinfectant tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
3. Préparation de la vitrification
- Nettoyez la paillasse à flux laminaire avec un désinfectant de surface tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
- Préparez une plaque à 6 puits, une passoire à cellules, un scalpel, une pince à épiler, un poinçon à biopsie de 2 mm et deux plats à fond rond de 90 mm. Préparez également le milieu : solution de conservation pour la transplantation de tissus et VS1-3. Pipeter 5 mL de chaque solution réfrigérée (VS1-3) dans des puits séparés et attendre 30 min pour que les solutions atteignent la température ambiante.
- Stériliser l’azote liquide à l’aide d’un système automatisé d’irradiation UV ; alternativement, utilisez l’irradiation UV de la hotte à flux laminaire pendant 120 min.
4. Vitrification des tissus
- Préparez le tissu du cortex ovarien en enlevant la moelle. Étant donné que le cortex est généralement plus dur que la moelle, ils peuvent être facilement distingués et séparés.
- Découper le tissu du cortex ovarien dans les formes souhaitées (10 mm x 5 mm pour la transplantation ; poinçons de 2 mm x 2 mm pour le comptage des follicules viables avant et après la vitrification), comme indiqué à la figure 4A.
REMARQUE : Évitez d’endommager le tissu en appuyant trop fort et manipulez-le avec précaution. Les échantillons de tissus peuvent varier d’un patient à l’autre.
- Découper le tissu du cortex ovarien dans les formes souhaitées (10 mm x 5 mm pour la transplantation ; poinçons de 2 mm x 2 mm pour le comptage des follicules viables avant et après la vitrification), comme indiqué à la figure 4A.
- Placez une passoire à cellules dans le premier puits de la plaque à 6 puits avec VS1. Équilibrez le tissu du cortex ovarien pendant 5 minutes dans 5 mL de VS1 dans le puits 1 de la plaque à 6 puits à l’aide de la crépine cellulaire.
- Ensuite, déplacez la crépine cellulaire avec le tissu du cortex vers le puits 2 contenant 5 mL de VS2, et équilibrez pendant 5 min. Enfin, équilibrez pendant 6 min dans 5 mL de VS3, comme indiqué à la figure 3 et au tableau 1.
- Ouvrez les cryoflacons préparés. Remplissez les flacons d’azote liquide stérilisé et placez-les dans le récipient de Dewar cryogénique rempli d’azote liquide. Chargez les échantillons de tissus sur la grille métallique du dispositif de vitrification en 1 minute (Figure 4B,C).
- Insérer les échantillons de tissus chargés sur la grille métallique dans l’azote liquide des cryoflacons préparés à base de grille (figure 4D).
REMARQUE : La congélation rapide du tissu chargé sur la grille métallique est essentielle au succès de cette méthode. Tous les travaux de culture tissulaire décrits ci-dessus doivent être effectués dans une hotte à flux laminaire de classe II. Nettoyez la paillasse à flux laminaire avec un désinfectant de surface tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
- Insérer les échantillons de tissus chargés sur la grille métallique dans l’azote liquide des cryoflacons préparés à base de grille (figure 4D).
5. Préparation des milieux chauffants rapides
- Préparez les solutions comme indiqué à la figure 5 et au tableau 2. Pesez le saccharose pour la solution de réchauffement rapide (RWS) et la solution d’équilibrage (ES) et transférez-le dans le tube. Ajouter le milieu de manipulation des ovocytes (complété par de l’albumine sérique humaine par le fabricant) à l’aide d’une pipette sérologique et d’un auxiliaire de pipetage. Ajouter le SSS et le saccharose comme indiqué dans le tableau 2.
- Fermez les tubes et laissez-les agiter sur un agitateur roulant jusqu’à dissolution complète.
REMARQUE : Tous les travaux de culture tissulaire décrits ci-dessus doivent être effectués dans une hotte à flux laminaire de classe II. Nettoyez la paillasse à flux laminaire avec un désinfectant de surface tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
6. Préparation rapide du réchauffement
- Un jour avant le réchauffement rapide, préparez les consommables et décontaminez-les à l’aide de la lumière UV dans le banc à flux laminaire : Préparez le bécher d’échantillon pour RWS, la plaque à 6 puits pour ES, RS1 et RS2, et le bécher d’échantillon pour le transport des tissus après un réchauffement rapide. Placez des pinces à épiler stériles et jetables, du matériel de pipetage et d’autres consommables dans le banc à flux laminaire.
- Préchauffez une plaque chauffante à 37,2 °C. Incuber RWS à 37 °C pendant au moins 1 h.
- Préparez une plaque stérile à 6 puits avec 6 mL d’ES, 6 mL de RS pour « RS1 » et 6 autres mL de RS pour « RS2 » dans le banc d’écoulement laminaire. Reportez-vous à la figure 5 pour une illustration schématique de la plaque à 6 puits. Laissez-les incuber à température ambiante pendant 1 h avant de réchauffer les tissus.
- Transférez le RWS dans un bécher d’échantillon stérile dans des conditions stériles et placez-le sur la plaque chauffante. Le RWS doit être maintenu à 37 °C.
REMARQUE : Le réchauffement rapide nécessite un taux de réchauffement rapide. Il est crucial de maintenir le RWS à 37 °C pour assurer le succès de la première étape.
7. Réchauffement rapide du tissu ovarien
- Transporter les flacons cryoconservés contenant du tissu cortical ovarien vitrifié dans de l’azote liquide vers le banc à flux laminaire. Ouvrez les flacons pendant qu’ils sont partiellement immergés sous l’azote liquide. Immergez rapidement le treillis avec le tissu vitrifié dans le RWS et laissez le tissu y reposer pendant 1 min à 37 °C.
REMARQUE : Il s’agit de l’étape la plus critique lors d’un réchauffement rapide et doit être effectuée sans délai. - À l’aide d’une pince stérile, transférez le tissu dans l’ES et incubez-le pendant 3 min tout en le secouant doucement sur un agitateur à bascule.
- Rincez le mouchoir à température ambiante pendant 10 minutes chacun avec RS1 et RS2 sur un agitateur à bascule, comme indiqué sur la figure 5.
- Transférez le tissu réchauffé dans un bécher stérile contenant 5 mL de solution de conservation pour la transplantation de tissus, qui doit être conservé à 4 °C pour être transporté au site de transplantation.
REMARQUE : Tous les travaux de culture tissulaire décrits ci-dessus doivent être effectués dans une hotte à flux laminaire de classe II. Nettoyez la paillasse à flux laminaire avec un désinfectant de surface tout en portant des gants de laboratoire jetables ; Les gants non poudrés sont recommandés.
8. Détermination de la viabilité folliculaire
- Amener le sulfoxyde de diméthyle (DMSO) à température ambiante pendant la nuit pour obtenir un état liquide. Pipeter 100 μL de DMSO dans un flacon de calcéine et remettre en suspension pour dissoudre la calcéine. Pipeter 3 μL de calcéine dissoute au fond d’un tube de 1,5 mL et conserver les flacons à -20 °C.
- Placez 0,007 g de collagénase dans un tube de 1,5 ml et conservez-le à -20 °C.
- Ajouter 997 μL de DPBS aux 3 μL de calcéine préaliquote et congelés dans un tube de 1,5 mL, et remettre en suspension pour dissoudre la calcéine. Ajouter 0,007 g de collagénase pour obtenir 1000 μL de solution de travail.
- Utilisez 500 μL de la solution de travail pour digérer deux morceaux de fragments de cortex ovarien de 2 mm pendant 90 min à 37 °C, à l’abri de la lumière, dans une boîte à 4 puits. Après 60 min et 70 min, remettez la solution en suspension à plusieurs reprises. Enfin, déterminez la viabilité folliculaire par microscopie à fluorescence, comme le montre la figure 6.
Résultats
Ce protocole présente les procédures de préparation des milieux de vitrification, des dispositifs de chargement, de la vitrification, de la préparation des milieux de réchauffement rapide, du réchauffement rapide et de la détermination de la viabilité folliculaire. Une comparaison directe de la viabilité folliculaire et des facteurs angiogéniques entre la congélation lente et la vitrification a été validée et publiée31,32.
Le succès global du protocole de vitrification décrit a été évalué en comparant le nombre de follicules vitaux avant et après la vitrification/réchauffement rapide. Le dispositif expérimental est illustré à la figure 1 et les résultats sont présentés à la figure 6. Chez 50 patients, un nombre moyen de 77,98 follicules vitaux a été observé avant la vitrification et de 62,99 après vitrification/réchauffement rapide, reflétant un taux de survie de 80,8%. Ce n’était pas significativement différent selon le test de Wilcoxon33.
Les grilles métalliques sont personnalisées individuellement à l’aide de ciseaux tranchants d’une taille de 25 mm x 8 mm, qui s’insèrent dans les bouchons des cryoflacons de 1,8 ml, comme le montrent les figures 2A et C. Après la stérilisation à l’autoclave à la vapeur, les grilles et les bouchons des flacons de 1,8 mL sont assemblés sous un banc à flux laminaire, comme l’indique la figure 2B. Cette configuration offre un maintien sûr dans le capuchon sans qu’il soit nécessaire d’effectuer des actions supplémentaires et offre une surface suffisante pour les tissus de différentes tailles. En règle générale, des morceaux de tissu de 5 mm x 10 mm pour la transplantation et des morceaux de 2 mm de diamètre pour évaluer le nombre de follicules vitaux après décongélation rapide sont vitrifiés. Les deux tailles s’adaptent parfaitement aux grilles métalliques.
L’équilibrage avec des solutions de vitrification (VS1, VS2 et VS3) est effectué dans une plaque à 6 puits sur un agitateur à bascule à température ambiante sous un banc d’écoulement laminaire, comme le montre la figure 3. Les délais prévus dans le schéma garantissent l’absorption efficace du cryoprotecteur éthylène glycol. Il est recommandé d’utiliser une plaque à 6 puits sur des vaisseaux uniques, car elle facilite le déplacement rapide du tissu entre les solutions et aide à prévenir les confusions.
Pour une vitrification verticale rapide dans l’azote liquide, le tissu du cortex ovarien est coupé en morceaux appropriés (Figure 4A). Des échantillons de cortex ovarien sont placés sur des dispositifs de charge (figures 4B, C) et immergés verticalement dans de l’azote liquide (figure 4D) pour obtenir un état d’agrégation vitreux par vitrification. Les grilles métalliques choisies permettent une manipulation verticale du tissu, comme le montre la figure 4D. De plus, les grilles métalliques sont hautement conductrices thermiquement, assurant des vitesses de refroidissement rapides de 22 °C à -196 °C, ce qui constitue une étape d’une importance cruciale dans le processus de vitrification.
Pour un réchauffement rapide, le RWS est préparé dans une tasse stérile à 37 °C. ES, RS1 et RS2 sont préparés dans une plaque à 6 puits sur un agitateur à bascule à température ambiante, comme le montre la figure 5. Le volume élevé de RWS préchauffé empêche la solution de refroidir excessivement lors de l’ajout du tissu vitrifié et assure un environnement constamment chaud pour le tissu tout au long du processus de réchauffement rapide.
Afin d’évaluer et d’assurer des normes de qualité élevées, des poinçons de biopsie de 2 mm x 2 mm sont colorés à la calcéine avant la vitrification et après un réchauffement rapide afin de déterminer la viabilité folliculaire à l’aide de la microscopie à fluorescence34,35 (Figure 6). Les follicules viables émettent une fluorescence verte à 495 nm après l’absorption intracellulaire de la calcéine. Alternativement, la viabilité folliculaire (tableau 3) peut être évaluée à l’aide de colorants rouges neutres36.
En suivant les étapes décrites dans ce protocole, le tissu ovarien se transforme en un état vitreux d’agrégation, ce qui facilite des taux de survie élevés après un réchauffement rapide, comme le confirme la microscopie à fluorescence.
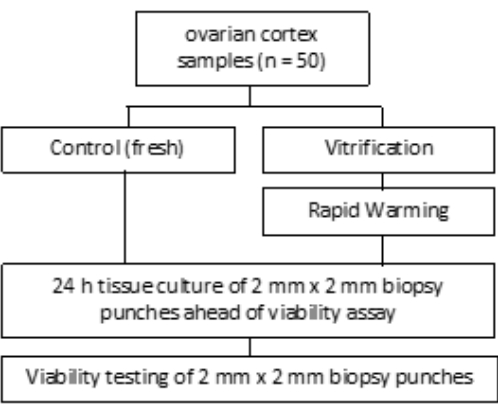
Figure 1 : Conception de l’étude. Des échantillons de corticale ovarienne de 50 patientes ont été examinés avant et après la vitrification et le réchauffement rapide pour déterminer le nombre de follicules viables. Pour chaque groupe, deux morceaux de tissu de 2 mm de diamètre ont été cultivés pendant 24 h avant l’évaluation de la numération folliculaire. Le tissu a été digéré avec de la collagénase et coloré avec de la calcéine pour évaluer la viabilité. Le nombre de follicules viables a été déterminé à l’aide d’un microscope. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation des dispositifs de chargement. Des grilles métalliques ont été découpées à une taille de 8 mm x 25 mm (A). Les grilles métalliques personnalisées ont été stérilisées par autoclave (B). Les grilles métalliques stérilisées ont ensuite été insérées dans des bouchons de flacons de 1,8 mL, prêts à l’emploi (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
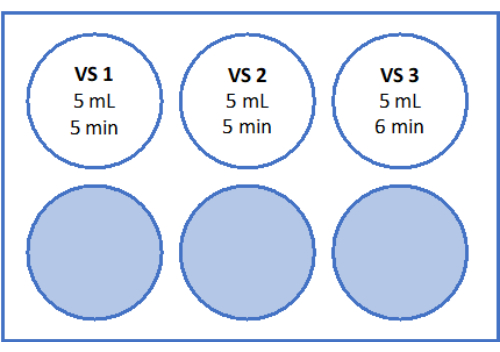
Figure 3 : Préparation des solutions de vitrification. Des solutions de vitrification (VS) ont été préparées et transférées sur une plaque à 6 puits. Les puits indiquent le volume de chaque solution et les temps d’incubation individuels utilisés dans le protocole de vitrification. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Traitement et vitrification du cortex ovarien. Le tissu du cortex ovarien a été traité pour la cryoconservation en retirant la moelle et en coupant le tissu en morceaux de 5 mm x 10 mm (A). Après l’incubation dans les solutions de vitrification illustrées à la figure 3, le tissu a été chargé sur le dispositif de charge de vitrification (B,C). Pour la vitrification verticale rapide d’échantillons de cortex ovarien, les capuchons contenant le tissu chargé ont été rapidement insérés dans de l’azote liquide stérilisé (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
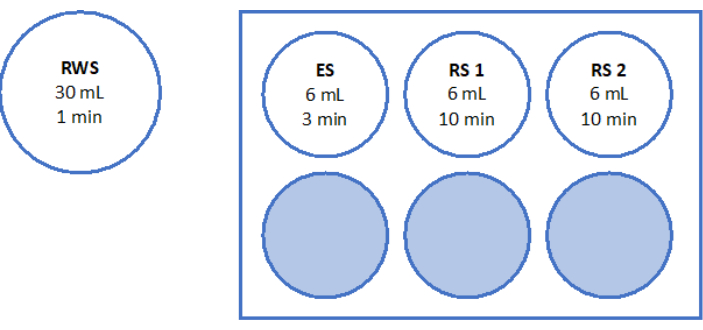
Figure 5 : Préparation de solutions de réchauffement rapide. Une solution de réchauffement rapide (RWS), une solution d’équilibrage (ES) et des solutions de rinçage (RS) 1 et 2 ont été préparées et transférées sur une plaque à 6 puits. Les récipients et les puits indiquent le volume de chaque solution et les temps d’incubation correspondants. Notez que le RWS est maintenu à 37,2 °C sur une plaque chauffante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
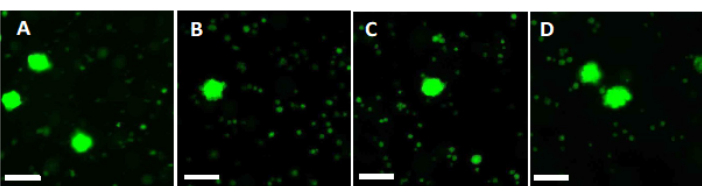
Figure 6 : Nombre de viabilité. Pour évaluer le nombre de follicules viables, des morceaux de tissu de 2 mm de diamètre ont été digérés avec de la collagénase et colorés avec de la calcéine. Les images représentatives montrent (A) une coloration à la calcéine de 3 follicules récupérés avant la vitrification. (B) Un follicule viable récupéré après vitrification et réchauffement rapide. (C) Un follicule viable récupéré avant une congélation lente. (D) Follicules viables récupérés après congélation et décongélation lentes. La viabilité folliculaire est indiquée par la calcéine, un colorant fluorescent vert qui émet une fluorescence verte lorsqu’il est converti enzymatiquement par des cellules viables à 495 nm. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| VS 1 (15 ml) | Éthylène glycol | 10% | 1,5 mL |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 12 ml | ||
| VS 2 (15 ml) | Éthylène glycol | 20% | 3 ml |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 10,5 ml | ||
| VS 3 (15 ml) | Éthylène glycol | 35% | 5,25 ml |
| SSS | 10% | 1,5 mL | |
| Saccharose | 0,5 mol/L | 2,57 grammes | |
| PVP | 5 % (p/v) | 0,75 g | |
| G-MOPS+ | ad 15 mL |
Tableau 1 : Composition des solutions de vitrification (VS).
| RWS (30 ml) | Saccharose | 0,8 mol/L | |
| 8,22 grammes | |||
| SSS | 10% | 3 ml | |
| G-MOPS+ | ad 30 mL | ||
| ES (15 ml) | Saccharose | 0,4 mol/L | 2,05 grammes |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | ad 15 mL | ||
| RS 1 et 2 (15 ml) | SSS | 10% | 1,5 mL |
| G-MOPS+ | ad 15 mL |
Tableau 2 : Composition de la solution de réchauffement rapide (RWS), de la solution d’équilibrage (ES) et des solutions de rinçage (RS). Ce tableau fournit les composants et les concentrations de la solution de réchauffement rapide (RWS), de la solution d’équilibre (ES) et des solutions de rinçage (RS) utilisées dans le traitement de post-vitrification.
| Paramètre | Frais | Intervalle | Réchauffement rapide après vitrification | Intervalle | n | *Valeur P |
| SD | SD | |||||
| Nombre de viabilité folliculaire [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Test de Wilcoxon |
Tableau 3 : Résultats représentatifs de la viabilité folliculaire. Ce tableau présente les résultats des évaluations de la viabilité folliculaire avant la cryoconservation et après un réchauffement rapide. Deux morceaux de tissu de 2 mm de diamètre par patient ont été utilisés pour compter le nombre de follicules viables avant et après vitrification/réchauffement rapide. Des échantillons de tissus appariés provenant de 50 patients ont été analysés à l’aide du test de Wilcoxon.
Discussion
Ici, un protocole de vitrification à haut débit du tissu du cortex ovarien humain, adapté à la routine clinique, est présenté. À l’instar de la vitrification d’ovocytes ou d’embryons, l’application réussie de la procédure nécessite le respect détaillé du protocole concernant la température des solutions de vitrification et de réchauffement, ainsi que la période d’équilibre. Le respect des directives européennes sur les tissus37 concernant la qualité de l’air et la stérilité est également essentiel.
Le processus de vitrification aboutit à un état non cristallin, amorphe ou vitreux. Dans l’ensemble, la vitrification est un processus polyvalent avec des implications importantes dans divers domaines scientifiques et technologiques. Le principal avantage de la vitrification est sa capacité à convertir les tissus à l’état vitreux, empêchant ainsi la formation de cristaux de glace 38,39,40, ce qui peut affecter négativement l’intégrité des tissus et de ses composants.
La supplémentation en agents cryoprotecteurs (CPA) avec de la polyvinylpyrrolidone (PVP) permet de réduire la concentration de CPA sans compromettre la qualité des solutions de vitrification41,42. De plus, l’utilisation de grilles métalliques offre une conductivité thermique élevée par rapport aux systèmes de support à base de plastique. La structure de la grille facilite également l’adhérence de surface, assurant la cryoconservation sûre et sécurisée des échantillons de tissus et des petits poinçons cortex pour les mesures de qualité. Si des cryorécipients d’autres fabricants sont utilisés, il est important de tester au préalable la taille des grilles métalliques pour assurer la stabilité et une bonne adhérence à l’intérieur du couvercle du récipient cryogénique, ainsi qu’un bon ajustement dans le récipient.
Les étapes essentielles pour assurer une vitrification réussie comprennent la vitrification rapide en immergeant les tissus dans de l’azote liquide stérilisé et en effectuant un réchauffement rapide sans délai pour éviter des résultats indésirables. En termes de rentabilité, la vitrification des tissus est moins exigeante que la procédure de congélation lente, ce qui peut influencer la planification du déploiement du personnel. De plus, la vitrification élimine le besoin d’acheter et d’entretenir l’équipement requis pour la congélation lente.
Des mesures biologiques et des méta-analyses ont démontré la comparabilité, voire les avantages, de la vitrification par rapport à la congélation lente43. Cependant, les différences dans les résultats après la vitrification peuvent être attribuées au manque de normalisation du dispositif de vitrification et du protocole, y compris les solutions utilisées, qui varient d’une étude à l’autre. Des recherches futures devraient explorer le potentiel de la culture de follicules à partir de tissus vitrifiés/à réchauffement rapide pour surveiller la croissance in vitro, comme démontré avec succès dans le tissu ovarien de souris par plusieurs groupes 44,45,46,47,48,49,50.
En résumé, la vitrification du tissu ovarien est une alternative significative au protocole de congélation lente largement utilisé, soutenu par cinq accouchements réussis signalés par Suzuki51 (Japon), Silber52 (États-Unis) et Sänger53 (Allemagne). Contrairement aux milieux de vitrification et aux kits pour cellules disponibles dans le commerce, il existe peu de systèmes approuvés par la FDA/CE pour le tissu ovarien, ce qui peut limiter leur application en milieu clinique. Par conséquent, le développement de kits et de milieux approuvés par la FDA/CE pour la vitrification et le réchauffement rapide du tissu ovarien est recommandé30.
Déclarations de divulgation
Aucun.
Remerciements
Nous remercions Cara Färber pour la relecture ; Katharina Wollersheim, Martin Mahlberg, Lea Korte et Jasmin Rebholz pour leur assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Références
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon