Method Article
Vitrificação do tecido do córtex ovariano para atingir um estado vítreo de agregação
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um protocolo para a vitrificação de tecido ovariano, como um método alternativo de criopreservação ao protocolo de congelamento lento amplamente utilizado, é apresentado.
Resumo
A criopreservação do tecido ovariano (OTC) é uma opção importante para a preservação da fertilidade. Para pacientes cujos tratamentos gonadotóxicos não podem ser adiados ou para meninas pré-púberes, muitas vezes é a única opção para proteção da fertilidade. A criopreservação pode ser realizada por vitrificação ou por congelamento lento. O congelamento lento é atualmente a abordagem padrão. Um número crescente de estudos indica que a vitrificação pode substituir o congelamento lento nos laboratórios de fertilização in vitro (FIV) de última geração, melhorando significativamente as taxas de sobrevivência ao descongelamento e simplificando os aspectos técnicos da criopreservação. Um protocolo de alto rendimento baseado em grade metálica para vitrificação rápida do tecido do córtex ovariano, adequado para a rotina clínica, é descrito. A esterilização de grades metálicas e nitrogênio líquido garante alta qualidade, atendendo aos padrões de boas práticas de fabricação (GMP). A vitrificação foi realizada para garantir taxas de resfriamento ultrarrápidas. Em vez de descongelar lentamente, as amostras foram aquecidas rapidamente. Para avaliar a viabilidade folicular, a coloração com calceína foi realizada antes da criopreservação e após o aquecimento rápido. A aplicação bem-sucedida de vitrificação e aquecimento rápido usando grades metálicas é relatada. Não foram observadas diferenças significativas na viabilidade folicular antes da vitrificação e após o aquecimento rápido. Esses resultados comprovam a alta capacidade de vitrificação de tecidos para aplicações de rotina clínica como um substituto potencial para o método de congelamento lento amplamente utilizado.
Introdução
A criopreservação do tecido ovariano é uma opção importante para a preservação da fertilidade. O tecido explantado contendo folículos ovarianos, no qual os oócitos estão embutidos, é criopreservado. Após o armazenamento, o tecido ovariano pode ser descongelado, aquecido e reimplantado na paciente. Para células ou tecidos viáveis, dois métodos de criopreservação estão disponíveis: congelamento lento e vitrificação1.
A vitrificação é utilizada para preservar materiais biológicos, como embriões e oócitos, com taxas de sobrevivência superiores em comparação com o protocolo de congelamento lento 1,2,3,4. O congelamento lento tem limitações, como a formação de cristais de gelo, que podem danificar as estruturas celulares e teciduais. No entanto, o congelamento lento é uma importante abordagem de criopreservação que facilita o armazenamento a longo prazo de amostras biológicas, e a funcionalidade desse método tem sido amplamente comprovada5. A vitrificação induz um estado vítreo de agregação, impedindo a formação de cristais de gelo 6,7. Em um nível técnico, a vitrificação simplifica significativamente o procedimento de criopreservação, reduzindo a manutenção do equipamento, diminuindo a probabilidade de erros técnicos e encurtando a duração do processo de criopreservação 8,9. Na preservação da fertilidade feminina, a criopreservação do tecido ovariano é uma abordagem decisiva antes do tratamento do câncer10. Diferentes grupos demonstraram com sucesso o conceito de criopreservação, descongelamento e transplante de tecido com base no protocolo de congelamento lento 11,12,13,14, que atualmente é considerado a abordagem padrão 15.
A vitrificação do tecido ovariano é considerada um método alternativo promissor 16,17,18,19,20,21, em termos de economia de recursos22, taxas de sobrevivência folicular, níveis de fragmentação do DNA e potencial angiogênico equilibrado 23,24,25,26,27. Isso é comprovado por entregas bem-sucedidas no Japão28, EUA29 e Alemanha30.
A comparação das duas opções de criopreservação de tecido ovariano (OTC)-vitrificação versus o procedimento padrão de congelamento lento - os resultados são parcialmente conflitantes nas meta-análises atuais16. Vários fatores podem ter contribuído para isso, pois os protocolos atuais de vitrificação variam muito. Essas diferenças incluem a escolha do crioprotetor ou combinação de protetores, sua concentração, a composição do meio OTC, o tamanho dos fragmentos de tecido e o dispositivo usado como transportador de tecido. Consequentemente, não existe um protocolo de aquecimento padronizado.
Como os autores encontraram um método que produz resultados convincentes em termos de manuseio, viabilidade, início de apoptose, liberação de fatores angiogênicos e até mesmo um relato de nascimento após reimplante 9,27, uma descrição muito detalhada do protocolo é fornecida. O método descrito oferece um protocolo válido e eficaz que pode contribuir para a padronização da vitrificação do tecido ovariano.
Protocolo
O estudo foi aprovado pelo comitê de ética do Hospital Universitário de Bonn (007/09). O consentimento informado por escrito foi obtido de cada paciente. O grupo de estudo incluiu tecido ovariano humano de 50 pacientes com idade média de 27,4 anos antes da criopreservação, conforme indicado na Figura 1. Os reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Preparação de dispositivos de carregamento
- Prepare tesouras cirúrgicas e malhas de metal para personalização. Corte as malhas em tiras de 25 mm x 8 mm, conforme indicado na figura 2A.
- Coloque as malhas metálicas personalizadas em um recipiente de esterilização e autoclave por 2 h (Figura 2B). Após a autoclavagem, coloque o recipiente de esterilização e os frascos de 1,8 mL sob a bancada de fluxo laminar.
- Ligue a irradiação ultravioleta (UV) da bancada de fluxo laminar por 30 min para esterilização adicional no comprimento de onda de 254 nm.
- Abra o recipiente de esterilização, remova as grades de metal e encaixe-as nas tampas dos frascos de 1,8 mL, conforme indicado na Figura 2C. Feche os frascos para injetáveis de 1,8 ml.
NOTA: Todos os trabalhos de cultura de tecidos descritos acima devem ser realizados em uma capela de fluxo laminar Classe II. Limpe a bancada de fluxo laminar com um desinfetante de superfície usando luvas de laboratório descartáveis; Recomenda-se o uso de luvas sem pó.
2. Preparação de meios de vitrificação
- Prepare uma pipeta sorológica de 10 mL, um aparelho de pipeta eletrônico e três tubos de 50 mL para Solução de Vitrificação 1 (VS1), Solução de Vitrificação 2 (VS2) e Solução de Vitrificação 3 (VS3), bem como para registrar a data de preparação. Ligue a radiação ultravioleta (UV) da bancada de fluxo laminar para esterilização adicional.
- Para VS1 (15 mL), pipete 12 mL de meio de manipulação de oócitos (suplementado com albumina sérica humana pelo fabricante), 1,5 mL de SSS (suplemento substituto de soro) e 1,5 mL de etilenoglicol em um tubo de 50 mL.
- Para VS2 (15 mL), pipete 10,5 mL de meio de manipulação de oócitos (suplementado com albumina sérica humana pelo fabricante), 3 mL de etilenoglicol e 1,5 mL de SSS em um tubo de 50 mL.
- Para VS3, pipetar 8,5 mL de meio de manipulação de oócitos (suplementado com albumina sérica humana pelo fabricante), 5,25 mL de etilenoglicol e adicionar 2,57 g de sacarose e 0,75 g de polivinilpirrolidona (PVP) em um tubo de 50 mL. Consulte a Figura 3 para obter detalhes. Misture todas as soluções por vórtice a 3.000 rpm.
NOTA: Todos os trabalhos de cultura de tecidos descritos acima devem ser realizados em uma capela de fluxo laminar Classe II. Limpe a bancada de fluxo laminar com um desinfetante usando luvas descartáveis de laboratório; Recomenda-se o uso de luvas sem pó.
3. Preparação para vitrificação
- Limpe a bancada de fluxo laminar com um desinfetante de superfície usando luvas de laboratório descartáveis; Recomenda-se o uso de luvas sem pó.
- Prepare uma placa de 6 poços, um filtro de células, um bisturi, uma pinça, um punção de biópsia de 2 mm e dois pratos de fundo redondo de 90 mm. Além disso, prepare os meios: solução de preservação para transplante de tecidos e VS1-3. Pipete 5 mL de cada solução resfriada (VS1-3) em poços separados e aguarde 30 minutos para que as soluções atinjam a temperatura ambiente.
- Esterilize o nitrogênio líquido com um sistema automatizado de irradiação UV; alternativamente, use a irradiação UV da capela de fluxo laminar por 120 min.
4. Vitrificação do tecido
- Prepare o tecido do córtex ovariano removendo a medula. Como o córtex é geralmente mais duro que a medula, eles podem ser facilmente distinguidos e separados.
- Corte o tecido do córtex ovariano nas formas desejadas (10 mm x 5 mm para transplante; punções de 2 mm x 2 mm para contagem de folículos viáveis antes e depois da vitrificação), conforme indicado na Figura 4A.
NOTA: Evite danificar o tecido pressionando com muita força e manuseie-o com cuidado. As amostras de tecido podem variar entre os pacientes.
- Corte o tecido do córtex ovariano nas formas desejadas (10 mm x 5 mm para transplante; punções de 2 mm x 2 mm para contagem de folículos viáveis antes e depois da vitrificação), conforme indicado na Figura 4A.
- Coloque um filtro de células no primeiro poço da placa de 6 poços com VS1. Equilibre o tecido do córtex ovariano por 5 min em 5 mL de VS1 no poço 1 da placa de 6 poços usando o filtro de células.
- Em seguida, mova o filtro de células com o tecido do córtex para o poço 2 contendo 5 mL de VS2 e equilibre por 5 min. Por fim, equilibrar-se por 6 min em 5 mL de VS3, conforme indicado na Figura 3 e na Tabela 1.
- Abra os crioviais preparados. Encha os frascos com nitrogênio líquido esterilizado e coloque-os no recipiente criogênico cheio de nitrogênio líquido. Carregue as amostras de tecido na grade metálica do dispositivo de vitrificação em 1 minuto (Figura 4B,C).
- Insira as amostras de tecido carregadas na grade de metal no nitrogênio líquido nos criogeniais baseados em grade preparados (Figura 4D).
NOTA: O congelamento rápido do tecido carregado na grade metálica é essencial para o sucesso deste método. Todos os trabalhos de cultura de tecidos descritos acima devem ser realizados em uma capela de fluxo laminar de Classe II. Limpe a bancada de fluxo laminar com um desinfetante de superfície usando luvas de laboratório descartáveis; Recomenda-se o uso de luvas sem pó.
- Insira as amostras de tecido carregadas na grade de metal no nitrogênio líquido nos criogeniais baseados em grade preparados (Figura 4D).
5. Preparação de meios de aquecimento rápido
- Prepare as soluções conforme indicado na Figura 5 e na Tabela 2. Pesar a sacarose para a solução de aquecimento rápido (RWS) e a solução de equilíbrio (ES) e transferi-la para o tubo. Adicione o meio de manipulação de oócitos (suplementado com albumina sérica humana pelo fabricante) usando uma pipeta sorológica e um auxiliar de pipetagem. Adicione SSS e sacarose conforme listado na Tabela 2.
- Feche os tubos e deixe-os agitar em um agitador até dissolver totalmente.
NOTA: Todos os trabalhos de cultura de tecidos descritos acima devem ser realizados em uma capela de fluxo laminar Classe II. Limpe a bancada de fluxo laminar com um desinfetante de superfície usando luvas de laboratório descartáveis; Recomenda-se o uso de luvas sem pó.
6. Preparação rápida do aquecimento
- Um dia antes do aquecimento rápido, prepare os consumíveis e descontamine-os usando luz ultravioleta na bancada de fluxo laminar: Prepare o béquer de amostra para RWS, a placa de 6 poços para ES, RS1 e RS2 e o béquer de amostra para transporte de tecido após aquecimento rápido. Coloque pinças descartáveis estéreis, equipamentos de pipetagem e outros consumíveis na bancada de fluxo laminar.
- Pré-aqueça uma placa de aquecimento a 37.2 °C. Incubar RWS a 37 °C durante pelo menos 1 h.
- Prepare uma placa estéril de 6 poços com 6 mL de ES, 6 mL de RS para "RS1" e outros 6 mL de RS para "RS2" na bancada de fluxo laminar. Consulte a Figura 5 para obter uma ilustração esquemática da placa de 6 poços. Deixe-os incubar em temperatura ambiente por 1 h antes de aquecer o tecido.
- Transferir o RWS para um copo de amostra estéril em condições estéreis e colocá-lo na placa de aquecimento. O RWS deve ser mantido a 37 °C.
NOTA: O aquecimento rápido requer uma taxa de aquecimento rápida. É crucial manter o RWS a 37 °C para garantir o sucesso da primeira etapa.
7. Aquecimento rápido do tecido ovariano
- Transportar os frascos criopreservados contendo tecido cortical ovariano vitrificado em nitrogênio líquido para a bancada de fluxo laminar. Abra os frascos enquanto estiverem parcialmente submersos em nitrogênio líquido. Mergulhe rapidamente a tela com o tecido vitrificado no RWS e deixe o tecido descansar por 1 min a 37 °C.
NOTA: Esta é a etapa mais crítica durante o aquecimento rápido e deve ser realizada sem demora. - Usando uma pinça estéril, transfira o tecido para o ES e incube-o por 3 min enquanto o agita suavemente em um agitador de balanço.
- Enxágue o tecido em temperatura ambiente por 10 minutos cada com RS1 e RS2 em um agitador de balanço, conforme indicado na Figura 5.
- Transfira o tecido aquecido para um copo de amostra estéril contendo 5 ml de solução de preservação para transplante de tecidos, que deve ser mantido a 4 °C para transporte para o local do transplante.
NOTA: Todos os trabalhos de cultura de tecidos descritos acima devem ser realizados em uma capela de fluxo laminar Classe II. Limpe a bancada de fluxo laminar com um desinfetante de superfície usando luvas de laboratório descartáveis; Recomenda-se o uso de luvas sem pó.
8. Determinação da viabilidade folicular
- Leve o dimetilsulfóxido (DMSO) à temperatura ambiente durante a noite para obter um estado líquido. Pipete 100 μL de DMSO em um frasco para injetáveis de calceína e ressuspenda para dissolver a calceína. Pipete 3 μL da calceína dissolvida no fundo de um tubo de 1,5 ml e armazene os frascos a -20 °C.
- Colocar 0,007 g de colagenase num tubo de 1,5 ml e conservá-lo a -20 °C.
- Adicione 997 μL de DPBS aos 3 μL de calceína pré-alicitados e congelados em um tubo de 1,5 mL e ressuspenda para dissolver a calceína. Adicione 0,007 g de colagenase para obter 1000 μL de solução de trabalho.
- Use 500 μL da solução de trabalho para digerir dois pedaços de fragmentos de córtex ovariano de 2 mm por 90 min a 37 ° C, protegidos da luz, em um prato de 4 poços. Após 60 min e 70 min, ressuspenda a solução repetidamente. Por fim, determinar a viabilidade folicular por meio de microscopia de fluorescência, conforme mostrado na Figura 6.
Resultados
Este protocolo apresenta os procedimentos para a preparação de meios de vitrificação, dispositivos de carregamento, vitrificação, preparação de meios de aquecimento rápido, aquecimento rápido e determinação da viabilidade folicular. Uma comparação direta da viabilidade folicular e fatores angiogênicos entre congelamento lento e vitrificação foi validada e publicada31,32.
O sucesso geral do protocolo de vitrificação descrito foi avaliado comparando a contagem de folículos vitais antes e depois da vitrificação/aquecimento rápido. A configuração experimental é mostrada na Figura 1 e os resultados são apresentados na Figura 6. Em 50 pacientes, foi observada uma contagem média de 77,98 folículos vitais antes da vitrificação e 62,99 após a vitrificação/aquecimento rápido, refletindo uma taxa de sobrevida de 80,8%. Isso não foi significativamente diferente de acordo com o teste de Wilcoxon33.
As grades metálicas são personalizadas individualmente com tesouras afiadas para um tamanho de 25 mm x 8 mm, que se encaixa nas tampas de criogenias de 1,8 mL, conforme mostrado na Figura 2A, C. Após a esterilização em autoclavagem a vapor, as grades e tampas dos frascos de 1,8 mL são montadas sob uma bancada de fluxo laminar, conforme indicado na Figura 2B. Essa configuração fornece uma fixação segura na tampa sem a necessidade de ações adicionais e oferece área suficiente para tecidos de vários tamanhos. Normalmente, pedaços de tecido de 5 mm x 10 mm para transplante e pedaços de 2 mm de diâmetro para avaliar a contagem de folículos vitais após o descongelamento rápido são vitrificados. Ambos os tamanhos se encaixam perfeitamente nas grades de metal.
O equilíbrio com soluções de vitrificação (VS1, VS2 e VS3) é conduzido em uma placa de 6 poços em um agitador de balanço à temperatura ambiente sob uma bancada de fluxo laminar, conforme mostrado na Figura 3. Os prazos do esquema garantem a absorção efetiva do crioprotetor etilenoglicol. Recomenda-se o uso de uma placa de 6 poços sobre vasos únicos, pois facilita o movimento rápido do tecido entre as soluções e ajuda a evitar confusões.
Para vitrificação vertical rápida em nitrogênio líquido, o tecido do córtex ovariano é cortado em pedaços adequados (Figura 4A). As amostras do córtex ovariano são colocadas em dispositivos de carregamento ( Figura 4B , C ) e submersas verticalmente em nitrogênio líquido ( Figura 4D ) para atingir um estado vítreo de agregação por meio de vitrificação. As grades metálicas escolhidas permitem o manuseio vertical do tecido, conforme mostrado na Figura 4D. Além disso, as grades metálicas são altamente condutoras termicamente, garantindo taxas de resfriamento rápidas de 22 °C a -196 °C, o que é uma etapa extremamente importante no processo de vitrificação.
Para aquecimento rápido, o RWS é preparado em um copo estéril a 37 ° C. ES, RS1 e RS2 são preparados em uma placa de 6 poços em um agitador à temperatura ambiente, conforme mostrado na Figura 5. O alto volume de RWS pré-aquecido evita que a solução esfrie excessivamente com a adição do tecido vitrificado e garante um ambiente consistentemente quente para o tecido durante todo o processo de aquecimento rápido.
Para avaliar e garantir altos padrões de qualidade, punções de biópsia de 2 mm x 2 mm são corados com calceína antes da vitrificação e após aquecimento rápido para determinar a viabilidade folicular usando microscopia de fluorescência34,35 (Figura 6). Os folículos viáveis emitem fluorescência verde a 495 nm após a captação intracelular de calceína. Alternativamente, a viabilidade folicular (Tabela 3) pode ser avaliada usando corantes vermelhos neutros36.
Seguindo as etapas descritas neste protocolo, o tecido ovariano é transformado em um estado vítreo de agregação, o que facilita altas taxas de sobrevivência após aquecimento rápido, conforme confirmado por microscopia de fluorescência.
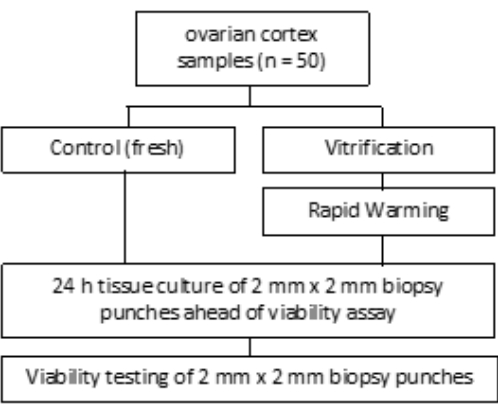
Figura 1: Desenho do estudo. Amostras corticais ovarianas de 50 pacientes foram examinadas antes (frescas) e depois da vitrificação e aquecimento rápido para o número de folículos viáveis. Para cada grupo, dois pedaços de tecido de 2 mm de diâmetro foram cultivados por 24 h antes da avaliação da contagem de folículos. O tecido foi digerido com colagenase e corado com calceína para avaliar a viabilidade. O número de folículos viáveis foi determinado usando um microscópio. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação dos dispositivos de carregamento. As grades metálicas foram cortadas no tamanho de 8 mm x 25 mm (A). As grades metálicas personalizadas foram esterilizadas em autoclave (B). As grades metálicas esterilizadas foram então inseridas em tampas de frascos de 1,8 mL, prontas para uso (C). Clique aqui para ver uma versão maior desta figura.
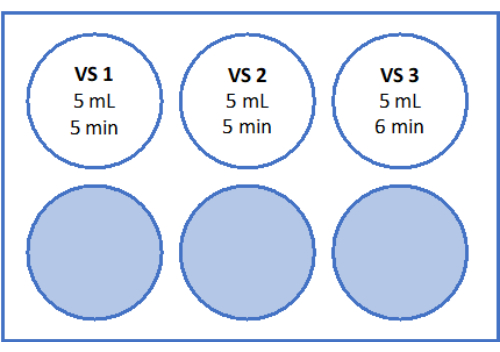
Figura 3: Preparação de soluções de vitrificação. As soluções de vitrificação (VS) foram preparadas e transferidas para uma placa de 6 poços. Os poços mostram o volume de cada solução e os tempos de incubação individuais utilizados no protocolo de vitrificação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Processamento e vitrificação do córtex ovariano. O tecido do córtex ovariano foi processado para criopreservação removendo a medula e cortando o tecido em pedaços de 5 mm x 10 mm (A). Após a incubação nas soluções de vitrificação mostradas na Figura 3, o tecido foi carregado no dispositivo de carga de vitrificação (B,C). Para vitrificação vertical rápida de amostras de córtex ovariano, as tampas com o tecido carregado foram rapidamente inseridas em nitrogênio líquido esterilizado (D). Clique aqui para ver uma versão maior desta figura.
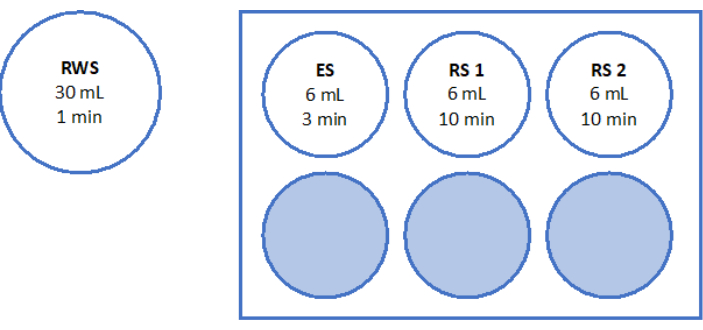
Figura 5: Preparação de soluções de aquecimento rápido. Solução de aquecimento rápido (RWS), solução de equilíbrio (ES) e soluções de enxágue (RS) 1 e 2 foram preparadas e transferidas para uma placa de 6 poços. Os recipientes e poços mostram o volume de cada solução e os tempos de incubação correspondentes. Observe que o RWS é mantido a 37,2 ° C em uma placa de aquecimento. Clique aqui para ver uma versão maior desta figura.
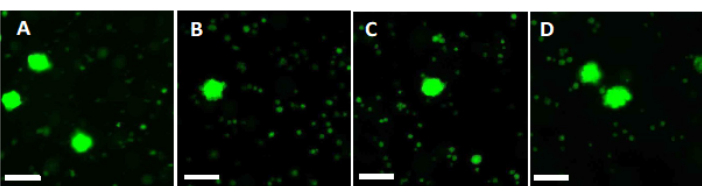
Figura 6: Contagem de viabilidade. Para avaliar o número de folículos viáveis, pedaços de tecido de 2 mm de diâmetro foram digeridos com colagenase e corados com calceína. As imagens representativas mostram (A) coloração de calceína de 3 folículos recuperados antes da vitrificação. (B) Um folículo viável recuperado após vitrificação e aquecimento rápido. (C) Um folículo viável recuperado antes do congelamento lento. (D) Folículos viáveis recuperados após congelamento e descongelamento lentos. A viabilidade folicular é indicada pela calceína, um corante fluorescente verde que emite fluorescência verde quando convertido enzimaticamente por células viáveis a 495 nm. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.
| VS 1 (15 mL) | Etilenoglicol | 10% | 1,5 mL |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 12 mL | ||
| VS 2 (15 mL) | Etilenoglicol | 20% | 3 mL |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | 10,5 mL | ||
| VS 3 (15 mL) | Etilenoglicol | 35% | 5,25 mL |
| SSS | 10% | 1,5 mL | |
| Sacarose | 0,5 mol/L | 2,57 gramas | |
| PVP | 5 % (m/v) | 0,75 g | |
| G-MOPS+ | ad 15 mL |
Tabela 1: Composição das soluções de vitrificação (VS).
| RWS (30 mL) | Sacarose | 0,8 mol/L | |
| 8,22 gramas | |||
| SSS | 10% | 3 mL | |
| G-MOPS+ | ad 30 mL | ||
| ES (15 mL) | Sacarose | 0,4 mol/L | 2,05 gramas |
| SSS | 10% | 1,5 mL | |
| G-MOPS+ | ad 15 mL | ||
| RS 1 e 2 (15 mL) | SSS | 10% | 1,5 mL |
| G-MOPS+ | ad 15 mL |
Tabela 2: Composição da solução de aquecimento rápido (RWS), solução de equilíbrio (ES) e soluções de enxágue (RS). Esta tabela fornece os componentes e concentrações para a solução de aquecimento rápido (RWS), solução de equilíbrio (ES) e soluções de enxágue (RS) usadas no processamento pós-vitrificação.
| Parâmetro | Fresco | Intervalo | Rápido aquecido após vitrificação | Intervalo | n | *Valor de p |
| SD | SD | |||||
| Contagem de viabilidade folicular [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Teste de Wilcoxon |
Tabela 3: Resultados representativos da viabilidade folicular. Esta tabela apresenta os resultados das avaliações de viabilidade folicular antes da criopreservação e após o aquecimento rápido. Dois pedaços de tecido de 2 mm de diâmetro por paciente foram usados para contar o número de folículos viáveis antes e depois da vitrificação/aquecimento rápido. Amostras de tecido pareadas de 50 pacientes foram analisadas usando o teste de Wilcoxon.
Discussão
Aqui, é apresentado um protocolo para vitrificação de alto rendimento do tecido do córtex ovariano humano, adequado para a rotina clínica. Semelhante à vitrificação de oócitos ou embriões, a aplicação bem-sucedida do procedimento requer o cumprimento detalhado do protocolo relativo à temperatura das soluções de vitrificação e aquecimento, bem como ao período de equilíbrio. A conformidade com as directivas da UE relativas aos tecidos37 relativas à qualidade do ar e à esterilidade é também essencial.
O procedimento de vitrificação resulta em um estado não cristalino, amorfo ou vítreo. No geral, a vitrificação é um processo versátil com implicações significativas em vários domínios científicos e tecnológicos. O principal benefício da vitrificação é sua capacidade de converter o tecido em um estado vítreo, evitando assim a formação de cristais de gelo 38,39,40, que pode afetar negativamente a integridade do tecido e seus componentes.
A suplementação de agentes crioprotetores (CPAs) com polivinilpirrolidona (PVP) permite uma redução na concentração de CPA sem comprometer a qualidade das soluções de vitrificação41,42. Além disso, o uso de grades metálicas fornece alta condutividade térmica em comparação com sistemas de suporte à base de plástico. A estrutura da grade também facilita a adesão da superfície, garantindo a criopreservação segura de amostras de tecido e pequenos punções de córtex para medidas de qualidade. Se forem usados vasos criogênicos de outros fabricantes, é importante testar o tamanho das grades de metal com antecedência para garantir a estabilidade e a aderência adequada dentro da tampa do recipiente criogênico, bem como um bom ajuste no recipiente.
As etapas críticas para garantir a vitrificação bem-sucedida incluem vitrificação rápida imergindo o tecido em nitrogênio líquido esterilizado e realizando um aquecimento rápido sem demora para evitar resultados adversos. Em termos de custo-efetividade, a vitrificação de tecidos é menos exigente em comparação com o procedimento de congelamento lento, o que pode influenciar o planejamento da implantação de pessoal. Além disso, a vitrificação elimina a necessidade de compra e manutenção de equipamentos necessários para congelamento lento.
Medidas biológicas e meta-análises demonstraram a comparabilidade ou mesmo as vantagens da vitrificação em comparação com o congelamento lento43. No entanto, as diferenças nos resultados após a vitrificação podem ser atribuídas à falta de padronização tanto no dispositivo de vitrificação quanto no protocolo, incluindo as soluções utilizadas, que variam entre os estudos. Pesquisas futuras devem explorar o potencial da cultura de folículos de tecido vitrificado / aquecido rapidamente para monitorar o crescimento in vitro, conforme demonstrado com sucesso em tecido ovariano de camundongo por vários grupos 44,45,46,47,48,49,50.
Em resumo, a vitrificação do tecido ovariano é uma alternativa significativa ao protocolo de congelamento lento amplamente utilizado, apoiado por cinco partos bem-sucedidos relatados por Suzuki51 (Japão), Silber52 (EUA) e Sänger53 (Alemanha). Em contraste com os meios de vitrificação e kits comercialmente disponíveis para células, existem poucos sistemas aprovados pela FDA / CE para tecido ovariano, o que pode limitar sua aplicação em ambientes clínicos. Portanto, recomenda-se o desenvolvimento de kits e meios aprovados pela FDA/CE para vitrificação e aquecimento rápido do tecido ovariano30.
Divulgações
Nenhum.
Agradecimentos
Agradecemos a Cara Färber pela revisão; Katharina Wollersheim, Martin Mahlberg, Lea Korte e Jasmin Rebholz pela assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Referências
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados