Method Article
Camsı bir agregasyon durumu elde etmek için yumurtalık korteks dokusunun vitrifikasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Yaygın olarak kullanılan yavaş dondurma protokolüne alternatif bir kriyoprezervasyon yöntemi olarak yumurtalık dokusunun vitrifikasyonu için bir protokol sunulmaktadır.
Özet
Yumurtalık dokusu kriyoprezervasyonu (OTC) fertilitenin korunması için önemli bir seçenektir. Gonadotoksik tedavileri ertelenemeyen hastalar veya ergenlik öncesi kızlar için, doğurganlığın korunması için genellikle tek seçenektir. Kriyoprezervasyon, vitrifikasyon veya yavaş dondurma ile gerçekleştirilebilir. Yavaş dondurma şu anda standart yaklaşımdır. Artan sayıda çalışma, vitrifikasyonun son teknoloji in vitro fertilizasyon (IVF) laboratuvarlarında yavaş dondurmanın yerini alabileceğini, çözülme sağkalım oranlarını önemli ölçüde iyileştirdiğini ve kriyoprezervasyonun teknik yönlerini basitleştirdiğini göstermektedir. Over korteks dokusunun hızlı vitrifikasyonu için klinik rutine uygun, metal ızgara tabanlı, yüksek verimli bir protokol tanımlanmıştır. Metal ızgaraların ve sıvı nitrojenin sterilizasyonu, iyi üretim uygulamaları (GMP) standartlarını karşılayan yüksek kalite sağlar. Ultra hızlı soğutma hızlarını sağlamak için vitrifikasyon yapıldı. Yavaşça çözülmek yerine, numuneler hızla ısıtıldı. Foliküler canlılığı değerlendirmek için, hem kriyoprezervasyondan önce hem de hızlı ısınmadan sonra kalsein boyaması yapıldı. Metal ızgaralar kullanılarak vitrifikasyon ve hızlı ısınmanın başarılı bir şekilde uygulandığı bildirilmiştir. Vitrifikasyondan önce ve hızlı ısınmadan sonra foliküler canlılıkta önemli bir fark gözlenmedi. Bu sonuçlar, yaygın olarak kullanılan yavaş dondurma yönteminin potansiyel bir ikamesi olarak klinik rutin uygulamalar için doku vitrifikasyonunun yüksek kapasitesini doğrulamaktadır.
Giriş
Yumurtalık dokusunun dondurularak saklanması fertilitenin korunması için önemli bir seçenektir. Oositlerin gömülü olduğu yumurtalık foliküllerini içeren ekilen doku kriyoprezervasyonla saklanır. Depolamadan sonra, yumurtalık dokusu çözülebilir, ısıtılabilir ve hastaya yeniden implante edilebilir. Canlı hücreler veya dokular için iki kriyoprezervasyon yöntemi mevcuttur: yavaş dondurma ve vitrifikasyon1.
Vitrifikasyon, embriyolar ve oositler gibi biyolojik materyalleri korumak için kullanılır ve yavaş dondurma protokolü 1,2,3,4'e kıyasla daha üstün hayatta kalma oranları ile kullanılır. Yavaş dondurmanın, hücre ve doku yapılarına potansiyel olarak zarar verebilecek buz kristali oluşumu gibi sınırlamaları vardır. Bununla birlikte, yavaş dondurma, biyolojik numunelerin uzun süreli saklanmasını kolaylaştıran önemli bir kriyoprezervasyon yaklaşımıdır ve bu yöntemin işlevselliği geniş çapta kanıtlanmıştır5. Vitrifikasyon, buz kristali oluşumunu önleyerek camsı bir agregasyon durumuna neden olur 6,7. Teknik düzeyde, vitrifikasyon, ekipman bakımını azaltarak, teknik hata olasılığını azaltarak ve kriyoprezervasyon işleminin süresini kısaltarak kriyoprezervasyon prosedürünü önemli ölçüde basitleştirir 8,9. Kadın fertilitesinin korunmasında, yumurtalık dokusunun kriyoprezervasyonu kanser tedavisinden önce belirleyici bir yaklaşımdır10. Farklı gruplar, şu anda standart yaklaşım15 olarak kabul edilen yavaş dondurma protokolü 11,12,13,14'e dayalı olarak dokunun kriyoprezervasyonu, çözülmesi ve nakli kavramını başarıyla göstermiştir.
Over dokusunun vitrifikasyonu, kaynak tasarrufu 22, foliküler sağkalım oranları, DNA fragmantasyon seviyeleri ve dengeli anjiyojenik potansiyel23,24,25,26,27 açısından umut verici bir alternatif yöntem 16,17,18,19,20,21 olarak kabul edilmektedir. Bu, Japonya28, ABD29 ve Almanya30'daki başarılı teslimatlarla doğrulanmaktadır.
Yumurtalık dokusu kriyoprezervasyon (OTC) - vitrifikasyon için iki seçeneğin standart yavaş dondurma prosedürü ile karşılaştırılması, mevcut meta-analizlerde kısmen çelişkilidir16. Mevcut vitrifikasyon protokolleri büyük ölçüde değiştiği için buna çeşitli faktörler katkıda bulunmuş olabilir. Bu farklılıklar, kriyoprotektan veya koruyucuların kombinasyonunun seçimini, konsantrasyonlarını, OTC ortamının bileşimini, doku parçalarının boyutunu ve doku taşıyıcı olarak kullanılan cihazı içerir. Buna göre, standart bir ısınma protokolü yoktur.
Yazarlar, kullanım, canlılık, apoptoz başlangıcı, anjiyojenik faktörlerin salınımı ve hatta reimplantasyon sonrası doğum raporu açısından ikna edici sonuçlar veren bir yöntem bulduklarıiçin 9,27, protokolün çok ayrıntılı bir açıklaması sağlanmaktadır. Tarif edilen yöntem, yumurtalık dokusunun vitrifikasyonunun standardizasyonuna katkıda bulunabilecek geçerli ve etkili bir protokol sunmaktadır.
Protokol
Çalışma, Bonn Üniversite Hastanesi etik kurul tarafından onaylanmıştır (007/09). Her hastadan yazılı bilgilendirilmiş onam alındı. Çalışma grubu, Şekil 1'de belirtildiği gibi, kriyoprezervasyondan önce ortalama yaşı 27.4 olan 50 hastadan alınan insan yumurtalık dokusunu içeriyordu. Bu çalışmada kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir.
1. Yükleme cihazlarının hazırlanması
- Özelleştirme için cerrahi makas ve metal ağlar hazırlayın. Kafesleri Şekil 25A'da gösterildiği gibi 8 mm x 2 mm ölçülerinde şeritler halinde kesin.
- Özelleştirilmiş metal ağları bir sterilizasyon kabına yerleştirin ve 2 saat otoklavlayın (Şekil 2B). Otoklavlamadan sonra sterilizasyon kabını ve 1,8 mL'lik şişeleri laminer akış tezgahının altına yerleştirin.
- 254 nm dalga boyunda ek sterilizasyon için laminer akış tezgahının ultraviyole (UV) ışınlamasını 30 dakika boyunca açın.
- Sterilizasyon kabını açın, metal ızgaraları çıkarın ve Şekil 2C'de gösterildiği gibi 1,8 mL'lik şişelerin kapaklarına yerleştirin. 1,8 mL'lik şişeleri kapatın.
NOT: Yukarıda açıklanan tüm doku kültürü çalışmaları, Sınıf II laminer akış başlığında gerçekleştirilmelidir. Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir yüzey dezenfektanı ile temizleyin; Pudrasız eldivenler tavsiye edilir.
2. Vitrifikasyon ortamının hazırlanması
- Vitrifikasyon Solüsyonu 1 (VS1), Vitrifikasyon Solüsyonu 2 (VS2) ve Vitrifikasyon Solüsyonu 3 (VS3) için bir serolojik 10 mL pipet, bir elektronik pipet yardımcısı ve üç adet 50 mL tüp hazırlayın ve ayrıca hazırlama tarihini kaydedin. Ek sterilizasyon için laminer akış tezgahının ultraviyole (UV) radyasyonunu açın.
- VS1 (15 mL) için, 12 mL oosit işleme ortamını (üretici tarafından insan serum albümini ile desteklenmiş), 1.5 mL SSS (Serum İkame Eki) ve 1.5 mL etilen glikolü 50 mL'lik bir tüpe pipetleyin.
- VS2 (15 mL) için, 10.5 mL oosit işleme ortamını (üretici tarafından insan serum albümini ile desteklenmiş), 3 mL etilen glikol ve 1.5 mL SSS'yi 50 mL'lik bir tüpe pipetleyin.
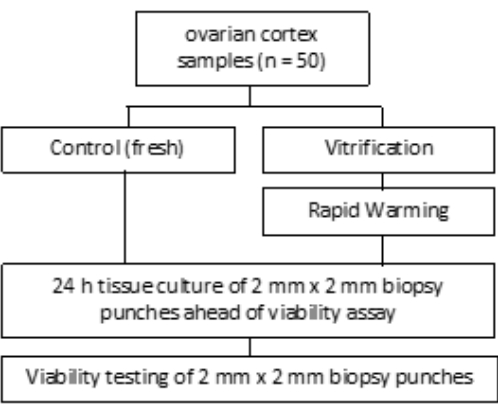
- VS3 için, 8.5 mL oosit işleme ortamını (üretici tarafından insan serum albümini ile desteklenmiş), 5.25 mL etilen glikolü pipetleyin ve 50 mL'lik bir tüpe 2.57 g sükroz ve 0.75 g Polivinilpirolidon (PVP) ekleyin. Ayrıntılar için Şekil 3'e bakın. Tüm çözeltileri 3.000 rpm'de girdaplayarak karıştırın.
NOT: Yukarıda açıklanan tüm doku kültürü çalışmaları, Sınıf II laminer akış başlığında gerçekleştirilmelidir. Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir dezenfektanla temizleyin; Pudrasız eldivenler tavsiye edilir.
3. Vitrifikasyon hazırlığı
- Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir yüzey dezenfektanı ile temizleyin; Pudrasız eldivenler tavsiye edilir.
- Bir adet 6 oyuklu plaka, bir hücre süzgeci, bir neşter, cımbız, bir adet 2 mm biyopsi zımbası ve iki adet 90 mm yuvarlak tabanlı tabak hazırlayın. Ayrıca, ortam hazırlayın: doku nakli ve VS1-3 için koruma çözeltisi. Her soğutulmuş çözeltiden (VS1-3) 5 mL ayrı kuyucuklara pipetleyin ve çözeltilerin oda sıcaklığına ulaşması için 30 dakika bekleyin.
- Sıvı nitrojeni otomatik bir UV ışınlama sistemi ile sterilize edin; alternatif olarak, laminer akış başlığının UV ışınlamasını 120 dakika boyunca kullanın.
4. Dokunun vitrifikasyonu
- Medullayı çıkararak yumurtalık korteks dokusunu hazırlayın. Korteks genellikle medulladan daha sert olduğu için kolayca ayırt edilebilir ve ayrılabilirler.
- Yumurtalık korteks dokusunu Şekil 4A'da gösterildiği gibi istenen şekillerde kesin (transplantasyon için 10 mm x 5 mm; vitrifikasyondan önce ve sonra canlı folikül sayımı için 2 mm x 2 mm zımbalar).
NOT: Çok sert bastırarak dokuya zarar vermekten kaçının ve dikkatli bir şekilde tutun. Doku örnekleri hastalar arasında farklılık gösterebilir.
- Yumurtalık korteks dokusunu Şekil 4A'da gösterildiği gibi istenen şekillerde kesin (transplantasyon için 10 mm x 5 mm; vitrifikasyondan önce ve sonra canlı folikül sayımı için 2 mm x 2 mm zımbalar).
- VS1 ile 6 oyuklu plakanın ilk kuyusuna bir hücre süzgeci yerleştirin. Hücre süzgecini kullanarak yumurtalık korteks dokusunu 5 oyuklu plakanın 1'inde 5 mL VS1'de 6 dakika boyunca dengeleyin.
- Daha sonra, hücre süzgecini korteks dokusu ile 5 mL VS2 içeren kuyu 2'ye taşıyın ve 5 dakika dengeleyin. Son olarak, Şekil 3 ve Tablo 1'de gösterildiği gibi 5 mL VS3'te 6 dakika dengeleyin.
- Hazırlanan kriyoviyalleri açın. Şişeleri sterilize edilmiş sıvı nitrojen ile doldurun ve sıvı nitrojenle doldurulmuş kriyo dewar kabına yerleştirin. Doku örneklerini 1 dakika içinde vitrifikasyon cihazının metal ızgarasına yükleyin (Şekil 4B,C).
- Metal ızgaraya yüklenen doku örneklerini hazırlanan ızgara bazlı kriyoviyallerdeki sıvı nitrojene yerleştirin (Şekil 4D).
NOT: Metal ızgara üzerine yüklenen dokunun hızlı bir şekilde dondurulması bu yöntemin başarısı için şarttır. Yukarıda tarif edilen tüm doku kültürü çalışmaları, Sınıf II laminer akış başlığında gerçekleştirilmelidir. Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir yüzey dezenfektanı ile temizleyin; Pudrasız eldivenler tavsiye edilir.
- Metal ızgaraya yüklenen doku örneklerini hazırlanan ızgara bazlı kriyoviyallerdeki sıvı nitrojene yerleştirin (Şekil 4D).
5. Hızlı ısınma ortamının hazırlanması
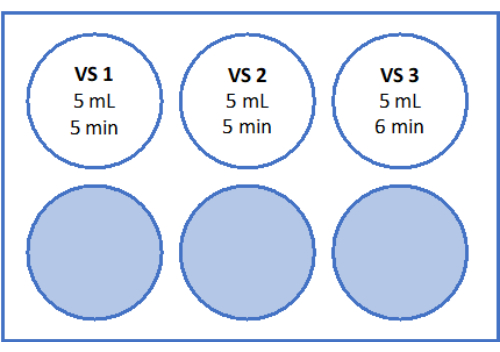
- Çözeltileri Şekil 5 ve Tablo 2'de belirtildiği gibi hazırlayın. Hızlı ısınma çözeltisi (RWS) ve dengeleme çözeltisi (ES) için sükrozu tartın ve tüpe aktarın. Serolojik bir pipet ve pipetleme yardımcısı kullanarak oosit işleme ortamını (üretici tarafından insan serum albümini ile desteklenmiş) ekleyin. Tablo 2'de listelendiği gibi SSS ve sükroz ekleyin.
- Tüpleri kapatın ve tamamen eriyene kadar yuvarlanan bir çalkalayıcı üzerinde çalkalamaya bırakın.
NOT: Yukarıda açıklanan tüm doku kültürü çalışmaları, Sınıf II laminer akış başlığında gerçekleştirilmelidir. Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir yüzey dezenfektanı ile temizleyin; Pudrasız eldivenler tavsiye edilir.
6. Hızlı ısınma hazırlığı
- Hızlı ısınmadan bir gün önce, sarf malzemelerini hazırlayın ve laminer akış tezgahında UV ışığı kullanarak dekontamine edin: RWS için numune beherini, ES, RS1 ve RS2 için 6 oyuklu plakayı ve hızlı ısınmadan sonra doku nakliyesi için numune kabını hazırlayın. Steril, tek kullanımlık cımbızları, pipetleme ekipmanlarını ve diğer sarf malzemelerini laminer akış tezgahına yerleştirin.
- Bir ısıtma plakasını önceden 37,2 °C'ye ısıtın. RWS'yi 37 °C'de en az 1 saat inkübe edin.
- Laminer akış tezgahında 6 mL ES, "RS1" için 6 mL RS ve "RS2" için 6 mL RS içeren steril 6 oyuklu bir plaka hazırlayın. 5 kuyucuklu plakanın şematik bir çizimi için Şekil 6'e bakın. Dokuyu ısıtmadan önce bunların oda sıcaklığında 1 saat inkübe etmesine izin verin.
- RWS'yi steril koşullar altında steril bir numune kabına aktarın ve ısıtma plakasına yerleştirin. RWS 37 °C'de tutulmalıdır.
NOT: Hızlı ısınma, hızlı bir ısınma oranı gerektirir. İlk adımın başarısını sağlamak için RWS'yi 37 °C'de tutmak çok önemlidir.
7. Yumurtalık dokusunun hızlı ısınması
- Sıvı nitrojen içinde vitrifiye yumurtalık kortikal dokusu içeren dondurularak saklanmış şişeleri laminer akış tezgahına taşıyın. Şişeleri kısmen sıvı nitrojen altına batırılmış durumdayken açın. Vitrifiye doku ile ağı hızla RWS'ye daldırın ve dokunun 37 ° C'de 1 dakika orada oturmasına izin verin.
NOT: Bu, hızlı ısınma sırasındaki en kritik adımdır ve herhangi bir gecikme olmaksızın gerçekleştirilmelidir. - Steril forseps kullanarak, dokuyu ES'ye aktarın ve sallanan bir çalkalayıcı üzerinde hafifçe sallarken 3 dakika inkübe edin.
- Dokuyu oda sıcaklığında 10 dakika boyunca RS1 ve RS2 ile Şekil 5'te gösterildiği gibi sallanan bir çalkalayıcı üzerinde durulayın.
- Isıtılmış dokuyu, nakil bölgesine taşınması için 4 ° C'de tutulması gereken, doku nakli için 5 mL koruma solüsyonu içeren steril bir numune kabına aktarın.
NOT: Yukarıda açıklanan tüm doku kültürü çalışmaları, Sınıf II laminer akış başlığında gerçekleştirilmelidir. Tek kullanımlık laboratuvar eldivenleri giyerken laminer akış tezgahını bir yüzey dezenfektanı ile temizleyin; Pudrasız eldivenler tavsiye edilir.
8. Foliküler canlılığın belirlenmesi
- Sıvı bir hal elde etmek için dimetil sülfoksiti (DMSO) gece boyunca oda sıcaklığına getirin. 100 μL DMSO'yu bir kalsein şişesine pipetleyin ve kalsiyi çözmek için yeniden süspanse edin. 3 μL çözünmüş kalseini 1,5 mL'lik bir tüpün dibine pipetleyin ve şişeleri -20 °C'de saklayın.
- 0,007 g kollajenazı 1,5 mL'lik bir tüpe koyun ve -20 °C'de saklayın.
- 1.5 mL'lik bir tüpte önceden ayrılmış ve dondurulmuş 3 μL kalseine 997 μL DPBS ekleyin ve kalseini çözmek için yeniden süspanse edin. 1000 μL'lik bir çalışma çözeltisi elde etmek için 0.007 g kollajenaz ekleyin.
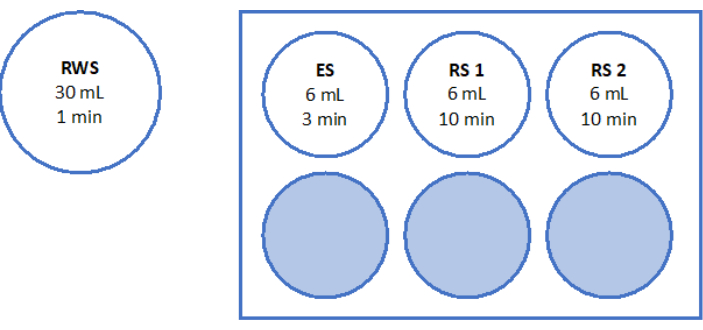
- 4 oyuklu bir tabakta 37 ° C'de 90 dakika boyunca ışıktan korunmuş iki parça 2 mm yumurtalık korteks parçasını sindirmek için 500 μL çalışma solüsyonu kullanın. 60 dakika ve 70 dakika sonra, çözeltiyi tekrar tekrar askıya alın. Son olarak, Şekil 6'da gösterildiği gibi floresan mikroskobu ile foliküler canlılığı belirleyin.
Sonuçlar
Bu protokolde vitrifikasyon ortamının hazırlanması, yükleme cihazları, vitrifikasyon, hızlı ısınma ortamının hazırlanması, hızlı ısınma ve foliküler canlılığın belirlenmesi ile ilgili prosedürler sunulmaktadır. Yavaş dondurma ve vitrifikasyon arasındaki foliküler canlılık ve anjiyojenik faktörlerin doğrudan bir karşılaştırması doğrulanmış ve yayınlanmıştır31,32.
Tarif edilen vitrifikasyon protokolünün genel başarısı, vitrifikasyon/hızlı ısınma öncesi ve sonrası hayati folikül sayısı karşılaştırılarak değerlendirildi. Deney düzeneği Şekil 1'de gösterilmiştir ve sonuçlar Şekil 6'da sunulmuştur. 50 hastada, vitrifikasyondan önce ortalama 77.98 hayati folikül sayısı ve vitrifikasyon/hızlı ısınmadan sonra 62.99 gözlendi, bu da %80.8'lik bir sağkalım oranını yansıtıyordu. Bu, Wilcoxon testi33'e göre önemli ölçüde farklı değildi.
Metal ızgaralar, Şekil 2A,C'de gösterildiği gibi, 1,8 mL kriyofilonların kapaklarına uyan 25 mm x 8 mm boyutunda keskin makaslarla ayrı ayrı özelleştirilir. Buharlı otoklavlama kullanılarak sterilizasyondan sonra, 1.8 mL'lik şişelerin ızgaraları ve kapakları, Şekil 2B'de gösterildiği gibi bir laminer akış tezgahı altına monte edilir. Bu kurulum, ek işlemlere gerek kalmadan kapakta güvenli bir tutuş sağlar ve çeşitli boyutlardaki dokular için yeterli alan sunar. Tipik olarak, transplantasyon için 5 mm x 10 mm'lik doku parçaları ve hızlı çözülme sonrası hayati folikül sayısını değerlendirmek için 2 mm çapında parçalar vitrifiye edilir. Her iki boyut da metal ızgaralara mükemmel uyum sağlar.
Vitrifikasyon çözeltileri (VS1, VS2 ve VS3) ile dengeleme, Şekil 3'te gösterildiği gibi, bir laminer akış tezgahı altında oda sıcaklığında sallanan bir çalkalayıcı üzerinde 6 oyuklu bir plakada gerçekleştirilir. Şemadaki zaman çerçeveleri, kriyoprotektan etilen glikolün etkili bir şekilde alınmasını sağlar. Dokunun solüsyonlar arasında hızlı hareketini kolaylaştırdığı ve karışıklıkları önlemeye yardımcı olduğu için tek damarlar üzerinde 6 oyuklu bir plaka kullanılması önerilir.
Sıvı nitrojende hızlı vertikal vitrifikasyon için over korteks dokusu uygun parçalara ayrılır (Şekil 4A). Yumurtalık korteks örnekleri, yükleme cihazlarına yerleştirilir (Şekil 4B,C) ve vitrifikasyon yoluyla camsı bir agregasyon durumu elde etmek için dikey olarak sıvı nitrojene daldırılır (Şekil 4D). Seçilen metal ızgaralar, Şekil 4D'de gösterildiği gibi dokunun dikey olarak işlenmesine izin verir. Ek olarak, metal ızgaralar termal olarak oldukça iletkendir ve vitrifikasyon işleminde kritik öneme sahip bir adım olan 22 °C ile -196 °C arasında yüksek soğutma hızları sağlar.
Hızlı ısınma için RWS, 37 °C'de steril bir kapta hazırlanır. ES, RS1 ve RS2, Şekil 5'te gösterildiği gibi, oda sıcaklığında sallanan bir çalkalayıcı üzerinde 6 oyuklu bir plakada hazırlanır. Yüksek hacimde önceden ısıtılmış RWS, vitrifiye dokusunun eklenmesi üzerine çözeltinin aşırı soğumasını önler ve hızlı ısınma süreci boyunca doku için sürekli olarak sıcak bir ortam sağlar.
Yüksek kalite standartlarını değerlendirmek ve sağlamak için, floresan mikroskobu34,35 kullanılarak foliküler canlılığı belirlemek için vitrifikasyondan önce ve hızlı ısınmadan sonra 2 mm x 2 mm biyopsi zımbaları kalsein ile boyanır (Şekil 6). Canlı foliküller, hücre içi kalsein alımından sonra 495 nm'de yeşil floresan yayar. Alternatif olarak, foliküler canlılık (Tablo 3) nötr kırmızı boyalar36 kullanılarak değerlendirilebilir.
Bu protokolde açıklanan adımları izleyerek, yumurtalık dokusu, floresan mikroskobu ile onaylandığı gibi, hızlı ısınmadan sonra yüksek hayatta kalma oranlarını kolaylaştıran camsı bir toplanma durumuna dönüştürülür.
Şekil 1: Çalışma tasarımı. 50 hastadan alınan yumurtalık kortikal örnekleri, canlı folikül sayısı için vitrifikasyon ve hızlı ısınma öncesi (taze) ve sonrası incelendi. Her grup için, folikül sayımı değerlendirmesinden önce 24 saat boyunca 2 mm çapında iki doku parçası kültürlendi. Doku kollajenaz ile sindirildi ve canlılığı değerlendirmek için kalsein ile boyandı. Canlı folikül sayısı mikroskop kullanılarak belirlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Yükleme cihazlarının hazırlanması. Metal ızgaralar 8 mm x 25 mm (A) boyutunda kesildi. Özelleştirilmiş metal ızgaralar otoklavlama (B) ile sterilize edildi. Sterilize edilmiş metal ızgaralar daha sonra kullanıma hazır (C) 1.8 mL'lik şişelerin kapaklarına yerleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: Vitrifikasyon solüsyonlarının hazırlanması. Vitrifikasyon çözeltileri (VS) hazırlandı ve 6 oyuklu bir plakaya aktarıldı. Kuyucuklar, vitrifikasyon protokolünde kullanılan her bir çözeltinin hacmini ve bireysel inkübasyon sürelerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Yumurtalık korteksinin işlenmesi ve vitrifikasyonu. Over korteks dokusu, medulla çıkarılarak ve doku 5 mm x 10 mm'lik parçalar halinde kesilerek dondurularak işlendi (A). Şekil 3'te gösterilen vitrifikasyon solüsyonlarında inkübasyondan sonra, doku vitrifikasyon yükleme cihazına (B,C) yüklendi. Yumurtalık korteks örneklerinin hızlı bir şekilde dikey vitrifikasyonu için, yüklü dokuya sahip kapaklar hızlı bir şekilde sterilize edilmiş sıvı nitrojen (D) içine yerleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Hızlı ısınma çözeltilerinin hazırlanması. Hızlı ısınma çözeltisi (RWS), dengeleme çözeltisi (ES) ve durulama çözeltileri (RS) 1 ve 2 hazırlandı ve 6 oyuklu bir plakaya aktarıldı. Kaplar ve kuyular, her bir çözeltinin hacmini ve karşılık gelen inkübasyon sürelerini gösterir. RWS'nin bir ısıtma plakası üzerinde 37.2 °C'de tutulduğunu unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
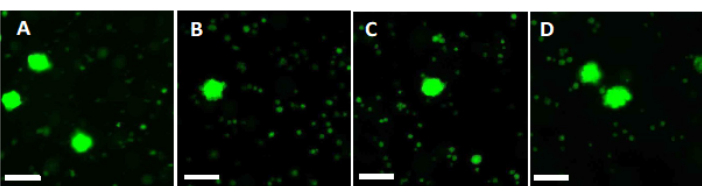
Şekil 6: Canlılık sayısı. Canlı folikül sayısını değerlendirmek için 2 mm çapındaki doku parçaları kollajenaz ile sindirildi ve kalsein ile boyandı. Temsili görüntüler, vitrifikasyondan önce kurtarılan 3 folikülün (A) kalsein boyamasını göstermektedir. (B) Vitrifikasyon ve hızlı ısınmadan sonra geri kazanılmış canlı bir folikül. (C) Yavaş dondurmadan önce geri kazanılmış canlı bir folikül. (D) Yavaş dondurma ve çözme işleminden sonra geri kazanılan canlı foliküller. Foliküler canlılık, 495 nm'de canlı hücreler tarafından enzimatik olarak dönüştürüldüğünde yeşil floresan yayan yeşil bir floresan boya olan kalsein ile gösterilir. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| VS 1 (15 mL) | Etilen glikol | 10% | 1,5 mL |
| Sıkça Sorulan T | 10% | 1,5 mL | |
| G-PASPASLAR+ | 12 mL | ||
| VS 2 (15 mL) | Etilen glikol | 20% | 3 mL |
| Sıkça Sorulan T | 10% | 1,5 mL | |
| G-PASPASLAR+ | 10,5 mL | ||
| VS 3 (15 mL) | Etilen glikol | 35% | 5.25 mL |
| Sıkça Sorulan T | 10% | 1,5 mL | |
| Sakaroz | 0,5 mol/L | 2.57 gr | |
| PVP | 5 % (a/h) | 0.75 gr | |
| G-PASPASLAR+ | reklam 15 mL |
Tablo 1: Vitrifikasyon çözeltilerinin bileşimi (VS).
| RWS (30 mL) | Sakaroz | 0,8 mol/L | |
| 8.22 gr | |||
| Sıkça Sorulan T | 10% | 3 mL | |
| G-PASPASLAR+ | reklam 30 mL | ||
| ES (15 mL) | Sakaroz | 0,4 mol/L | 2.05 gr |
| Sıkça Sorulan T | 10% | 1,5 mL | |
| G-PASPASLAR+ | reklam 15 mL | ||
| RS 1 ve 2 (15 mL) | Sıkça Sorulan T | 10% | 1,5 mL |
| G-PASPASLAR+ | reklam 15 mL |
Tablo 2: Hızlı ısınma çözeltisi (RWS), dengeleme çözeltisi (ES) ve durulama çözeltilerinin (RS) bileşimi. Bu tablo, vitrifikasyon sonrası işlemede kullanılan hızlı ısınma çözeltisi (RWS), dengeleme çözeltisi (ES) ve durulama çözeltileri (RS) için bileşenleri ve konsantrasyonları sağlar.
| Parametre | Taze | Ara | Vitrifikasyondan sonra hızlı ısındı | Ara | n | *P değeri |
| SD | SD | |||||
| Foliküler canlılık sayısı [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *Wilcoxon testi |
Tablo 3: Foliküler canlılığın temsili sonuçları. Bu tablo, kriyoprezervasyon öncesi ve hızlı ısınmadan sonra foliküler canlılık değerlendirmelerinin sonuçlarını sunmaktadır. Vitrifikasyon / hızlı ısınma öncesi ve sonrası canlı folikül sayısını saymak için hasta başına 2 mm çapında iki doku parçası kullanıldı. 50 hastadan alınan eşleştirilmiş doku örnekleri Wilcoxon testi kullanılarak analiz edildi.
Tartışmalar
Burada, insan yumurtalık korteks dokusunun klinik rutine uygun, yüksek verimli vitrifikasyonu için bir protokol sunulmaktadır. Oositlerin veya embriyoların vitrifikasyonuna benzer şekilde, prosedürün başarılı bir şekilde uygulanması, vitrifikasyon ve ısıtma solüsyonlarının sıcaklığı ile dengeleme süresi ile ilgili protokole ayrıntılı bir şekilde uyulmasını gerektirir. Hava kalitesi ve sterilite ile ilgili AB doku direktifleri37 ile uyumluluk da önemlidir.
Vitrifikasyon prosedürü kristal olmayan, amorf veya camsı bir durumla sonuçlanır. Genel olarak, vitrifikasyon, çeşitli bilimsel ve teknolojik alanlarda önemli etkileri olan çok yönlü bir süreçtir. Vitrifikasyonun birincil faydası, dokuyu camsı bir duruma dönüştürme yeteneğidir, böylece doku bütünlüğünü ve bileşenlerini olumsuz yönde etkileyebilecek buz kristalioluşumunu 38,39,40 önler.
Kriyoprotektif ajanların (CPA'lar) polivinilpirolidon (PVP) ile takviyesi, vitrifikasyon solüsyonlarınınkalitesinden ödün vermeden CPA konsantrasyonunda bir azalmaya izin verir 41,42. Ayrıca metal ızgaraların kullanılması, plastik esaslı taşıyıcı sistemlere göre yüksek ısı iletkenliği sağlar. Izgara yapısı ayrıca yüzey yapışmasını kolaylaştırarak doku örneklerinin ve kalite ölçümleri için küçük korteks zımbalarının güvenli ve emniyetli bir şekilde dondurularak saklanmasını sağlar. Diğer üreticilerin kriyodamarları kullanılıyorsa, kriyodamar kapağı içinde stabilite ve uygun tutuşun yanı sıra kaba iyi bir uyum sağlamak için metal ızgaraların boyutunun önceden test edilmesi önemlidir.
Başarılı bir vitrifikasyon sağlamak için kritik adımlar, dokuyu sterilize edilmiş sıvı nitrojene daldırarak hızlı vitrifikasyonu ve olumsuz sonuçlardan kaçınmak için gecikmeden hızlı ısınmayı içerir. Maliyet etkinliği açısından, doku vitrifikasyonu, yavaş dondurma prosedürüne kıyasla daha az talepkardır ve bu da personel dağıtım planlamasını etkileyebilir. Ek olarak, vitrifikasyon, yavaş dondurma için gerekli ekipman satın alma ve servis ihtiyacını ortadan kaldırır.
Biyolojik ölçümler ve meta-analizler, yavaş dondurma ile karşılaştırıldığında vitrifikasyonun karşılaştırılabilirliğini ve hatta avantajlarını göstermiştir43. Bununla birlikte, vitrifikasyon sonrası sonuçlardaki farklılıklar, hem vitrifikasyon cihazında hem de kullanılan solüsyonlar da dahil olmak üzere protokolde standardizasyon eksikliğine bağlanabilir ve bu da çalışmalar arasında farklılık gösterir. Gelecekteki araştırmalar, fare yumurtalık dokusunda birkaç grup tarafından başarılı bir şekilde gösterildiği gibi, in vitro olarak büyümeyi izlemek için vitrifiye / hızlı ısınan dokudan folikül kültürü potansiyelini araştırmalıdır 44,45,46,47,48,49,50.
Özetle, yumurtalık dokusunun vitrifikasyonu, Suzuki51 (Japonya), Silber52 (ABD) ve Sänger53 (Almanya) tarafından bildirilen beş başarılı doğumla desteklenen, yaygın olarak kullanılan yavaş dondurma protokolüne önemli bir alternatiftir. Ticari olarak temin edilebilen vitrifikasyon ortamı ve hücreler için kitlerin aksine, yumurtalık dokusu için klinik ortamlarda uygulamalarını sınırlayabilecek az sayıda FDA / CE onaylı sistem vardır. Bu nedenle, yumurtalık dokusunun vitrifikasyonu ve hızlı ısınması için FDA / CE onaylı kitlerin ve ortamların geliştirilmesi önerilmektedir30.
Açıklamalar
Hiç kimse.
Teşekkürler
Düzeltme için Cara Färber'e teşekkür ederiz; Katharina Wollersheim, Martin Mahlberg, Lea Korte ve Jasmin Rebholz'a teknik yardımları için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
Referanslar
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047(2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885(2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052(2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537(2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65(2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346(2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940(2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. Meryman, H. T. , Alan R. Liss. New York, USA. 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538(2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4(2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38(2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940(2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır