Method Article
ויטריפיקציה של רקמת קליפת המוח השחלתית להשגת מצב זגוגי של צבירה
In This Article
Summary
מוצג פרוטוקול לוויטריפיקציה של רקמת השחלה, כשיטת שימור הקפאה חלופית להקפאה איטית הנפוצה.
Abstract
שימור רקמת שחלה בהקפאה (OTC) הוא אופציה חשובה לשימור פוריות. עבור מטופלות שלא ניתן לדחות את הטיפולים הגונדוטוקסיים שלהן או עבור נערות לפני גיל ההתבגרות, זו לעתים קרובות האפשרות היחידה להגנה על פוריות. שימור בהקפאה יכול להתבצע על ידי ויטריפיקציה או על ידי הקפאה איטית. הקפאה איטית היא כיום הגישה הסטנדרטית. מספר גדל והולך של מחקרים מצביעים על כך שויטריפיקציה יכולה להחליף הקפאה איטית במעבדות המתקדמות ביותר להפריה חוץ גופית (IVF), לשפר משמעותית את שיעורי ההפשרה ולפשט את ההיבטים הטכניים של שימור בהקפאה. מתואר פרוטוקול מבוסס רשת מתכת, בתפוקה גבוהה לוויטריפיקציה מהירה של רקמת קליפת השחלות, המתאים לשגרה קלינית. עיקור רשתות מתכת וחנקן נוזלי מבטיח איכות גבוהה ועמידה בתקני תנאי ייצור נאותים (GMP). הוויטריפיקציה בוצעה כדי להבטיח קצבי קירור אולטרה-מהירים. במקום להפשיר לאט, הדגימות התחממו במהירות. כדי להעריך את הכדאיות הפוליקולרית, צביעת קלצאין בוצעה הן לפני שימור בהקפאה והן לאחר התחממות מהירה. היישום המוצלח של ויטריפיקציה והתחממות מהירה באמצעות רשתות מתכת מדווח. לא נצפו הבדלים משמעותיים בכדאיות הזקיקים לפני הוויטריפיקציה ולאחר ההתחממות המהירה. תוצאות אלה מאששות את הקיבולת הגבוהה של ויטריפיקציה רקמתית ליישומים קליניים שגרתיים כתחליף פוטנציאלי לשיטת ההקפאה האיטית הנפוצה.
Introduction
שימור בהקפאה של רקמת השחלה הוא אופציה חשובה לשימור פוריות. רקמה מושתלת המכילה זקיקי שחלות, שבה מוטמעים ביציות, נשמרת בהקפאה. לאחר האחסון, ניתן להפשיר, לחמם ולהשתיל מחדש את רקמת השחלה במטופלת. עבור תאים או רקמות קיימא, שתי שיטות שימור קריוגני זמינות: הקפאה איטית ויטריפיקציה1.
ויטריפיקציה משמשת לשימור חומרים ביולוגיים, כגון עוברים וביציות, עם שיעורי הישרדות גבוהים יותר בהשוואה לפרוטוקול הקפאה איטית 1,2,3,4. להקפאה איטית יש מגבלות, כגון היווצרות גבישי קרח, שעלולים לפגוע במבני תאים ורקמות. עם זאת, הקפאה איטית היא גישה חשובה לשימור בהקפאה המאפשרת אחסון לטווח ארוך של דגימות ביולוגיות, והפונקציונליות של שיטה זו הוכחה באופן נרחב5. ויטריפיקציה גורמת למצב זכוכית של צבירה, ומונעת היווצרות גבישי קרח 6,7. ברמה הטכנית, ויטריפיקציה מפשטת באופן משמעותי את הליך ההקפאה על ידי הפחתת תחזוקת הציוד, הפחתת הסבירות לשגיאות טכניות וקיצור משך תהליך ההקפאה 8,9. בשימור פוריות האישה, שימור רקמת שחלה בהקפאה הוא גישה מכרעת לפני טיפול בסרטן10. קבוצות שונות הדגימו בהצלחה את הרעיון של שימור בהקפאה, הפשרה והשתלה של רקמה בהתבסס על פרוטוקול הקפאה איטית 11,12,13,14, הנחשב כיום לגישה הסטנדרטית15.
ויטריפיקציה של רקמת שחלה נחשבת לשיטה חלופית מבטיחה 16,17,18,19,20,21, במונחים של חיסכון במשאבים22, שיעורי הישרדות זקיקים, רמות פיצול DNA ופוטנציאל אנגיוגני מאוזן 23,24,25,26,27. עדות לכך היא מסירות מוצלחות ביפן28, ארה"ב29 וגרמניה30.
השוואת שתי האפשרויות לשימור רקמת שחלה בהקפאה (OTC) לעומת ההליך הסטנדרטי של תוצאות הקפאה איטית סותרות חלקית במטא-אנליזות הנוכחיות16. ייתכן שמספר גורמים תרמו לכך, שכן פרוטוקולי הוויטריפיקציה הנוכחיים משתנים מאוד. הבדלים אלה כוללים את הבחירה של cryoprotectant או שילוב של protectants, הריכוז שלהם, הרכב של מדיה OTC, את גודל שברי רקמות, ואת המכשיר המשמש נשא רקמות. בהתאם לכך, אין פרוטוקול התחממות סטנדרטי.
מכיוון שהמחברים מצאו שיטה שמניבה תוצאות משכנעות מבחינת טיפול, כדאיות, הופעת אפופטוזיס, שחרור גורמים אנגיוגניים, ואפילו דיווח על לידה לאחר השתלה מחדש 9,27, ניתן תיאור מפורט מאוד של הפרוטוקול. השיטה המתוארת מציעה פרוטוקול תקף ויעיל שעשוי לתרום לסטנדרטיזציה של ויטריפיקציה של רקמת השחלה.
Protocol
המחקר אושר על ידי ועדת האתיקה בבית החולים האוניברסיטאי בון (007/09). התקבלה הסכמה מדעת בכתב מכל מטופל. קבוצת המחקר כללה רקמת שחלה אנושית מ-50 מטופלות בגיל ממוצע של 27.4 שנים לפני ההקפאה, כפי שניתן לראות באיור 1. הריאגנטים והציוד ששימשו במחקר זה מפורטים בטבלת החומרים.
1. הכנת מכשירי טעינה
- הכינו מספריים כירורגיים ורשתות מתכת להתאמה אישית. חתכו את רשתות הרשת לרצועות בגודל 25 מ"מ x 8 מ"מ, כפי שמצוין באיור 2A.
- הניחו את רשתות המתכת המותאמות אישית במיכל עיקור ובאוטוקלאבה למשך שעתיים (איור 2B). לאחר autoclaving, מניחים את מיכל העיקור ובקבוקונים 1.8 מ"ל מתחת לספסל זרימה למינרית.
- הפעל את הקרינה האולטרה סגולה (UV) של ספסל הזרימה הלמינרית למשך 30 דקות לעיקור נוסף באורך גל של 254 ננומטר.
- פתחו את מיכל העיקור, הסירו את רשתות המתכת והכניסו אותן למכסים של בקבוקוני 1.8 מ"ל, כפי שמצוין באיור 2C. סגור את בקבוקוני 1.8 מ"ל.
הערה: כל עבודת תרבית הרקמה המתוארת לעיל צריכה להתבצע במכסה מנוע זרימה למינרית Class II. נקה את ספסל הזרימה הלמינרית עם חומר חיטוי משטח תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
2. הכנת מדיה ויטריפיקציה
- הכינו פיפטה סרולוגית אחת של 10 מ"ל, עזר פיפטה אלקטרוני אחד ושלוש שפופרות של 50 מ"ל עבור פתרון ויטריפיקציה 1 (VS1), פתרון ויטריפיקציה 2 (VS2) ופתרון ויטריפיקציה 3 (VS3), וכן לרישום תאריך ההכנה. הפעל את הקרינה האולטרה סגולה (UV) של ספסל הזרימה הלמינרית לצורך עיקור נוסף.
- עבור VS1 (15 מ"ל), פיפטה 12 מ"ל של מדיום טיפול בביציות (בתוספת אלבומין בסרום אנושי על ידי היצרן), 1.5 מ"ל של SSS (תוסף תחליף סרום), ו 1.5 מ"ל של אתילן גליקול לתוך צינור אחד 50 מ"ל.
- עבור VS2 (15 מ"ל), פיפטה 10.5 מ"ל של מדיום טיפול בביציות (בתוספת אלבומין בסרום אנושי על ידי היצרן), 3 מ"ל אתילן גליקול, ו 1.5 מ"ל של SSS לתוך צינור אחד 50 מ"ל.
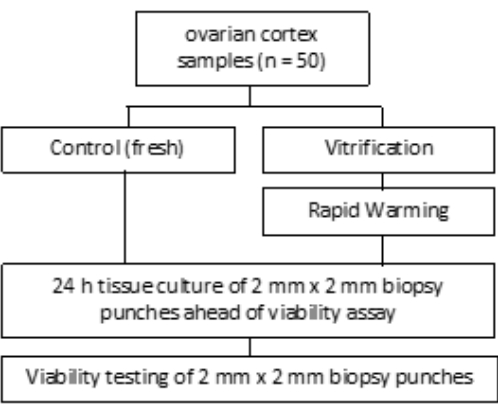
- עבור VS3, פיפטה 8.5 מ"ל של מדיום טיפול בביציות (בתוספת אלבומין בסרום אנושי על ידי היצרן), 5.25 מ"ל של אתילן גליקול, ולהוסיף 2.57 גרם סוכרוז ו 0.75 גרם של פוליוויניל פירולידון (PVP) לתוך צינור אחד 50 מ"ל. ראו איור 3 לפרטים. ערבבו את כל הפתרונות על ידי מערבולות ב-3,000 סל"ד.
הערה: כל עבודת תרבית הרקמה המתוארת לעיל צריכה להתבצע במכסה מנוע זרימה למינרית Class II. לנקות את ספסל זרימה למינרית עם חומר חיטוי תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
3. הכנת ויטריפיקציה
- נקה את ספסל הזרימה הלמינרית עם חומר חיטוי משטח תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
- הכינו צלחת אחת של 6 בארות, מסננת תאים, אזמל, פינצטה, ניקוב ביופסיה אחד בקוטר 2 מ"מ ושתי מנות בעלות תחתית עגולה בקוטר 90 מ"מ. כמו כן, הכינו מדיה: פתרון שימור להשתלת רקמות VS1-3. פיפטה 5 מ"ל מכל תמיסה מצוננת (VS1-3) לבארות נפרדות וממתינים 30 דקות עד שהתמיסות יגיעו לטמפרטורת החדר.
- עיקור חנקן נוזלי באמצעות מערכת הקרנת UV אוטומטית; לחלופין, השתמש בקרינת UV של מכסה המנוע של הזרימה הלמינרית למשך 120 דקות.
4. ויטריפיקציה של רקמות
- הכן רקמת קליפת השחלות על ידי הסרת medulla. מאחר שקליפת המוח בדרך כלל קשה יותר מהמדולה, ניתן להבחין ביניהם ולהפריד ביניהם בקלות.
- חתכו את רקמת קליפת המוח השחלתית לצורות הרצויות (10 מ"מ x 5 מ"מ להשתלה; אגרופים בגודל 2 מ"מ x 2 מ"מ לספירת זקיקים בת קיימא לפני ואחרי ויטריפיקציה), כפי שמצוין באיור 4A.
הערה: הימנע מפגיעה ברקמה על ידי לחיצה חזקה מדי, וטפל בה בזהירות. דגימות הרקמה עשויות להשתנות בין מטופלים.
- חתכו את רקמת קליפת המוח השחלתית לצורות הרצויות (10 מ"מ x 5 מ"מ להשתלה; אגרופים בגודל 2 מ"מ x 2 מ"מ לספירת זקיקים בת קיימא לפני ואחרי ויטריפיקציה), כפי שמצוין באיור 4A.
- מניחים מסננת תאים לתוך הבאר הראשונה של צלחת 6 בארות עם VS1. אזנו את רקמת קליפת המוח השחלתית למשך 5 דקות ב-5 מ"ל של VS1 בבאר 1 של צלחת 6 הבארות באמצעות מסננת התא.
- לאחר מכן, העבירו את מסננת התא עם רקמת קליפת המוח לבאר 2 המכילה 5 מ"ל של VS2, ושיווי משקל למשך 5 דקות. לבסוף, יש לאזן במשך 6 דקות ב-5 מ"ל של VS3, כפי שמצוין באיור 3 ובטבלה 1.
- פתח את cryovials מוכן. מלאו את הבקבוקונים בחנקן נוזלי מעוקר והכניסו אותם לכלי הדיואר של הקריו המלא בחנקן נוזלי. טענו את דגימות הרקמה על רשת המתכת של מכשיר הוויטריפיקציה תוך דקה אחת (איור 4B,C).
- הכניסו את דגימות הרקמה שהוטענו ברשת המתכת לחנקן הנוזלי בקריובלים מבוססי הרשת המוכנים (איור 4D).
הערה: הקפאה מהירה של הרקמה העמוסה ברשת המתכת חיונית להצלחת שיטה זו. כל עבודת תרבית הרקמה המתוארת לעיל צריכה להתבצע במכסה מנוע זרימה למינרית Class II. נקה את ספסל הזרימה הלמינרית עם חומר חיטוי משטח תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
- הכניסו את דגימות הרקמה שהוטענו ברשת המתכת לחנקן הנוזלי בקריובלים מבוססי הרשת המוכנים (איור 4D).
5. הכנת אמצעי התחממות מהירה
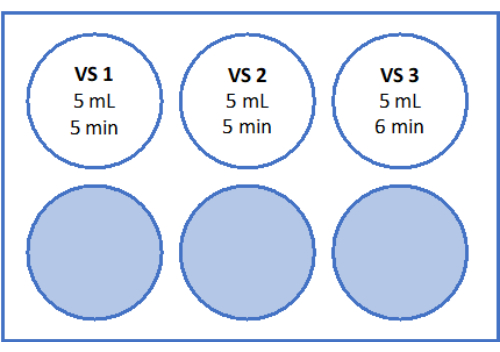
- הכינו את הפתרונות כפי שמצוין באיור 5 ובטבלה 2. שוקלים את הסוכרוז לתמיסת ההתחממות המהירה (RWS) ולתמיסת שיווי המשקל (ES) ומעבירים אותו לצינור. מוסיפים את מדיום הטיפול בביציות (בתוספת אלבומין בסרום אנושי על ידי היצרן) באמצעות פיפטה סרולוגית ועזר לפיפטציה. הוסף SSS וסוכרוז כמפורט בטבלה 2.
- סגרו את הצינורות ותנו להם להתסיס על שייקר מתגלגל עד להמסה מלאה.
הערה: כל עבודת תרבית הרקמה המתוארת לעיל צריכה להתבצע במכסה מנוע זרימה למינרית Class II. נקה את ספסל הזרימה הלמינרית עם חומר חיטוי משטח תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
6. הכנה להתחממות מהירה
- יום לפני ההתחממות המהירה, הכינו את החומרים המתכלים וטיהרו אותם באמצעות אור UV בספסל הזרימה הלמינרית: הכינו את הדגימה עבור RWS, את צלחת 6 הקידוחים עבור ES, RS1 ו-RS2, ואת הדגימה להובלת רקמות לאחר התחממות מהירה. הניחו פינצטה סטרילית חד פעמית, ציוד צנרת וחומרים מתכלים אחרים בספסל הזרימה הלמינרית.
- מחממים צלחת חימום ל 37.2 מעלות צלזיוס. לדגור RWS ב 37 ° C במשך 1 שעה לפחות.
- הכינו צלחת סטרילית של 6 בארות עם 6 מ"ל של ES, 6 מ"ל של RS עבור "RS1", ועוד 6 מ"ל של RS עבור "RS2" בספסל הזרימה הלמינרית. עיינו באיור 5 להמחשה סכמטית של לוח 6 הקידוחים. תן להם לדגור בטמפרטורת החדר במשך 1 שעה לפני חימום הרקמה.
- מעבירים RWS לכוס דגימה סטרילית בתנאים סטריליים ומניחים אותה על פלטת החימום. RWS צריך להישמר ב 37 °C (77 °F).
הערה: התחממות מהירה דורשת קצב התחממות מהיר. חיוני להחזיק את ה-RWS בטמפרטורה של 37°C כדי להבטיח את הצלחת הצעד הראשון.
7. התחממות מהירה של רקמת השחלות
- העבירו את הבקבוקונים השמורים בהקפאה המכילים רקמת קליפת המוח השחלתית המזוגגת בחנקן נוזלי לספסל הזרימה הלמינרית. פתח את הבקבוקונים בזמן שהם שקועים חלקית תחת חנקן נוזלי. השקיעו במהירות את הרשת עם הרקמה המזוגגת לתוך RWS ותנו לרקמה לשבת שם במשך דקה אחת ב 37 °C.
הערה: זהו השלב הקריטי ביותר במהלך התחממות מהירה ויש לבצע אותו ללא כל דיחוי. - בעזרת מלקחיים סטריליים, מעבירים את הרקמה ל-ES ודורים עליה במשך 3 דקות תוך כדי ניעור עדין על שייקר נדנדה.
- שטפו את הרקמה בטמפרטורת החדר במשך 10 דקות כל אחת עם RS1 ו-RS2 על שייקר נדנדה, כפי שמצוין באיור 5.
- מעבירים את הרקמה המחוממת לכוס דגימה סטרילית המכילה 5 מ"ל של תמיסת שימור להשתלת רקמות, אותה יש להחזיק בטמפרטורה של 4 מעלות צלזיוס לצורך הובלה לאתר ההשתלה.
הערה: כל עבודת תרבית הרקמה המתוארת לעיל צריכה להתבצע במכסה מנוע זרימה למינרית Class II. נקה את ספסל הזרימה הלמינרית עם חומר חיטוי משטח תוך לבישת כפפות מעבדה חד פעמיות; מומלץ להשתמש בכפפות ללא אבקה.
8. קביעת כדאיות זקיקים
- הביאו דימתיל סולפוקסיד (DMSO) לטמפרטורת החדר למשך הלילה כדי לקבל מצב נוזלי. פיפטה 100 μL של DMSO לתוך בקבוקון אחד של calcein ו resuspend כדי להמיס את calcein. פיפטה 3 μL של calcein מומס לתוך החלק התחתון של צינור אחד 1.5 מ"ל ולאחסן את הבקבוקונים ב -20 ° C.
- מניחים 0.007 גרם של collagenase בצינור אחד של 1.5 מ"ל ואחסנו אותו ב -20 °C.
- הוסף 997 μL של DPBS ל- 3 μL של calcein בצינור אחד של 1.5 מ"ל, והשהה מחדש כדי להמיס את הקלצאין. הוסף 0.007 גרם של collagenase כדי לקבל 1000 μL של פתרון עבודה.
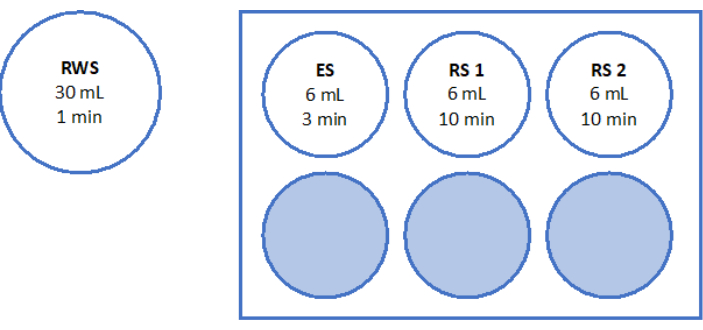
- השתמש 500 μL של פתרון העבודה כדי לעכל שתי חתיכות של 2 מ"מ קליפת המוח השחלתית במשך 90 דקות ב 37 ° C, מוגן מפני אור, בצלחת 4 באר. לאחר 60 דקות ו-70 דקות, השהה מחדש את הפתרון שוב ושוב. לבסוף, קבעו את הכדאיות הפוליקולרית באמצעות מיקרוסקופ פלואורסצנטי, כפי שמוצג באיור 6.
תוצאות
פרוטוקול זה מציג את הנהלים להכנת אמצעי ויטריפיקציה, מכשירי טעינה, ויטריפיקציה, הכנת אמצעי התחממות מהירה, התחממות מהירה וקביעת כדאיות זקיקים. השוואה ישירה של כדאיות זקיקים וגורמים אנגיוגניים בין הקפאה איטית לוויטריפיקציה אומתה ופורסמה31,32.
ההצלחה הכוללת של פרוטוקול הוויטריפיקציה המתואר הוערכה על ידי השוואת ספירת הזקיקים החיוניים לפני ואחרי ויטריפיקציה/התחממות מהירה. מערך הניסוי מוצג באיור 1, והתוצאות מוצגות באיור 6. ב-50 חולים נצפתה ספירה ממוצעת של 77.98 זקיקים חיוניים לפני ויטריפיקציה ו-62.99 לאחר ויטריפיקציה/התחממות מהירה, המשקפת שיעור הישרדות של 80.8%. זה לא היה שונה באופן משמעותי על פי מבחן וילקוקסון33.
רשתות מתכת מותאמות אישית עם מספריים חדים לגודל של 25 מ"מ x 8 מ"מ, אשר מתאים למכסים של קריובלים של 1.8 מ"ל, כפי שמוצג באיור 2A,C. לאחר עיקור באמצעות אוטוקלאבינג בקיטור, הרשתות והמכסים של בקבוקונים בנפח 1.8 מ"ל מורכבים מתחת לספסל זרימה למינרי, כפי שמצוין באיור 2B. מערך זה מספק אחיזה בטוחה בפקק ללא צורך בפעולות נוספות ומציע שטח מספיק לרקמות בגדלים שונים. בדרך כלל, חתיכות רקמה של 5 מ"מ x 10 מ"מ להשתלה וחתיכות בקוטר 2 מ"מ להערכת ספירת זקיקים חיונית לאחר הפשרה מהירה הן זגוגיות. שני הגדלים מתאימים באופן מושלם לרשתות המתכת.
שיווי משקל עם תמיסות ויטריפיקציה (VS1, VS2 ו-VS3) מתבצע בצלחת בת 6 בארות על שייקר נדנדה בטמפרטורת החדר מתחת לספסל זרימה למינרי, כפי שמוצג באיור 3. מסגרות הזמן בתכנית מבטיחות ספיגה יעילה של אתילן גליקול cryoprotectant. מומלץ להשתמש בצלחת בעלת 6 בארות מעל כלי דם בודדים מכיוון שהיא מאפשרת תנועה מהירה של הרקמה בין תמיסות ומסייעת במניעת ערבובים.
עבור ויטריפיקציה אנכית מהירה בחנקן נוזלי, רקמת קליפת המוח השחלתית נחתכת לחתיכות מתאימות (איור 4A). דגימות מקליפת המוח של השחלות ממוקמות על מכשירי העמסה (איור 4B,C) ושקועות אנכית בחנקן נוזלי (איור 4D) כדי להשיג מצב זכוכית של צבירה באמצעות ויטריפיקציה. רשתות המתכת שנבחרו מאפשרות טיפול אנכי ברקמה, כפי שניתן לראות באיור 4D. בנוסף, רשתות המתכת מוליכות תרמית מאוד, ומבטיחות קצבי קירור מהירים מ -22 ° C ל -196 ° C, המהווה שלב חשוב ביותר בתהליך הוויטריפיקציה.
להתחממות מהירה, RWS מוכן בכוס סטרילית בטמפרטורה של 37°C. ES, RS1 ו-RS2 מוכנים בצלחת של 6 בארות על שייקר נדנדה בטמפרטורת החדר, כפי שמוצג באיור 5. הנפח הגבוה של RWS שחומם מראש מונע מהתמיסה להתקרר יתר על המידה עם הוספת הרקמה המזוגגת ומבטיח סביבה חמה באופן עקבי לרקמה לאורך כל תהליך ההתחממות המהירה.
כדי להעריך ולהבטיח תקני איכות גבוהים, אגרופי ביופסיה בגודל 2 מ"מ x 2 מ"מ מוכתמים בקלצין לפני ויטריפיקציה ולאחר התחממות מהירה כדי לקבוע את כדאיות הזקיקים באמצעות מיקרוסקופ פלואורסצנטי34,35 (איור 6). זקיקים בני קיימא פולטים פלואורסצנטיות ירוקה ב-495 ננומטר לאחר ספיגה תוך-תאית של קלצאין. לחלופין, ניתן להעריך את כדאיות הזקיקים (טבלה 3) באמצעות צבעים אדומים ניטרליים36.
על ידי ביצוע השלבים המתוארים בפרוטוקול זה, רקמת השחלה הופכת למצב זכוכית של צבירה, המאפשר שיעורי הישרדות גבוהים לאחר התחממות מהירה, כפי שאושר על ידי מיקרוסקופ פלואורסצנטי.
איור 1: עיצוב המחקר. דגימות קליפת המוח של השחלות מ-50 מטופלות נבדקו לפני (טרי) ואחרי ויטריפיקציה והתחממות מהירה עבור מספר הזקיקים הקיימים. עבור כל קבוצה, שתי פיסות רקמה בקוטר 2 מ"מ גודלו בתרבית במשך 24 שעות לפני הערכת ספירת הזקיקים. הרקמה עוכלה עם collagenase ומוכתמת בקלצין כדי להעריך את הכדאיות. מספר הזקיקים בני קיימא נקבע באמצעות מיקרוסקופ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הכנת מכשירי טעינה. רשתות מתכת נחתכו לגודל של 8 מ"מ x 25 מ"מ (A). רשתות המתכת המותאמות אישית עוקרו על ידי אוטוקלאבינג (B). רשתות המתכת המעוקרות הוכנסו למכסים של בקבוקונים בנפח 1.8 מ"ל, מוכנים לשימוש (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 3: הכנת תמיסות ויטריפיקציה. פתרונות ויטריפיקציה (VS) הוכנו והועברו לצלחת 6 בארות. הבארות מציגות את הנפח של כל תמיסה ואת זמני הדגירה האינדיבידואליים המשמשים בפרוטוקול הוויטריפיקציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: עיבוד וויטריפיקציה של קליפת המוח השחלתית. רקמת קליפת המוח השחלתית עובדה לשימור בהקפאה על ידי הסרת המדולה וחיתוך הרקמה לחתיכות בגודל 5 מ"מ x 10 מ"מ (A). לאחר הדגירה בתמיסות הוויטריפיקציה המוצגות באיור 3, הרקמה הועמסה על מכשיר טעינת הוויטריפיקציה (B,C). עבור ויטריפיקציה אנכית מהירה של דגימות קליפת השחלות, הכובעים עם הרקמה הטעונה הוכנסו במהירות לחנקן נוזלי מעוקר (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 5: הכנת פתרונות התחממות מהירה. תמיסת התחממות מהירה (RWS), תמיסת שיווי משקל (ES) ותמיסות שטיפה (RS) 1 ו-2 הוכנו והועברו לצלחת בעלת 6 בארות. הכלים והבארות מראים את הנפח של כל פתרון ואת זמני הדגירה המתאימים. שים לב כי RWS נשמר ב 37.2 ° C על צלחת חימום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
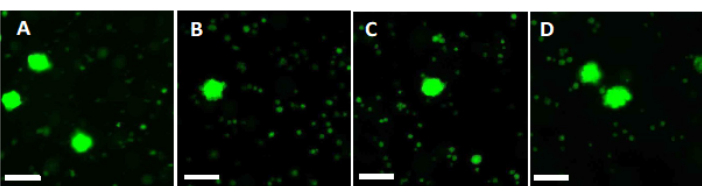
איור 6: ספירת כדאיות. כדי להעריך את מספר הזקיקים קיימא, חתיכות רקמה בקוטר 2 מ"מ עוכלו עם collagenase ומוכתמות עם calcein. התמונות המייצגות מראות (A) צביעת קלצאין של 3 זקיקים שנמצאו לפני ויטריפיקציה. (B) זקיק בר קיימא שהתאושש לאחר ויטריפיקציה והתחממות מהירה. (C) זקיק בר קיימא שהוחזר לפני הקפאה איטית. (D) זקיקים ברי קיימא שנמצאו לאחר הקפאה והפשרה איטיות. כדאיות זקיקים מסומנת על ידי calcein, צבע פלואורסצנטי ירוק הפולט פלואורסצנטיות ירוקה כאשר מומר אנזימטית על ידי תאים קיימא ב 495 ננומטר. סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| VS 1 (15 מ"ל) | אתילן גליקול | 10% | 1.5 מ"ל |
| אס.אס.אס | 10% | 1.5 מ"ל | |
| G-MOPS+ | 12 מ"ל | ||
| לעומת 2 (15 מ"ל) | אתילן גליקול | 20% | 3 מ"ל |
| אס.אס.אס | 10% | 1.5 מ"ל | |
| G-MOPS+ | 10.5 מ"ל | ||
| VS 3 (15 מ"ל) | אתילן גליקול | 35% | 5.25 מ"ל |
| אס.אס.אס | 10% | 1.5 מ"ל | |
| סוכרוז | 0.5 מול/ל' | 2.57 גרם | |
| PVP | 5 % (ללא רב) | 0.75 גרם | |
| G-MOPS+ | מודעה 15 מ"ל |
טבלה 1: הרכב פתרונות ויטריפיקציה (VS).
| RWS (30 מ"ל) | סוכרוז | 0.8 מול/ליטר | |
| 8.22 גרם | |||
| אס.אס.אס | 10% | 3 מ"ל | |
| G-MOPS+ | מודעה 30 מ"ל | ||
| ES (15 מ"ל) | סוכרוז | 0.4 מול/ל | 2.05 גרם |
| אס.אס.אס | 10% | 1.5 מ"ל | |
| G-MOPS+ | מודעה 15 מ"ל | ||
| RS 1&2 (15 מ"ל) | אס.אס.אס | 10% | 1.5 מ"ל |
| G-MOPS+ | מודעה 15 מ"ל |
טבלה 2: הרכב תמיסת התחממות מהירה (RWS), תמיסת שיווי משקל (ES) ותמיסות שטיפה (RS). טבלה זו מספקת את הרכיבים והריכוזים עבור תמיסת ההתחממות המהירה (RWS), תמיסת שיווי משקל (ES) ותמיסות שטיפה (RS) המשמשות בעיבוד שלאחר ויטריפיקציה.
| פרמטר | טריים | מרווח זמן | התחממות מהירה לאחר ויטריפיקציה | מרווח זמן | n | *ערך P |
| SD | SD | |||||
| ספירת כדאיות זקיקים [n] | 77.98 | 0-386 | 62.99 | 0.5-349 | 50 | 0.130 |
| 77.95 | 80.02 | |||||
| *מבחן Wilcoxon |
טבלה 3: תוצאות מייצגות של כדאיות זקיקים. טבלה זו מציגה את התוצאות של הערכות כדאיות זקיקים לפני שימור בהקפאה ולאחר התחממות מהירה. שתי פיסות רקמה בקוטר 2 מ"מ לכל מטופל שימשו לספירת מספר הזקיקים הקיימים לפני ואחרי ויטריפיקציה/התחממות מהירה. דגימות רקמה מזווגים של 50 חולים נותחו באמצעות מבחן Wilcoxon.
Discussion
כאן מוצג פרוטוקול לוויטריפיקציה בתפוקה גבוהה של רקמת קליפת השחלות האנושית, המתאים לשגרה קלינית. בדומה לוויטריפיקציה של ביציות או עוברים, יישום מוצלח של ההליך דורש היצמדות מפורטת לפרוטוקול הנוגע לטמפרטורה של תמיסות הוויטריפיקציה וההתחממות, כמו גם תקופת שיווי המשקל. עמידה בהנחיות הרקמה37 של האיחוד האירופי בנוגע לאיכות האוויר וסטריליות חיונית אף היא.
תהליך הוויטריפיקציה גורם למצב לא גבישי, אמורפי או זכוכיתי. בסך הכל, ויטריפיקציה היא תהליך רב-תכליתי בעל השלכות משמעותיות בתחומים מדעיים וטכנולוגיים שונים. היתרון העיקרי של ויטריפיקציה הוא יכולתו להמיר רקמה למצב זכוכיתי, ובכך למנוע היווצרות גבישי קרח 38,39,40, אשר יכולים להשפיע לרעה על שלמות הרקמה ומרכיביה.
תוספת של חומרים cryoprotective (CPAs) עם polyvinylpyrrolidone (PVP) מאפשר ירידה בריכוז CPA מבלי להתפשר על איכות פתרונות ויטריפיקציה41,42. יתר על כן, השימוש ברשתות מתכת מספק מוליכות תרמית גבוהה בהשוואה למערכות נשא מבוססות פלסטיק. מבנה הרשת גם מאפשר הידבקות פני השטח, ומבטיח שימור קריוגני בטוח ובטוח של דגימות רקמה ואגרופי קליפת מוח קטנים למדדי איכות. אם משתמשים בכלי קריו-כלים מיצרנים אחרים, חשוב לבדוק מראש את גודל רשתות המתכת כדי להבטיח יציבות ואחיזה נכונה בתוך מכסה כלי ההקפאה, כמו גם התאמה טובה לכלי.
צעדים קריטיים כדי להבטיח ויטריפיקציה מוצלחת כוללים ויטריפיקציה מהירה על ידי טבילת הרקמה בחנקן נוזלי מעוקר וביצוע התחממות מהירה ללא דיחוי כדי למנוע תוצאות שליליות. במונחים של עלות-תועלת, ויטריפיקציה של רקמות היא פחות תובענית בהשוואה להליך ההקפאה האיטי, מה שעשוי להשפיע על תכנון פריסת כוח האדם. בנוסף, ויטריפיקציה מבטלת את הצורך לרכוש ולטפל בציוד הנדרש להקפאה איטית.
מדדים ביולוגיים ומטא-אנליזות הוכיחו את יכולת ההשוואה או אפילו היתרונות של ויטריפיקציה בהשוואה להקפאה איטית43. עם זאת, ניתן לייחס הבדלים בתוצאות לאחר ויטריפיקציה לחוסר סטנדרטיזציה הן במכשיר הוויטריפיקציה והן בפרוטוקול, כולל הפתרונות בהם נעשה שימוש, המשתנים בין מחקרים. מחקר עתידי צריך לחקור את הפוטנציאל של תרבית זקיקים מרקמה מזוגגת/מחוממת במהירות כדי לעקוב אחר צמיחה במבחנה, כפי שהודגם בהצלחה ברקמת שחלה עכברית על ידי מספר קבוצות 44,45,46,47,48,49,50.
לסיכום, ויטריפיקציה של רקמת השחלה היא חלופה משמעותית לפרוטוקול ההקפאה האיטית הנפוץ, הנתמך על ידי חמש לידות מוצלחות שדווחו על ידי סוזוקי51 (יפן), סילבר52 (ארה"ב) וסנגר53 (גרמניה). בניגוד לאמצעי ויטריפיקציה זמינים מסחרית וערכות לתאים, יש מעט מערכות מאושרות FDA / CE עבור רקמת השחלה, אשר עשוי להגביל את היישום שלהם במסגרות קליניות. לכן, מומלץ לפתח ערכות ומדיה מאושרות FDA/CE לוויטריפיקציה והתחממות מהירה של רקמת השחלה.
Disclosures
ללא.
Acknowledgements
אנו מודים לקארה פרבר על ההגהה; קתרינה וולרסהיים, מרטין מהלברג, לאה קורטה ויסמין רבהולץ על עזרתם הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| 1.8 mL vials | VWR International GmbH | 479-6837 | |
| 10 mL serological pipette | Sarstedt | 86.1254.001 | |
| 4 well plate | Gynemed | GYOOPW-FW04 | |
| 50 mL Tube | Sarstedt | 62.559.001 | |
| 6 well plates | Sarstedt | 83.3920 | |
| Bacillol AF | Hartmann | 973385 | |
| Calcein AM | Merck | 17783 | |
| Collagenase type 1A | Merck | C2674 | |
| Cryosure DMSO | WAK Chemie | WAK-DMSO-10 | |
| Custodiol | Dr. Franz Köhler Chemie | 00867288 | |
| DPBS CTS | Gibco Life technologies | A12856-01 | |
| ErgoOne pipette aid | Starlab | S7166-0010 | |
| Ethylene glycol | Sigma Aldrich | 102466 | |
| Euronda sterilization container | euronda | 282021 | |
| G-MOPS+ | Vitrolife | 10130 | |
| Metal meshes | Sigma Aldrich | S0770 | |
| Metzenbaum scissors | world precision instruments | 501262102 | |
| N-Bath System | Nterilizer | N-Bath 3.0 | |
| Polyvinylpyrrolidone (PVP) | SAGE | ART-4005 | |
| Serum substitute supplement (SSS) | Fujifilm Irvine scientific | 99193 | |
| Sterile cup | Sarstedt | 75.562.105 | |
| Sterile forceps | Carl Roth | KL05.1 | |
| Sucrose | Merck | S0389 |
References
- Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., Hassani, F., Movaghar, B. Vitrification versus slow freezing gives excellent survival, post-warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assist Reprod Genet. 26 (6), 347-354 (2009).
- Levi-Setti, P. E., Patrizio, P., Scaravelli, G. Evolution of human oocyte cryopreservation: Slow freezing versus vitrification. Curr Opin Endocrinol Diabetes Obes. 2 (6), 445-450 (2016).
- Glujovsky, D., et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 9, CD010047 (2014).
- AbdelHafez, F. F., Desai, N., Abou-Setta, A. M., Falcone, T., Goldfarb, J. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online. 20 (2), 209-222 (2010).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryo-preserving ovarian tissue. Reprod Biomed Online. 23, 160-186 (2011).
- Fahy, G. M., MacFarlane, D. R., Angell, C. A., Meryman, H. T. Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426 (1984).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67 (6), 1671-1680 (2002).
- Schallmoser, A., et al. Comparison of angiogenic potential in vitrified vs. slow frozen human ovarian tissue. Sci Rep. 13 (1), 12885 (2023).
- Schallmoser, A., et al. The effect of high-throughput vitrification of human ovarian cortex tissue on follicular viability: A promising alternative to conventional slow freezing. Arch Gynecol Obstet. 307 (2), 591-599 (2023).
- Jadoul, P., et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: Lessons learned from 545 cases. Hum Reprod. 32 (5), 1046-1054 (2017).
- Meirow, D., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 353, 318-321 (2005).
- Meirow, D., et al. Transplantations of frozen-thawed ovarian tissue demonstrate high reproductive performance and the need to revise restrictive criteria. Fertil Steril. 106, 467-474 (2016).
- Hoekman, E. J., et al. Ovarian tissue cryopreservation: Low usage rates and high live-birth rate after transplantation. Acta Obstet Gynecol Scand. 00, 1-9 (2019).
- Rodriguez-Wallberg, K. A., et al. 86 Successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: Focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 34, 325-336 (2017).
- Anderson, R. A., et al. The ESHRE guideline group on female fertility preservation, ESHRE guideline: Female fertility preservation. Hum Reprod Open. 2020 (4), hoaa052 (2020).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Keros, V., et al. Vitrification versus controlled rate freezing in cryopreservation of human ovarian tissue. Hum Reprod. 24, 1670-1683 (2009).
- Xiao, Z., Wang, Y., Li, L., Luo, S., Li, S. W. Needle immersed vitrification can lower the concentration of cryoprotectant in human ovarian tissue cryopreservation. Fertil Steril. 94, 2323-2328 (2010).
- Fabbri, R., et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification. Biomed Res Int. 2014, 673537 (2014).
- Chang, H. J., et al. Optimal condition of vitrification method for cryopreservation of human ovarian cortical tissues. J Obstet Gynaecol Res. 37 (8), 1092-1101 (2011).
- Wang, Y., Xiao, Z., Li, L., Fan, W., Li, S. W. Novel needle immersed vitrification: A practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation. Hum Reprod. 23 (10), 2256-2265 (2020).
- Fabbri, R., et al. Morphological, ultrastructural and functional imaging of frozen/thawed and vitrified/warmed human ovarian tissue retrieved from oncological patients. Hum Reprod. 31 (8), 1838-1849 (2023).
- Xiao, Z., Wang, Y., Li, L. L., Li, S. W. In vitro culture thawed human ovarian tissue: NIV versus slow freezing method. Cryo Letters. 34 (5), 520-526 (2013).
- Locatelli, Y., et al. In vitro survival of follicles in prepubertal ewe ovarian cortex cryopreserved by slow freezing or non-equilibrium vitrification. J Assist Reprod Genet. 36 (9), 1823-1835 (2017).
- Nikiforov, D., et al. Innovative multi-protectoral approach increases survival rate after vitrification of ovarian tissue and isolated follicles with improved results in comparison with conventional method. J Ovarian Res. 11 (1), 65 (2018).
- Wang, T., et al. Human single follicle growth in vitro from cryopreserved ovarian tissue after slow freezing or vitrification. Human Reprod. 31 (4), 763-773 (2016).
- Lee, S., et al. Comparison between slow freezing and vitrification for human ovarian tissue cryopreservation and xenotransplantation. Int JMol Sci. 20 (13), 3346 (2019).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprod Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed Online. 49 (1), 103940 (2024).
- Sugishita, Y., et al. Quantification of residual cryoprotectants and cytotoxicity in thawed bovine ovarian tissues after slow freezing or vitrification. Hum Reprod. 37 (3), 522-533 (2022).
- Abir, R., et al. Attempts to improve human ovarian transplantation outcomes of needle-immersed vitrification and slow-freezing by host and graft treatments. J Assist Reprod Genet. 34 (5), 633-644 (2017).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Schallmoser, A., Einenkel, R., Färber, C., Sänger, N. In vitro growth (IVG) of human ovarian follicles in frozen thawed ovarian cortex tissue culture supplemented with follicular fluid under hypoxic conditions. Arch Gynecol Obstet. 306 (4), 1299-1311 (2022).
- Kristensen, S. G., et al. A simple method to quantify follicle survival in cryopreserved human ovarian tissue. Hum Reprod. 33 (12), 2276-2284 (2018).
- Mortimer, D. A critical assessment of the impact of the European Union Tissues and Cells Directive (2004) on laboratory practices in assisted conception. Reprod Biomed. 11 (2), 162-176 (2005).
- Amorim, C. A., Curaba, M., Van Langendonckt, A., Dolmans, M. M., Donnez, J. Vitrification as an alternative means of cryopreserving ovarian tissue. Reprod Biomed. 23 (2), 160-186 (2011).
- Fahy, G. M., Meryman, H. T. Vitrification: A new approach to organ cryopreservation. Transplantation: Approaches to Graft Rejection. , 305-335 (1986).
- Kattera, S., Chen, C. Cryopreservation of embryos by vitrification: Current development. Int Surg. 91 (5 Suppl), S55-S62 (2006).
- Fuller, B., Paynter, S. Fundamentals of cryobiology in reproductive medicine. Reprod Biomed. 9, 680-691 (2004).
- Liebermann, J., et al. Potential importance of vitrification in reproductive medicine. Biol Reprod. 67, 1671-1680 (2002).
- Shi, Q., Xie, Y., Wang, Y., Li, S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-analysis. Sci Rep. 7 (1), 8538 (2017).
- Hasegawa, A., Hamada, Y., Mehandjiev, T., Koyama, K. In vitro growth and maturation as well as fertilization of mouse preantral oocytes from vitrified ovaries. Fertil Steril. 81 (Suppl 1), 824-830 (2004).
- Segino, M., et al. In vitro culture of mouse GV oocytes and preantral follicles isolated from ovarian tissues cryopreserved by vitrification. Hum Cell. 16 (3), 109-116 (2003).
- Kagawa, N., et al. Production of the first offspring from oocytes derived from fresh and cryopreserved pre-antral follicles of adult mice. Reprod Biomed. 14 (6), 693-699 (2007).
- Haidari, K., et al. The effects of different concentrations of leukemia inhibitory factor on the development of isolated preantral follicles from fresh and vitrified mouse ovaries. Iran Biomed J. 10, 4 (2006).
- Haidari, K., Salehnia, M., Rezazadeh Valojerdi, M. The effect of leukemia inhibitory factor and coculture on the in vitro maturation and ultrastructure of vitrified and nonvitrified isolated mouse preantral follicles. Fertil Steril. 90 (6), 2389-2397 (2008).
- Lin, T. C., et al. Comparison of the developmental potential of 2-week-old preantral follicles derived from vitrified ovarian tissue slices, vitrified whole ovaries and vitrified/transplanted newborn mouse ovaries using the metal surface method. BMC Biotechnol. 8, 38 (2008).
- Wang, X., Catt, S., Pangestu, M., Temple-Smith, P. Live offspring from vitrified blastocysts derived from fresh and cryopreserved ovarian tissue grafts of adult mice. Reproduction. 138 (3), 527-535 (2009).
- Suzuki, N., et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 30 (3), 608-615 (2015).
- Silber, S. J., et al. Cryopreservation and transplantation of ovarian tissue: Results from one center in the USA. J Assist Reprodu Genet. 35 (12), 2205-2213 (2018).
- Sänger, N., John, J., Einenkel, R., Schallmoser, A. First report on successful delivery after retransplantation of vitrified, rapid warmed ovarian tissue in Europe. Reprod Biomed. 49 (1), 103940 (2024).
- Parmegiani, L., et al. Testing the efficacy and efficiency of a single "universal warming protocol" for vitrified human embryos: prospective randomized controlled trial and retrospective longitudinal cohort study. J Assist Reprod Gen. 35 (10), 1887-1895 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved