A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام قليل النيوكليوتيدات الاصطناعية المعدلة لفحص إنزيمات استقلاب الحمض النووي
In This Article
Summary
هنا ، يتم تقديم بروتوكول لفحص إنزيمات استقلاب الحمض النووي ، باستخدام أمثلة على إنزيمات ligase و nuclease و polymerase. يستخدم الفحص قليل النيوكليوتيدات الموسومة بالفلورسنت وغير المسماة والتي يمكن دمجها لتشكيل دوبلكس تحاكي أضرار الحمض النووي الريبي و / أو الحمض النووي أو وسيطة المسار ، مما يسمح بتوصيف سلوك الإنزيم.
Abstract
سمح توفر مجموعة من قليل النيوكليوتيدات الاصطناعية المعدلة من البائعين التجاريين بتطوير مقايسات متطورة لتوصيف الخصائص المتنوعة لإنزيمات استقلاب الحمض النووي التي يمكن تشغيلها في أي مختبر بيولوجيا جزيئية قياسي. جعل استخدام الملصقات الفلورية هذه الطرق في متناول الباحثين الذين لديهم معدات PAGE الكهربائية القياسية وجهاز تصوير يدعم الفلورسنت ، دون استخدام مواد مشعة أو الحاجة إلى مختبر مصمم لتخزين وإعداد المواد المشعة ، أي مختبر ساخن. يمكن أن تؤدي الإضافة الاختيارية للتعديلات القياسية مثل الفسفرة إلى تبسيط إعداد الفحص ، في حين يمكن استخدام الدمج المحدد للنيوكليوتيدات المعدلة التي تحاكي تلف الحمض النووي أو المواد الوسيطة لاستكشاف جوانب محددة من سلوك الإنزيم. هنا ، يتم عرض تصميم وتنفيذ المقايسات لاستجواب العديد من جوانب معالجة الحمض النووي بواسطة الإنزيمات باستخدام oligonucleotides الاصطناعية المتاحة تجاريا. وتشمل هذه قدرة الأربطة على الانضمام أو النيوكليازات على تحلل الهياكل الهجينة المختلفة للحمض النووي والحمض النووي الريبي ، واستخدام العامل المساعد التفاضلي بواسطة إنزيم ربط الحمض النووي ، وتقييم قدرة ربط الحمض النووي للإنزيمات. تتم مناقشة العوامل التي يجب مراعاتها عند تصميم ركائز النوكليوتيدات الاصطناعية ، ويتم توفير مجموعة أساسية من oligonucleotides التي يمكن استخدامها لمجموعة من فحوصات إنزيم الحمض النووي ، والبلمرة ، ومقايسات إنزيم النيوكلياز.
Introduction
تتطلب جميع أشكال الحياة إنزيمات معالجة الحمض النووي لتنفيذ العمليات الحيوية الأساسية، بما في ذلك التضاعف والنسخ وإصلاح الحمض النووي (DNA). الوظائف الأنزيمية الرئيسية لهذه المسارات هي البلمرة ، التي تولد نسخا من جزيئات الحمض النووي الريبي / الحمض النووي ، والأربطة التي تنضم إلى ركائز عديد النوكليوتيد ، والنيوكليازات التي تحللها ، واللوليكات و topoisomerases ، التي تذوب دوبلكس الحمض النووي أو تغير طوبولوجيتها1،2،3،4،5،6،7،8،9،10. بالإضافة إلى ذلك ، توفر العديد من هذه الإنزيمات أدوات جزيئية أساسية لتطبيقات مثل الاستنساخ والتشخيص والتسلسل عالي الإنتاجية11،12،13،14،15.
يمكن تحديد الخصائص الوظيفية والحركية وخصائص الركيزة لهذه الإنزيمات باستخدام ركائز الحمض النووي / الحمض النووي الريبي المسماة التي تنتجها قلة النيوكليوتيدات التلدين. تم تحقيق ركائز التتبع والمنتجات تقليديا من خلال إدخال ملصق مشع (32P) إما في نهاية الشريط 5 بوصات ، والذي يمكن اكتشافه بعد ذلك بواسطة فيلم فوتوغرافي أو باستخدام نظام تصوير الفوسفور16,17. في حين أن الركائز ذات العلامات الإشعاعية توفر ميزة زيادة الحساسية التجريبية ولا تغير الخواص الكيميائية للنيوكليوتيد ، فإن المخاطر الصحية المحتملة من العمل مع النظائر المشعة شجعت على تطوير وسم الحمض النووي غير المشع لتوفير بديل أكثر أمانا للكشف عن الحمض النووي والحمض النووي الريبي18،19،20. من بين هؤلاء ، يبرز الكشف عن التألق ، بما في ذلك الكشف المباشر عن التألق ، والتألق الذي تم حله بمرور الوقت ، ومقايسات التبريد لنقل الطاقة / التألق باعتباره الأكثر تنوعا21،22،23،24. تتيح المجموعة الواسعة من الفلوروفورات تصميمات مختلفة لركائز الحمض النووي / الحمض النووي الريبي التي تتميز بمراسلين فريدين على كل قليل النوكليوتيد25. بالإضافة إلى ذلك ، فإن استقرار الفلوروفورات ، عند مقارنته بالنظائر المشعة ، يسمح للمستخدمين بإنتاج والحفاظ على كميات كبيرة من ركائز الحمض النووي الموسومة بالفلورسنت19. يمكن تحضين هذه الركائز ذات العلامات الفلوروفور بالبروتين محل الاهتمام ، جنبا إلى جنب مع مجموعات مختلفة من العوامل المساعدة للمعادن والنيوكليوتيدات ، لتحليل نشاط الارتباط و / أو الإنزيم. يمكن ملاحظة تصور الارتباط أو النشاط باستخدام قنوات صبغة الفلوروفور المختلفة مع نظام تصوير هلام. نظرا لأن قليل النيوكليوتيدات المسمى بالفلورسنت فقط سيكون مرئيا باستخدام هذه التقنية ، فإن أي زيادة أو نقصان في حجم قليل النوكليوتيد المسمى سيكون من السهل متابعته. يمكن أيضا تلطيخ المواد الهلامية بعد ذلك ، باستخدام أصباغ تلطيخ الحمض النووي لتصور جميع أشرطة الحمض النووي الموجودة على الجل.
أربطة الحمض النووي المتعددة هي إنزيمات تنضم إلى شظايا الحمض النووي / الحمض النووي الريبي ، وتحفز ختم الفواصل عن طريق تكوين رابطة فوسفاتية ثنائية الإستر بين ترميني الحمض النووي المفسفر 5 بوصات و 3 'OH من الحمض النووي. يمكن تقسيمها إلى مجموعتين وفقا لمتطلبات ركيزة النوكليوتيدات. تم العثور على الأربطة المعتمدة على NAD المحفوظة بشكل كبير في جميع البكتيريا26 بينما يمكن تحديد الإنزيمات المتنوعة هيكليا المعتمدة على ATP من خلال جميع مجالات الحياة 8,27. تلعب أربطة الحمض النووي دورا مهما في معالجة شظايا أوكازاكي أثناء النسخ المتماثل بالإضافة إلى مشاركتها في مسارات إصلاح الحمض النووي المختلفة ، مثل إصلاح النوكليوتيدات واستئصال القاعدة ، من خلال ختم النكات والخدوش التلقائية التي تترك بعد الإصلاح 8,10. تظهر أربطة الحمض النووي المختلفة قدرات متفاوتة على الانضمام إلى المطابقات المختلفة لفواصل الحمض النووي ، بما في ذلك الشقوق في دوبلكس ، وفواصل مزدوجة تقطعت بهم السبل ، وعدم تطابق ، وفجوات ، بالإضافة إلى هجين الحمض النووي الريبيوالحمض النووي 28،29،30. يمكن تجميع مجموعة متنوعة من الركائز القابلة للربط عن طريق تلدين قليل النوكليوتيدات مع فوسفات 5 'لتوليد 5' و 3' تيرميني جنبا إلى جنب في حمض نووي مزدوج31،32،33. الطريقة الأكثر شيوعا للتحليل هي الدقة بواسطة urea PAGE في تنسيق فحص نقطة النهاية. ومع ذلك ، فقد تضمنت الابتكارات الحديثة استخدام الرحلان الكهربائي للهلام الشعري ، والذي يسمح بإنتاجية عالية34 ، والتنميط الطيفيالكتلي 35 ، بالإضافة إلى مقايسة منارة جزيئية متجانسة ، والتي تسمح بالمراقبة التي تم حلهابمرور الوقت 36.
الخطوة الأولى في تفاعل الربط هي أدينيل إنزيم الليجاز بواسطة أدينوسين ثلاثي الفوسفات (ATP) أو نيكوتيناميد الأدينين ثنائي النوكليوتيد (NAD) ، مما ينتج عنه إنزيم تساهمي وسيط. الخطوة الثانية في التفاعل هي أدينيل ركيزة الحمض النووي على الطرف 5' من موقع النيك ، والذي يتبعه ربط خيوط الحمض النووي. يتم تنقية العديد من إنزيمات الليغاز التي يتم التعبير عنها بشكل مؤتلف في الإشريكية القولونية في شكل الأدينيل ، وبالتالي ، فهي قادرة على ربط الأحماض النووية بنجاح دون إضافة عامل مساعد نيوكليوتيد. وهذا يجعل من الصعب تحديد نوع العامل المساعد للنيوكليوتيدات الذي تحتاجه لربط الأحماض النووية. بالإضافة إلى وصف المقايسات لتقييم نشاط ربط الحمض النووي ، يتم أيضا تقديم طريقة لتحديد استخدام العامل المساعد بشكل موثوق عن طريق إزالة أدينيل الإنزيم باستخدام ركائز غير مصنفة.
النيوكليازات هي مجموعة كبيرة ومتنوعة من الإنزيمات المعدلة للحمض النووي / الحمض النووي الريبي والحمض النووي الريبي التحفيزي الذي يشق روابط الفوسفاتيستر بين الأحماض النووية37. وظائف إنزيم النيوكلياز مطلوبة في تكرار الحمض النووي وإصلاحه ومعالجة الحمض النووي الريبي ويمكن تصنيفها حسب خصوصية السكر للحمض النووي أو الحمض النووي الريبي أو كليهما. تحلل النوكليازات الداخلية روابط ثنائي الإستر الفوسفاتية داخل شريط الحمض النووي / الحمض النووي الريبي ، بينما تحلل إكسونوكلياز الحمض النووي / الحمض النووي الريبي نيوكليوتيد واحد في كل مرة من الطرف 3 'أو 5' وقد تفعل ذلك إما من 3' إلى 5' أو 5' إلى 3' نهاية الحمض النووي38.
في حين أن العديد من بروتينات النيوكلياز غير محددة وقد تشارك في عمليات متعددة ، فإن البعض الآخر محدد للغاية لتسلسل معين أو تلف الحمض النووي6،39،40. تستخدم النيوكليازات الخاصة بالتسلسل في مجموعة واسعة من تطبيقات التكنولوجيا الحيوية ، مثل الاستنساخ ، والطفرات ، وتحرير الجينوم. النيوكليازات الشائعة لهذه التطبيقات هي نيوكليازات التقييد41 ، نيوكليازات إصبع الزنك42 ، نيوكليازات المستجيب الشبيهة بالمنشط النسخي ، ومؤخرا ، نيوكليازات كريسبر43 الموجهة بالحمض النووي الريبي. تم تحديد النيوكليازات الخاصة بالضرر مؤخرا ، مثل EndoMS nuclease ، والتي تتميز بخصوصية عدم التطابق في الحمض النووي من خلال مجال النيوكلياز الشبيه ب RecB الخاص بعدم التطابق 5,44. تم إجراء فحوصات نشاط النيوكلياز ، تاريخيا ، كمقايسات متقطعة مع ركائز مشعة. ومع ذلك ، بالإضافة إلى عيوبها الأخرى ، لا تسمح هذه بتحديد الموقع الذي يتم قطعه بواسطة بروتين nuclease ، وهو أمر ممكن عند استخدام ركائز تحمل علامة الفلورسنت45,46. في الآونة الأخيرة ، تم تطوير مقايسات النيوكلياز المستمرة التي تعمل باستخدام أصباغ الحمض النووي المختلفة التي تتفاعل مع الحمض النووي في حالات مختلفة. على سبيل المثال ، إصدار إشارة فلورية أعلى عند التفاعل مع dsDNA مقارنة بحالته غير المنضمة ، أو الارتباط على وجه التحديد بالحمض النووي الريبي القصير47. تستخدم فحوصات النيوكلياز المستمرة الأخرى دبابيس شعر الحمض النووي مع مجموعة الفلوروفور على 5 'وإخماد في الطرف 3' بحيث يزداد التألق مع تحلل قليل النوكليوتيد بسبب فصل الفلوروفور والمروي48. في حين أن هذه المقايسات تسمح للمرء بتوصيف حركية البروتينات المهينة للحمض النووي ، فإنها تتطلب معرفة سابقة بوظيفة الإنزيم والركيزة وتقتصر أيضا على الإنزيمات التي تغير شكل الحمض النووي لإحداث اختلاف في ارتباط الصبغة. لهذا السبب ، لا تزال فحوصات نقطة النهاية التي تحل منتجات النيوكلياز الفردية مرغوبة لتوفير نظرة ثاقبة لتعديلات الحمض النووي الناتجة عن نشاط البروتين.
هنا ، يتم تقديم إجراء مفصل لتصميم قليل النيوكليوتيدات ذات العلامات الفلورية DNA / RNA والتي يمكن خلطها ومطابقتها لتوليد ركائز لاختبار نشاط إنزيمات النيوكلياز والبلمرة والليجاز الجديدة. إن التحقق من صحة هذه المجموعة الأساسية من تسلسل قليل النوكليوتيد يبسط التصميم التجريبي ويسهل التنميط الاقتصادي لمجموعة واسعة من الوظائف الأنزيمية دون الحاجة إلى شراء عدد كبير من الركائز المخصصة. يتم توفير إجراء مفصل لتشغيل مقايسة إنزيم معالجة الحمض النووي القياسية مع هذه الركائز ، باستخدام مثال نشاط ربط الحمض النووي والتعديلات لفحص وتحليل إنزيمات النيوكلياز والبلمرة. بالإضافة إلى ذلك ، يتم إعطاء اختبار معدل لتحديد خصوصية العامل المساعد لإنزيم ربط الحمض النووي بدقة عالية ، وتستخدم مجسات مزدوجة العلامات لتقييم تجميع الروابط متعددة المكونات. أخيرا ، تتم مناقشة التعديلات على تنسيق الفحص الأساسي للسماح باستخدامه لتحديد تفاعلات البروتين والحمض النووي مع نفس الركائز بواسطة مقايسة تحول الحركة الكهربية (EMSA).
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تصميم وشراء قليل النوكليوتيدات
ملاحظة: صمم قليل النيوكليوتيدات أحادية الشريط ليتم تجميعها وتلدينها في الدوبلكس المطلوب. يجب أن يحمل واحد أو أكثر من الخيوط في دوبلكس جزءا من الفلورسنت لتتبع معالجة قليل النوكليوتيد بواسطة الإنزيم محل الاهتمام. وترد في الجدول 1 مجموعة أساسية من التسلسلات المفردة التي يمكن تجميعها لمجموعة من الأنشطة.
- قم بدمج التعديلات المحددة اللازمة للإنزيم محل الاهتمام كما هو موضح أدناه.
- بالنسبة لركائز إنزيم ربط الحمض النووي (الشكل 1): قم بتجميع أبسط ركيزة من ثلاثة قليل النيوكليوتيدات: حبلا مانحا مفسفرا 5 بوصات (NL2) ، وشريط متقبل يحمل علامة FAM مقاس 5 بوصات (NL1) ، ومكمل يربط بين الاثنين (NL3).
- تأكد من فسفرة الخيوط التي توفر نهاية 5 بوصات من الشق القابل للشفط قبل تجميع المزيج الرئيسي للركيزة في الخطوة 2. اطلب هذا كتعديل على NL2 (كما هو موضح في الجدول 1) أو استخدم الفسفرة الأنزيمية مع كيناز متعدد النوكليوتيد T4 بعد تعليق قليل النيوكليوتيدات.
- قم بتضمين الفسفرة الطرفية 5 'ل NL6 و NL8 ، والتي تشتمل على تكملة الفواصل المزدوجة التي تقطعت بها السبل الموضحة في الشكل 1A (NL6 / NL7 و NL8 / NL9) لأن هذا يشبه إلى حد كبير الركيزة الطبيعية المنتجة من نوكلياز داخلي مقيد. استخدم ركيزة مزدوجة التسمية لتحديد النطاقات النسبية للربط للتجميعات متعددة الأجزاء (انظر الخطوة 6).
- قم بتغيير الشريط المكمل لإنتاج عدم تطابق (NL10) وفجوات (NL11).
ملاحظة: يتم تصوير الاختلافات على الركيزة البسيطة في الشكل 1A. من الممكن استخدام تسلسلات أخرى لإنتاج نطاق أوسع من عدم التطابق أو فجوات أطول عن طريق تغيير الموضع الذي تحته خط. - استبدل قليل النيوكليوتيدات في الحمض النووي (DNA) بقليل النيوكليوتيدات في الحمض النووي الريبي.
ملاحظة: يتم تصوير الاختلافات على الركيزة البسيطة في الشكل 1B. يمكن إنشاء نطاق أوسع من دوبلكس الحمض النووي / الحمض النووي الريبي من خلال مجموعات إضافية من مجموعة الأساس المعطاة هنا لتوليد ، على سبيل المثال ، فواصل مزدوجة الشريط تحتوي على كل من الحمض النووي الريبي والحمض النووي. ويرد مثال على هذا الاختلاف في الخطوة 6 أدناه، حيث يتم استخدام استراتيجية التسمية المزدوجة.
- بالنسبة لركائز بوليميراز الحمض النووي: قم بتجميع قليل النيوكليوتيدات NL1 و NL3 المدرجة في الجدول 1 لإعطاء اختبار بسيط لتمديد التمهيدي. تحقق من الجوانب الإضافية لنشاط البلمرة عن طريق إدخال تعديلات على خيوط NL1 (التمهيدي) أو NL3 (القالب).
- دمج نظائر القاعدة التالفة في قليل النوكليوتيد NL3 قبل الموضع 20 لتحديد القدرة على تجاوز الآفات التالفة على حبلا القالب.
- دمج نظائر القاعدة التالفة في قليل النوكليوتيد NL1 في الموضع 20 لتحديد القدرة على تمديد التمهيدي التالف.
- استخدم إما RNL1 أو RNL3 في الطباعة على الوجهين للتحقيق في امتداد التمهيدي للحمض النووي الريبي أو استخدام قالب الحمض النووي الريبي.
- بالنسبة لركائز النيوكلياز (الشكل 2): قم بتجميع قليل النيوكليوتيدات لإعطاء مجموعة غير شاملة من الركائز المزدوجة والمفردة التي تقطعت بها السبل (الشكل 2Ai) بالإضافة إلى مجموعة من التقاطعات المرفرفة والمفلطحة (الشكل 2Aii) والركائز التالفة (الشكل 2B).
- للتحقق من أنشطة الريبونوكلياز ، استبدل بشكل متكرر NL1 و NL2 و NL3 ب RNL1 و RNL2 و RNL3. استخدم إصدارات RNA إضافية من HJ5 و HJ6 لتوسيع هذه المجموعة بشكل أكبر.
- استخدم قليل النيوكليوتيدات MD5 و MD6 و MD9 التي تحتوي على تعديل مركزي يحاكي الضرر التأكسدي أو وسيط إصلاح غير أساسي أو منتج نزع الأمين (الشكل 2 ب). ستكتشف الركائز انشقاق الخيط في هذا الموضع. قم بتسمية الشريط المكمل NL3 بفلوروفور متعامد مثل TAMRA للكشف عن الانقسام المزدوج (انظر الخطوة 6).
- استخدم الملصقات المتعامدة للمكمل للكشف عن القطع المزدوج الذي تقطعت به السبل في المواقع غير المتطابقة على كل من المسبار (NL5 و ND9) والخيوط المتممة (MD10 و NL10).
- بالنسبة لركائز إنزيم ربط الحمض النووي (الشكل 1): قم بتجميع أبسط ركيزة من ثلاثة قليل النيوكليوتيدات: حبلا مانحا مفسفرا 5 بوصات (NL2) ، وشريط متقبل يحمل علامة FAM مقاس 5 بوصات (NL1) ، ومكمل يربط بين الاثنين (NL3).
- اطلب قليل النيوكليوتيدات الاصطناعية التي تتضمن الفلوروفورات ذات الصلة والتعديلات الأخرى من بائع تجاري.
ملاحظة: مقياس توليف 100 نانومتر وتنقية HPLC بعد التوليف مناسبان للفحوصات الموصوفة.
2. تجميع وتلدين دوبلكس الحمض النووي
- إعادة تعليق وتخفيف قليل النوكليوتيدات
- قبل الفتح ، يقوم جهاز الطرد المركزي بقليل النيوكليوتيدات المجففة بالتجميد في أنابيب 2 مل بأقصى سرعة في جهاز طرد مركزي على الطاولة لمدة 2-5 دقائق لضمان وجود الحمض النووي في قاع الأنبوب.
- قم بإعداد مخزون رئيسي يبلغ 100 ميكرومتر عن طريق إعادة تعليق قليل النوكليوتيدات في المخزن المؤقت TE (10 mM tris (hydroxymethyl) aminomethane (Tris) ، 1 mM ethylenediaminetetraacetic acid (EDTA)). تأكد من إعادة تعليق قليل النوكليوتيدات تماما عن طريق الدوامة اللطيفة المتكررة والطرد المركزي القصير بأقصى سرعة.
- قم بإعداد مخزون 10 ميكرومتر عن طريق تخفيف حصة المخزون الرئيسي باستخدام مخزن TE المؤقت. قم بتخفيف مخزون 10 ميكرومتر بماء فائق النقاء (ماء MQ) لإعداد مخزون عامل بتركيزات 0.5 ميكرومتر أو 0.7 ميكرومتر أو 2.5 ميكرومتر كما هو موضح في الجدول 2.
- تجميع وتلدين الخلطات الرئيسية للتفاعل
- استخدم مخزون العمل لتكوين الخلطات الرئيسية للتفاعل باستخدام المجموعات الواردة في الجدول 2 والأحجام الواردة في الجدول 3. بالنسبة لمقايسة ربط الحمض النووي القياسية ومعظم المقايسات الأخرى الموصوفة هنا ، فإن التركيب العازل النهائي هو 50 mM Tris pH 8.0 ، 50 mM NaCl ، 10 mM Dithiothreitol (DTT) مع 10 mM Mg ككاتيون ثنائي التكافؤ.
- قم بتلدين قليل النيوكليوتيدات في أنبوب PCR أو أنبوب طرد مركزي دقيق عن طريق التسخين عند 95 درجة مئوية لمدة 5 دقائق باستخدام كتلة تسخين أو جهاز تدوير حراري. اتركيه ليبرد إلى درجة حرارة الغرفة لمدة 30 دقيقة (الأحجام <1 مل) إلى 1 ساعة (الأحجام >1 مل). للحصول على قليل النيوكليوتيدات الأطول (>40 nt) ، قم بإجراء تبريد أبطأ باستخدام جهاز تدوير حراري مع منحدر سفلي من 95 درجة مئوية إلى 25 درجة مئوية على مدار 45 دقيقة ، أو قم بتعويم الأنبوب الذي يحتوي على خليط التلدين في دورق سعة 1 لتر من الماء المغلي واتركه يبرد إلى درجة حرارة الغرفة طوال الليل.
- أضف العوامل المساعدة للنيوكليوتيدات والمكونات العازلة الأخرى الحساسة للحرارة إلى المزيج الرئيسي بعد التبريد إلى درجة حرارة الغرفة. استخدم خليط التفاعل النهائي مباشرة للفحص عن طريق إضافة الإنزيم (انظر الخطوة 3 أدناه) أو خزنه في -20 درجة مئوية للاستخدام في المستقبل.
3. إعداد الفحص القياسي
- تجميع وبدء رد فعل الفحص
- اجمع بين 22.5 ميكرولتر من مزيج الركيزة الرئيسي المثير للاهتمام مع 2.5 ميكرولتر من إنزيم ربط الحمض النووي أو أي إنزيم آخر مهم في أنبوب تفاعل البوليميراز المتسلسل. قم بتشغيل التفاعلات في نسختين أو ثلاث نسخ ، خاصة إذا كانت النتائج سيتم قياسها كميا.
- قم بتضمين عنصر تحكم خال من البروتين (مخزن مؤقت فقط) في عينات الفحص. لا تقم بتضمين عناصر تحكم العامل المساعد في هذه المرحلة ، إذا لزم الأمر.
ملاحظة: يمكن تخزين الإنزيمات عند -20 درجة مئوية في 50٪ v / v glycerol ، مما يسمح بسحبها مباشرة من المحلول. تأكد من خلط محاليل الإنزيم مع الجلسرين جيدا قبل الإضافة ، إما عن طريق السحب للخلط أو عن طريق الدوامة اللطيفة.
- نقل ردود الفعل على الفور إلى جهاز PCR على حرارة 25 درجة مئوية واحتضانها لمدة 30 دقيقة. تختلف درجة الحرارة والمدة حسب الظروف المثلى لنشاط الإنزيم.
- إخماد التفاعلات عن طريق إضافة 5 ميكرولتر من صبغة التحميل (95٪ فورماميد ، 0.5 متر حمض إيثيلين ديامينيترايتيك (EDTA) ، بروموفينول أزرق) واحتضانها عند 95 درجة مئوية لمدة 5 دقائق.
4. تحليل نتائج الفحص
- تحضير المواد الهلامية Tris-Borate-EDTA (TBE)-Urea PAGE كما هو موضح أدناه.
- تحضير مخزون من 20 ٪ مادة الأكريلاميد ، 7 M اليوريا ، و 1x TBE الحل. بالنسبة لمجموعة قليل النوكليوتيد الموصوفة هنا ، استخدم محلول الأكريلاميد / مكرر بنسبة 29: 1 للحصول على الدقة المثلى.
- بالنسبة لهلام واحد ، امزج 10 مل من 20٪ أكريلاميد و 7 M محلول يوريا مع 100 ميكرولتر من APS (10٪) و 3 ميكرولتر من رباعي ميثيل إيثيلين ديامين (TMED) وصب في عجلة هلام.
- بعد أن يصلب الجل ، قم بتشغيل العينات على جل اليوريا TBE عند 45 - 55 درجة مئوية.
- قم بتشغيل الجل مسبقا في مخزن مؤقت 1x TBE لمدة 30 دقيقة عند 10 مللي أمبير لكل هلام مع تسخين خارجي.
- قم بإزالة اليوريا الزائدة في آبار الجل عن طريق التنظيف باستخدام 1x TBE باستخدام ماصة المراعي.
- قم بتحميل 10 ميكرولتر من كل تفاعل وقم بتشغيله عند 10 مللي أمبير لمدة 1.0-1.5 ساعة مع التسخين الخارجي.
- تصور الجل على جهاز التصوير بالإعدادات الصحيحة للفلوروفور المختار. بالنسبة إلى FAM ، استخدم مجموعة مرشح تعطي إثارة / انبعاثا عند 495/519 نانومتر ، والتي يتم تخزينها كإعداد مسبق في معظم أجهزة التصوير.
- حدد شدة النطاق للمنتج والركيزة باستخدام برنامج معالجة الصور مع جهاز التصوير ، أو برنامج خارجي مثل ImageJ49,50 واحسب النسبة المئوية للمنتج باستخدام الصيغة
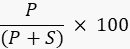
حيث P هي القيمة المتكاملة لنطاق المنتج ، و S هي المنطقة المتكاملة لنطاق الركيزة. في حالة مثال تفاعل إنزيم الربط DNA ، يعمل شريط الناتج عند 40 نيوكليوتيدات (nt) وشريط الركيزة عند 20 nt.
5. إزالة أدينيل من إنزيم الحمض النووي لاختبار خصوصية العامل المساعد
- تحضير خلطات التفاعل الرئيسية
- قم بإعداد مجموعة واحدة من المزيج الرئيسي الذي يحتوي على قليل النوكليوتيد NL1 المسمى FAM كما هو موضح في الجدول 4. قم بإعداد مجموعة ثانية تحتوي على قليل النوكليوتيد NL1 بدون ملصق FAM ، كما هو موضح في الجدول 4.
- بشكل منفصل ، سخني كلا من DNA duplexs إلى 95 درجة مئوية لمدة 5 دقائق وابرد لمدة 30 دقيقة إلى 1 ساعة عند 25 درجة مئوية. لا تقم بإضافة عامل مساعد النوكليوتيدات إلى أي من المزيج الرئيسي.
- تجميع وبدء تفاعل إزالة الأدينيل
- قم بإعداد تفاعل واحد لإزالة الأدينيل لكل نوع / تركيز عامل مساعد ليتم اختباره من خلال الجمع بين 10 ميكرولتر من المزيج الرئيسي غير المسمى مع 2.5 ميكرولتر من إنزيم الليجاز.
- قم بإعداد أنابيب إضافية كتحكم بدون عامل مساعد ولا تحكم في البروتين (2.5 ميكرولتر من المخزن المؤقت المضاف بدلا من الإنزيم).
- احتضان التفاعلات عند درجة حرارة محددة للنشاط الأمثل للإنزيم ، لمدة 1-2 ساعة. يمكن زيادة وقت الحضانة إذا كان الإنزيم لا يزال أدينيل.
- قم بتشغيل تفاعل الربط مع العامل المساعد.
- أضف 10 ميكرولتر من المزيج الرئيسي المسمى و 2.5 ميكرولتر من العوامل المساعدة للنيوكليوتيدات المرغوبة (على سبيل المثال ، ATP أو NAD أو ADP أو GTP) مباشرة إلى تفاعل إزالة الأدينيل (0.1-1 mM التركيز النهائي).
- أضف 2.5 ميكرولتر من المخزن المؤقت للتفاعل إلى عنصر التحكم في العامل المساعد بدون نيوكليوتيدات.
- احتضان التفاعلات لنفس الفترة الزمنية ودرجة الحرارة المستخدمة سابقا. إخماد وتصور كما هو موضح في الخطوة 4.
6. استخدام ركائز مزدوجة التسمية لربط الجبيرة أو التجميع متعدد الأجزاء
- تصميم وشراء قليل النوكليوتيد مع جزء فلورسنت له طيف إثارة / انبعاث مختلف عن الفلوروفور المستخدم بالفعل.
- في الإعداد الموصوف هنا ، استخدم قليل النوكليوتيد NL2 (TAMRA) الذي يحتوي على 5-كربوكسي تترا ميثيل رودامين (TAMRA) في نهاية 3 '(الجدول 1).
- قم بتجميع المزيج الرئيسي كما هو موضح أدناه.
- اجمع بين مكونات التفاعل الموصوف في الخطوة 2 ، بما في ذلك النسب المتساوية لجميع oligonucleotides المستخدمة في التجميع ، وكذلك الكاتيونات العازلة وثنائية التكافؤ.
- يصلب عن طريق التسخين عند 95 درجة مئوية لمدة 5 دقائق والتبريد عند 25 درجة مئوية لمدة 30 دقيقة - 1 ساعة. أضف العامل المساعد والإنزيم واحتضانه كما هو موضح في الخطوة 3.
- قم بتشغيل وتصوير العينات كما هو موضح في الخطوة 4 باستخدام القنوات المناسبة لزوج الفلوروفور في الركيزة. في حالة FAM و TMRA ، هذه هي قنوات Fluorescein (FITC) و Tetramethyl rhodamine (TRITC) الموجودة في معظم أجهزة التصوير.
7. تقييم ارتباط الحمض النووي بواسطة مقايسة تحول الحركة الكهربائية (EMSA) على الجل الأصلي
- قم بإعداد جل TBE PAGE الأصلي بنسبة 10٪ كما هو موضح أدناه.
- الجمع بين 2.5 مل من 40 ٪ مادة الأكريلاميد ، 1 مل من 10x TBE ، 100 ميكرولتر من 10 ٪ APS ، 3 ميكرولتر من TMED ، و 6.5 مل من الماء MQ ويلقي في عجلة هلام.
- قم بتجميع تفاعل الربط كما هو موضح أدناه.
- قم بتجميع ركيزة EMSA وفقا للجدول 5 بحيث يتم تضمين EDTA (10 mM) وحذف أيونات المعادن.
- اجمع بين 20 ميكرولتر من المزيج الرئيسي للركيزة EMSA مع 5 ميكرولتر من البروتين في أنبوب PCR. قم بتضمين عينة خالية من البروتين. احتضان لمدة 30 دقيقة على 25 درجة مئوية.
- تحليل بواسطة الكهربائي الأصلي كما هو موضح أدناه.
- أضف 5 ميكرولتر من صبغة التحميل الأصلية 5x (100 mM EDTA ، 0.25٪ بروموفينول أزرق ، 25٪ v / v جلسرين ، وماء MQ حتى 1 مل) إلى العينات.
- قم بالتحميل على الجل المحضر وقم بتشغيله عند 60 فولت لمدة 2-3 ساعات مع التبريد عن طريق دوران الماء حتى تصبح واجهة الصبغة على ارتفاع بضعة سنتيمترات فوق نهاية الجل.
- تصور وتحليل المواد الهلامية كما هو موضح في الخطوة 4.
Access restricted. Please log in or start a trial to view this content.
النتائج
الربط بواسطة إنزيم ربط الحمض النووي
سيؤدي النشاط الأنزيمي لإنزيم ربط الحمض النووي إلى زيادة في حجم قليل النوكليوتيد المسمى بالفلورسنت عند تصوره على هلام اليوريا PAGE. في حالة الركائز لكل من ربط الحمض النووي والحمض النووي الريبي المدرجة في الجدول 2 ، فإن هذا يتوافق مع مضا...
Access restricted. Please log in or start a trial to view this content.
Discussion
الخطوات الحاسمة في البروتوكول
تصميم وشراء قليل النوكليوتيد: عند شراء قليل النوكليوتيدات لتشكيل مزدوج ، من الضروري مراعاة تصميم التسلسل. يوصى باستخدام أداة محلل oligo للتنبؤ بخصائص تسلسل النوكليوتيدات ، مثل محتوى GC ، ودرجة حرارة الانصهار ، والبنية الثانوية ، وإمكانية dimerization ، قب?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
SEG و UR موظفان في ArcticZymes Technologies AS التي توزع R2D ligase. ليس لدى AW و ER-S و RS مصالح متنافسة.
Acknowledgements
يتم دعم AW من قبل زمالة رذرفورد ديسكفري (20-UOW-004). RS هو المستفيد من منحة نيوزيلندا بعد القطب الجنوبي. تعترف SG و UR بالمعهد الكيميائي في جامعة ترومسو - جامعة القطب الشمالي النرويجية للدعم الفني.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution (29:1) | BioRad | 1610156 | |
| Adenosine triphosphate (ATP) | Many suppliers | ||
| Ammonium persulfate (APS) | Many suppliers | ||
| Benchtop centrifuge | Many suppliers | ||
| Borate | Many suppliers | ||
| Bromophenol blue | Many suppliers | ||
| Dithiothreitol (DTT) | Many suppliers | ||
| Electrophoresis system with circulating water bath | Many suppliers | ||
| Ethylenediaminetetraacetic acid (EDTA) | Many suppliers | ||
| Fluoresnence imager, e.g. iBright FL1000 | Thermo Fisher Scientific | A32752 | |
| Formamide | Many suppliers | ||
| Gel casting system | Many suppliers | ||
| Heating block | Many suppliers | ||
| Magnesium Chloride | Many suppliers | Other metal ions may be preferred depending on the protein studied | |
| Microcentrifuge tubes (1.5 mL) | Many suppliers | ||
| Micropipettes and tips | Many suppliers | 1 mL, 0.2 mL, 0.02 mL, 0.002 mL | |
| Nicotinamide adenine dinucleotide (NAD+) | Many suppliers | ||
| Oligonucleotides | Integrated DNA Technologies | NA | Thermo Fisher, Sigma-Aldrich, Genscript and others also supply these |
| pasture pipette | Many suppliers | ||
| PCR thermocycler | Many suppliers | ||
| PCR tubes | Many suppliers | ||
| RNAse away | ThermoFisher | 7002PK | Only needed when working with RNA oligos |
| RNase AWAY | Merck | 83931-250ML | Surfactant for removal of RNAse contamination on surfaces |
| RNAse-free water | New England Biolabs | B1500L | Only needed when working with RNA oligos |
| Sodium Chloride | Many suppliers | ||
| SUPERase IN RNase inhibitor | Thermo Fisher Scientific | AM2694 | Broad spectrum RNAse inhibitir (protein-based) |
| SYBR Gold | Thermo Fisher Scientific | S11494 | This may be used to post-stain gels and visualise unlabelled oligonucleotides |
| Tetramethylethylenediamine (TMED) | Many suppliers | ||
| Tris, or tris(hydroxymethyl)aminomethane | Many suppliers | ||
| Ultrapure water (Milli-Q) | Merck | ||
| urea | Many suppliers | ||
| Vortex | Many suppliers |
References
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363 (6429), 7003(2019).
- Yang, W., Gao, Y. Translesion and repair DNA polymerases: Diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Lohman, T. M., Fazio, N. T. How does a helicase unwind DNA? Insights from RecBCD Helicase. Bioessays. 40 (6), e1800009(2018).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Res. 45 (20), 12025-12038 (2017).
- Wozniak, K. J., Simmons, L. A. Bacterial DNA excision repair pathways. Nat Rev Microbiol. 20 (8), 465-477 (2022).
- Zhang, L., Jiang, D., Wu, M., Yang, Z., Oger, P. M. New insights into DNA repair revealed by NucS endonucleases from hyperthermophilic Archaea. Front Microbiol. 11, 1263(2020).
- Saathoff, J. H., Kashammer, L., Lammens, K., Byrne, R. T., Hopfner, K. P. The bacterial Mre11-Rad50 homolog SbcCD cleaves opposing strands of DNA by two chemically distinct nuclease reactions. Nucleic Acids Res. 46 (21), 11303-11314 (2018).
- Williamson, A., Leiros, H. S. Structural insight into DNA joining: from conserved mechanisms to diverse scaffolds. Nucleic Acids Res. 48 (15), 8225-8242 (2020).
- Caglayan, M. Interplay between DNA polymerases and DNA ligases: Influence on substrate channeling and the fidelity of DNA ligation. J Mol Biol. 431 (11), 2068-2081 (2019).
- Shuman, S. DNA ligases: Progress and prospects. J Biol Chem. 284 (26), 17365-17369 (2009).
- Lohman, G. J., Tabor, S., Nichols, N. M. DNA ligases. Curr Prot Mol Biol. , Chapter 3, Unit 3.14 (2011).
- Rittié, L., Perbal, B. Enzymes used in molecular biology: a useful guide. J Cell Commun Signal. 2 (1-2), 25-45 (2008).
- Chandrasegaran, S., Carroll, D. Origins of programmable nucleases for genome engineering. J Mol Biol. 428 (5), Part b 963-989 (2016).
- Aschenbrenner, J., Marx, A. DNA polymerases and biotechnological applications. Curr Opin Biotechnol. 48, 187-195 (2017).
- Loenen, W. A. M., Dryden, D. T. F., Raleigh, E. A., Wilson, G. G., Murray, N. E. Highlights of the DNA cutters: a short history of the restriction enzymes. Nucleic Acids Res. 42 (1), 3-19 (2013).
- Voytas, D., Ke, N. Detection and quantitation of radiolabeled proteins and DNA in gels and blots. Curr Protoc Immunol. , Appendix 3 (A) (2002).
- Phillips, D. H. Detection of DNA modifications by the 32P-postlabelling assay. Mutat Res. 378 (1-2), 1-12 (1997).
- Huang, C., Yu, Y. T. Synthesis and labeling of RNA in vitro. Curr Prot Mol Biol. , Chapter 4, Unit 4.15 (2013).
- Ballal, R., Cheema, A., Ahmad, W., Rosen, E. M., Saha, T. Fluorescent oligonucleotides can serve as suitable alternatives to radiolabeled oligonucleotides. J Biomol Tech. 20 (4), 190-194 (2009).
- Anderson, B. J., Larkin, C., Guja, K., Schildbach, J. F. Using fluorophore-labeled oligonucleotides to measure affinities of protein-DNA interactions. Meth Enzymol. 450, 253-272 (2008).
- Liu, W., et al. Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay. Sci Rep. 7 (1), 40125(2017).
- Ma, C., et al. Simultaneous detection of kinase and phosphatase activities of polynucleotide kinase using molecular beacon probes. Anal Biochem. 443 (2), 166-168 (2013).
- Li, J., Cao, Z. C., Tang, Z., Wang, K., Tan, W. Molecular beacons for protein-DNA interaction studies. Meth Mol Biol. 429, 209-224 (2008).
- Yang, C. J., Li, J. J., Tan, W. Using molecular beacons for sensitive fluorescence assays of the enzymatic cleavage of nucleic acids. Meth Mol Biol. 335, 71-81 (2006).
- Nikiforov, T. T., Roman, S. Fluorogenic DNA ligase and base excision repair enzyme assays using substrates labeled with single fluorophores. Anal Biochem. 477, 69-77 (2015).
- Pergolizzi, G., Wagner, G. K., Bowater, R. P. Biochemical and structural characterisation of DNA ligases from bacteria and Archaea. Biosci Rep. 36 (5), 00391(2016).
- Martin, I. V., MacNeill, S. A. ATP-dependent DNA ligases. Genome Biol. 3 (4), REVIEWS3005 (2002).
- Bilotti, K., et al. Mismatch discrimination and sequence bias during end-joining by DNA ligases. Nucleic Acids Res. 50 (8), 4647-4658 (2022).
- Bauer, R. J., et al. Comparative analysis of the end-joining activity of several DNA ligases. PLoS One. 12 (12), e0190062(2017).
- Lohman, G. J. S., Zhang, Y., Zhelkovsky, A. M., Cantor, E. J., Evans, T. C. Efficient DNA ligation in DNA-RNA hybrid helices by Chlorella virus DNA ligase. Nucleic Acids Res. 42 (3), 1831-1844 (2014).
- Bullard, D. R., Bowater, R. P. Direct comparison of nick-joining activity of the nucleic acid ligases from bacteriophage T4. Biochem J. 398 (1), 135-144 (2006).
- Magnet, S., Blanchard, J. S. Mechanistic and kinetic study of the ATP-dependent DNA ligase of Neisseria meningitidis. Biochemistry. 43 (3), 710-717 (2004).
- Williamson, A., Grgic, M., Leiros, H. S. DNA binding with a minimal scaffold: structure-function analysis of Lig E DNA ligases. Nucleic Acids Res. 46 (16), 8616-8629 (2018).
- Lohman, G. J., et al. A high-throughput assay for the comprehensive profiling of DNA ligase fidelity. Nucleic Acids Res. 44 (2), e14(2016).
- Kim, J., Mrksich, M. Profiling the selectivity of DNA ligases in an array format with mass spectrometry. Nucleic Acids Res. 38 (1), e2(2010).
- Tang, Z. W., et al. Real-time monitoring of nucleic acid ligation in homogenous solutions using molecular beacons. Nucleic Acids Res. 31 (23), e148(2003).
- Yang, W. Nucleases: diversity of structure, function and mechanism. Q Rev Biophys. 44 (1), 1-93 (2011).
- Marti, T. M., Fleck, O. DNA repair nucleases. Cell Mol Life Sci. 61 (3), 336-354 (2004).
- Wang, B. B., et al. Review of DNA repair enzymes in bacteria: With a major focus on AddAB and RecBCD. DNA Repair. 118, 103389(2022).
- Pidugu, L. S., et al. Structural insights into the mechanism of base excision by MBD4. J Mol Biol. 433 (15), 167097(2021).
- Roberts, R. J. How restriction enzymes became the workhorses of molecular biology. Proc Natl Acad Sci U S A. 102 (17), 5905-5908 (2005).
- Miller, J. C., et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nat Biotechnol. 25 (7), 778-785 (2007).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Takemoto, N., Numata, I., Su'etsugu, M., Miyoshi-Akiyama, T. Bacterial EndoMS/NucS acts as a clamp-mediated mismatch endonuclease to prevent asymmetric accumulation of replication errors. Nucleic Acids Res. 46 (12), 6152-6165 (2018).
- Reardon, J. T., Sancar, A. Molecular anatomy of the human excision nuclease assembled at sites of DNA damage. Mol Cell Biol. 22 (16), 5938-5945 (2002).
- Kunkel, T. A., Soni, A. Exonucleolytic proofreading enhances the fidelity of DNA synthesis by chick embryo DNA polymerase-gamma. J Biol Chem. 263 (9), 4450-4459 (1988).
- Sheppard, E. C., Rogers, S., Harmer, N. J., Chahwan, R. A universal fluorescence-based toolkit for real-time quantification of DNA and RNA nuclease activity. Sci Rep. 9 (1), 8853(2019).
- Li, J. J., Geyer, R., Tan, W. Using molecular beacons as a sensitive fluorescence assay for enzymatic cleavage of single-stranded DNA. Nucleic Acids Res. 28 (11), e52(2000).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Meth. 9 (7), 671-675 (2012).
- Sharma, J. K., et al. Methods for competitive enrichment and evaluation of superior DNA ligases. Meth Enzymol. 644, 209-225 (2020).
- Rzoska-Smith, E., Stelzer, R., Monterio, M., Cary, S. C., Williamson, A. DNA repair enzymes of the Antarctic Dry Valley metagenome. Front Microbiol. 14, 1156817(2023).
- Williamson, A., Pedersen, H. Recombinant expression and purification of an ATP-dependent DNA ligase from Aliivibrio salmonicida. Protein Expres Purif. 97 (0), 29-36 (2014).
- Akey, D., et al. Crystal structure and nonhomologous end-joining function of the ligase component of Mycobacterium DNA ligase D. J Biol Chem. 281 (19), 13412-13423 (2006).
- Kim, D. J., et al. ATP-dependent DNA ligase from Archaeoglobus fulgidus displays a tightly closed conformation. Acta Crystallogr Sect F Struct Biol Cryst Commun. 65, Pt 6 544-550 (2009).
- Nishida, H., Kiyonari, S., Ishino, Y., Morikawa, K. The closed structure of an archaeal DNA ligase from Pyrococcus furiosus. J Mol Biol. 360 (5), 956-967 (2006).
- Gundesø, S., et al. R2D ligase: Unveiling a novel DNA ligase with surprising DNA-to-RNA ligation activity. Biotechnol J. 19 (3), e2300711(2024).
- Hendling, M., Barišić, I. In silico design of DNA oligonucleotides: Challenges and approaches. Comput Struct Biotechnol J. 17, 1056-1065 (2019).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harb Prot. 2019 (2), 10.1101/pdb.top101857 (2019).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). J Vis Exp. (32), e1485(2009).
- Smith, D. R. Gel Electrophoresis of DNA. Mol Biometh Handbook. , Humana Press. Totowa, NJ. 17-33 (1998).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. (63), e3998(2012).
- Rousseau, M., et al. Characterisation and engineering of a thermophilic RNA ligase from Palaeococcus pacificus. Nucleic Acids Res. 52 (7), 3924-3937 (2024).
- Kestemont, D., Herdewijn, P., Renders, M. Enzymatic synthesis of backbone-modified oligonucleotides using T4 DNA ligase. Curr Prot Chem Biol. 11 (2), e62(2019).
- Farell, E. M., Alexandre, G. Bovine serum albumin further enhances the effects of organic solvents on increased yield of polymerase chain reaction of GC-rich templates. BMC Res Notes. 5, 257(2012).
- Nazarenko, I., Pires, R., Lowe, B., Obaidy, M., Rashtchian, A. Effect of primary and secondary structure of oligodeoxyribonucleotides on the fluorescent properties of conjugated dyes. Nucleic Acids Res. 30 (9), 2089-2195 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved