Research Article
تعمل Munziq العشبية على تحسين إصابة نقص تروية عضلة القلب عن طريق تثبيط الالتهاب
In This Article
Summary
تبحث هذه الدراسة في التأثيرات الوقائية للقلب ل Munziq ، وهو مستحضر عشبي تقليدي من الأويغور ، على إصابة نقص تروية عضلة القلب (MIRI) في الفئران ذات سوائل الجسم غير الطبيعية. من خلال الأساليب التجريبية الشاملة ، نوضح قدرة Munziq على التخفيف من MIRI عن طريق قمع مسار إشارات NF-κB.
Abstract
كان الهدف من هذه الدراسة هو التحقيق في التأثيرات الوقائية للقلب لموزيك على إصابة نقص تروية عضلة القلب وإعادة التروية غير الطبيعية لسوائل الجسم (MIRI) وآليتها الأساسية. تمت معالجة الفئران والجرذان الطبيعية ذات سوائل الجسم غير الطبيعية (ABF) مسبقا ب Munziq لمدة 21 يوما. بعد ذلك ، تم إنشاء نماذج MIRI. لوحظت التغيرات النسيجية المرضية وتغيرات البنية التحتية لعضلة القلب عن طريق تلطيخ الهيماتوكسيلين والإيوسين (HE) والفحص المجهري الإلكتروني للإرسال لمراقبة المظاهر المرضية لإصابة عضلة القلب. تم الكشف عن مستويات مصل CK-MB و cTn-T و ICAM-1 بواسطة مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) لمراقبة العلامات المتعلقة بإصابة عضلة القلب. كما تم الكشف عن مستويات IL-1β و IL-6 و TNF-α في أنسجة المصل وعضلة القلب بواسطة ELISA لمراقبة التأثير المضاد للالتهابات. تم الكشف عن مستويات التعبير عن البروتينات المرتبطة بمسار إشارات NF-κB NIK و IKKα و Pikα و p65 عن طريق تحليل اللطخة الغربية. أظهرت النتائج أن إصابة عضلة القلب في مجموعة ABF MIRI كانت أكثر حدة مقارنة بمجموعة MIRI الضابطة. يمكن للعلاج المسبق Munziq التخفيف من التغيرات المرضية الناجمة عن إصابة نقص التروية وإعادة التروية ويمكن أن يحمي وظائف القلب. تم تنظيم مستويات البروتين في مسار NF-κB والمؤثرات النهائية IL-1β و IL-6 و TNF-α بشكل ملحوظ في مجموعة MIRI بينما تم تنظيمها في مجموعة Munziq. ومن المثير للاهتمام ، أنه كان هناك المزيد من تنشيط مسار إشارات NF-κB ومستويات أعلى من السيتوكينات الالتهابية النهائية في مجموعة ABF MIRI. تشير النتائج إلى أن MIRI كان أكثر حدة في ABF. Munziq له تأثيرات وقائية للقلب في نقص التروية وإصابة إعادة التروية. يمكن أن يتصرف هذا التأثير الوقائي عن طريق قمع مسار إشارات NF-κB.
Introduction
نقص تروية عضلة القلب هو حالة لا يتلقى فيها عضلة القلب تدفقا كافيا للدم ، ناتج في المقام الأول عن تضيق أو تجلط الشرايين التاجية1 ، مما قد يؤدي إلى نتائج مميتة للمرضى2،3. نظرا لأن استقلاب عضلة القلب هوائي حصري تقريبا ويحتوي على مخازن الجليكوجين المحدودة للغاية ، فمن الضروري استعادة إمدادات الدم على الفور ، بشكل أساسي من خلال PCI أو انحلال التخثر في الوريد. في حين أن إعادة تروية عضلة القلب الفعالة أمر بالغ الأهمية لتحسين تشخيص عضلة القلب الإقفارية ، إلا أنه يقدم أيضا خطر الإصابة بنقص تروية عضلة القلب (MIRI) 4،5،6. يعد MIRI تحديا كبيرا يؤثر على فعالية علاجات إعادة تروية عضلة القلب7. تساهم عوامل وآليات متعددة في تطوير MIRI. على سبيل المثال ، في الخلايا البطانية ، يؤدي إعادة التروية إلى تراكم أنواع الأكسجين التفاعلية (ROS) واستنفاد زبالات الجذور الحرة ، مما يشير إلى وجود الإجهاد التأكسدي4،8. قد يؤدي هذا الإجهاد التأكسدي لاحقا إلى استجابة التهابية ، مما يؤدي إلى تعزيز إطلاق العوامل الالتهابية ، وزيادة إنتاج جزيئات الالتصاق ، وتجنيد الكريات البيض9،10،11. يلعب محسن السلسلة الخفيفة للعامل النووي للخلايا البائية المنشطة (NF-κB) دورا مهما في الاستجابة الالتهابية أثناء إقفار عضلة القلب / إصابة إعادة التروية12. تشتمل عائلة عامل النسخ NF-κB للثدييات على خمسة أفراد: NF-κB1 (المعروف أيضا باسم p105 / p50) ، NF-κB2 (المعروف أيضا باسم p100 / p52) ، p65 (يشار إليه أيضا باسم RELA) ، RELB (متماثل الجين الورمي الفيروسي للشبكية V-Rel) ، و c-REL13،14. ثبت أن تثبيط مسار NF-κB يخفف من إصابة نقص التروية / إعادة التروية في الأنسجة المختلفة ، بما في ذلك عضلة القلب12،15 ، والأمعاء16 ، والمبيض17 ، والدماغ18،19 ، والكلى20 ، والكبد21. والجدير بالذكر أن مسار إشارات NF-κB قد تم توثيقه على نطاق واسع كوسيط محوري في استجابة عضلة القلب لنقص التروية وإعادة التروية12،14 ، وتشمل الآليات الممكنة تعزيز الاستجابات الالتهابية ، وتنظيم التعبير عن جزيئات التصاق الخلايا ، والمشاركة في تفاعلات الإجهاد التأكسدي ، والتأثير على موت الخلايا ومسارات البقاءعلى قيد الحياة 12،20،22،23 ،24،25. أظهرت التدخلات العلاجية التي تهدف إلى تخفيف تنشيط NF-κB إمكانات كبيرة في التخفيف من MIRI23،26.
تأسس طب الأويغور، وهو جزء لا يتجزأ من الطب الصيني التقليدي، على نظرية أربع فكاهة: النار والهواء والماء والأرض. تؤدي هذه الأخلاط إلى ظهور سوائل الجسم مثل الدم والبلغم والصفراء الصفراء والصفراء السوداء27،28. يعد الحفاظ على التوازن الديناميكي بين هذه السوائل الأربعة أمرا بالغ الأهمية للصحة العامة لجسم الإنسان. يمكن أن يؤدي أي خلل في هذه السوائل ، يشار إليها باسم سوائل الجسم غير المتوازنة ، إلى ظهور الأمراض. من بين سوائل الجسم المختلفة غير المتوازنة ، يعرف السوائل السائدة باسم سائل الجسم غير الطبيعي (ABF) ، ويعرف أيضا باسم متلازمة سافدا غير الطبيعية (ASS) 27 ، 28. يوصف مونزيق ، وهو دواء أويغوري تقليدي يستخدمه أطباء الأويغور على نطاق واسع ، لعلاج سوائل الجسم غير الطبيعية. وهو مستحضر طبي عشبي يتكون من عشرة أنواع طبية مختلفة ، كما هو موضح في ملحق العبوة ، بما في ذلك Cordia dichotoma Forst. f. و Anchusaitalica Retz. و Glycyrrhiza uralensis Fisch. و Adiantum capillusveneris L. و Euphorbia humifusa Willd. و Ziziphus jujuba Mill. و Lavandula angustifolia Mill. و Foeniculum vulgare Mill. و Melissa officinalis L. و Alhagi pseudoalhagi Desv29. تمت الموافقة على Munziq من قبل إدارة الغذاء والدواء الحكومية في عام 2003 تحت الرقم الرمزي Z65020166. تشمل مكوناته الكيميائية النشطة النحاس والفينولات والأحماض العضوية والأحماض الأمينية والصابونين والسكر وغيرها. يظهر Munziq تأثيرات متعددة ، بما في ذلك مضادات الأكسدة ، ومضادة للالتهابات ، ومنظمة المناعة ، ومضادة لتجميع الصفائح الدموية ، وتأثيرات مضادة للتخثر27،28،30.
أظهرت دراساتنا السابقة أن دواء Munziq يمكن أن يخفف من نقص تروية عضلة القلب / إصابة إعادة التروية (MIRI) ، على الرغم من أن الآليات المحددة لا تزال غير واضحة. تم عرض التأثيرات الوقائية لعضلة القلب ل Munziq في الفئران المصابة بإصابة نقص تروية عضلة القلب المصابة بمتلازمة سافدا غير الطبيعية. يحمي تثبيط مسار العامل النووي kappa b إقفار عضلة القلب / إصابة إعادة التروية في الفئران الخاضعة للعلاج بحبيبات Fufang Munziq (Munziq) 27،28،30. ومع ذلك ، هناك أبحاث محدودة تبحث في دور وآلية Munziq في MIRI.
تهدف هذه الدراسة إلى التحقيق في التأثيرات الواقية للقلب ل Munziq على إصابة نقص تروية عضلة القلب (MIRI) في الفئران ذات سوائل الجسم غير الطبيعية (ABF) واستكشاف الآليات الأساسية ، مع التركيز بشكل خاص على مسار إشارات NF-κB. الفرضية المقترحة في هذه الدراسة هي أن المعالجة المسبقة ل Munziq يمكن أن تخفف من التغيرات المرضية التي يسببها MIRI وتحمي وظائف القلب ، ربما عن طريق قمع مسار إشارات NF-κB والاستجابات الالتهابية النهائية. يتم اختبار الفرضية من خلال إنشاء نماذج الوسام وإصابة نقص التروية وإعادة التروية (MIRI) وإصابة نقص التروية وإعادة التروية + Munziq في كل من مجموعات التحكم و ABF. تتم مراقبة وظائف القلب والمؤشرات المتعلقة بالالتهاب والبروتينات المرتبطة بمسار NF-κB.
Protocol
تم استخدام ذكور الجرذ البالغ Sprague-Dawley (SD) الذي يزن 200-220 جم وفقا للمبادئ التوجيهية للمعاهد الوطنية للصحة لرعاية واستخدام المختبر. مركز التجارب الحيوانية التابع لجامعة شينجيانغ الطبية. تم توفير نماذج حيوانية ذات سوائل جسم غير طبيعية (ABF) من قبل مركز التجريبية التابع لجامعة شينجيانغ الطبية. تم الاحتفاظ بالفئران في بيئة جافة وباردة كما هو موضح سابقا ، وهو أمر ضروري لإنشاء نموذج سائل الجسم غير الطبيعي (ABF) في الفئران ، وفقا لنظرية الطب الأويغوري التقليدية وكما هو موضح في الدراسات السابقة29،33. أجريت جميع التجارب على وفقا للإرشادات الأخلاقية لجامعة شينجيانغ الطبية وتم إجراؤها وفقا لإرشادات ARRIVE. تمت الموافقة على بروتوكول دراسات الفقارية (الفئران) من قبل اللجنة الأخلاقية المؤسسية لجامعة شينجيانغ الطبية (IACUC-20200318-16).
1. تجميع ، وإدارة الأدوية ، وإنشاء نموذج MIRI
- قم بتعيين الفئران بشكل عشوائي للمجموعات الست التالية: أ) مجموعة التحكم الوهم ، ب) مجموعة التحكم MIRI ، ج) مجموعة ABF الوهم ، رابعا) مجموعة ABF MIRI ، v) مجموعة MIRI + Munziq الضابطة و 6) مجموعة ABF MIRI + Munziq.
- ضع الفئران في مجموعة ABF في بيئة خاضعة للرقابة داخل صناديق مناخية مضبوطة على درجة حرارة 6 درجات مئوية ± 1 درجة مئوية ونطاق رطوبة نسبية من 25٪ إلى 32.8٪. تزويد الفئران بالأعلاف العادية الممزوجة بالطعام الجاف البارد ، وهي بذور الشعير والكزبرة بنسبة 7: 1.5: 1.5 ، وتطبيق هذه الطريقة لمدة 21 يوما لإنشاء نموذج ABF29،33.
- يتم تطبيق 5 غ/كغ من Munziq (5.0 جم من Munziq المذاب في 1 مل من الماء المقطر) عن طريق الإعطاء داخل المعدة لمجموعة Munziq لمدة 21 يوما قبل جراحة MIRI، وهو ضعف الجرعة السريرية الفعالة. بالنسبة للحيوانات غير ABF ، مثل مجموعات Control Sham و Control MIRI و Control MIRI + Munziq ، قم بإعطاء كمية متساوية من المحلول الملحي الطبيعي لمجموعة الوشم ومجموعة MIRI وتوفير إعطاء Munziq داخل المعدة لمجموعة Munziq.
- بعد 21 يوما من المعالجة المسبقة ، قم بإنشاء نموذج MIRI.
- إجراء الجراحة في غرفة عمليات مخصصة للحيوانات مجهزة بمواد معقمة لضمان بيئة معقمة. تخدير الفئران بحقن داخل الصفاق (IP) من البنتوباربيتال الصوديوم (35 مجم / كجم) ؛ مراقبة استرخاء العضلات والاستجابة للمنبهات الخارجية ومعدل التنفس والعمق لتقييم تأثير التخدير. راقب هذه المعلمات كل 15 دقيقة طوال الإجراء. في حال ظهور علامات تخدير غير كاف (توتر عضلي، استجابة ملحوظة للمنبهات، زيادة أو انخفاض معدل التنفس)، يتم تطبيق جرعة تكميلية قدرها 20 ملغ/كغ. حافظ على التخدير طوال العملية بأكملها حتى جمع الدم النهائي. أثناء الإجراء ، حافظ على درجة حرارة جسم الفئران عند 37 درجة مئوية باستخدام وسادة تسخين مع مراقبة مستمرة عبر مسبار درجة حرارة المستقيم. ضع مرهما بيطري على العينين لمنع الجفاف أثناء التخدير.
- إجراء فغر القصبة الهوائية للتنفس بمساعدة جهاز التنفس الصناعي. قبل فتح الصدر لكشف القلب ، اغسل موقع الجراحة بالماء والصابون ، واحلق منطقة الجراحة ، ونظف المنطقة بمحلول مطهر مثل الكلورهيكسيدين واليود. استخدم أدوات معقمة لهذا الإجراء.
- لفتح الصدر وفضح القلب ، استخدم الأدوات الجراحية الصدرية المعقمة القياسية ، بما في ذلك المقص والملقط والمباعدات. افتح جدار الصدر وفضح القلب. تحديد الشريان الأمامي الأيسر الهابط (LAD) تحت التصور المباشر. إنه فرع رئيسي من الشريان التاجي الأيسر الذي يقع على سطح القلب. استخدم خياطة 6-0 (4-5 سم) ، وربط LAD (النزوح الأمامي الأيسر) لمدة 30 دقيقة للحث على نقص التروية الموضعي. تحديد انسداد LAD الفعال من خلال ملاحظة لون شاحب في عضلة القلب.
- بعد 30 دقيقة من الربط ، حرر الرباط وقم بإجراء إعادة التروية لمدة 120 دقيقة. تحديد إعادة تروية عضلة القلب عندما يتعافى إلى اللون الأحمر الفاتح. في الفئران التي تخضع لعملية زائفة ، قم بإجراء نفس الإجراء ولكن بدون ربط LAD.
- بعد إعادة التروية ، ظلت الفئران تحت التخدير الناجم عن البنتوباربيتال الصوديوم (35 مجم / كجم ، ip) 34. بمجرد أن تدخل الفئران في التخدير العميق ، اجمع 1-2 مل من عينات الدم من الشريان الأورطي البطني باستخدام أنبوب جمع الدم المفرغ.
- بعد جمع عينة الدم من الشريان الأورطي البطني ، قم بالقتل الرحيم للفئران عن طريق خلع عنق الرحم بينما لا تزال تحت التخدير العميق. اجمع أنسجة عضلة القلب من منطقة الاحتشاء في البطين الأيسر باستخدام ملقط ومقص معقم، مع التأكد من أخذ الأنسجة التي تبدو شاحبة وتالفة فقط، مما يشير إلى المنطقة المصابة بالاحتشاء. ضع الأنسجة المجمعة في وعاء معقم لمزيد من التحليل.
2. جمع العينات
- جمع عينات الأنسجة: باستخدام مقص معقم وشفرة معقمة، قم بتحويل القلب أفقيا إلى نصفين على طول نقطة منتصف المحور الطويل للبطين الأيسر، بشكل عمودي على اتجاه القلب. قسم نصف الجزء القمي إلى جزأين: احتفظ بواحد في 4٪ بارافورمالدهيد للفحص المورفولوجي في درجة حرارة الغرفة أو 4 درجات مئوية لمدة 2-24 ساعة ، والآخر في الجلوتارالديهايد للفحص المجهري الإلكتروني عند 4 درجات مئوية لمدة 1-4 ساعات.
- قسم الجزء الأساسي من القلب ، بما في ذلك المناطق الإقفارية وغير الإقفارية ، إلى جزأين: ضع جزءا واحدا في التبريد ، وقم بتجميد الأنسجة بسرعة في النيتروجين السائل ، ثم انقله إلى فريزر بدرجة حرارة منخفضة للغاية -80 درجة مئوية لاختبار البيولوجيا الجزيئية. استخدم الجزء الطازج الآخر للكشف عن مستويات أنواع الأكسجين التفاعلية للأنسجة (ROS) واستخراج الميتوكوندريا.
- جمع عينات المصل: في نهاية التجربة ، اسحب 1-2 مل من الدم الوريدي من الوريد الأجوف السفلي ، وجهاز الطرد المركزي عند 1000 × جم لمدة 10 دقائق ، وقم بتخزين المصل في فريزر بدرجة حرارة منخفضة للغاية -80 درجة مئوية بعد الانفصال.
3. تلطيخ HE ومراقبة المجهر الإلكتروني للإرسال
- إجراء تلطيخ HE (تلطيخ الهيماتوكسيلين - اليوزين) على عضلة القلب البطينية وفقا للإجراء الروتيني35. ثبت الأنسجة في 4٪ بارافورمالدهيد لمدة 24 ساعة. قم بتضمين العينات في البارافين ، وقم بتقطيعها إلى أقسام بسمك 4 ميكرومتر ، وقم بلطخها باستخدام طريقة تلطيخ الهيماتوكسيلين - اليوزين وفقا للبروتوكول. حدد بشكل عشوائي خمسة حقول لمراقبة التغيرات النسيجية المرضية تحت المجهر.
- قم بمعالجة أنسجة عضلة القلب من الفئران التي تم تثبيتها في الفورمالين ، من كل مجموعة ، لتجارب تلطيخ HE باتباع الخطوات أدناه.
- ضع أقسام المناديل في حاضنة 65 درجة مئوية للخبز لمدة 1.5 إلى 2.
- اغمر أقسام الأنسجة في الزيلين لمدة 10 دقائق ، واستبدل الزيلين ، واغمرها مرة أخرى لمدة 10 دقائق أخرى. اغمر بالتتابع في الكحول اللامائي الأول والثاني لمدة 5 دقائق لكل منهما ، متبوعا بالكحول 95٪ و 90٪ و 80٪ و 70٪ ، والماء المقطر لمدة 5 دقائق لكل منهما.
- وصمة عار مع الهيماتوكسيلين لمدة 3 دقائق. قم بإجراء التمايز الحمضي بحمض الهيدروكلوريك المضاف في الكحول لبضع ثوان (1-2 ثانية). إنهاء التمايز في ماء الصنبور لمدة 5 دقائق.
- اغمر في الماء المقطر ، 70٪ و 80٪ و 90٪ و 95٪ كحول لمدة 3 دقائق لكل منهما ، والكحول اللامائي الأول والثاني لمدة 5 دقائق لكل منهما.
- وصمة عار مع 0.5٪ يوزين في الإيثانول لمدة 1 دقيقة ، اشطف الأقسام في 95٪ من الإيثانول لإزالة اللون الأحمر الزائد ، ثم اغمر في الإيثانول اللامائي لمدة 5 دقائق. انغمس في الزيلين الأول والثاني لمدة 5 دقائق لكل منهما.
- جبل مع بلسم محايد. مراقبة التغيرات المرضية للأنسجة تحت المجهر.
4. الكشف عن ELISA للسيتوكينات الدموية ومؤشرات إصابات القلب
- الحصول على عينة مصل الفئران من الدم المحيطي عن طريق الطرد المركزي عند 1000 × جم لمدة 10 دقائق ، وتخزينها في درجة حرارة -80 درجة مئوية. الكشف عن مستويات مؤشرات إصابات القلب مثل CK-MB و cTn-T و ICAM-1 والسيتوكينات الالتهابية مثل IL-1β و IL-6 و TNF-α في المصل باستخدام مجموعات ELISA وفقا لتعليمات الشركات المصنعة وكما هو موضح أدناه.
- اسمح لجميع الكواشف بالتوازن مع درجة حرارة الغرفة (18-25 درجة مئوية) لمدة 30 دقيقة على الأقل ، وقم بإعداد الكواشف وفقا لتعليمات الشركة المصنعة ، واجعلها جاهزة للاستخدام.
- قم بإعداد الآبار القياسية وعينات الآبار ، حيث تحتوي الآبار القياسية على تركيزات معروفة من المحاليل القياسية المتوفرة في مجموعة الفحص. تستخدم هذه لإنشاء منحنى قياسي أثناء التجربة لتحديد تركيز التحليل المحدد في العينات التي يتم اختبارها. أضف 100 ميكرولتر من العينة القياسية أو العينة إلى كل بئر ، واخلطها برفق عن طريق الرج ، وقم بتغطيتها بختم صفيحة ، واحتضانها عند 37 درجة مئوية لمدة ساعتين.
- تخلص من السائل وجففه عن طريق الصب ولا تغسله. أضف 100 ميكرولتر من محلول العمل المضاد المسمى بالبيوتين (المخفف مسبقا 1: 100) إلى كل بئر ، وقم بتغطيته بختم لوحة جديد ، واحتضانه عند 37 درجة مئوية لمدة 1 ساعة.
- تخلص من السائل من الآبار ، وجففه عن طريق الصب ، واغسل الطبق 3x. نقع لمدة دقيقتين لكل غسلة ، 200 ميكرولتر لكل بئر ، وجفف عن طريق الصب.
- أضف 100 ميكرولتر من محلول عمل الستربتافيدين المسمى بيروكسيداز الفجل الحار إلى كل بئر ، وقم بتغطيته بختم صفيحة جديد ، واحتضانه عند 37 درجة مئوية لمدة 1 ساعة.
- تخلص من السائل من الآبار وجففه عن طريق الصب واغسل الطبق 5x. نقع لمدة دقيقتين لكل غسلة ، 200 ميكرولتر لكل بئر ، وجفف عن طريق الصب.
- أضف بالتتابع 90 ميكرولتر من محلول الركيزة إلى كل بئر ، وقم بتطوير اللون في الظلام عند 37 درجة مئوية لمدة 15-30 دقيقة.
- أضف بالتتابع 50 ميكرولتر من محلول التوقف إلى كل بئر لإنهاء التفاعل. في غضون 5 دقائق بعد إيقاف التفاعل ، قم بقياس الكثافة الضوئية (قيم OD) لكل بئر بالتسلسل عند 450 نانومتر باستخدام قارئ صفيحة دقيقة.
5. قياس MDA ، NO و LDH
- بعد إعادة التروية ، اجمع أنسجة عضلة القلب (5 مم × 7 مم) من منطقة الاحتشاء في البطين الأيسر. اكتشف LDH (نازعة هيدروجين اللاكتات) و MDA (مالوندي الديهايد) باستخدام مجموعة مقايسة LDH ومجموعة مقايسة MDA ، باتباع تعليمات الشركة المصنعة. اكتشف NO عند 550 نانومتر باستخدام مجموعة فحص أكسيد النيتريك (NO) وفقا لتعليمات الشركة المصنعة.
6. تحليل اللطخة الغربية
- استخرج البروتينات الكلية من أنسجة البطين في الفئران باستخدام تحلل RIPA. حدد تركيز البروتين باستخدام مجموعة فحص البروتين BCA.
- للحفاظ على البروتينات داخل الخلايا ومنع التحلل الخلوي ، اغمر العينات في النيتروجين السائل لتجميدها بسرعة. بعد ذلك ، استرجع العينات المجمدة وطحنها إلى مسحوق ، وخذ ما يقرب من 100 مجم من العينة ، وأضفها إلى أنبوب طرد مركزي مبرد مسبقا سعة 1.5 مل. أضف 400 ميكرولتر من محلول تحلل RIPA (مكمل مع مثبطات البروتياز ومثبط الفوسفاتيز واسع الطيف) ، ثم اخلطه جيدا واترك الخليط يقف عند 4 درجات مئوية لمدة 60 دقيقة.
- الطرد المركزي الخليط على حرارة 1000 × جم لمدة 15 دقيقة عند 4 درجات مئوية. اجمع المادة الطافية وقم بقياس تركيز البروتين باستخدام طريقة BCA.
- قم بتخفيف معايير BSA باستخدام مخفف يطابق نظام العازلة للعينات ، وفقا للجدول 1.
- تحضير الكواشف وفقا لتعليمات الشركة المصنعة. بناء على عدد العينات ، قم بخلط الكواشف A و B بنسبة حجم 50: 1 لتحضير كمية كافية من محلول عمل BCA وخلطها جيدا. قبل تحضير محلول عمل BCA ، رج الكاشف A لخلط جيدا.
- خذ 20 ميكرولتر من محلول BSA القياسي المحضر حديثا والعينات المخففة (مخففة 10 أضعاف) من الجدول 1 وأضفها إلى طبق 96 بئرا.
- أضف 200 ميكرولتر من محلول عمل BCA إلى كل بئر واخلطه جيدا. أغلق الطبق ، واحتضنه عند 37 درجة مئوية لمدة 30 دقيقة ، ثم تبرد إلى درجة حرارة الغرفة أو ضعه في درجة حرارة الغرفة لمدة دقيقتين.
- قم بقياس الامتصاص عند 562 نانومتر باستخدام قارئ صفيحة دقيقة واحسب تركيز البروتين في العينات بناء على المنحنى القياسي.
- أضف كمية مناسبة من 5x SDS-PAGE المخزن المؤقت للتحميل (يحتوي على β-mercaptoethanol) إلى العينات ، والمعالجة الحرارية عند 100 درجة مئوية في الماء المغلي لمدة 5 دقائق لتغيير طبيعة البروتينات بالكامل ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 5 دقائق ، وأخذ المادة الطافية للاستخدام.
- توضح الصيغة الواردة في الجدول 2 تحضير المواد الهلامية المنفصلة بنسبة 15٪ و 12٪ و 8٪ ، بالإضافة إلى جل التراص بنسبة 5٪. جهز الحلول وفقا لذلك. أضف محلول الجل المنفصل إلى ارتفاع 2/3 في علبة الجل ، وقم بتغطيته بالماء المقطر ، واتركه في درجة حرارة الغرفة لمدة 40 دقيقة. ثم أضف جل التكديس لملء الكاسيت ، وأدخل المشط ، واتركه لمدة 10 دقائق.
- قم بتحميل 9 ميكرولتر من علامة البروتين الملطخة مسبقا في كل بئر ، وقم بتحميل 50 ميكروغرام من عينة البروتين لكل بئر.
- ضع جهدا ثابتا قدره 80 فولت حتى يصل اللون الأزرق البروموفينول إلى الجل الفاصل، ثم ضع جهدا ثابتا قدره 100 فولت لمدة 90 دقيقة. أوقف الرحلان الكهربائي عندما ينتقل البروموفينول الأزرق إلى الجزء السفلي من الجل.
- بعد الانتهاء من SDS-PAGE ، اغمر غشاء PVDF في الميثانول لمدة 10 ثوان ، واشطفه في الماء المقطر لمدة 1 دقيقة ، ثم انقع هلام بولي أكريلاميد ، وورق الترشيح ، وغشاء PVDF المعالج في مخزن النقل لمدة 10 دقائق.
- قم بتجميع شطيرة النقل بحيث يكون الجانب الأسود من المشابك متجها لأسفل ، متبوعا بجانب شفاف من المشابك من ورق الترشيح الإسفنجي والجل والغشاء PVDF. ضع المشابك في علبة النقل ، مع التأكد من أن الجانب الأسود من المشبك يواجه الجانب الأسود من الكاسيت والجانب الأبيض يواجه الجانب الأحمر. قم بإجراء النقل بجهد ثابت يبلغ 100 فولت واستخدم غشاء PVDF مع وقت نقل 60 دقيقة.
- بعد النقل ، اغسل غشاء PVDF بالماء 3 مرات لمدة 5 دقائق لكل منهما. سد الغشاء بمحلول مانع يحتوي على 5٪ حليب جاف خالي الدسم لمدة ساعة واحدة ، ثم اغسلها باستخدام TBST 3x لمدة 5 دقائق لكل منهما.
- تمييع الجسم المضاد الأولي مع TBST وفقا لنسب التخفيف المدرجة في الجدول 3 واحتضانه عند 4 درجات مئوية طوال الليل. تشمل الأجسام المضادة الأولية الجسم المضاد ل NF-κB p65 ، والأجسام المضادة المضادة ل NF-κB المحفزة للكيناز (NIK) ، والأجسام المضادة ل IKKα ، والجسم المضاد المضاد β الأكتين.
- اشطف الغشاء 3 مرات باستخدام 1x TBST لمدة 5 دقائق لكل منهما. أضف الجسم المضاد الثانوي المخفف بشكل مناسب (حسب الجدول 3) واحتضنه في درجة حرارة الغرفة لمدة 1 ساعة. الأجسام المضادة الثانوية هي الماعز المترافق HRP المضاد للفأر IgG والماعز المترافق HRP المضاد للأرانب IgG.
- اشطف الغشاء مرة أخرى باستخدام 1x TBST 3x لمدة 5 دقائق لكل منهما. امزج المحاليل النامية A و B ، وأضف 2 مل إلى الغشاء ، واكتشف وصور باستخدام أداة التلألؤ الكيميائي المصغرة.
- تطوير الغشاء باستخدام التلألؤ الكيميائي المعزز بالإضافة إلى الكاشف. امسح الفيلم المطور ضوئيا باستخدام نظام التصوير. تحليل صور اللطخة الغربية باستخدام البرنامج. استخدم β-actin كعنصر تحكم في التحميل. احسب مستوى البروتين النسبي بناء على القيمة الرمادية ل β-actin.
7. تحليل تفاعل البوليميراز المتسلسل في الوقت الحقيقي (qRT-PCR)
- استخراج الحمض النووي الريبي الكلي
- قم بإعداد محلول DEPC بنسبة 0.1٪ و 70٪ كحول معالج ب DEPC وفقا لتعليمات الشركة المصنعة. عالج جميع أحجام أنابيب الطرد المركزي الدقيقة وأنواع مختلفة من أطراف الماصات باستخدام محلول DEPC بنسبة 0.1٪. نقع طوال الليل ، ثم الأوتوكلاف.
- اجمع الخلايا في مرحلة النمو اللوغاريتمي مع حالة نمو جيدة. تخلص من وسط الثقافة من قارورة زراعة الخلية واغسل الخلايا 2x بمحلول هانك. أضف 1 مل من التربسين لكل 10 سم² من الخلايا، ورجه برفق لفصل الخلايا، واستخدم ماصة لضمان الانفصال الكامل. احتضن في درجة حرارة الغرفة لمدة 5 دقائق للسماح بالتحلل الكامل ، ثم قم بتحريك الماصة لأعلى ولأسفل 7x-10x لتعطيل الخلايا بالكامل. انقل المحللة إلى أنابيب سعة 1.5 مل ، وأجهزة الطرد المركزي ، وقم بتخزين المادة الطافية.
- أضف كمية متساوية من الكلوروفورم إلى المادة الطافية ، واخلطها جيدا ، واتركها في درجة حرارة الغرفة لمدة 10 دقائق. جهاز طرد مركزي عند 4 درجات مئوية لمدة 5 دقائق عند 1,000 × جم لفصل المراحل. انقل المرحلة المائية العلوية بعناية إلى أنبوب جديد (في حالة استخراج الحمض النووي والبروتينات ، احتفظ بالمرحلة السفلية وقم بتخزينها عند 4 درجات مئوية).
- أضف الأيزوبروبانول (0.5 مل لكل 1 مل من التريزول) ، واخلطه جيدا ، واتركه في درجة حرارة الغرفة لمدة 10 دقائق. جهاز الطرد المركزي عند 4 درجات مئوية لمدة 10 دقائق عند 1,000 × جم ، قم بإزالة المادة الطافية برفق وتخلص منها.
- اغسل حبيبات الحمض النووي الريبي بنسبة 75٪ من الإيثانول ، وجهاز الطرد المركزي عند 4 درجات مئوية لمدة 5 دقائق عند 8,000 × جم ، وقم بإزالة المادة الطافية برفق ، وجفف الحبيبات بالهواء أو جففها بالمكنسة الكهربائية. قم بإذابة الحمض النووي الريبي في 50 ميكرولتر من ماء DEPC ، وتخزينه عند -70 درجة مئوية أو تابع النسخ العكسي إلى الحمض النووي (cDNA).
- النسخ العكسي إلى (كدنا)
- قم بإجراء نسخ عكسي ل (كدنا) باستخدام مجموعة باتباع تعليمات الشركة المصنعة.
- تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي
- صمم بادئات بناء على تسلسل الجينات وتحقق منها باستخدام BLAST على موقع NCBI. قم بإعداد محاليل مخزون 10 ميكرومتر من الاشعال الأمامية والخلفية ل CK20 و β-actin. يوضح الجدول 4 التسلسلات التمهيدية.
- تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي
- أضف 1 ميكرولتر من الحمض النووي (cDNA) ، و 10 ميكرولتر من 2x من المزيج الرئيسي ، و 0.4 ميكرولتر من التمهيدي الأمامي والخلفي لكل منهما ، و 8.2 ميكرولتر من الماء الخالي من RNase في نظام التفاعل.
- قم بإجراء تفاعل البوليميراز المتسلسل بالبرنامج التالي: التمسخ الأولي عند 95 درجة مئوية لمدة دقيقتين ، متبوعا ب 40 دورة من 95 درجة مئوية لمدة 15 ثانية و 60 درجة مئوية لمدة دقيقة واحدة. استخدم β-actin كعنصر تحكم داخلي. احسب التعبير النسبي باستخدام طريقة 2-ΔΔCt .
8. التحليل الإحصائي
- استخدم برنامجا تجاريا للتحليل الإحصائي. عرض البيانات كمتوسط ± انحراف معياري (متوسط ± SD). قم بإجراء ANOVA أحادي الاتجاه لمقارنة الاختلافات بين المجموعات المختلفة. حدد الفرق المعنوي على أنه p < 0.05.
النتائج
يخفف Munziq من التغيرات المرضية الناجمة عن إصابة نقص التروية وإعادة التروية
لفحص التغيرات المورفولوجية في أنسجة عضلة القلب ، أجرينا في البداية تلطيخ HE. كما هو موضح في الشكل 1 ، لاحظنا التنكس الحبيبي والتنكس الفراغي في بعض خلايا عضلة القلب في مجموعة الوهم. بالإضافة إلى ذلك ، كان هناك وجود محدود لخلايا الدم الحمراء وتسلل الخلايا الليمفاوية بين خلايا عضلة القلب. بشكل دوري ، لاحظنا تمدد الأوعية الدموية واحتقانها. أظهرت أنسجة عضلة القلب من مجموعة MIRI ضعفا أكثر حدة وأظهرت تغيرات مورفولوجية أكثر وضوحا. تضمنت هذه التغييرات التنكس الحبيبي الواسع النطاق ، والتنكس الفراغي ، وتسلل خلايا الدم الحمراء والخلايا الليمفاوية ، وتمدد الأوعية الدموية ، والاحتقان. كانت إصابة أنسجة عضلة القلب في مجموعة ABF MIRI أكثر حدة مقارنة بتلك التي لوحظت في مجموعة MIRI الضابطة. ومع ذلك ، في كل من مجموعة Munziq ، أظهرت بعض خلايا عضلة القلب تنكسا حبيبيا خفيفا وتنكس فراغي. كان وجود خلايا الدم الحمراء وتسلل الخلايا الليمفاوية وتمدد الأوعية الدموية والاحتقان نادرا. علاوة على ذلك ، تشير النتائج إلى أن Munziq يظهر تأثيرات وقائية فائقة للقلب في فئران ABF MIRI ويتحكم في فئران MIRI. في الختام ، تشير هذه النتائج إلى أن المعالجة المسبقة ل Munziq لديها القدرة على التخفيف من التغيرات المرضية الناجمة عن إصابة نقص التروية وإعادة التروية في القلب.
قام Munziq بتحسين اضطراب الميتوكوندريا وألياف عضلة القلب الناجم عن إصابة نقص التروية / إعادة التروية
لمزيد من التحقق من الدور الوقائي ل Munziq في إصابة MIRI ، قمنا بفحص البنية التحتية للميتوكوندريا وألياف عضلة القلب باستخدام TEM. كما هو موضح في الشكل 2 ، أظهرت خلايا عضلة القلب في المجموعة الوهمية بنية سليمة مع لييفات عضلية مرتبة عن كثب وطول قسري عضلي مماثل. بدا هيكل الشعيرات العضلية واضحا وفضفاضا قليلا ، بينما لوحظ عدد كبير من الميتوكوندريا. على العكس من ذلك ، أظهرت مجموعة MIRI خصائص مرضية تدل على خلايا عضلة القلب التالفة ، بما في ذلك تورم الخلايا ، وطول القشر العضلي المتنوع ، وبنية الشعيرات العضلية غير الواضحة والمرتبة بشكل فضفاض. ولوحظ أن هناك اضطرابا وتفككا واسعا للميتوكوندريا في مجموعة I / R مقارنة بالمجموعة الوهمية. إلى جانب ذلك ، كانت ألياف عضلة القلب غير منتظمة ومكسورة استجابة لإصابة I / R. ومن المثير للاهتمام أن شدة هذه التغييرات كانت أعلى بشكل ملحوظ في مجموعة ABF MIRI. في المقابل ، أظهرت كلتا المجموعتين اللواتي عولجان ب Munziq سمات مرضية مخففة مرتبطة بخلايا عضلة القلب التالفة. تم تقليل تورم خلايا عضلة القلب ، وكانت هياكل اللييفات العضلية ، والقشة العضلية ، والخيوط العضلية ، وعدد الميتوكوندريا مشابهة لتلك التي لوحظت في المجموعة الوهمية. بشكل جماعي ، أشارت هذه البيانات إلى أن المعالجة المسبقة ل Munziq يمكن أن تخفف من اضطراب الميتوكوندريا وألياف عضلة القلب الناجمة عن جراحة I / R.
تفاقمت إصابة نقص تروية عضلة القلب وإعادة التروية في الفئران ABF MIRI والمعالجة المسبقة Munziq تحمي وظائف القلب
تم الكشف عن مستويات مصل cTn-T و CK-MB و ICAM-1 باستخدام طريقة ELISA. كشفت النتائج عن عدم وجود تفاوتات ملحوظة بين مجموعة الوهم الضابطة ومجموعة ABF الوهمية. ومع ذلك ، من الجدير بالذكر أن مجموعة ABF MIRI أظهرت مستويات مرتفعة بشكل كبير من cTn-T (الشكل 3 أ) و CK-MB (الشكل 3 ب) و ICAM-1 (الشكل 3 ج) مقارنة بمجموعة MIRI الضابطة. من أجل تقييم التأثيرات الوقائية للقلب ل Munziq ، تم إخضاع كل من فئران MIRI الضابطة وفئران ABF MIRI للمعالجة المسبقة Munziq. كما هو موضح في الشكل 3 ، انخفضت مستويات cTn-T و CK-MB و ICAM-1 بشكل ملحوظ في مجموعة المعالجة المسبقة Munziq. تشير هذه النتائج إلى أن Munziq يعرض خصائص وقائية للقلب ملحوظة في فئران ABF MIRI.
للتحقيق في تأثير المعالجة المسبقة ل Munziq على إصابة الإجهاد التأكسدي الناجم عن إعادة تروية نقص التروية في ABF والجرذان الضابطة ، تم قياس تغيرات LDH و MDA و NO في أنسجة عضلة القلب. كما هو موضح في الشكل 3D ، F ، أظهرت مجموعة ABF MIRI مستويات مرتفعة بشكل كبير من MDA وانخفضت بشكل كبير مستويات NO مقارنة بمجموعة MIRI الضابطة. أدت المعالجة المسبقة Munziq إلى انخفاض كبير في محتوى LDH و MDA في عضلة القلب الإقفارية. في الوقت نفسه ، زادت المعالجة المسبقة من Munziq من مستوى NO في أنسجة عضلة القلب.
خففت المعالجة المسبقة ب Munziq من التهاب MIRI عن طريق إعاقة إنتاج السيتوكينات المؤيدة للالتهابات
تلعب السيتوكينات المؤيدة للالتهابات دورا مهما في التوسط في الاستجابة المناعية الفطرية ، وتم تنشيط السيتوكينات المؤيدة للالتهابات خلال MIRI31. لمزيد من التحقيق في التأثير المضاد للالتهابات ل Munziq ، خضع كل من فئران MIRI الضابطة وفئران ABF MIRI للمعالجة المسبقة Munziq. استخدمنا طريقة ELISA لقياس مستويات مصل IL-1β و IL-6 و TNF-α وتحليل qRT-PCR لتقييم مستويات mRNA ل IL-1β و IL-6 و TNF-α في أنسجة عضلة القلب. كشفت النتائج عن عدم وجود فروق ذات دلالة إحصائية في مستويات السيتوكين هذه بين مجموعة الوسام الضابطة ومجموعة ABF الوهمية. تم تنظيم مستويات IL-1β و IL-6 و TNF-α بشكل كبير في مجموعة ABF MIRI مقارنة بمجموعة MIRI الضابطة. على وجه التحديد ، أظهر IL-1β زيادة كبيرة على كل من مستويات mRNA والبروتين ، مع ملاحظة اختلاف ذي دلالة إحصائية. في حين لم يكن هناك فرق في مستوى الرنا المرسال ل IL-6 ، تم العثور على تباين على مستوى البروتين. وبالمثل ، لم يظهر TNF-α أي اختلاف في مستويات mRNA ولكنه أظهر اختلافات على مستوى البروتين. كما هو موضح في الشكل 4 ، انخفضت مستويات IL-1β و IL-6 و TNF-α بشكل ملحوظ في مجموعة المعالجة المسبقة Munziq.
خففت المعالجة المسبقة ب Munziq من الالتهاب من خلال مسار إشارة NF-κB
يرتبط إنتاج السيتوكينات ارتباطا وثيقا بتنشيط مسارات إشارات NF-κB في معظم مراحل الاستجابة الالتهابية. يعتبر NF-κB هدفا علاجيا محتملا للأمراض الالتهابية32. لتقييم ما إذا كان مسار NF-κB متورطا في التأثيرات المضادة للالتهابات ل Munziq ، أجرينا في البداية تحليل Western Blot لقياس مستويات التعبير عن المكونات الرئيسية لمسار NF-κB ، بما في ذلك NIK و IKKα و pIKKα و p6513. كما هو موضح في الشكل 5 ، تسببت الإصابة الإقفارية وإعادة التروية في تنظيم ملحوظ ل NIK و p-IKKα و p-p65 داخل مجموعة MIRI. خفف العلاج ب Munziq بشكل فعال من هذا التنظيم. أشارت النتائج إلى أن Munziq يلعب دورا مهما في مكافحة الالتهابات عن طريق قمع تنشيط مسار إشارات NF-κB.
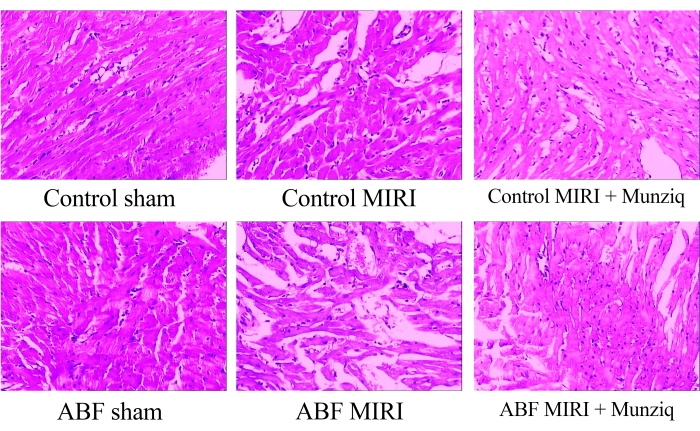
الشكل 1: التغيرات المورفولوجية لأنسجة عضلة القلب التي لوحظت بواسطة تلطيخ HE. ممثل HE تلطيخ الصور لمجموعات مختلفة. التكبير: 100x. الاختصارات: ABF = سائل غير طبيعي للجسم ؛ MIRI = إصابة نقص تروية عضلة القلب ؛ (ن = 6). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
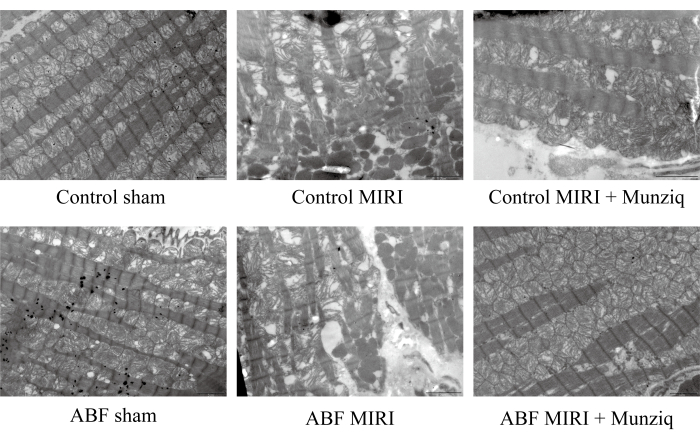
الشكل 2: قام Munziq بتحسين اضطراب الميتوكوندريا وألياف عضلات القلب الناجمة عن إصابة I / R. تم إجراء المجهر الإلكتروني الماسح لمراقبة البنية التحتية للميتوكوندريا وتغيرات ألياف عضلة القلب. تم عرض صور تمثيلية. شريط المقياس: 5 ميكرومتر ؛ (ن = 3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
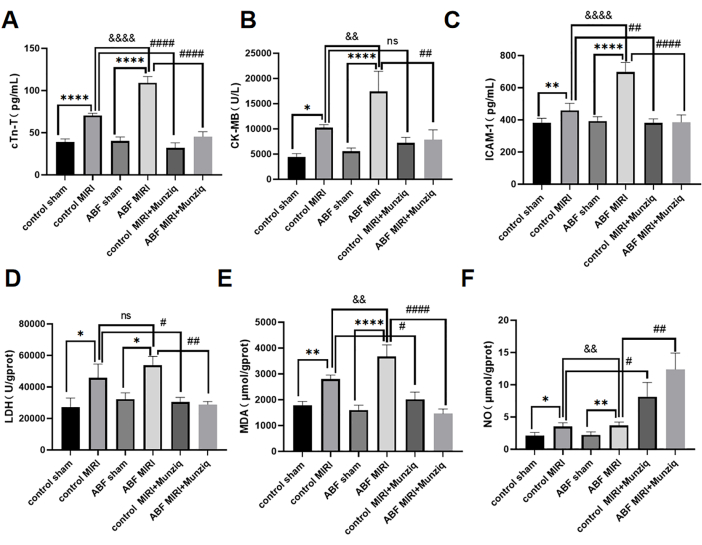
الشكل 3: تفاقمت إصابة نقص تروية عضلة القلب وإعادة التروية في فئران ABF MIRI ، ويمكن أن تحمي المعالجة المسبقة ل Munziq وظائف القلب. (أ) مصل cTn-T ، (ب) CK-MB ، و (ج) ICAM-1. تم الكشف عن المستويات بواسطة ELISA ، وتم قياس التغيرات في LDH و MDA و NO في أنسجة عضلة القلب (n = 6). *p<0.05 ، ** p<0.01 ، ***p<0.001 ، ****p<0.0001 مقارنة بالمجموعة الوهمية. #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 مقارنة بمجموعة MIRI; &p<0.05 ، & p<0.01 ، &&&<p0.001 ، &&&<p0.0001 مقارنة بالمجموعة الضابطة. تم تقديم البيانات كمتوسط ± SD. تم إجراء التحليل الإحصائي باستخدام ANOVA أحادي الاتجاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
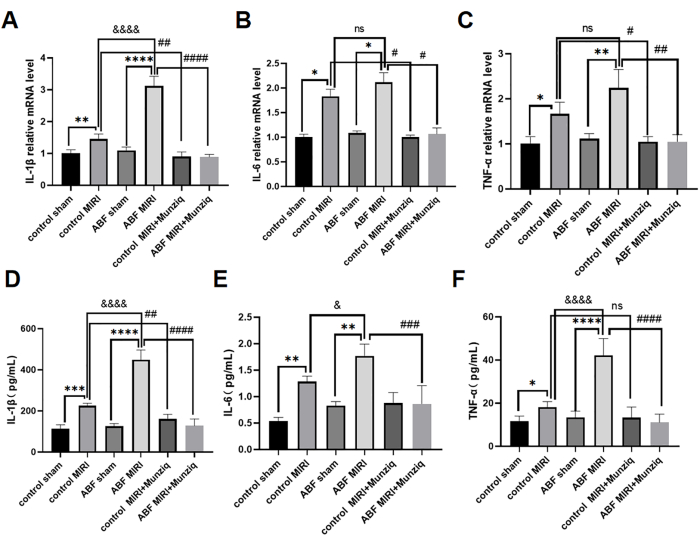
الشكل 4: خففت المعالجة المسبقة ب Munziq من التهاب MIRI عن طريق منع إنتاج السيتوكينات المؤيدة للالتهابات. اكتشف qRT-PCR مستويات mRNA ل (A) IL-1β و (B) IL-6 و (C) TNF-α في أنسجة عضلة القلب. قم بقياس مستويات (D) IL-1β و (E) IL-6 و (F) TNF-α في المصل بواسطة ELISA (ن = 6). *p<0.05 ، ** p<0.01 ، ***p<0.001 ، ****p<0.0001 مقارنة بالمجموعة الوهمية. #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 مقارنة بمجموعة MIRI; &<0.05 ، & p<0.01 ، &&&< 0.001 ، &&< 0.0001 مقارنة بالمجموعة الضابطة. تم تقديم البيانات كمتوسط ± SD. تم إجراء التحليل الإحصائي باستخدام ANOVA أحادي الاتجاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
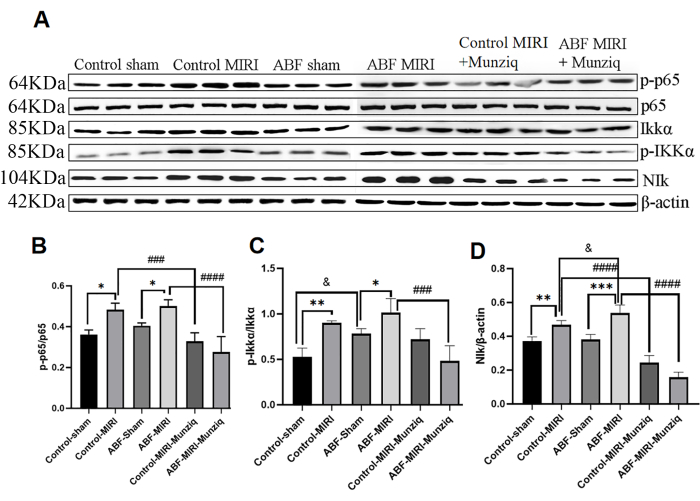
الشكل 5: خففت المعالجة المسبقة ب Munziq الالتهاب من خلال مسار إشارة NF-κB. تم الكشف عن تعبير بروتين p-IKKα و IKKα و p-p65 و p65 و NIk في أنسجة عضلة القلب بواسطة اللطخة الغربية (N = 3 لكل مجموعة). (أ) نطاقات البروتين التي لوحظت في تحليل اللطخة الغربية. (ب-د) يتم تحديد مستوى التعبير النسبي بناء على القيمة الرمادية. *p<0.05 ، ** p<0.01 ، ***p<0.001 ، ****p<0.0001 مقارنة بالمجموعة الوهمية. #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 مقارنة بمجموعة MIRI; &p<0.05 ، & p<0.01 ، &&&<p0.001 ، & & p<0.0001 مقارنة بالمجموعة الضابطة. تم تقديم البيانات كمتوسط ± SD. تم إجراء التحليل الإحصائي باستخدام ANOVA أحادي الاتجاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رقم الأنبوب | حجم المخفف (مل) | حجم BSA (مصدر) | تركيز BSA النهائي (مجم / مل) |
| A | 0 | 20 (محلول المخزون) | 500 |
| B | 2 | 18 (محلول المخزون) | 400 |
| C | 4 | 16 (محلول المخزون) | 300 |
| D | 6 | 14 (محلول المخزون) | 200 |
| E | 8 | 12 (محلول المخزون) | 150 |
| F | 12 | 8 (محلول المخزون) | 100 |
| G | 16 | 4 (محلول المخزون) | 50 |
| H | 20 | 0 (محلول المخزون) | 0 |
الجدول 1: مخطط تحضير التركيز القياسي BSA.
| فصل المواد الهلامية | 15٪ جل التراص | 12٪ جل التراص | 8٪ جل التراص | 5٪ جل التراص | |
| الكواشف | حجم | حجم | حجم | الكواشف | حجم |
| الماء منزوع الأيونات (مل) | 2.76 | 3.96 | 5.52 | الماء منزوع الأيونات (مل) | 4 |
| 30٪ أكريلاميد (مل) | 6 | 4.8 | 3.24 | 30٪ أكريلاميد (مل) | 1 |
| 1.5 مول / لتر.حمض الهيدروكلوريك (PH8.8) (مل) | 3 | 3 | 3 | 1.0 م Tris.HCl (الرقم الهيدروجيني 6.8 ؛ مل) | 1 |
| 10٪ SDS (ميكرولتر) | 120 | 120 | 120 | 10٪ SDS (ميكرولتر) | 80 |
| 10٪ AP (ميكرولتر) | 120 | 120 | 120 | 10٪ AP (ميكرولتر) | 60 |
| TEMED (ميكرولتر) | 4.8 | 4.8 | 7.2 | TEMED (ميكرولتر) | 8 |
| الحجم الكلي (مل) | 12 | 12 | 12 | الحجم الكلي (مل) | 6 |
الجدول 2: تحضير تركيز الجل.
| الجسم المضاد الأولي | نسبة التخفيف | الجسم المضاد الثانوي | نسبة التخفيف |
| β أكتين | 1:1000 | الماعز المضاد للفأر IgG H&L (HRP) | 1:15000 |
| ص 65 | 1:1000 | الماعز المضاد للأرانب IgG H & L (HRP) | 1:5000 |
| ف - ف 65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| باكس | 1:1000 | 1:5000 | |
| DRP1 | 1:800 | 1:5000 | |
| فيس 1 | 1:1000 | 1:5000 | |
| إم فن2 | 1:800 | 1:5000 |
الجدول 3: نسب تخفيف الأجسام المضادة.
| الجين | تسلسل التمهيدي (5 'إلى 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| بيتا أكتين-F | CCCATCTATGAGGGTTACGC | ||
| بيتا أكتين-آر | TTTAATGTCACGCACGATTTC | ||
الجدول 4: تسلسلات التمهيدي.
Discussion
MIRI ، الذي يرمز إلى إصابة نقص تروية عضلة القلب - إعادة التروية ، هو من المضاعفات الشائعة والهامة التي تحدث بعد إعادة تروية عضلة القلب في جراحة القلب36،37 ، وقد أدى عدد قليل من الأدوية أو المواد المساعدة إلى تحسين النتائج السريرية بشكل نهائي مقارنة بالضوابط المعاصرة38. لذلك ، هناك حاجة ملحة لعلاجات فعالة لحماية القلب من مثل هذه الإصابة. أظهر مونزيق ، وهو مستحضر عشبي تقليدي ، تأثيرات علاجية معينة على إصابة نقص تروية القلب27،28،30. ومع ذلك ، فإن هذه النتائج أولية ، ولا تزال الآليات الأساسية غير معروفة. كان الغرض من هذه الدراسة هو إجراء مزيد من التحقيق والتحقق من صحة تأثيرات وآليات مونزيق الوقائية على MIRI.
يشار إلى سوائل الجسم غير الطبيعية على أنها مظهر شائع لمختلف الأمراض المزمنة ، بما في ذلك أمراض القلب والأوعية الدموية ، وفقا لطب الأويغور التقليدي39،40. في النظام الطبي الأويغوري ، يعتقد أن ABF ناتج عن الإجهاد طويل الأمد ويشار إليه على أنه مصدر الأمراضالمختلفة 39. في هذه الدراسة ، تم استخدام نموذج غير طبيعي لسائل الجسم لمحاكاة الخصائص الأساسية لأمراض القلب والأوعية الدموية التي تتطلب جراحة القلب. تم تحفيز MIRI في الفئران المصابة ب ABF لتحديد إصابة نقص تروية عضلة القلب وإعادة التروية.
إصابة نقص التروية هي حالة مرضية معقدة تنطوي على عمليات متعددة. تم الإبلاغ عن أن نقص التروية وإعادة التروية في القلب يؤدي إلى تغيرات مرضية في عضلة القلب4. تتجلى هذه التغيرات المرضية في المقام الأول على شكل خلايا عضلة القلب القصيرة ، وتعطل البنية السارمية ، وتورم الميتوكوندريا41 ، والسييفات العضلية الساركوميرية المرتبة بشكل فضفاض ، كما لوحظ في هذه الدراسة. تؤدي إصابة عضلة القلب أيضا إلى تغييرات في إنزيمات المصل. من المعروف أن مستويات cTnT و CK-MB و ICAM-1 في المصل تزيد بعد إصابة عضلة القلب42،43. لذلك ، تستخدم هذه المؤشرات الحيوية لتقييم مدى إصابة عضلة القلب الحادة. في هذه الدراسة ، لاحظنا التغيرات المرضية في عضلة القلب وارتفاع إنزيمات المصل بعد إصابة نقص التروية وإعادة التروية ، مما يشير إلى التأسيس الناجح لنموذج MIRI. أظهرت النتائج أن إصابة عضلة القلب في مجموعة ABF MIRI كانت أكثر حدة مقارنة بمجموعة MIRI الضابطة. بعد العلاج ب Munziq ، تم تخفيف التغيرات المرضية بشكل ملحوظ ، وانخفضت مستويات إنزيم المصل بشكل ملحوظ. بشكل جماعي ، توضح هذه النتائج التأثيرات الوقائية للقلب ل Munziq أثناء MIRI.
في هذه الدراسة ، تم ربط الشريان الهابط الأمامي الأيسر (LAD) لمدة 30 دقيقة ، متبوعا بإعادة التروية لمدة 120 دقيقة لإنشاء نموذج إصابة نقص التروية وإعادة التروية في الفئران. أشار التحليل التلوي44 الذي يلخص 43 دراسة تستخدم لإنشاء نماذج إصابة نقص التروية وإعادة التروية في الفئران إلى أن أوقات نقص التروية تراوحت من 30 إلى 60 دقيقة ، مع مدة إعادة التروية من 30 إلى 120 دقيقة. اعتمدت بعض الدراسات بروتوكولا مدته 5 دقائق من نقص التروية متبوعا ب 5 دقائق من إعادة التروية ، تتكرر 4 ×45. من بين هذه الطرق ، تم استخدام بروتوكول يتضمن 30 دقيقة من نقص التروية و 120 دقيقة من إعادة التروية بشكل متكرر ، وظهر في 19 حالة. خلال العملية التجريبية ، لاحظنا تلوينا شاحبا لعضلة القلب من خلال الفحص البصري المباشر بعد 30 دقيقة من نقص التروية. بالإضافة إلى التقييم البصري لتغيرات لون عضلة القلب ، تم استخدام مراقبة مخطط كهربية القلب (ECG) لتحديد علامات نقص التروية ، مثل ارتفاع الجزء ST. يمكن أن تعمل علامات المصل ، بما في ذلك التروبونين والكرياتين كيناز ، بالإضافة إلى المعلمات الديناميكية الدموية مثل معدل ضربات القلب (HR) والضغط الانبساطي البطيني الأيسر (LVDP) والضغط الانقباضي للبطين الأيسر (LVSP) ، كمؤشرات لتقييم فعالية نموذج نقص التروية46. في هذه الدراسة ، اعتمدنا بشكل أساسي على الملاحظة البصرية لتقييم آثار نقص التروية وإعادة التروية. نظرا للاختلافات الفردية بين الفئران ، ينصح بتكملة الفحص البصري بمقاييس موضوعية إضافية لتقييم فعالية نقص التروية بدلا من تطبيق مدة إقفارية موحدة على جميع الفئران.
في الثدييات ، تتكون عائلة NF-κB من خمسة أعضاء ، أحدهم هو p6513،47. هناك مساران رئيسيان لتنشيط NF-κB في الخلايا47. في المسار الكنسي ، يؤدي تنشيط مركب IKK (IKKα و IKKβ و IKKγ) إلى فسفرة بروتينات IκB ، مما يؤدي إلى تنشيط NF-κB. في مسار NF-κB غير المتعارف عليه ، يتم التوسط في تنشيط NF-κB عن طريق فسفرة NIK و IKKα. تشير الأدلة الواسعة إلى أن مسار NF-κB يلعب دورا مهما في التوسط في نقص التروية وإصابة إعادة التروية48،49،50. يمكن أن يؤدي التدخل في تنشيط NF-κB إلى تخفيف الإصابة الناجمة عن نقص التروية وإعادة التروية51،52. ومن المثير للاهتمام ، أنه كان هناك المزيد من تنشيط مسار إشارات NF-κB في مجموعة ABF MIRI ومستويات أعلى من السيتوكينات الالتهابية في اتجاه مجرى النهر.
ثبت أن العديد من أدوية الطب الصيني التقليدي لها تأثيرات وقائية ضد نقص التروية وإصابة إعادة التروية عن طريق تعديل مسار NF-κB. على سبيل المثال ، وجد Liu et al.53 أن الكيرسيتين خفف من MIRI عن طريق تثبيط مسار NF-κB. أفاد Han et al.54 أن هيدروكسي سافلور الأصفر A خفف من MIRI عن طريق تثبيط إشارات TLR4 / NF-κB. ومع ذلك ، فإن ما إذا كان Munziq يلعب دورا وقائيا في MIRI من خلال مسار إشارات NF-κB لا يزال غير مستكشف. لمزيد من التوضيح لآلية Munziq ، حللت هذه الدراسة مستويات التعبير عن العقد الرئيسية في مسار إشارات NF-κB ، بما في ذلك NIK و IKKα و pIKKα و p65. أظهرت النتائج أن مستويات التعبير عن هذه البروتينات قد تم تنظيمها بشكل كبير بعد علاج Munziq ، مما يشير إلى أن Munziq يثبط التعبير عن العقد الرئيسية في مسار إشارات NF-κB أثناء MIRI.
هناك أدلة كثيرة تدعم فكرة أن تنشيط NF-κB يؤدي إلى إنتاج البروتينات الالتهابية وجزيئات الالتصاق ، مما يؤدي إلى تجنيد الخلايا الليمفاوية55. على سبيل المثال ، اكتشف Valen et al.56 أن NF-κB قد تم تنشيطه وأن مستويات IL-1β و TNF-α كانت مرتفعة أثناء نقص تروية عضلة القلب / إعادة الضهار. علاوة على ذلك ، يظهر IL-6 ، وهو سيتوكين مؤيد للالتهابات ينظمه NF-κB ، زيادة في التعبير أثناء إعادة التروية57. تمشيا مع هذه النتائج ، تظهر نتائج هذه الدراسة أن Munziq يثبط بشكل كبير مستويات السيتوكينات المسببة للالتهابات (بما في ذلك IL-1β و IL-6 و TNF-α) في سياق نقص تروية عضلة القلب / إصابة إعادة التروية (MIRI). من هذا ، يمكن الاستدلال على أن Munziq يمارس آثاره المثبطة على التعبير عن السيتوكينات المسببة للالتهابات من خلال قمع مسار إشارات NF-κB.
في الختام ، تشير النتائج إلى أن MIRI كان أكثر خطورة في ABF. Munziq له تأثيرات وقائية للقلب في نقص التروية وإصابة إعادة التروية. يمكن أن يتصرف هذا التأثير الوقائي عن طريق قمع مسار إشارات NF-κB. تشير هذه النتائج إلى أن Munziq لديه إمكانات كبيرة كعامل علاجي لحماية القلب من إصابة إعادة التروية أثناء جراحة القلب.
هناك العديد من القيود على الدراسة. أولا ، يتم إجراء الدراسة في نموذج الفئران ، والذي ، على الرغم من كونه نموذجا انتقاليا قيما ، قد لا يكرر بشكل كامل تعقيد حالة القلب والأوعية الدموية البشرية. ثانيا ، تركز الدراسة بشكل أساسي على مسار إشارات NF-κB كأساس ميكانيكي لتأثيرات مونزيق. ومع ذلك ، فإن MIRI هي عملية متعددة العوامل قد تتضمن مسارات إشارات وآليات جزيئية أخرى مختلفة.
في حين أن الدراسة الحالية تقدم رؤى قيمة حول التأثيرات الوقائية المحتملة للقلب لموزيك في نموذج الفئران لإصابة نقص تروية عضلة القلب (MIRI) ، لا سيما في سياق سوائل الجسم غير الطبيعية (ABF) ، هناك العديد من المجالات للاستكشاف المستقبلي. يتمثل أحد السبل لمزيد من البحث في إجراء دراسات في المختبر باستخدام خلايا عضلة القلب المستنبتة لمراقبة تأثيرات Munziq بشكل مباشر على الاستجابات الخلوية لنقص التروية وإعادة التروية. بالإضافة إلى ذلك ، يمكن أن يوفر اعتماد نهج متعدد الأومكس رؤية أكثر شمولا للتغيرات الجزيئية المرتبطة بعلاج Munziq ، مما قد يكشف عن مسارات وآليات إضافية تساهم في تأثيرات حماية القلب. سيكون من المفيد أيضا استكشاف جرعات مختلفة من Munziq لتحديد الجرعة المثلى لأقصى قدر من حماية القلب مع تقليل الآثار الجانبية المحتملة. من الضروري إجراء دراسات طويلة الأمد لتقييم الآثار المستمرة ل Munziq على وظائف القلب ومراقبة أي آثار ضارة محتملة مرتبطة بالاستخدام المطول.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
مساهمة المؤلف:
أجرى Duolikun Mutailifu التجارب ، وكتب Abudusaimi Aini المسودة الأولية للمخطوطة وحلل البيانات. ساهمت Aili Aibibula في تصور وتصميم الدراسة. شارك Zheng Liu و Abudunaibi Maimaitiaili في تصميم الدراسة. رتبت أبو النعيبي ميميتييلي أموال الدراسة. وقرأ جميع المؤلفين المخطوطة النهائية ووافقوا عليها.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين [رقم المنحة: 82060907] وبرنامج تنمية المواهب الطبية والصحية رفيع المستوى "Tianshan Elite" [رقم المنحة. TSYC202301B004].
Materials
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
References
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved